Аллергические заболевания
Клиническая иммунология и аллергология. Ляликов С.А. 2015
- Аллергены. Классификация аллергенов. Зависимость характера аллергической реакции от путей проникновения аллергена
- Этиология и патогенез
- Бронхиальная астма. Аспириновая астма
- Аллергический ринит
- Атопический дерматит
- Крапивница
- Ангионевротический отек
- Анафилаксия
Механизмы иммунной защиты слизистых оболочек мало зависят от конкретной локализации, в целом функционируют идентично. Поэтому чужеродные ферменты и хитин (антигены, в первую очередь ассоциированные с глистной инвазией) способны индуцировать в любом компартаменте слизистой ответ по противопаразитарному сценарию, описанному в предыдущей главе. Однако антигены, являющиеся по своей природе ферментами, в организм могут проникнуть не только в кишечник, но и через слизистую дыхательных путей. Так, пыльца растений представляет собой гамету, спрятанную в оболочку и содержащую ферменты; экскременты насекомых очень богаты пищеварительными ферментами. Плесень также содержит большое количество ферментов, которые при высыхании попадают в воздух, смешиваются с пылью и затем вместе с ней могут попасть в дыхательные пути. В состав пыли входят также останки насекомых, содержащие хитин. Таким образом, иммунные процессы, реализуемые в кишечнике в ответ на глистную инвазию, могут иметь место и в слизистых дыхательных путей, но уже в ответ на проникновение не паразитарных, но схожих с ними по строению антигенов.
Иммунный ответ на неинфекционные обычно безвредные антигены окружающей среды (пыльца, пища, лекарства и др.) называется аллергическим. Следовательно, аллергические заболевания – это результат ошибки иммунной системы при распознавании антигенов.
Наиболее часто аллергический иммунный ответ связан c IgE-обусловленными реакциями гиперчувствительности 1-го типа. Этот механизм лежит в основе IgE-опосредованных аллергических заболеваний, к которым относят, например, аллергическую бронхиальную астму, аллергический ринит, системные анафилактические реакции, некоторые виды лекарственной аллергии и др.
Среди IgE-опосредованных аллергических реакций выделяют атопические и неатопические. Атопия – генетически обусловленная предрасположенность к развитию IgE-зависимой сенсибилизации к аллергенам. Неатопические IgE-опосредованные аллергические реакции не связаны с наследственной предрасположенностью (аллергические реакции на яд насекомых, лекарственные средства и др.).
Второй, третий и четвертый типы гиперчувствительности лежат в основе неиммуноглобулин E-опосредованных аллергических заболеваний, таких как сывороточная болезнь, аллергический контактный дерматит, аллергический альвеолит, хроническая крапивница и др.
Аллергены
Аллергены – это антигены, вызывающие у чувствительных к ним людей аллергические реакции.
Аллергены характеризуются рядом свойств, которые определяют развитие иммунного ответа в направлении T H 2-ответа и продукции IgЕ. Аллергены по своей природе, как правило, являются белками или полипептидами, так как только они могут индуцировать Т-клеточный ответ. К аллергенам относят также низкомолекулярные вещества (например, лекарственные), которые, образуя комплексы с белками организма, приобретают иммуногенность. Проникновение аллергенов в организм через слизистые оболочки и в низких концентрациях способствует дифференцировке наивных антигенспецифичных Т-клеток в Т-хелперы 2-го типа. В большинстве случаев аллергены – это ферменты, которые, разрушая межклеточные связи эпителиальных клеток, способствуют проникновению этих веществ в слизистые оболочки. Низкий молекулярный вес аллергенов (10–40 кДа) определяет их высокую растворимость, а также облегчает проникновение в слизистые оболочки.
Классификация аллергенов
Существует несколько классификаций аллергенов. Например, в зависимости от пути проникновения в организм их разделяют на ингаляционные, пищевые, контактные, парентеральные (инсектные, лекарственные). Однако такая классификация не всегда корректна, поскольку один и тот же аллерген может проникать в организм разными путями, поэтому обычно аллергены классифицируют по происхождению:
- на бытовые – домашняя и бытовая пыль, продукты переработки нефти, используемые в быту, моющие средства, косметика и т.п.;
- эпидермальные – шерсть, пух, перо, перхоть, экскременты, слюна домашних животных (кошек, собак, морских свинок, хомяков, птиц, кроликов, лошадей, овец и др.), эпидермис человека;
- грибковые – основной компонент домашней пыли, чаще речь идет о плесневых и дрожжевых грибках;
- инсектные – экскременты и останки микроскопических клещей, паукообразных и тараканов, яд жалящих и кровососущих насекомых,
- пыльцевые – пыльца различных растений, чаще злаковых, сорных трав, деревьев;
- пищевые – потенциально любой пищевой продукт может быть аллергеном.
Высокая степень аллергизирующей активности у коровьего молока, рыбы и морепродуктов, яичного белка, куриного мяса, сои, пшеницы, клубники, малины, цитрусовых, шоколада, орехов. Наиболее часто пищевые аллергены являются причинным фактором аллергопатологии раннего детского возраста;
лекарственные – аллергенами могут быть любые лекарственные препараты, включая и противоаллергические средства.
Зависимость характера аллергической реакции от путей проникновения аллергена
Иммуноглобулин Е-опосредованный ответ на любые аллергены всегда связан с дегрануляцией тучных клеток, но клинические симптомы аллергической реакции зависят от пути проникновения аллергена, т.е. от того, какие тучные клетки дегранулируют: расположенные в соединительной ткани возле с осудов или в слизистом слое респираторного и желудочнокишечного трактов.
Аллергены, поступающие через респираторный тракт, активируют ТК слизистых оболочек дыхательных путей. В результате выделения медиаторов в верхних отделах дыхательной системы происходит усиление секреции слизи, раздражение и отек назальной слизистой (аллергический ринит). В нижних дыхательных путях – гиперсекреция слизи, отек слизистой и сокращение гладких мышц бронхов (бронхиальная астма). Аллергический ринит характеризуется такими симптомами, как зуд, чихание, ринорея, затруднение носового дыхания из-за отека слизистой. Основными клиническим симптомами бронхиальной астмы являются кашель, свистящее дыхание, чувство стеснения в груди и экспираторная одышка.
Попадание в организм пищевых аллергенов (оральный путь) сопровождается большим разнообразием клинических проявлений, особенно у детей раннего возраста. Аллергены, проникающие в организм через эпителий слизистых оболочек желудочно-кишечного тракта, у маленьких детей могут вызывать рвоту из-за сокращения гладких мышц кишечника или диарею из-за гиперсекреции слизи. Пищевые аллергены, всасываясь в кишечнике, могут попадать в кровоток, что приводит к появлению острой крапивницы. В основе развития острой крапивницы лежит IgE-опосредованная дегрануляция ТК в ответ на аллерген, в отличие от хронической крапивницы, при которой эти реакции не имеют существенного значения. Пищевые аллергены, попадающие в кровь из кишечника, также могут быть причиной развития атопического дерматита, иногда могут развиваться жизнеугрожающие анафилактические реакции.
Поступление аллергена через кожу также приводит к активации соединительнотканых ТК, в результате развивается местная аллергическая реакция в виде отека и гиперемии, как, например, после укуса насекомых или при проведении кожных прик-тестов с аллергенами. У атопиков аэроаллергены, проникающие через кожу, могут вызывать развитие атопического дерматита и его обострений. В недавних исследованиях была доказана роль дефицита филагрина в развитии атопического дерматита. Филагрин – это белок, который связывает клетки эпидермиса между собой, способствуя формированию плотного барьера, препятствующего потере влаги и проникновению в кожу аэроаллергенов. Дефицит филагрина приводит к развитию сухости кожных покровов и снижению их барьерной функции, в результате чего создаются условия для сенсибилизации людей с атопией аэроаллергенами. Как оказалось, многие пациенты с атопической экземой имеют мутации в гене, кодирующем белок филагрин.
Однако атопический дерматит у детей раннего возраста чаще всего развивается как реакция на пищевые аллергены, например коровье молоко. Это первый индикатор атопии у сенсибилизированных детей. Преобладание T H 2-ответа у людей с атопической экземой приводит к подавлению T H 1-реакций и соответственно снижению противоинфекционной защиты кожных покровов. Однако в иммунопатогенезе АтД имеет значение не только T H 2-ответ и IgE-опосредованные реакции, но и T H 1-ответ. В некоторых случаях последний даже доминирует, поскольку ремоделирование ткани и развитие фиброзных изменений при АтД в большей степени обусловлено апоптозом кератиноцитов, индуцируемым ИФ-γ и TNF-α – цитокинами T H 1.
Аллерген, попадающий прямо в системный кровоток, например в результате укуса пчелы или инъекций, активирует соединительнотканые ТК, расположенные возле сосудов. Это приводит к немедленному высвобождению гистамина и других медиаторов в кровоток – в результате развиваются анафилактические реакции. Проявления анафилаксии могут варьировать от легких форм в виде локального отека или крапивницы, до тяжелых, которые манифестируют клинической картиной отека гортани и (или) системного коллапса, анафилактического шока и сопровождаются потенциальной угрозой жизни. Анафилактический шок является результатом системного высвобождения в кровоток больших количеств гистамина, который повышает сосудистую проницаемость и приводит к катастрофическому падению давления, бронхоконстрикции и затрудненному дыханию, а отек клетчатки подсвязочного пространства и надгортанника – к асфиксии.
Сенсибилизация и анафилактические реакции на яды насекомых, пищевые продукты и лекарства не связаны с атопией, хотя и являются IgE-опосредованными реакциями.
Крапивница
Крапивница (от лат. urticaria) – дерматит преимущественно аллергического происхождения, характеризующийся быстрым появлением зудящих волдырей, сходных по виду с волдырями от ожога крапивой. Крапивница может быть самостоятельным заболеванием (обычно аллергической реакцией на какой-либо раздражитель) либо одним из проявлений другого заболевания.
Хотя бы один раз в жизни крапивницу перенесли 15–35% населения. Наиболее часто заболевание встречается у женщин в возрасте 20–60 лет. У 70–75% пациентов оно имеет острое течение, у 25–30% – хроническое. В общей популяции распространенность хронической крапивницы составляет 0,5–5,0%. В половине случаев крапивница сочетается с ангионевротическим отеком, изолированная крапивница наблюдается примерно у 40% пациентов.
Симптомы крапивницы, не сопровождающейся ангионевротическим отеком, не представляют угрозы для жизни пациента, однако могут приводить к утрате трудоспособности и существенно ухудшать качество жизни, вызывая значительный дискомфорт. У пациентов отмечают нарушения сна, повседневной активности, расстройство эмоциональной сферы, стремление к социальной изоляции. Наибольшее беспокойство вызывает зуд кожи. Результаты последних исследований свидетельствуют о том, что влияние симптомов хронической крапивницы на пациента сопоставимо с таковыми проявлений ишемической болезни сердца.
Патогенез. Причиной появления зудящих волдырей при крапивнице являются активные вещества, выделяемые при дегрануляции тучных клеток (гистамин, простагландины, лейкотриены, фактор активации тромбоцитов, брадикинин). Медиаторы, высвобождаемые из ТК, вызывают повышение проницаемости сосудов кожи, а также гиперемию и зуд. Формы заболевания классифицируются на основании факторов, вызывающих дегрануляцию.
Острая крапивница чаще всего обусловлена реакцией гиперчувствительности немедленного типа в ответ на пищевые аллергены, лекарственные средства, реже – на эпидермальные, клещевые, пыльцевые аллергены и яд перепончатокрылых. Примерно в 70% случаев ее возникновению способствуют гельминтозы, а также вирусные или бактериальные инфекции. Острая крапивница, вызванная йодсодержащими и другими подобными веществами (рентгеноконтрастными средствами, топическими бактерицидными препаратами и т.д.), обусловлена прямым (неиммуноглобулин E-зависимым) воздействием вещества на тучные клетки.
Причины хронизации крапивницы в большинстве случаев остаются неясными. Предполагается, что в первую очередь провоцирует рецидивы этого заболевания хроническое носительство простейших (Endolimax nana, Giardia lamblia), грибков (Candida spp., Trichophyton spp.), вирусов (Herpes simplex и др.), бактериальной (стрептококковой, стафилококковой, хеликобактерной) инфекции, а также кишечный дисбиоз и эндокринная патология.
Не редко хронической крапивнице сопутствуют аутоиммунные заболевания (на первом месте аутоиммунный тиреоидит). В сыворотке пациентов с хронической крапивницей, чаще развившейся на фоне аутоиммунных или опухолевых заболеваний, выявляются аутоантитела (класса G) к высокоафинному рецептору IgE (Fc ε R1), обладающие способностью непосредственно вызывать дегрануляцию ТК. Высокий тонус парасимпатического звена вегетативной нервной системы является фактором, способствующим возникновению крапивницы, индуцируемой физическими факторами (холодом, теплом, давлением, вибрацией, инсоляцией и др.). Предполагается, что определенную роль в патогенезе хронической крапивницы играют некоторые нейропептиды, в частности вазоактивный интестинальный пептид, субстанция Р и нейрокинин. Установлено, что в коже пациентов с хронической крапивницей увеличено число ТК.
Следует заметить, что наличие других атопических заболеваний, не смотря на схожесть патогенезов, не повышает риск возникновения хронической крапивницы и не влияет на прогноз заболевания.
Классификация. По патогенетическим механизмам крапивницу подразделяют:
- на аллергическую (IgE-опосредованная);
- неаллергическую (исключены иммунологические механизмы).
По течению крапивница бывает:
- острая (сохраняется менее 6 недель);
- хроническая (сохраняется более 6 недель).
В МКБ-10 приведена следующая классификация этого заболевания.
L50. Крапивница.
- L50.0. Аллергическая крапивница.
- L50.1. Идиопатическая крапивница.
- L50.2. Крапивница, вызванная воздействием низкой или высокой температуры.
- L50.3. Дерматографическая крапивница.
- L50.4. Вибрационная крапивница.
- L50.5. Холинергическая крапивница.
- L50.6. Контактная крапивница.
- L50.8. Другая крапивница.
Крапивница: хроническая, периодически повторяющаяся.
L20.9. Крапивница неуточненная.
Диагностика. Основная цель сбора анамнеза у пациента с крапивницей – установить причинно-значимый фактор, провоцирующий появление патологических симптомов. Для этого выясняют переносимость пищевых продуктов и лекарственных препаратов, наличие реакции на физические факторы (холод, тепло, инсоляцию, давление, вибрацию и т.д.), контакт с различными веществами (водой, моющими средствами, промышленными факторами, растениями и т.д.), бытовые и пыльцевые аллергены, укусы насекомых, физическую нагрузку, стрессовые ситуации. Уточняют наличие сезонности и наследственной предрасположенности к аллергической, аутоиммунной, онкологической патологии, у женщин – связь проявлений с менструальным циклом. Обращают внимание на ранее перенесенные пациентом заболевания, присутствие очагов хронической инфекции, признаки, свидетельствующие о наличии сопутствующей патологии (ЖКТ, эндокринной, ЛОР-органов, вегетативной дисфункции, системных и паразитарных заболеваний и т.д.).
Клинически крапивница проявляется волдырями, которые имеют пять типичных признаков:
- четко отграниченные, возвышающиеся над поверхностью кожи размером от нескольких миллиметров до нескольких сантиметров;
- окруженные зоной эритемы;
- бледнеют при надавливании;
- сопровождаются зудом и иногда чувством жжения;
- исчезают обычно через 1–24 ч.
Для подтверждения диагноза определяют общий уровень IgE и число эозинофилов в крови, проводят кожные пробы с аллергенами или исследуют сыворотку на наличие в ней специфических IgE. В диагностике крапивницы, вызванной физическими факторами, ведущую роль играют провокационные пробы. Дерматографическая крапивница подтверждается выраженной реакцией при механическом воздействии на кожу (проверке дермографизма), крапивница от давления – положительным результатом на пробу с грузиком, холодовая – на пробу с кубиком льда, тепловая – при контакте с флаконом воды, имеющей температуру 43 °С, солнечная – на ультрафиолетовое излучение, контактная – на воздействие причинно-значимого вещества на кожный покров, аквагенная – на прикладывание салфетки, смоченной водой с температурой 37 °С, холинергическая – на физическую нагрузку.
Скрининговым тестом для определения аутоиммунной крапивницы является кожная проба с аутологичной сывороткой. Используется также тест дегрануляции базофилов доноров под действием сыворотки обследуемого. Кроме того, в сыворотке крови пациентов с такой крапивницей нередко присутствуют антимикросомальные антитела. Необходимо провести обследование на наличие хронической инфекции (в первую очередь хеликобактерной, герпетической, кандидозной, лямблиозной, стрептококковой, стафилококковой и на гельминтозы). Пациент должен проконсультироваться у оториноларинголога, стоматолога, гинеколога.
При составлении плана обследования следует помнить, что пациенты с крапивницей в анамнезе относятся к группе повышенного риска по развитию лейкемии, лимфомы или миеломы. Кроме того, эта патология может быть симптомом аутоиммунной патологии, поэтому взрослые пациенты должны обследоваться на предмет таких заболеваний, как СКВ, синдром Шегрена, ревматоидный артрит, аутоиммунный тиреоидит.
В тех случаях, когда анамнестические данные, результаты инструментального и лабораторного обследования не позволяют установить причину заболевания, хроническая крапивница считается идиопатической.
Общие принципы лечения. Целью обучения является максимальный контроль триггеров. Для этого пациенту (родителям пациента) следует объяснить, какие факторы являются возможной причиной его заболевания, что способствует возникновению и усилению патологических проявлений и как можно избежать воздействия этих триггеров. Необходимо научить пациента методам контроля заболевания и оказания неотложной помощи.
В большинстве случаев средствами первого выбора в лечении пациентов с крапивницей считают блокаторы Н 1 -рецепторов. При острой крапивнице предпочтение отдается антигистаминным препаратам 1-го поколения (дифенгидрамину, хлоропирамину, клемастину, прометазину, мебгидролину, диметиндену, ципрогептадину и др.), которые быстро и обратимо связываются с Н 1 -рецепторами. Длительность приема антигистаминных препаратов при острой форме – 5–7 дней. Для достижения основного фармакологического эффекта требуются высокие дозы таких антагонистов. Кроме того, кратковременность действия этих препаратов требует их многократного применения в течение суток, но при этом чаще и интенсивнее проявляются их побочные свойства. Антигистаминные препараты 1-го поколения в терапевтических дозах оказывают блокирующее действие на холинорецепторы, что проявляется повышением вязкости секретов, сухостью слизистых оболочек, расстройством мочеиспускания, тошнотой, рвотой, диареей, потерей аппетита. Центральная холинолитическая активность выражается сонливостью, нарушением координации движений, вялостью, снижением концентрации внимания, скачками артериального давления. Кроме того, при длительном применении их терапевтическая эффективность уменьшается (тахифилаксия).
При хронической крапивнице используют антигистаминные средства 2-го поколения (цетиризин, терфенадин, астемизол, лоратадин, эбастин и др.), которые более прочно и неконкурентно блокируют Н 1 -рецепторы, могут использоваться однократно в сутки и не обладают тахифилаксией. Последнее очень важно, так как в ряде случаев необходимая длительность приема этих препаратов – месяцы. В отличие от своих предшественников блокаторы Н 1 -рецепторов 2-го поколения не оказывают или оказывают крайне незначительное седативное воздействие. Однако некоторые из них имеют определенные ограничения, связанные с сочетанным применением с другими лекарственными средствами (макролидами, кетоконазолом и др.).
Дозы антигистаминных препаратов при лечении хронической крапивницы подбираются индивидуально и могут в 2–3 раза превышать средние терапевтические. При лечении дермографической крапивницы блокаторы H 1 -гистаминовых рецепторов следует сочетать с H 2 -гистаминоблокаторами (ранитидином, фамотидином). При холинергической, а также других вариантах крапивницы у пациентов с клиническими проявлениями повышенного парасимпатотонуса в дополнение к антигистаминным препаратам применяют М-холиноблокаторы (препараты белладонны в течение 4 недель повторяющимися курсами).
Применение мембраностабилизирующих препаратов (кетотифена, налкрома) также может быть полезно при лечении хронической крапивницы. Их эффективность оценивают через 1–2 месяца от начала приема. При наличии положительного эффекта продолжают принимать 3–6 месяцев.
Показаниями для назначения системных ГКС являются тяжелое течение заболевания и отсутствие эффекта от блокады Н 1 -рецепторов. ГКС назначают в дозе 1–2 мг/кг⋅сут (по преднизолону) в течение 5–7 дней.
При подозрении на пищевую природу аллергенов для связывания и выведения их из ЖКТ используют энтеросорбенты (энтеросгель, активированный уголь, лактофильтрум). Длительность приема сорбентов – 5–7 дней (не более 10). Обязательно следует следить за регулярностью стула, в случае его нерегулярности или отсутствия – назначать слабительные препараты или очистительные клизмы.
Основными методами лечения, индуцирующими ремиссию у пациентов с аутоиммунной крапивницей, являются плазмаферез, внутривенное введение иммуноглобулина, применение циклоспорина А и ГКС. Топические антигистаминные средства и ГКС показаны, если зуд не удается купировать энтеральным приемом препаратов.
Обязательным является лечение выявленной хронической инфекции и сопутствующих заболеваний – триггеров. Следует отметить, что ремиссия хронической крапивницы независимо от того, проводилось или не проводилось лечение, у 50% пациентов наступает в течение шести месяцев с момента дебюта заболевания, у 25% – в течение трех лет, у 20% – в течение пяти лет. У 5% пациентов заболевание длится более 10 лет. У каждого второго пациента со спонтанной ремиссией хронической крапивницы в дальнейшем развивается по меньшей мере один рецидив заболевания.
Ангионевротический отек
Ангионевротический отек (АНО) – заболевание, проявляющееся внезапным, резко выраженным отеком дермы и подкожной клетчатки, сопровождающимся скорее болью, чем зудом, часто с вовлечением подслизистого слоя слизистых оболочек внутренних органов, разрешается медленно, может сохраняться до 72 ч.
Распространенность ангионевротического отека в популяции составляет от 0,2 до 3,0 %, причем на формы, не связанные с дегрануляцией ТК, приходится от 2,0 до 13,0 % из общего числа случаев ангионевротического отека.
Патогенез. В основе патогенезе ангионевротического отека лежат несколько совершенно различных механизмов. Наиболее частый вариант заболевания по механизму развития идентичен крапивнице – так же является IgE-опосредованным, индуцируется медиаторами ТК и обычно возникает на фоне крапивницы. При других вариантах клинические проявления обусловлены высвобождением брадикинина (брадикинининдуцированный АНО – БИАНО). Причиной, по крайней мере половины случаев БИАНО, являются полиморфизм гена SERPING1, кодирующего сывороточный ингибитор С1-эстеразы – С1 inh . Дефектные полиморфные варианты гена наследуются по аутосомно-доминантному типу и обусловливают либо полное отсутствие С1 inh , либо снижение его продукции.
C1 inh принадлежит суперсемейству ингибиторов сериновых протеаз и является основным ингибитором ряда протеаз системы комплемента (C1r, C1s, ассоциированными с МСЛ сериновыми протеазами 1 и 2) и системы контактных протеаз (плазменного калликреина и фактора свертывания XIIa), а также минорным ингибитором фибринолитической протеазы плазмина и фактора свертывания XIa.
Установлено, что за возникновение отеков при БИ ангионевротическом отеке несет ответственность брадикинин, увеличивающий проницаемость сосудов. Нанопептид брадикинин образуется при расщеплении кининогена под действием активированного плазменного калликреина. Последний активируется под влиянием фактора XIIa. В норме и плазменный каликреин и фактор XIIa ингибируются С1 inh . Таким образом, при отсутствии или дефиците последнего, создаются предпосылки для образования большого количества брадикинина. Еще один вариант БИАНО ассоциирован с мутацией в гене, кодирующем фактор XII, при этом продукция С1 inh не нарушена, но симптоматика также обусловлена избыточным образованием брадикинина.
Возникновение отеков при этих вариантах БИ ангионевротического отека провоцируется неспецифическими факторами (триггерами): случайными травмами, хирургическими операциями, удалением зубов, использованием эстрогенсодержащих противозачаточных средств или гормональной заместительной терапией, антагонистами ангиотензинпревращающего фермента (АПФ), стрессами, усталостью, повышением температуры, алкоголем, хеликобактерной инфекцией, менструацией и т.д.
Существует вариант БИАНО, связанный с приемом ингибиторов АПФ. У одного из 200–1000 пациентов, принимающих препараты этой группы, развиваются отеки. Это объясняется тем, что АПФ, иначе называемый кининаза II, обладает способностью инактивировать брадикинин.
Классификация. В директиве ВОЗ по тактике ведения наследственного ангионевротического отека (WAO Guideline for the Management of Hereditary Angioedema, 2012) приведена патогенетическая классификация ангионевротического отека (табл. 25), базирующаяся на основной причине возникновения отеков.
В МКБ-10 для этого заболевания отведены две подрубрики различных рубрик, причем варианты HAE-1и HAE-2 кодируются первой из них, а все остальные – второй:
D84.1. Дефект в СК. Дефицит C1-ингибитора эстеразы (C1-INH).
T78.3. Ангионевротический отек. Гигантская крапивница Отек Квинке.
Диагностика. Принципы диагностики ангионевротического отека, индуцированных медиаторами ТК, такие же, как при установлении диагноза крапивница.
Таблица 25. Патогенетическая классификация ангионевротического отека
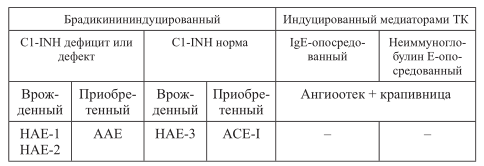
Примечание. Выделяют еще идиопатический вариант, когда заболевание не связано ни с одним из указанных в таблице факторов: HAE-1 – hereditary angioedema due to C1 inhibitor defi ciency; HAE-2 – hereditary angioedema due to C1 Inhibitor defect; AAE – acquired angioedema; HAE-3 – hereditary angioedema with normal C1 inhibitor levels; ACE-I – angiotensin-converting enzyme-induced angioedema.
Названия вариантов предложены ВОЗ в качестве международных. При диагностике вариантов БИАНО необходимо опираться на данные анамнеза: наличие подобных заболеваний в роду; возникновение заболевания в детском или подростковом возрасте; периодически возникающие острые боли в животе; указание на случаи затрудненного дыхания на фоне рецидива заболевания; наличие продромальных симптомов, предшествующих появлению отека; отсутствие эффекта от антигистаминовых средств, ГКС или адреналина; факт приема ингибиторов АПФ.
Лабораторная диагностика должна включать определение содержания в крови С4 и C1 inh , а также оценку активности C1 inh . Ненормально низкие значения этих показателей характерны для вариантов БИАНО HAE-1, HAE-2 и AAE, но не ACE-I и HAE-3. Наличие вариантов HAE-1, HAE-2 можно подтвердить с помощью секвенирования гена SERPING1. Для варианта AAE характерно появление первых симптомов после 40 лет, низкий уровень C1q-компонента комплемента и наличие антител к C1 inh . Вариант HAE-3 можно диагностировать с помощью секвенирования гена XII фактора. Вариант ACE-I устанавливается на основании анамнеза.
Общие принципы лечения. Терапевтическая тактика при брадикинининдуцированных вариантах ангионевротического отека и отеках, индуцированных медиаторами ТК, принципиально различается. Последние лечатся, как крапивница.
Помощь при БИАНО следует начинать оказывать как можно раньше (при первых признаках возникающего отека) и использовать в качестве терапевтических средств очищенный, концентрированный C1 inh , ингибитор каллекреина или блокатор рецептора брадикинина. Детям и беременным женщинам предпочтительно назначение концентрированного C1 inh . При отсутствии указанных средств вводится свежезамороженная плазма. Если эффект от проводимой терапии отсутствует и начинается отек верхних дыхательных путей, то пациенту производят трахеотомию с интубацией.
В качестве профилактических мер при БИ ангионевротическом отеке рекомендуется избегать воздействия триггеров, показана вакцинация с целью снижения риска возникновения инфекционных заболеваний, а также прием андрогенов (даназола или станозолола) короткими или пролонгированными курсами. Каждый пациент должен постоянно иметь при себе препараты для оказания неотложной помощи. Рекомендуется также использовать эти препараты в качестве профилактических средств перед проведением хирургических вмешательств или инвазивных диагностических процедур (бронхоскопией, лапароскопией и т.п.).
Заключение
У восприимчивых лиц повторяющиеся контакты с безвредными для большинства людей антигенами могут привести к развитию аллергических реакций. Большинство таких реакций связано с повышенной продукцией антител класса IgE против аллергенов окружающей среды. IgE играет важнейшую роль в механизмах защиты от паразитарной инвазии. Естественными индукторами его синтеза являются вещества, ассоциированные с глистной инвазией, например ферменты, хитин и др. Многие из аллергенов содержат эти вещества или схожи с ними. Генетически обусловленная склонность к продукции IgE-антител против различных аллергенов называется атопией. Причина повышенного синтеза IgE – поляризация иммунного ответа в сторону T H 2 под влиянием хемокинов и цитокинов, запускающих конкретные сигнальные пути. IgE связывается с высокоафинным рецептором Fc ε RI, который экспрессирует тучные клетки и базофилы – процесс сенсибилизации. При повторной встрече с причинно-значимым аллергеном происходит дегрануляция тучных клеток, клинические проявления этого зависят от локализации процесса.
Аллергические болезни – группа заболеваний, обусловленных повышенной чувствительностью организма к экзогенным аллергенам. В патогенезе аллергических болезней участвуют преимущественно I (реагиновый) и IV (клеточный) тип гиперчувствительности (по P.G.H. Gell, R.R.A. Coombs). Повреждение при аллергических болезнях проявляется аллергическим воспалением самой разнообразной локализации, зудом, спазмом гладкой мускулатуры, падением артериального давления и др.
К числу аллергических болезней относятся бронхиальная астма, аллергический ринит, атопический дерматит, крапивница, ангеоневротический отек, лекарственная аллергия, пищевая аллергия, инсектная аллергия, анафилаксия. Бронхиальную астму, АР и АтД называют классическими атопическими болезнями. К ним обычно имеется наследственная предрасположенность, а в основе патогенеза лежат гиперчувствительность и гиперреактивность. Хроническое аллергическое воспаление способствует развитию гиперреактивности, которая, в свою очередь, поддерживает воспаление. Важнейшей диагностической задачей при этих заболеваниях является установление причинно-значимого аллергена с помощью кожных тестов или определения уровня специфических IgE.
Программа ведения пациентов с аллергическими заболеваниями включает их обучение, устранение воздействия причинных факторов, медикаментозную терапию (базисную и средства скорой помощи), проводимую ступенчатым методом, мониторирование тяжести заболевания, специфическую иммунотерапию.
Дополнительная информация
Базофилы, эозинофилы и тучные клетки взаимодействуют между собой и с В-лимфоцитами. Так, главный основной белок эозинофилов вызывает дегрануляцию базофилов и ТК. Тучные клетки и базофилы могут регулировать синтез IgЕ В-лимфоцитами. Сенсибилизация приводит к активации этих клеток и они начинают секретировать ИЛ-4 и экспрессировать CD40L, поэтому тучные клетки и базофилы, наподобие T-хелперов II типа, могут индуцировать переключение В-лимфоцитов на синтез IgЕ непосредственно в месте реализации иммунного ответа.
