ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА
Глава 14. Анализ лекарственных средств группы хинолина и изохинолина
Широкое применение в медицине производных изохинолина связано с изучением алкалоидов мака снотворного. В млечном соке зеленых коробочек мака содержится около 25 алкалоидов: морфин, кодеин, тебаин, наркотин, папаверин и др. Алкалоиды группы изохинолина (и лекарственные вещества, созданные на их основе) относятся главным образом к производным бензилизохинолина, морфинана и апорфина. Морфинан и апорфин относятся к группе фенантренизохинолина:

Производные бензилизохинолина
К данной группе относятся папаверина гидрохлорид и дротаверина гидрохлорид (являющийся производным 1,2,3,4-тетрагидроизохинолина) (табл. 61).

Папаверина гидрохлорид — соль слабого азотистого основания, не растворимого в уксусной кислоте. Поэтому при добавлении к раствору препарата раствора ацетата натрия выделяется осадок основания. Это испытание позволяет отличить папаверина гидрохлорид от солей более сильных оснований.
Папаверин взаимодействует с общеалкалоидными осадительными реактивами.
Восстановительные свойства папаверина гидрохлорида объясняются наличием в структуре 2 ароматических фрагментов, связанных метиленовой группой, а также 4 метоксидных групп. Лекарственное вещество легко окислятся на свету и в присутствии примеси ионов тяжелых металлов. Первыми продуктами окисления являются спирт папаверинол и кетон папаверальдин (окисление происходит по метиленовому фрагменту).
При добавлении к папаверину гидрохлориду сильных окислителей и последующем нагревании образуются различно окрашенные продукты. Так, взаимодействие с кислотой азотной концентрированной приводит к появлению желтого окрашивания, переходящего в оранжево-красное при нагревании. Нагревание с концентрированной Н2SО4 приводит к образованию продукта, окрашенного в фиолетовый цвет:

Известны и другие реакции окисления папаверина. При взаимодействии с реактивом Марки возникает желтое окрашивание, переходящее в оранжевое. Дальнейшее добавление бромной воды и раствора аммиака приводит к образованию грязно-фиолетового осадка, растворяющегося в этаноле с образованием раствора, окрашенного в фиолетовый или красно-фиолетовый цвет (реакция О.Н. Соболевой).
Одной из наиболее известных реакций на папаверин, включенной в некоторые национальные фармакопеи, является каролиоевая проба: к порошку папаверина гидрохлорида добавляют концентрированную Н2SО4, уксусный ангидрид и нагревают. Возникает ярко-желтое окрашивание с зеленой флюоресценцией:

Количественное определение папаверина гидрохлорида проводят в среде уксусного ангидрида и муравьиной кислоты; титрант — 0,1 М раствор кислоты хлорной.
Дротаверина гидрохлорид является синтетическим спазмолитиком, близким по химическому строению к папаверину, но с более выраженными спазмолитическими свойствами. Молекулу дротаверина можно рассматривать как продукт конденсации 6,7-диэтокситетрагидроизохинолина и 3,4-диэтоксибензальдегида. Препарат имеет характерный спектр поглощения в УФ-области.
Дротаверин проявляет более выраженные основные свойства, чем папаверин, поэтому для выделения основания из раствора препарата следует добавить раствор щелочи.
Как и папаверин, дротаверин обладает выраженными восстановительными свойствами. При добавлении к навеске препарата концентрированной Н2SО4 с дальнейшим добавлением капли разведенной азотной кислоты возникает темно-коричневое окрашивание.
Количественное определение дротаверина гидрохлорида проводят так же, как и папаверина гидрохлорида.
Производные фенантренизохинолина
Большинство лекарственных веществ этой группы относится к подгруппе морфинана (табл. 62). К подгруппе апорфина относится апоморфина гидрохлорид.


Производные морфинана
Морфинан является частично гидрированным октагидрофенантренизохинолином. Сочетание циклов А,В,С образует частично гидрированный фенантрен; С,D — гидрированный изохинолин; цикл D — пиперидин.
У морфина появляется еще один цикл, образованный эпоксигруппой и соседними атомами углерода. Наличие 5 асимметрических атомов углерода (5,6,9,13,14) придает соединению оптическую активность.
Кислотно-основные свойства морфина объясняются наличием третичного атома азота (центр основности) и фенольного гидроксила (центр кислотности). Основные свойства морфина выражены слабее, чем у аммиака, а кислотные — несколько сильнее, чем у фенола.
ГФ регламентирует как одно из испытаний подлинности морфина гидрохлорида взаимодействие его раствора с раствором аммиака (выпадает белый осадок основания). Дальнейшее прибавление раствора натрия гидроксида приводит к растворению осадка (образование фенолята).
Как и соли других оснований, морфина гидрохлорид взаимодействует с общеалкалоидными осадительными реактивами.
Выраженные восстановительные свойства обусловлены принадлежностью морфина к частично гидрированной системе фенантрена, а также наличием фенольного гидроксила и вторичной спиртовой группы.
Растворы морфина гидрохлорида очень легко окисляются, особенно на свету и в щелочной среде. Наибольшая устойчивость растворов препарата наблюдается при pH 2,5.
При свободном окислении морфина гидрохлорида образуются дегидродиморфин (псевдоморфин) и N-оксид морфина в соотношении 9:1.
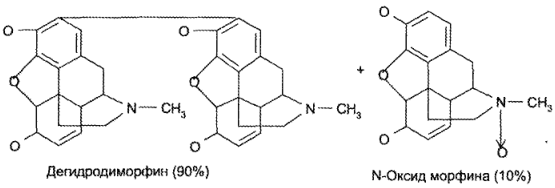
Взаимодействие морфина гидрохлорида и других препаратов группы морфинана с сильными окислителями приводит к образованию различно окрашенных продуктов окисления.
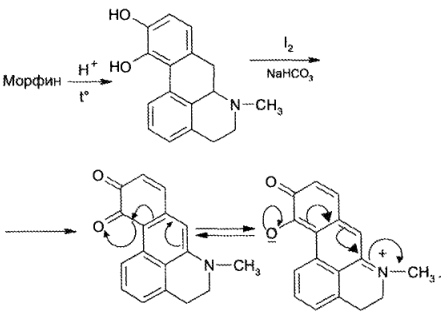
ГФ в качестве испытаний подлинности морфина гидрохлорида приводит реакции препарата с реактивом Марки и с раствором молибдата аммония в концентрированной Н2SО4 (реактив Фреде). При взаимодействии морфина с реактивом Марки образуется пурпурное окрашивание, переходящее в фиолетовое:
В результате взаимодействия препарата с реактивом Фреде появляется фиолетовое окрашивание, переходящее в синее и (при стоянии) в зеленое.
Известны и другие (неофицинальные) реакции морфина гидрохлорида с различными окислителями. Так. при взаимодействии е реактивом Эрдмана (смесь концентрированных серной и азотной кислот) образуется продукт красного цвета:

Окисление морфина реактивом Манделина (раствор ванадата аммония в концентрированной Н2SО4) приводит к образованию продукта фиолетового цвета.
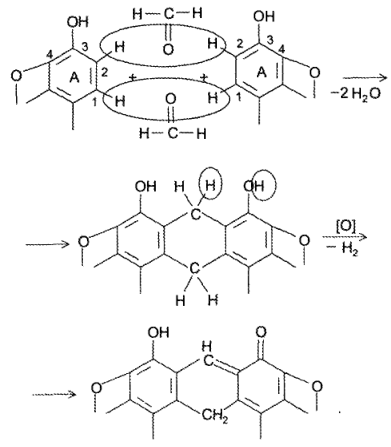
Окисление морфина раствори йода (реакция Пеллагри) проходит в 2 стадии. На 1-й морфин переводят в апоморфин нагреванием с концентрированной Н2SО4. Затем кислоту нейтрализуют и добавляют раствор йода и натрия гидрокарбонат. В результате образуется мезомерно стабилизированный красного цвета о-хинон:
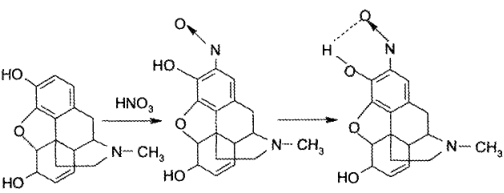
Реакция морфина с кислотой азотной концентрированной приводит к образованию оранжево-красного внутримолекулярного хелата:
При добавлении к раствору препарата раствора калия гексацианоферрата (III) образуются псевдоморфин и калия гексацианоферрат (II):
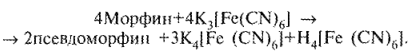
Дальнейшее прибавление раствора железа (III) хлорида приводит к образованию берлинской лазури синего цвета:
![]()
Известны реакции морфина гидрохлорида и другими окислителями.
Наличием в молекуле морфина фенольного и вторичного спиртового гидроксилов обусловлены характерные для этих функциональных групп реакции. Так, при взаимодействии раствора препарата с раствором железа (III) хлорида появляется сине-фиолетовое окрашивание (образование комплексного соединения по фенольному гидроксилу), быстро исчезающее из-за окисления морфина реактивом.
Как и другие фенолы, морфин вступает в SE-реакции (галогенирование, азосочетание с солями диазония и др.).
Возможно окисление вторичного спиртового гидроксила до кетона с последующим образованием оксимов, гидразонов, семикарбазонов.
Морфин легко этерифипируется и по фенольному, и по вторичному спиртовому гидроксилам.
ГФ регламентирует также определение величины удельного вращения морфина гидрохлорида.
Количественное определение морфина гидрохлорида проводят методом кислотно-основного титрования в среде ледяной уксусной кислоты с добавлением ртути (II) ацетата.
Содержание кодеина в опии невелико, поэтому препарат получают полусинтетически — метилированием морфина. Особенностью кодеина, отличающей его от других алакалоидов и синтетических оснований, является растворимость в воде, с чем связаны выраженные основные свойства препарата.
Структурным сходством кодеина с морфином можно объяснить взаимодействие препаратов с одинаковыми окислителями. Но различие в окрашивании получающихся продуктов реакций позволяет различать эти препараты.
Реакция кодеина с реактивом Марки приводит к образованию сине-фиолетового окрашивания, усиливающегося при стоянии.
С концентрированной Н,SО4 в присутствия железа (III) хлорида как катализатора получается продукт синего цвета, переходящий после добавления небольшого количества разведенной азотной кислоты в красный.
При реакции кодеина с концентрированной азотной кислотой возникает оранжевое окрашивание, переходящее в желтое.
С реактивом Фреде кодеин реагирует с образованием фиолетового окрашивания, а с реактивом Эрдмана — красного.
Как и морфин, кодеин легко этерифииируется по вторичному спиртовому гидроксилу.
Специфической примесью в кодеине (по ГФ — до 0,0001 %) является морфин. Его примесь определяется в определенной навеске кодеина по реакции с раствором натрия нитрита в кислой среде и при последующем добавлении раствора аммиака. Интенсивность возникшего при реакции окрашивания сравнивают с окрашиванием эталонного раствора морфина после взаимодействия с теми же реактивами:
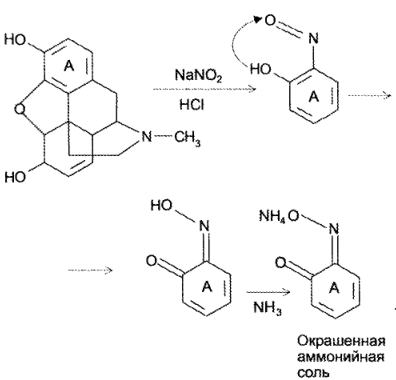
Кодеин, являющийся метиловым эфиром морфина по фенольному гидроксилу, в реакцию с натрия нитритом не вступает.
Количественное определение кодеина — ацидиметрия. Кодеин отличается от многих алкалоидов и синтетических оснований не только растворимостью в воде, но и силой основности. Значение pH водного раствора препарата находится в пределах 9,0, Это позволяет определять количественно кодеин методом кислотно-основного титрования в водной среде. Титрант — 0,1 М раствор кислоты хлороводородной, индикатор — метиловый красный.
Кодеина фосфат количественно определяют методом кислотноосновного титрования в неводной среде (растворитель — кислота уксусная ледяная; титрант — 0,1 М кислоты хлорной).
Этилморфина гидрохлорид анализируется в тех же условиях, что и морфина гидрохлорид и кодеин. При взаимодействии препарата с концентрированной Н2SО4 в присутствии железа (III) хлорида как катализатора возникает зеленое окрашивание, переходящее в фиолетово-синее, а при добавлении 1 капли кислоты азотной разведенной — в красное.
Синтетические аналоги морфина по фармакологическому действию
С учетом степени социального зла, связанного с опиоидными анальгетиками, во многих лабораториях мира проводится большая работа по созданию синтетических аналогов морфина по фармакологическому действию. Одним из первых в этом ряду был синтезирован промедол, а сравнительно недавно — трамал:
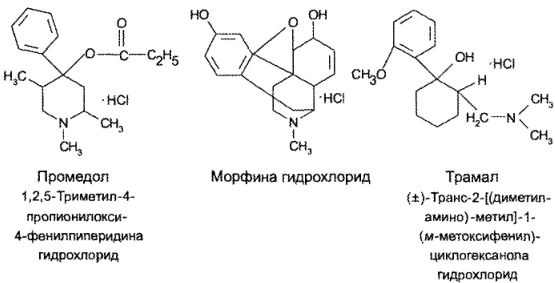
Сравнение приведенных структур показывает сходство химического строения промедола и трамала с таковым предшественника — морфина, хотя трамал не является даже гетероциклическим соединением.
Следует, однако, отметить, что промедол и трамал действуют, по-видимому, на те же центры коры головного мозга, что и морфин. Поэтому их длительное применение также вызывает привыкание.
Производные апорфина

Апоморфин следует рассматривать как продукт промежуточного окисления морфина, с учетом внешнего вида и химических свойств препарата. Апоморфина гидрохлорид неустойчив при хранении, особенно на свету, и легко окисляется как в нейтральной, так и в кислой и щелочной среде.
Окисление в кислой и нейтральной среде (pH 2—7) приводит к образованию дикетона (реакция Пеллагри — см. выше), а в щелочной — к ортохинону (10%) и хиноидному аниону (70%):

Подлинность апоморфина гидрохлорида определяют взаимодействием препарата с азотной кислотой (см. Химизм нитрования морфина) и реакцией Пеллагри.
Другие реакции апоморфина связаны с его амфотерным характером и наличием в его молекуле 2 фенольных гидроксилов.
Количественное определение апоморфина гидрохлорида — кислотно-основное титрование в неводной среде
