Получение интерферонов методом генной инженерии
Интерфероны были открыты в 1957 г. в Национальном институте медицинских исследований в Лондоне как факторы устойчивости к вирусной инфекции. Было установлено, что клетки животных, подвергнутые воздействию вируса, выделяют в среду фактор, способный придавать свежим клеткам устойчивость к вирусной инфекции: он как бы препятствовал (интерферировал) размножению вирусов в клетке и в силу этой способности был назван интерфероном.
Известны три группы интерферонов: а-интерфероны (а-И), образующиеся при воздействии вирусов на лейкоциты; бета-интерфероны (б-И), появляющиеся при воздействии вирусов на фибробласты; у-интерфероны, продуцируемые Т-лимфоцитами в ответ на воздействие бактериальными и вирусными антигенами или антисыворотками против поверхностных детерминант лимфоцитов.
Все интерфероны (кроме а-И) гликопротеины; они представляют собой типичные глобулярные белки, причем на долю а-спиральных структур приходится от 40 до 75 %. В а-И обнаружены две дисульфидные связи. Интерфероны — низкомолекулярные белки из 146—166 аминокислотных остатков; видоспецифичны.
К числу наиболее хорошо исследованных интерферонов человека следует отнести а-интерфероны; число генов, их кодирующих, примерно 20. у-Интерферон в отличие от гетерогенного класса а- интерферонов представлен всего одним индивидуальным белком, который кодируется одним геном. Менее ясна ситуация в отношении бета-интерферонов. Выделен только один белок, соответствующий бета-интерферону человека, — интерферон р,; ему соответствует практически вся противовирусная активность, обнаруживаемая после индукции фибробластов. Не исключено, что в геноме существует ряд генов, кодирующих различные бета-интерфероны. Интерфероны — это как бы первая линия обороны против инфекции.
Интерфероны широко используются для лечения различных тяжелых заболеваний — острого вирусного гепатита, рассеянного склероза, остеосаркомы, миеломы и некоторых видов лимфом. Их применяют и для лечения меланом, ряда опухолей гортани, легких и мозга.
С учетом видоспецифичности интерферонов, предназначенных для лечения, необходимы такие препараты, которые получены из клеток человека. Традиционно их извлекают из крови человека (из 1 л крови можно выделить всего 1 мкг интерферона, т. е. примерно одну дозу для инъекции). Долгое время большая часть мирового производства интерферонов осуществлялась в Финляндии (Хельсинки), а позже — во Франции. С 1980 г. одна из японских компаний наладила производство лимфобластоидного интерферона из лимфобластоидных клеток. С этой целью культура данных клеток индуцировалась вирусом сендай, после чего интерферон выделяли с помощью хроматографических колонок, заполненных моноклональными антителами против получаемого интерферона. В Швеции лимфобласты выращивали в ферментерах объемом 2000 л; полученные интерфероны очищали с помощью моноклональных антител.
Из всех видов интерферонов для мирового производства наиболее пригоден бета-И. Фибробласты, получаемые из тканей плода, можно поддерживать в культуре клеток, что дает возможность массового производства. Метод получения бета-интерферона был разработан в Англии.
В целом вышеперечисленные методы получения интерферонов характеризуются низким выходом, высокой стоимостью и недостаточной чистотой препарата. На современном этапе наиболее перспективный метод — биосинтез интерферонов с помощью генетически сконструированных микроорганизмов. Однако использование генно-инженерных технологий для получения интерферонов человека сопряжено с рядом трудностей. Во-первых, в смеси мРНК, кодирующих различные белки, содержание кодирующих интерферон чрезвычайно мало — всего около 0,1%. Тем не менее кДНК, полученные обратным транскрибированием, были клонированы в Е. coli, что явилось революционным событием в теоретических и прикладных исследованиях интерферонов. Ген интерферона был встроен в векторную ДНК, и к нему были присоединены бактериальные регуляторные элементы, программирующие его транскрипцию и трансляцию в бактериальной клетке (рис. 5.15).
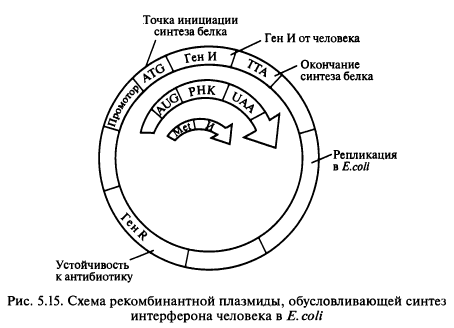
Установлено, что интерфероны синтезируются в клетке сначала в виде предшественников, содержащих на N-конце полипептидной цепи сигнальный пептид, который затем отщепляется, и в результате образуется зрелый интерферон, обладающий полной биологической активностью. Бактерии не содержат ферментов, способных отщепить сигнальный пептид с образованием зрелого белка. Поэтому для того чтобы бактерии синтезировали зрелый интерферон, следует ввести в плазмиду только ту часть гена, которая его кодирует, и удалить часть гена, кодирующую сигнальный пептид. Данная процедура осуществлялась следующим образом. Ген интерферона содержит три участка расщепления рестриктазой Sau 3А1, из которых один находится рядом с сигнальной частью. Неполное расщепление гена этим ферментом позволяет выделить фрагмент гена, содержащий нуклеотидную последовательность, кодирующую зрелый интерферон, но без первого цистеина. Триплет ATG, кодирующий цистеин, отщепляется ферментом вместе с сигнальной частью. Для восстановления полинуклеотидной последовательности полного гена химически был синтезирован небольшой фрагмент ДНК, содержащий данный триплет, а также примыкающий к нему триплет ATG — точка инициации синтеза белка. Этот фрагмент присоединили к изолированной части зрелого гена, и в результате был восстановлен полный ген зрелого интерферона. Реконструированный ген ввели в плазмиду таким образом, что с ним оказался рядом участок ДНК-промотор, обеспечивающий начало синтеза мРНК. Экстракты из Е. coli, содержащие такую плазмиду, обладали противовирусной активностью.
Синтезированный генно-инженерным способом интерферон был выделен, очищен, и его физико-химические свойства оказались близкими свойствам интерферона, полученного из крови, доноров. Удалось получить бактерии, способные синтезировать до 5 мг интерферона на 1 л бактериальной суспензии, содержащей примерно 1011 бактериальных клеток, что в 5000 раз превосходит то количество интерферона, которое можно извлечь из 1 л крови доноров. При использовании генно-инженерных технологий в разных лабораториях были получены штаммы бактерий, продуцирующих различные интерфероны: а-, б- и у-типов. Недостаток использования Е. coli для получения б- и у-интерферонов — отсутствие в бактерии аппарата гликозилирования эукариотических белков, что приводит к синтезу негликозилированных молекул. И хотя роль гликозилирования неясна и негликозилированные б- и у-интерфероны практически полностью сохраняют противовирусную активность, эта особенность диктует осторожный подход к использованию генно-инженерных препаратов в медицинской практике.
В настоящее время гены интерферонов клонированы в дрожжи и клетки высших эукариот, способных осуществлять гликозилирование.
В 1981 г. в США впервые для синтеза лейкоцитарного интерферона человека были употреблены генетически сконструированные клетки дрожжей Saccharomyces cerevisiae. Полученная эффективная экспрессия гена LeIF и замена бактерий клетками дрожжей позволили увеличить производство интерферона в 10 раз.
Большое количество исследований было посвящено химическому синтезу гена, кодирующего ЛИЧ из 166 аминокислот. Соответственно, данный ген из 514 н.п. оказался самым крупным геном, синтезированным в 1982 г. группой английских ученых. В России в 1984 г. был осуществлен полный синтез гена а-И размером примерно 600 н.п. (Институт биоорганической химии под руководством М. Н. Колосова).
Несмотря на успехи, достигнутые в области получения интерферонов с помощью генно-инженерных технологий и их применения для лечения различных вирусных заболеваний, в том числе онкологических, предстоит еще решить многие вопросы. На coвременном этапе не все гены интерферонов идентифицированы: обнаружены новые гены aL; мало известно о генах фибробластного интерферона (кроме гена бетаi); до конца не расшифрованы механизмы их биосинтеза и взаимодействия с другими веществами. Выяснение многих явлений, связанных с интерферонами, приведет; к созданию новых средств для лечения ряда тяжелых заболеваний.
Схема биологического действия интерферона представлена на рис. 5.16.
Механизм действия интерферона можно свести к следующим основным этапам. Связываясь с клеточными рецепторами, интерфероны инициируют синтез двух ферментов: 2′,5′-олигоаденилатсинтетазы и протеинкиназы за счет инициации транскрипции соответствующих генов. Оба фермента проявляют свою активность в присутствии двухцепочечных ДНК, являющихся продуктами репликации многих вирусов или содержащихся в их вирионах. Фермент 2′,5′-олигоаденилатсинтетаза катализирует синтез 2′,5′-олигоаденилатов (из АТР), которые активируют клеточную рибонуклеазу I; протеинкиназа фосфорилирует (и тем самым активирует) фактор инициации трансляции IF2. В результате этих событий ингибируются биосинтез белка и размножение вируса (деградация иРНК. и рРНК) в инфицированной клетке, что вызывает ее лизис. Вероятны и другие механизмы действия интерферонов, например, инактивация тРНК, нарушение процессов метилирования и др. .

