ПОЛУЧЕНИЕ ИНСУЛИНА НА ОСНОВЕ МЕТОДОВ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ
Инсулин — гормон поджелудочной железы, регулирующий углеводный обмен и поддерживающий нормальный уровень сахара в крови. Недостаток этого гормона в организме приводит к одному из тяжелейших заболеваний — сахарному диабету, который как причина смерти стоит на третьем месте после сердечно-сосудистых заболеваний и рака. Инсулин — небольшой глобулярный белок, содержащий 51 аминокислотный остаток и состоящий из двух полипептидных цепей, связанных между собой двумя дисульфидными мостиками. Синтезируется он в виде одноцепочечного предшественника — препроинсулина, содержащего концевой сигнальный пептид (23 аминокислотных остатка) и 35-звенный соединительный пептид (С-пептид). При удалении сигнального пептида в клетке образуется проинсулин из 86 аминокислотных остатков, в котором А и В-цепи инсулина соединены С-пептидом, обеспечивающим им необходимую ориентацию при замыкании дисульфидных связей. После протеолитического отщепления С-пептида образуется инсулин.
Известно несколько форм сахарного диабета. Самая тяжелая форма, для лечения которой больному необходим инсулин (инсулин зависимая форма заболевания), вызвана избирательной гибелью клеток, синтезирующих этот гормон (клетки островков Лангерганса в поджелудочной железе). Форма сахарного диабета, для лечения которой инсулин не требуется, распространена чаще, с ней удается справляться с помощью соответствующих диет и режима. Обычно поджелудочная железа крупного рогатого скота и свиней не используется в мясной и консервной промышленности и поставляется в вагонах-рефрижераторах на фармацевтические предприятия, где проводят экстракцию гормона. Для получения 100 г кристаллического инсулина необходимо 800— 1000 кг исходного сырья.
Синтез обеих цепей и соединение их дисульфидными связями для получения инсулина были проведены в 1963 и 1965 гг. тремя коллективами исследователей в США, Китае и ФРГ. В 1980 г. датская компания «Ново индастри» разработала метод превращения инсулина свиньи в инсулин человека путем замещения 30-го остатка аланина в цепи В на остаток треонина. Оба инсулина не различались по активности и времени действия.
Работы по генно-инженерному получению инсулина начались около 20 лет назад. В 1978 г. появилось сообщение о получении штамма кишечной палочки, продуцирующего крысиный проинсулин (США). В этом же году были синтезированы отдельные цепи человеческого инсулина посредством экспрессии их синтетических генов в клетках Е. coli (рис. 5.11). Каждый из полученных синтетических генов подстраивался к 3′-концу гена фермента бета-галактозидазы и вводился в векторную плазмиду (pBR322). Клетки Е. coli, трансформированные такими рекомбинантными плазмидами, производили гибридные (химерные) белки, состоящие из фрагмента бета-галактозидазы и А или В пептида инсулина, присоединенного к ней через остаток метионина. При обработке химерного белка бромцианом пептид освобождается. Однако замыкание дисупьфидных мостиков между образованными цепями инсулина происходило с трудом.

В 1981 г. синтезирован ген-аналог проинсулина — мини-С- проинсулин, в котором 35-звенный С-пептид был заменен на сегмент из шести аминокислот: арг-арг-гли-сер-лиз-арг и показана его экспрессия в Е. coli.
В 1980 г. У.Гилберт с сотрудниками выделили мРНК инсулина из опухоли бета-клеток поджелудочной железы крысы и с помощью обратной транскриптазы получили с нее кДНК Полученную кДНК встроили в плазмиду pBR322 Е. coli, в среднюю часть гена пенициллиназы. Рекомбинантная плазмида содержала информацию о структуре проинсулина. В результате трансляции мРНК в клетках синтезировался гибридный белок, содержащий последовательности пенициллиназы и проинсулина, который выщепляли из такого белка трипсином.
В 1978 г. сотрудниками Института биоорганической химии под руководством академика Ю. А. Овчинникова был осуществлен синтез двух структурных генов, кодирующих синтез нейропептидов: лейцин-энкефалина и брадикинина. Синтезированный ген лейцин-энкефалина имел два «липких» конца:
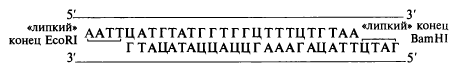
Полученный синтетический ген был встроен вместе с фрагментом природной ДНК, содержащим промотор и проксимальную часть гена белка бета-галактозидазы кишечной палочки Е. coli, в плазмиду-вектор pBR322 и обработан смесью рестриктаз — EcoRI и BamHI. Полученная рекомбинантная плазмида рЕк была трансформирована в клетки Е. coli. В результате экспрессии встроенного ген бактерия начала продуцировать гибридный (химерный) белок, cодержащий на N-конце участок бета-галактозидазы, а на С-конце последовательность нейропептида. С помощью бромциана химерный белок расщепляли in vitro и получали активный лейцин-энкефалин. На рис. 5.12 представлены схема клонирования синтетиче| кого гена лейцин-энкефалина и его экспрессия в клетках кишечной палочки.

СИНТЕЗ СОМАТОСТАТИНА
Аналогичным путем был синтезирован соматостатин — гормон гипоталамуса (рис. 5.13). Молекула соматостатина состоит из 14 аминокислотных остатков. Соматостатин подавляет выделение инсулина и гормона роста человека. В Национальном медицинском центре «Хоуп» (Калифорния) был осуществлен химико-ферментативный синтез гена длиной в 42 нуклеотида, способного кодировать соматостатин. Участок ДНК, кодирующий гормон соматостатин, получен путем соединения тринуклеотидов. Из 52 н. п. синтетического гена 42 пары составляли структурный ген гормона, а остальные служили для присоединения синтетического гена к плазмиде pBR322, а также к сегменту лактозного оперона (lac) из генома Е. coli или к бета-галактозидазному гену. Такую синтетическую чужеродную ДНК встраивали непосредственно за бактериальным геномом (или внутри его) после расщепления ДНК рестрикционными эндонуклеазами с образованием в результате трансляции гибридного белка.

Основные этапы генно-инженерного синтеза соматостатина показаны на рис. 5.14. Синтетический ген соматостатина был встроен в плазмиду pBR322 Е. coli вблизи конца гена, кодирующего фермент бета-галактозидазу. Между двумя генами был помещен кодон метионина. После выделения рекомбинантной плазмиды в бактериальную клетку кишечная палочка стала синтезировать гибридный белок. Часть его (соматостатин) затем отщепляли от бета-галактозидазы BrCN. Такой сложный способ получения гормона был необходим, так как соматостатин, синтезированный в виде свободных молекул, быстро деградирует под действием бактериальных протеаз. Первый синтез соматостатина генно-инженерным способом был осуществлен в 1977 г. Бойером. Выход гормона составил 10000 молекул на одну клетку. Из 100 г биомассы Е.coli, выращенной в ферментере объемом 8 л, удалось выделить 5 мг соматостатина, т.е. столько, сколько можно его выделить из 100 г овечьих мозгов.

5.8. СИНТЕЗ СОМАТОТРОПИНА
Соматотропин (или гормон роста человека ГРЧ) секретируется передней долей гипофиза. Впервые он был выделен и очищен в 1963 г. из гипофиза. Его недостаток приводит к заболеванию — гипофизарной карликовости (1 случай на 5000 человек). Гормон обладает видовой специфичностью. Обычно его получают из гипофиза трупов, но в недостаточном количестве. Гормона хватает лишь для лечения 1/3 случаев гипофизарной карликовости в развитых странах. Основные производители — Швеция, Италия, Швейцария и США. Молекула ГРЧ состоит из 191 аминокислотного остатка.
Препарат из трупного материала представляет собой смесь из нескольких форм, из которых пять имеют 22 кДа, другие являются димерами, а остальные — фрагментами, образующимися при протеолизе. Это приводило к тому, что у 30 % больных, получавших препарат, против гормона вырабатывались антитела, сводившие на нет его биологическую активность.
Принимая во внимание это обстоятельство, в настоящее время ГРЧ синтезируют методами генетической инженерии в специально сконструированных клетках бактерий. Будучи синтезированным в клетках Е. coli, ГРЧ содержит дополнительный остаток метионина на Н2N-конце молекулы. Биосинтез ГРЧ из 191 аминокислотного остатка был осуществлен в 1979 г. Д. Гедделем с сотрудниками. Сначала клонировали двунитевую кДНК; далее путем расщепления получали последовательность, кодирующую аминокислотный порядок гормона, за исключением первых 23 аминокислот, — с фен (—NH2) долей (23), и синтетический полинуклеотид, соответствующий аминокислотам от первой до двадцать третьей со стартовым ATG-кодоном в начале. Затем два фрагмента объединяли и подстраивали к паре lac-промоторов и участку связывания рибосом. Конечный выход гормона составил 2,4 мкг на 1 мл культуры, что составляет 100 000 молекул гормона на клетку; Полученный гормон на конце полипептидной цепи содержал дополнительный остаток метионина и обладал значительной биологической активностью. С 1984 г. после серьезных клинических испытаний на токсичность компанией «Генетек» (Сан-Франциско) было начато широкомасштабное производство бактериального соматотропина.
ГРЧ в клетках Е. coli и в культуре клеток животных был получен в 1982 г. одновременно в Институте Пастера (Париж) и в Институте молекулярной биологии (Москва). Оказалось, что в бактериальных клетках возможен синтез аналогов ГРЧ, с помощью которых изучались участки молекулы, важные для стимулирования роста и процесса неоглюкогенеза на молекулярном уровне.
Огромный интерес представляют выделение и синтез полипептида, обладающего полной биологической активностью гипоталамического рилизинг-фактора соматотропина (СТГ-РФ). Введение этого фактора способно компенсировать недостаток соматотропина. Таким образом, наличие СТГ-РФ и самого гормона, полученных в генетически сконструированных бактериальных клетках, очень важно для успешного лечения заболеваний, обусловленных недостатком этого гормона, и ряда патологических заболеваний, таких, как некоторые формы диабета, регенерация тканей после ожогов и др. Предполагаем, что СТГ-РФ можно использовать и для увеличения массы и роста домашних животных, так как он, не обладая видовой специфичностью, способен стимулировать освобождение гормона роста у ряда животных.
бета-Эндорфин — опиат мозга, состоящий из 31 аминокислотного остатка, был синтезирован в генетически сконструированных клетках в 1980 г. группой ученых из Австралии и США. Бета-эндорфин получен в клетках Е. coli в виде гибридного белка с бета-галактозидазой. Процедура синтеза бета-эндорфина включала: получение путем обратной транскрипции мРНК — кДНК, кодирующей белок- предшественник, содержащий помимо последовательности бета-эндорфина последовательность АКТГ и бета-липотропина (Р-ЛТГ), в дальнейшем удаляемые. Бета-эндорфин, полученный из гибридного белка и тщательно очищенный, обладал значительной биологической активностью. Он специфически взаимодействовал с антисывороткой против бета-эндорфина. От бета-эндорфина человека генно-инженерный бета-эндорфин отличался по двум аминокислотам, и эти отличия можно было легко устранить на нуклеотидном уровне путем замены двух кодонов в ДНК бактериальной плазмиды.
