Передача (трансдукция) информации через клеточную мембрану
Биомембранология Болдырев А.А., Кяйвяряйнен Е.И., Илюха В.А.
- Типы рецепторов при передаче информации через мембрану
- Передача гормонального сигнала через мембрану
- Передача сигнала в фоторецепторных клетках сетчатки
- Биохимические механизмы обоняния и усиления первичных запаховых сигналов
- Рецепторы возбудимых тканей
- Механочувствительные ионные каналы
- Рецепторы, отвечающие за перенос макромолекул в клетку
Важное свойство всех живых существ – способность воспринимать, перерабатывать и передавать информацию. Несмотря на громадное разнообразие систем получения и переработки информации, функционирующих в животных и растительных организмах, все они основаны на едином принципе. Процесс получения информации, как правило, начинается с взаимодействия сигнала (химического агента, кванта света, механического воздействия и т.п.) с рецептором – мембранным белком. Следующий этап – передача информации в центр переработки информации, находящийся внутри клетки. Этот процесс происходит с помощью вторичных мессенджеров (посредников). В ответ на получение сигнала вторичного мессенджера в клетке происходит биохимическая модификация специализированных молекул-эффекторов, через которые и формируется ответ биологической системы (рис. 63).
Именно по такому принципу функционируют нервная, гормональная и иммунная системы животных, на такие же стадии могут быть разложены и фотобиологические процессы, протекающие в организмах как животных, так и в растений. Общий принцип действия всех систем приема и передачи информации связан не только с химической модификацией мембранных белков, но и с изменением концентрации заряженных ионов внутри и вне клетки, формирование трансмембранного потенциала. В последнее время выяснилось, что этот процесс играет важную физиологическую роль не только в нервной ткани, но и при переработке информации в тромбоцитах, лимфоцитах, тучных клетках.
Сигнальные молекулы, включая молекулы большинства гормонов, как правило, не проникают внутрь клетки, а специфически взаимодействуют с рецепторами, локализованными во внешней клеточной мембране и представляющими собой интегральные мембранные белки, полипептидная цепь которых пронизывает толщу мембраны несколько раз и которые могут быть выделены из мембраны только после ее разрушения, например, с помощью детергента. Стероидные и тиреоидные гормоны, будучи гидрофобными по своей природе, способны проникать через плазматическую мембрану внутрь клетки, где они взаимодействуют с растворимыми рецепторными белками, локализованными в цито- и (или) нуклеоплазме. Они представляют, по-видимому, эволюционно более примитивный (но и более гарантированный) способ передачи информации. Разнообразные молекулы, инициирующие трансмембранную передачу сигналов, активируют рецепторы, действуя на них обычно при очень низких концентрациях, порядка 10-8-10-9 М.
Важно помнить, что поверхность животной клетки очень динамична. Внутриклеточные везикулы часто сливаются с плазматической мембраной, а участки плазматической мембраны, в свою очередь, могут отшнуровываться с образованием внутриклеточных везикул. Эти процессы составляют часть эндоцитозного и экзоцитозного путей, в которых рецепторы также играют важную роль.
БИОХИМИЧЕСКИЕ МЕХАНИЗМЫ ОБОНЯНИЯ И УСИЛЕНИЯ ПЕРВИЧНЫХ ЗАПАХОВЫХ СИГНАЛОВ
В начале 50-х годов ХХ в. Эрл Сёзерленд на примере адреналина, стимулирующего образование глюкозы из гликогена, расшифровал принципы действия адреналинового рецептора, который оказался общим для широкого круга рецепторов. Уже в конце ХХ в. было обнаружено, что восприятие запахов осуществляется аналогичным образом, вплоть до деталей строения белков-рецепторов.
Первичные рецепторные белки – это весьма сложные молекулы, связывание которых со своими субстратами вызывает в них ощутимые структурные изменения, вслед за которыми начинается каскад каталитических (ферментативных) реакций. Для рецептора запаха (одорантного), так же как и для зрительного рецептора, этот процесс завершается нервным импульсом, воспринимаемым нервными клетками соответствующих отделов мозга. На рис. 74 схематически показан механизм действия адреналинового рецептора. Согласно последним данным, строение одорантного рецептора совершенно аналогично.
Как видно на рисунке 74 рецепторный белок включает такую последовательность аминокислот, которая содержит семь гидрофобных регионов от 20 до 28 остатков в каждом. Эти полипептидные участки, свернутые в α-спираль, образуют микротрубочки. Таким образом, рецепторный интегральный белок представляет собой своеобразную пачку из семи микротрубочек, пересекающих биомембрану. Толщина липидного бислоя в мембране составляет 30 Å, а длина одного остатка в α-спирали равна 1,5 Å. Пептидные участки в 20–28 остатков на αспиральном участке белковой молекулы имеют достаточную длину, чтобы пересечь мембранный бислой. Такая структура интегральных белков характерна для рецепторов опсина в сетчатке глаза, рецепторов серотонина, адреналина, гистамина и одорантов.
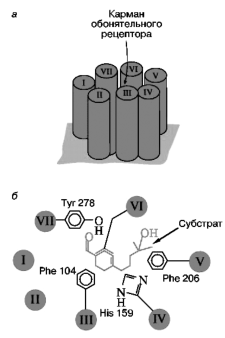
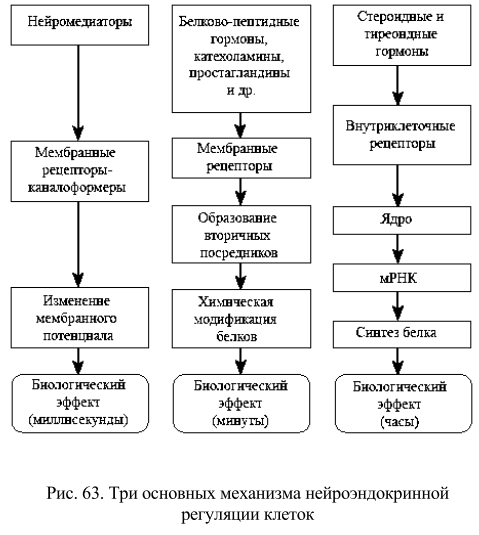
Рис. 74. Схема строения обонятельного рецептора а – поперечное сечение семидоменной структуры; б – схема взаимодействия одорант (лирал) – рецептор (вид сверху).
С внешней стороны клеточной мембраны белок-рецептор представляет собой розетку, построенную однотипно для разных рецепторных систем. На рис. 74 представлена схема взаимодействия между молекулой лирала (синтетический одорант) и обонятельным рецепторов крысы, представленным пятью гидрофобными доменами. В таких схемах в настоящее время широко используются аналоговые компьютерные модели, поскольку для большинства белков пока еще не имеется точных рентгеноструктурных данных. Рис. 75. Схематическая диаграмма строения обонятельного жгутика и два химических механизма усиления сигнала запаха внутри обонятельного волоска I – мембранный интегральный комплекс – рецептор (R) + ГТФсвязывающий белок (G) + аденилатциклаза (АЦ); II – мембранный интегральный комплекс – рецептор (R) + ГТФ-связывающий белок + фосфолипаза С (ФЛС).
Согласно этим представлениям, обонятельный рецептор образован семью гидрофобными доменами мембранного белка. Лиганд-связывающие аминокислотные остатки формируют «карман», расположенный, по крайней мере, на расстоянии 12 Å от поверхности клетки. Он похож на аналогичный центр рецептора адреналина и связывающий карман других надмолекулярных мембранных комплексов, также содержащих по семь гидрофобных спиральных доменов внутри мембранной структуры. В мембране обонятельного волоска представлены обе триады мембранных интегральных белков, представляющих собой нековалентно связанные рецепторы, G-белки и ферменты, образующие соответствующие вторичные мессенджеры, которые запускают внутриклеточный каскад реакций (рис. 75). Таким образом, фосфорилирование белков протеинкиназами и дефосфорилирование их соответствующими фосфатазами оказалось универсальным механизмом мгновенного ответа клетки на внешнее воздействие.
В результате фосфорилирования мембранных белков открываются каналы проводимости катионов, и, как следствие, мгновенно меняется мембранный потенциал клетки, в результате чего генерируется потенциал действия. Последний передается по аксону в обонятельную луковицу, где и происходит оценка и отделение биологически значимых сигналов от обонятельного «шума», а затем отобранные сигналы направляются в мозг, где и вызывают поведенческий ответ.
МЕХАНОЧУВСТВИТЕЛЬНЫЕ ИОННЫЕ КАНАЛЫ
Функционирование ионных каналов может зависеть от локального растяжения мембраны и изменения градиента ее кривизны. Канальные структуры, которые изменяют свою активность в зависимости от натяжения мембраны, называются механочувствительными, хотя кроме них описаны каналы, увеличивающие активность и при обратном изменении натяжения. Впервые Ca 2+ -проводящие механочувствительные каналы были показаны на эндотелиальных клетках животных, где они выполняют роль сенсора кровяного давления. Каналы с аналогичными свойствами были обнаружены в бактериях, грибах и высших растениях.
Функционирование механочувствительных каналов происходит в тесном взаимодействии с цитоскелетом. Чувствительность этих каналов к натяжению возрастает, если сила, приложенная к большому участку мембраны, концентрируется на канале посредством элементов цитоскелета. Связь осуществляется набором белков, известных как анкирины (см. выше). Выделяют два типа каналов, чувствительных к натяжению мембраны: SA-каналы (stretch-activated), активирующиеся при растяжении мембраны и SI-каналы (stretch-inactivated), которые при растяжении мембраны инактивируются. В зависимости от объекта и типа клетки встречаются механочувствительные каналы, селективные к К + , Cl — , а также Са 2+ и другим двухвалентным катионам, проницаемые для одно- и двухвалентных катионов, и неселективные (или слабоселективные) для анионов и катионов. Наиболее часто в качестве ингибитора механочувствительных каналов используют гадолиний (Gd 3+), который обратимо блокирует работу каналов в низких концентрациях (10 мкМ), действуя с наружной стороны мембраны.
В отличие от рецептор- и потенциал-зависимых ионных каналов, механочувствительные каналы имеют гораздо меньшую плотность распределения в мембранах (она составляет в среднем 1/мкм 2 ). Тем не менее, при мембранном потенциале -60 мВ кальциевый ток через SA-канал может достигать величин 0,1 нА. Наиболее важное значение механочувствительные ионные каналы имеют в ростовых движениях различного типа и в регуляции работы устьичного аппарата. Механическое взаимодействие клеток в ходе их развития приводит к натяжению (или сдвигам) клеточных мембран, активации механочувствительных каналов и появлению векторных ионных потоков, которые уже непосредственно осуществляют регуляцию процессов роста и дифференцировки. У млекопитающих (в том числе, у человека) функционирование механорецепторов выстилки слизистой желудка обеспечивают ощущение сытости. При генетическом нарушении этих каналов возникают заболевания, приводящие к булимии.
РЕЦЕПТОРЫ, ОТВЕЧАЮЩИЕ ЗА ПЕРЕНОС МАКРОМОЛЕКУЛ В КЛЕТКУ
Информация может передаваться в клетку не только с помощью ионных каналов или цепи реакций, регулируемых G-белками. На поверхности некоторых клеток имеются рецепторы, способные распознавать макромолекулы и «организовывать» их перенос через мембрану внутрь клетки. К таким клеткам относятся макрофаги, осуществляющие один из первых актов активации иммунной системы. В этом случае участок плазматической мембраны обволакивает захватываемый материал, который в итоге попадает внутрь клетки. В процессе этого акта он заключается в мембранный пузырек-везикулу, стенки которой образуются из участков плазматической мембраны. Этот процесс называется эндоцитозом.
Существуют три вида эндоцитоза:
- фагоцитоз – захват клеткой больших структурных компонентов, вплоть до целых клеток, например клеток бактерий одноклеточными организмами и макрофагами;
- пиноцитоз – неспецифический захват клетками внеклеточной жидкости и ее содержимого;
- специфический захват молекул, опосредованный специальными рецепторами (рис. 78).
В этом разделе мы рассмотрим только специфический эндоцитоз. Впервые эндоцитоз, обусловленный специфическими рецепторами, был обнаружен в середине прошлого века при изучении захвата яйцеклетками белков, которые используются для питания зародыша. Позднее было выяснено, что некоторые белки синтезируются в печени, оттуда переносятся руслом крови к яичникам, там связываются со специфическими рецепторами плазматической мембраны ооцита, а затем происходит «впячивание» плазматической мембраны, после чего рецептор с белком попадает внутрь клетки.
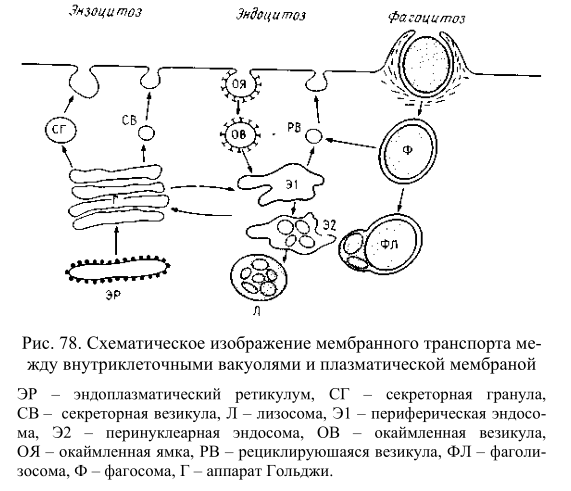
Рис. 78. Схематическое изображение мембранного транспорта между внутриклеточными вакуолями и плазматической мембраной ЭР – эндоплазматический ретикулум, СГ – секреторная гранула, СВ – секреторная везикула, Л – лизосома, Э1 – периферическая эндосома, Э2 – перинуклеарная эндосома, ОВ – окаймленная везикула, ОЯ – окаймленная ямка, РВ – рециклируюшаяся везикула, ФЛ – фаголизосома, Ф – фагосома, Г – аппарат Гольджи.
У млекопитающих по механизму опосредованного специфическими рецепторами эндоцитоза передаются структурные носители иммунитета от материнского организма к плоду. Антитела из кровотока материнского организма связываются с клетками плода, окружающими желточный мешок. На поверхности этих клеток имеются рецепторы, специфически связывающиеся с иммуноглобулинами и переносящие их в кровоток плода.
Клетки иммунной системы также функционируют с помощью эндоцитоза. Макрофаги захватывают антиген, внутри клетки он претерпевает процессинг – расщепление гидролитическими ферментами с вычленением сравнительно небольших фрагментов, несущих отдельные антигенные детерминанты. Заключительный этап этого процесса – экспрессия фрагментов антигена на поверхность макрофага, где они оказываются в комплексе с собственными антигенами гистосовместимости II класса (которые можно рассматривать как своего рода рецепторы). Далее запускается специфическая цепь иммунологических реакций, в которой участвуют лимфоциты различных типов.
В основе пиноцитоза и опосредованного рецепторами поглощения растворенных веществ лежит образование окаймленных ямок и окаймленных везикул. Термин «окаймленные ямки» относится к морфологии этих структур, выявляемой с помощью электронной микроскопии. Отличительной их особенностью является наличие решетчатой структуры из молекул белка клатрина, который связывается с углублениями на поверхности плазматической мембраны и везикулами, образующимися из таких ямок. На долю окаймленных ямок обычно приходится 1–2% общей площади поверхности плазматической мембраны, и большинство белков плазматической мембраны не обнаруживаются на этих участках. Однако определенные белки концентрируются в области формирования окаймленных ямок (возможно, с помощью специальных механизмов), и концентрация некоторых белков в этих ямках очень высока.
Как показано в модельных экспериментах in vitro, после образования эндоцитозных везикул оболочка из клатрина удаляется специфическим белком в ходе АТФ-зависимой реакции. Везикулы без клатрина становятся частью сложной системы трубочек и везикул, называемых периферическими эндосомами; они локализованы вблизи плазматической мембраны. Конечный пункт эндоцитозного пути находится во вторичных лизосомах, где происходит деградация отдельных растворенных веществ (таких, как ЛНП).
В табл. 12 перечислены некоторые рецепторы плазматической мембраны, участвующие в поглощении специфических лигандов с помощью окаймленных ямок и везикул. В некоторых случаях сродство рецептора к окаймленным ямкам постоянно, в других случаях рецепторы концентрируются в этих структурах только при связывании лиганда (например, рецептор фактора роста эпидермиса). Примерно 70% рецепторов ЛНП сконцентрировано в клатриновых ямках, где они легко подвергаются интернализации. Физиологический смысл этого явления заключается в том что с помощью опосредованного рецепторами эндоцитоза происходит захват клетками ЛНП из кровяного русла. Этот механизм представляет собой основной путь «доставки» холестерина к клеткам.
Таблица 12. Некоторые рецепторы, интернализуемые при эндоцитозе

Рецепторы ЛНП были открыты на мембранах фибробластов в конце ХХ в. Оказалось, что они специфически связывают ЛНП за счет «узнавания» апо-протеина 5-100 или апопротеина Е. При этом специфичность узнавания так велика, что связывание происходит даже при концентрации ЛНП 10 -9 М. Свободный холестерин, покидая лизосомы, участвует в формировании мембран, а в специализированных клетках надпочечников и яичников включается в синтез стероидных гормонов. Рецепторы ЛНП присутствуют практически во всех тканях, наибольшая их плотность наблюдается в клетках печени, надпочечников и яичников – органах, испытывающих наибольшую потребность в холестерине.
ЛНП-рецептор человека – это типичный рецептор группы I, который возвращается к плазматической мембране, в то время как его лиганд, сывороточный ЛНП, попадает в лизосому. По данным об аминокислотной последовательности рецептора он состоит из пяти доменов. Выраженная гомология с другими мембранными рецепторами отсутствует. Рецептор имеет единственный трансмембранный домен и непротяженный цитоплазматический С-концевой домен. Показано, что у лиц с таким генетическим заболеванием, как семейная гиперхолестеролемия, функция ЛНП-рецепторов существенно ослаблена.
