Окислительно-восстановительные процессы
Общая химия. Учебное пособие — Таирова А.Р., Кузнецов А.И. — 2005
- 8.1 Степень окисления элементов
- 8.2. Окислительно-восстановительные реакции
- 8.3. Составление уравнений окислительно-восстановительных реакций
- 8.3.1.Метод электронного баланса
- 8.3.2. Ионно-электронный метод
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ.
8.1 Степень окисления элементов. В простых веществах химическая связь — ковалентная неполярная. В двухцентровой двухэлектронной связи связывающая электронная пара симметрична и сосредоточена посредине межатомного расстояния. Оба взаимодействующих атома проявляют ковалентность, равную сумме порядков всех связей данного атома с другими атомами молекулы. Взаимодействующие атомы не имеют эффективных зарядов, связь неполярна, электровалентности атомов равны нулю.
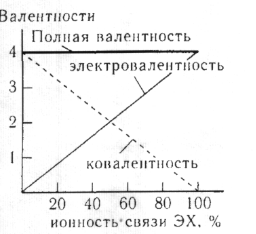
Рис.23. Изменение ковалентности и электровалентности центрального атома идеализированной молекулы состава ЭХ4 в зависимости от ионности химической связи; атом Х одновалентный атом, типа Н, F и т.п
Если химическая связь образована двумя атомами с близкими электроотрицательностями, то также образуется ковалентная связь. Ковалентность также равна порядку связи, относящемуся к той его доле, которая соответствует неполярной ковалентной связи. Однако часть электронной плотности химической связи в некоторой мере смещена к более электроотрицательному атому. На этом атоме появляется эффективный отрицательный заряд, а на менее электроотрицательном — эффективный, положительный заряд атома. Величина этого
заряда есть электровалентность атома. Значит, при повышении полярности атома убывает, а электровалентность – возрастает. В предельном случае полярной связи -ионной — связывающая электронная плотность полностью смещена к более электроотрицательномуатому. Эффективные заряды на взаимодействующих атомах приобретают мак симальные по модулю значения, а ковалентная составляющая связи отсутствует. Таким образом, в ионной связи ковалентность взаимодействующих атомов – равна нулю, а электровалентность достигает экстремальных значений (рис. 23).
Рис.23 построен на основании того, что ковалентность атома определяется неполярной составляющей химической связи, а электровалентность — эффективными зарядами атомов. Из рис.23 также видно, что, хотя ковалентность и электровалентности атомов изменяются различным образом, сумма ковалентности и модуля электровалентности, т. е. валентность атома остается постоянной.
Для уравнивания и определения вида возможных продуктов многих химических реакций существует специальный метод, основанный на понятии степени окисления. Для примера рассмотрим несколько соединений (табл. 20).
Таблица 20. Валентности и степени окисления атомов в некоторых соединениях
| Молекула | Ионность связи, % | Атом | Ковалентность | Электровалентность | Валентность:
v = ve+| ve | |
Степень окисления |
| С (алмаз) | 0 | 4 | 0 | 4 | 0 | 0 |
| SiH4 | 1,8 | Si
H |
3,93
0,98 |
+0,07
-0,02 |
4
1 |
+4
-1 |
| CH4 | 3,1 | C
H |
3,87
0,97 |
-0,13
+0,03 |
4
1 |
-4
+1 |
| CO2 | 15 | C
O |
3,40
1,70 |
+0,60
-0,30 |
4
2 |
+4
-2 |
| SiF4 | 59 | Si
F |
1,64
0,41 |
+2,36
-0,59 |
4
1 |
+4
-1 |
| H2S | 3,1 | S
H |
1,94
0,97 |
-0,06
+0,03 |
2
1 |
-2
+1 |
| SO3 | 15 | S
O |
5,10
1,70 |
+0,90
-0,30 |
6
2 |
+6
-2 |
| MgCl2 | 51 | Mg
Cl |
0,98
0,49 |
+1,02
-0,51 |
2
1 |
+2
-1 |
| CsF | 89 | Cs
F |
0,11
0,11 |
+0,89
-0,89 |
1
1 |
+1
-1 |
| HONO2 | H – O
(H)O – N N = O |
H
O O N |
0,71
1,66 1,90 3,80 |
+0,29
-0,34 -0,10 +1,20 |
1
2 2 5 |
+1
-2 -2 +5 |
Изтаблицы 20 видно, что по мере увеличения ионности связи уменьшается доля ковалентности атома и увеличивается доля электровалентности атома при постоянстве его общей валентности. В последнем столбце табл. 20 приведены значения валентности атома со знаком его электровалентности. Соответствующая величина называется степенью окисления.
Атом азота имеет всего четыре валентных орбитали, поэтому максимальная для него ковалентность равна четырем и, казалось бы, не может быть степени окисления равной пяти. Однако хорошо известно, что в молекуле азотной кислоты, ее производных и в ряде других соединений азот имеет степень окисления +5. В табл. 20 также приводится значение валентности азота, равное пяти. Поясним, его происхождение.
Три электрона азота образуют три σ -связи с соседними атомами кислорода и еще два — делокализованную трехцентровую π -связь с атомами кислорода, не связанными с атомом водорода. Расщепление МО — трех
центровой связи показано на рис. 25. Для трехцентровых МО характерно
такое расщепление, когда одна орбиталь становится связывающей, другая – несвязывающей, а третья — разрыхляющей. Определение порядка связи как полусуммы связывающих и разрыхляющих электронов в молекуле справедливо только для двухцентровых связей. Для многоцентровых и, в частности, для трехцентровой π — связи в молекуле азотной кислоты требуется другое, более строгое определение порядка связи. Связывающая π -МО дает вклад в порядок связи равный 1. В итоге ковалентность азота равна 4 (три σ — и одна π — связь). Рассмотрим вклад несвязывающей π -МО. Вид данной МО таков, что электроны, описываемые ею, находятся практически только на атомах кислорода О(2) и О(з). При этом на атомах кислорода возникают избыточные отрицательные заряды (-0,5), а на атоме азота — избыточный положительный (+1,0). Значит вклад данной МО в ковалентность атома равен нулю, а вклад в электровалентность азота равен +1. В итоге сумма ковалентности и электровалентности азота, т. е. его валентность равна 5, а степень окисления — (+5).
Таким образом, степень окисления характеризует валентность и электроотрицательность атома элемента в составе молекулы. Если бы связи в молекуле были абсолютно ионными, то степень окисления равнялась бы электровалентностям атомов.
Введено понятие степени окисления для характеристики состояния элементов в соединениях. Под степенью окисления (С.О.) понимается условный заряд атома в соединении, вычисленный, исходя из предположения, что соединение состоит из ионов. Определение степени окисления проводят, используя следующие правила:
1. Степень окисления элемента в простом веществе, например, в металле или в Н2, N2, О3 равна нулю.
2. Степень окисления элемента в виде одноатомного иона в соединении, имеющем ионное строение, равна заряду данного иона, например:
![]()
3. В соединениях с ковалентными полярными связями отрицательный заряд относят к более электроотрицательному элементу, причем, принимают следующие степени окисления:
а) для фтора (ЭО-4) С.О. = -1;
б) для кислорода (ЭО = 3,5) С.О. = -2, за исключением пероксидов, где С.О. = -1, надпероксидов (С.О. = —1/2), озонидов (С.О. = —1/3) и
OF2 (С.О. = +2);
в) для водорода (ЭО = 2,0) С.О. = +1, за исключением солеобразных гидридов, например LiH, где С.О. = -1;
г) для щелочных и щелочно-земельных металлов (ЭО = 0,7-1,0)
С.О. = +1 и +2 соответственно,
4. Алгебраическая сумма С.О. элементов в нейтральной молекуле
равна нулю, в сложном ионе — заряду иона.
Понятие С.О. для большинства соединений имеет условный характер, так как не отражает реальный эффективный заряд атома. Однако это понятие весьма широко используется в химии.
Большинство элементов могут проявлять переменную С.О. в соединениях (рис.24). В качестве примера рассчитаем С.О. азота в соединениях КNО2 и HNO3. Степень окисления водорода и щелочных металлов в соединениях равна +1, а С.О. кислорода -2. Соответственно С.О. азота равна
KNО2 1+х + 2(-2) = 0→х = +3 ,
HNO3 1 +х + 3(-2) = 0→х = +5.
Аналогичным способом можно определить степень окисления элементов в любых соединениях. Для примера приведем соединения азота с разными степенями его окисления:
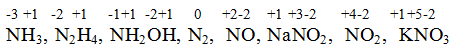
Как видно из рис.24, максимальная, а для неметаллов и минимальная степени окисления имеют периодическую зависимость от порядкового номера в периодической системе элементов, что обусловлено электронным строением атомов.
Степень окисления является формализованным отображением общей валентности элемента в соединении, определяемой суммой его ковалентности и электровалентности.
Степени окисления можно рассчитать квантовохимически на основании рассмотрения распределения электронной плотности в молекуле. Однако гораздо раньше для расчета степеней окисления элемента в его соединениях выработаны простые и удобные эмпирические правила, не требующие трудоемких квантово-химических расчетов. В краткой форме они приведены были выше. Рассмотрим их подробнее.
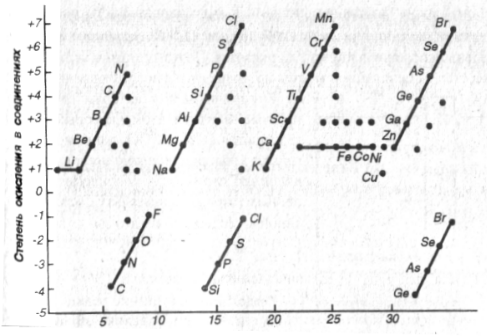
Рис. 24. Наиболее распространенные степени окисления первых 35 элементов. Линиями соединены высшие и низшие степени окисления
В простых веществах степень окисления, элемента всегда равна нулю. Нулевые значения степени окисления имеют, например, атомы в молекулах водорода (Н2), кислорода (О2), серы (S3, S4, S6, S8, … Sn где n обычно принимает значения порядка постоянной Авогадро), в чистых металлах (Me) и др.
В простых веществах только благородных газов, представляющих собой одноатомные молекулы при н.у., валентность элемента равна нулю. Атомы остальных элементов проявляют ненулевую валентность например, валентность углерода в алмазе равна четырем. Однако степень окисления углерода при этом принимается равной нулю, так как нет преимущественных смещений электронной плотности между эквивалентными атомами углерода и, следовательно, нет оснований представить вещество алмаз, состоящим из ионов С4+ и С4– . Поэтому степень окисления является лишь отображением валентности, но не совпадает с ней.
В сложных соединениях некоторые элементы проявляют всегда одну и ту же степень окисления, но для большинства элементов она может принимать несколько значений. Постоянную степень окисления имеют щелочные элементы (+ 1), бериллий, магний, щелочноземельные элементы (+2), фтор (- 1). Для водорода в большинстве соединений характерна степень окисления +1, а в его соединениях с ч-элементами и в некоторых других соединениях она равна — 1. Степень окисления кислорода, как правило, равна — 2; к важнейшим исключениям относятся пероксидные соединения, где она равна — 1, и фторид кислорода OF2, в котором степень окисления кислорода равна +2.
8.2. Окислительно-восстановительные реакции. Рассмотрим основные положения теории окислительно-восстановительных реакций.
- Окислением называют процесс отдачи электронов атомом, молекулой или ионом. Степень окисления при этом повышается. Например:
А1 — 3ē = А13+ Н2 — 2ē = 2Н+
Fe2+ — ē = Fe3+ 2С1– — 2ē = С12
2. Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом. Степень окисления при этом понижается. Например:
S + 2ē =S2-, С12 +2ē =2С1—, Fe3+ + ē = Fe2+
- Атомы, молекулы или ионы, отдающие электроны, называют восстановителями. Во время реакции они окисляются. Атомы, молекулы или ионы, присоединяющие электроны, называют окислителями.
Во время реакции они восстанавливаются. Так как атомы, молекулы и ионы входят в состав определенных веществ, то и эти вещества соответственно называют окислителями или восстановителями - Окисление всегда сопровождается восстановлением и, наоборот, восстановление всегда связано с окислением, что можно выразить уравнениями:
восстановитель — ē ↔ окислитель
окислитель +ē ↔ восстановитель
Окисление-восстановление — это единый, взаимосвязанный процесс.
Окисление приводит к повышению степени окисления восстановителя, а восстановление — к ее понижению у окислителя.
Повышение или понижение степени окисления атомов отражается в электронных уравнениях: окислитель принимает электроны, а восстановитель их отдает. При этом не имеет значения, переходят ли электроны от одного атома к другому полностью и образуются ионные связи или электроны только оттягиваются к более электроотрицательному атому и возникает полярная связь. О способности того или иного вещества проявлять окислительные, восстановительные или двойственные (как окислительные, так и восстановительные) свойства можно судить по степени окисления атомов окислителя и восстановителя.
Атом того или иного элемента в своей высшей степени окисления не может ее повысить (отдать электроны) и проявляет только окислительные свойства, а в своей низшей степени окисления не может ее понизить (принять электроны) и проявляет только восстановительные свойства. Атом же элемента, имеющий промежуточную степень окисления, может проявлять как окислительные, так и восстановительные свойства.
Например:

При окислительно-восстановительных реакциях валентность атомов может и не меняться. Например, в окислительно-восстановительной реакции Н02 + С102 = 2H+Cl валентность атомов водорода и хлора до и после реакции равна единице. Изменилась их степень окисления. Валентность определяет число связей, образованных данным атомом, и поэтому знака заряда не имеет. Степень же окисления имеет знак плюс или минус.
Таблица 21 Важнейшие восстановители и окислители
| Восстановители | Окислители |
| Металлы, водород, уголь
Оксид углерода (II) СО Сероводород H2S, сульфид натрия Na2S, оксид серы (IV) SO2, сернистая кислота H2SO3 и ее соли, тиосульфат натрия Na2S2O3 Иодоводород HI, бромоводородная кислота HBr, соляная кислота HCl Хлорид олова (II) SnCl2, сульфат железа (II) FeSO4, сульфат марганца (II) MnSO4, сульфат хрома (III) Cr2(SO4)3 Азотистая кислота HNO2, аммиак NH3, гидразин N2H4, оксид азота (II) NO Фосфористая кислота H3PO3, ортомышьяковистая кислота H3AsO3, гексоцианоферрат (II) калия K4[Fe(CN)6] Альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза Катод при электролизе |
Галогены
Оксид марганца (VII) Mn2O7, оксид марганца (IV) MnO2, перманганат калия KMnO4, манганат калия K2MnO4 Оксид хрома (VI) CrO3, хромат калия K2CrO4, дихромат калия K2Cr2O7 Азотная кислота HNO3 Кислород O2, озон O3, пероксид водорода H2O2 Серная кислота H2SO4 (конц.), селеновая кислота H2SeO4 Оксид меди (II) CuO, оксид серебра (I) Ag2O, оксид свинца (IV) PbO2 Ионы благородных металлов (Ag+, Au3+, и др.) Висмутат натрия NaBiO3, персульфат аммония (NH4)2S2O8, гексацианоферрат (III) калия K3[Fe(CN)6], хлорид железа (III) Гипохлориты, хлораты, перхлораты Царская водка, смесь концентрированных азотной и плавикивой кислот Анод при электролизе |
