Мембранные липиды. Состав биологических мембран
Биомембранология Болдырев А.А., Кяйвяряйнен Е.И., Илюха В.А.
- 4.1. Мембранные липиды
- 4.1.1. Фосфолипиды, гликолипиды, стероиды
- 4.1.2. Роль холестерина в биологических мембранах
- 4.1.3. Жирные кислоты и их пространственная конфигурация
- 4.2. Принципы организации липидного бислоя
- 4.2.1. Фосфолипиды как структурная основа бислоя
- 4.2.2. Трансмембранная асимметрия липидов
- 4.2.3. Различные виды подвижности компонентов липидного бислоя
- 4.2.4. Дефектные зоны. Роль холестерина
- 4.2.5. Микровязкость мембран
- 4.2.6. Фазовые переходы мембранных липидов
- 4.2.7. Биологические функции мембранных липидов
- 4.3. Мембранные белки – особенности строения
- 4.3.1. Локализация и подвижность белков в бислое
- 4.3.2. Белок-липидные взаимодействия
- 4.3.3. Функции мембранных белков
- 4.4. Цитоскелет и гликокаликс мембран. Углеводы мембран
В состав биологических мембран входят представители трех классов веществ, обмен которых составляет основу метаболизма: это белки, жиры (липиды) и углеводы. В весовом отношении белки составляют 40–60%, согласно некоторым данным от 20% до 80%, остальное приходится на долю липидов. Часть углеводов представлена свободными олигосахаридами, а часть входит в состав сложных липидов (гликолипиды) или сложных белков (гликопротеиды). Белковый состав мембран чрезвычайно разнообразен, он в значительной мере определяет свойства мембран и их функциональную активность. Мембранные белки, как правило, почти не отличаются от растворимых по количеству входящих в них гидрофобных аминокислот. Однако эти гидрофобные аминокислоты сгруппированы в мембранных белках в ряд доменов так, что гидрофильных групп пептидной цепи недостает для их маскировки. Такие белки не активны вне гидрофобного окружения. Мембраны предоставляют им возможность стабилизировать свою структуру и нормально функционировать.
ФОСФОЛИПИДЫ, ГЛИКОЛИПИДЫ, СТЕРОИДЫ
Липиды клеточных структур эукариотических клеток представлены 3 основными группами: фосфолипиды, гликолипиды и стероиды. Распространение и свойства фосфолипидов изучены наиболее детально.
Фосфолипиды подразделяются на 2 группы:
- глицерофосфолипиды (производные фосфатидной кислоты – фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозит)
- сфингофосфолипиды (производные церамида, сфингомиелины).
Глицерофосфолипиды представляют собой производные фосфатидной кислоты, к гидроксилу фосфорной кислоты которой сложноэфирной связью присоединен радикал Х (рис. 4., табл. 1), где R1 и R2 – ацильные остатки жирных кислот, содержащих от 12 до 18 атомов углерода (как правило, четное количество). В названия фосфолипидов, потерявших одну из двух ацильных цепей, вводится приставка «лизо». Лизофосфолипиды обнаруживаются в мембранах в небольших количествах – появление этих веществ приводит к нарушению структуры бислоя и лизису клеток.
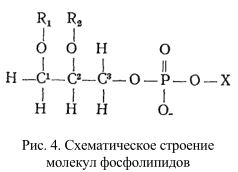
Таблица 1. Классификация фосфолипидов осуществляется по структуре полярных радикалов
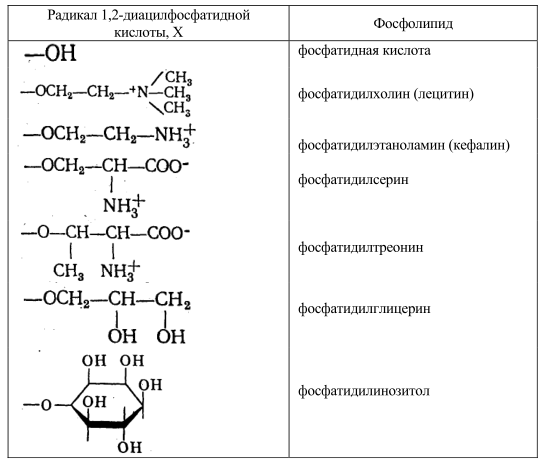
Характеристика липидного состава некоторых мембран животных представлена ниже (табл. 2). Видно, что основными липидами мембран животных клеток являются глицерофосфолипиды: фосфатидилхолин и фосфатидилэтаноламин. Структура фосфатидилхолина представлена на рисунке 5. Наиболее часто встречающиеся фосфолипиды построены по единому плану, их молекулы стерически хорошо соответствуют друг другу. В то же время, огромное разнообразие фосфолипидов обеспечивается различием жирных кислот, которые входят в состав их молекул. Так, есть несколько десятков природных видов фосфатидилхолина, причем диолеилфосфатидилхолин сильно отличается по своим свойствам от дипальмитоилфосфатидилхолина.
Таблица 2. Липидный состав некоторых биологических мембран (в % от общего их количества)
Существует несколько групп фосфолипидов, отличающихся от приведенных в таблице 1 по своему строению:
1) плазмалогены,
2) диольные фосфолипиды
3) дифосфатидилглицериды.
В молекуле плазмалогена первый углерод глицерина (С 1) вместо ацильной группы присоединяет альдегид (рис. 4). Радикал Х в плазмалогенах мышц представлен холином, в плазмалогенах мозга – серином или этаноламином. Диольные фосфолипиды характеризуются тем, что вместо глицерина в составе их молекул содержатся двухатомные спирты: этиленгликоль или пропандиол; это одноцепочечные липиды. По физико-химическим свойствам, например растворимости, диольные фосфолипиды напоминают лизоформы фосфолипидов. В отношении клеточных мембран они обладают более сильной разрушающей способностью, чем лизолецитин. В малых дозах они не повреждают мембрану, а лишь изменяют ее свойства, например, повышают проницаемость для небольших молекул и ионов. В больших дозах они вызывают гемолиз эритроцитов, снижают рецепцию ацетилхолина, модифицируют иммунные реакции. По-видимому, некоторые клетки используют это свойство – начинают интенсивно синтезировать диольные липиды в период быстрого роста и прекращают их образование, когда клеточный рост замедляется. Возможно, это связано с тем, что в период роста клеток их мембраны должны быть более лабильными. Они присутствуют в виде незначительных примесей в органах и тканях, характеризующихся усиленной активностью (созревание семян, регенерация печени и т.д.).
Биологическое действие диольных фосфолипидов основано на их способности модифицировать структуру мембраны. Любопытно, что существуют организмы, которым не страшны высокие концентрации диольных липидов. Клетки морских звезд, например, могут накапливать очень много диолов без вреда для их собственных мембран, хотя механизм защиты клеточных мембран от этих соединений не известен.
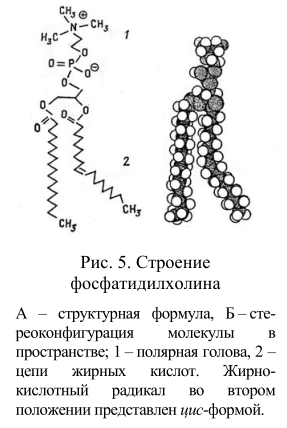
Жирнокислотный радикал во втором положении представлен цис-формой.
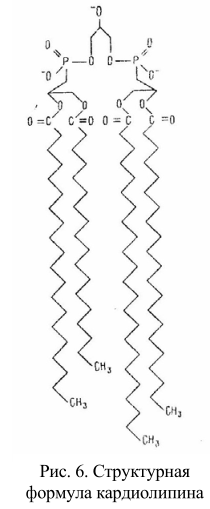
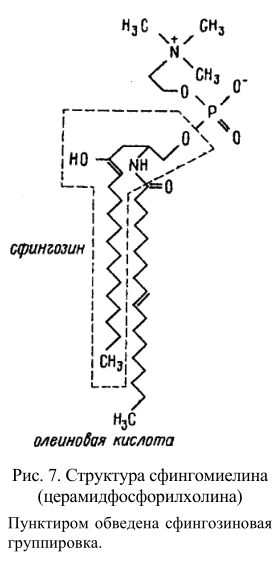
Дифосфатидилглицериды – наиболее широко распространенным представителем этой группы фосфолипидов является кардиолипин – непременный компонент митохондриальных мембран, выделенный первоначально из сердечной мышцы (рис. 6). Как упоминалось выше, кроме глицерофосфолипидов в группу фосфолипидов входят и сфинголипиды, которые можно представить как производные церамида (жирнокислотного эфира ненасыщенного аминоспирта сфингозина) и монофосфорных эфиров спиртов. В случае наиболее распространенного сфинголипида – сфингомиелина таким эфиром является фосфорилхолин (рис. 7).
Сфингомиелин содержится в больших количествах в белом веществе мозга, в миелиновых оболочках нервных стволов. Жирные кислоты, входящие в его состав, – длинноцепочечные и содержат мало двойных связей. Обычно это лигноцериновая С 24:0 и невроновая С 24:1 кислоты. В сером веществе мозга до 70% жирных кислот сфингомиелина представлено стеариновой кислотой С 18:0.
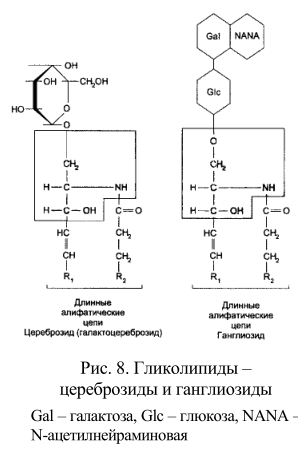
Гликолипиды клеточных мембран — гликозильные производные церамида, представлены цереброзидами, сульфатидами и ганглиозидами (рис. 8). В гликолипидах гидрофобная часть представлена церамидом. Гидрофильная группа – углеводный остаток, присоединенный гликозидной связью к гидроксильной группе у первого углеродного атома церамида (рис. 9).
В зависимости от длины и строения углеводной части различают цереброзиды, содержащие моно- или олигосахаридный остаток, и ганглиозиды, к ОН-группе которых присоединен сложный, разветвленный олигосахарид, N-ацетилнейраминовую кислоту (рис. 8). Гликолипиды в большом количестве присутствуют в мембранах миелина. Природной функцией мембранных ганглиозидов является участие в дифференцировке нейрональной ткани, ганглиозиды других клеток — лимфоцитов, определяют видоспецифичность и регулируют межклеточные контакты. Накапливается все больше фактов, характеризующих роль различных гликолипидов в функции иммунокомпетентной системы организма. При определенных состояниях организма некоторые ганглиозиды могут являться модуляторами иммунного ответа. Стероиды – спирты со стерановым скелетом, к которым относятся как немембранные липиды (из них наиболее важны гормоны), так и компоненты мембран. В перечень мембранных компонентов стероидного ряда входят холестерин, ситостерин, тетрахименин. В тканях животных распространен холестерин.
В растительных клетках холестерин не обнаружен, его заменяют фитостерины. У бактерий стероиды отсутствуют. Холестерин и его эфиры – непременные составляющие плазматических мембран клеток животных. При этом холестерин легче встраивается в мембрану, чем его эфиры (рис. 10). Молекула холестерина не содержит длинных прямых цепочек, а состоит из четырех колец; крайнее шестичленное кольцо соединено с полярной гидроксильной группой (ОН), а наиболее отдаленное от него пятичленное кольцо – с разветвленной углеводородной цепочкой из восьми атомов углерода (рис. 10).
Таким образом, молекулы холестерина, как и другие липидные молекулы, имеют полярную голову и вытянутую в длину неполярную часть. Поэтому они хорошо встраиваются в бислойные липидные структуры, образующие клеточные мембраны (рис. 10). При образовании эфиров холестерина (через гидроксильную группу) связь молекулы с бислоем ослабляется, что облегчает его вытеснение из мембраны. Особенно много холестерола содержится в наружных мембранах. Например, в плазматической мембране клеток печени холестерин составляет около 30% всех мембранных липидов.
ЖИРНЫЕ КИСЛОТЫ И ИХ ПРОСТРАНСТВЕННАЯ КОНФИГУРАЦИЯ
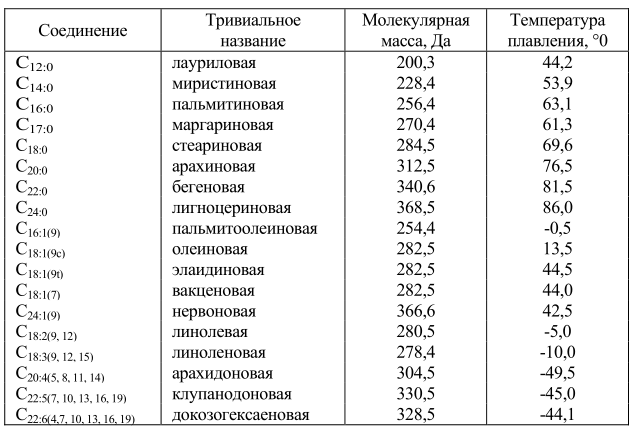
И фосфо-, и гликолипиды включают в состав молекул различные жирнокислотные радикалы (табл. 3). Холестерин и его аналоги также способны образовывать эфиры с разнообразными жирными кислотами. Вследствие этого свойства образующихся при этом липидов сильно варьируют. При всем разнообразии жирных кислот преобладающими для данной ткани являются обычно две или три из них.
В организме животных кроме пальмитиновой и олеиновой кислот содержатся большие количества стеариновой кислоты, а также и более высокомолекулярные кислоты с числом атомов углерода 20 и более. Как правило, они имеют четное количество атомов углерода; жирные кислоты с нечетным числом атомов встречаются только в составе цереброзидов и ганглиозидов.
Ацильные связи в молекулах природных фосфолипидов, как правило, представлены различными жирными кислотами. Они различаются как длиной цепи, так и степенью ее ненасыщенности. Если ненасыщенной является лишь одна жирнокислотная цепь, то она присоединена ко второму углеродному атому глицерина. Число двойных связей в молекулах жирных кислот колеблется от 1 до 6 и зависит от среды обитания, состава пищи, сезона и т.д. Двойные связи в жирных кислотах животного происхождения разделены метиленовой группировкой –СН=СН-СН 2 -СН=СН-.
В высших растениях присутствуют, в основном, пальмитиновая, олеиновая, и линолевая кислоты (стеариновая почти не обнаруживается), а кислоты с четным числом атомов углерода от 20 до 24 встречаются крайне редко. Жирные кислоты растений часто имеют сопряженные (конъюгированные) связи: -СН=СН-СН=СН-.
Таблица 3. Распространенные жирные кислоты в составе мембранных липидов
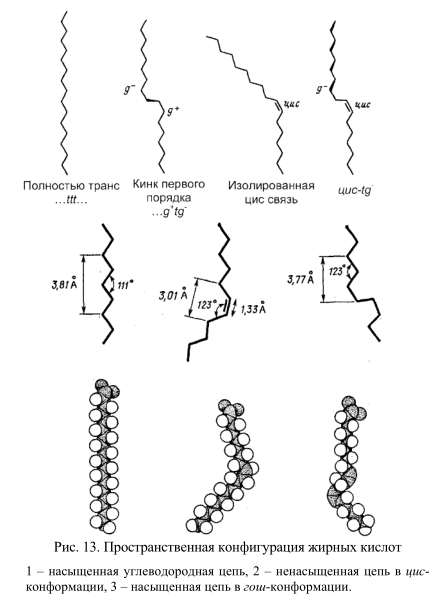
Углеродные связи в молекулах жирных кислот имеют различную конформацию (рис. 13). По своей структурной конфигурации насыщенные жирные кислоты сильно отличаются от ненасыщенных. Насыщенные жирные кислоты могут принимать множество конфигураций вследствие высокой свободы вращения вокруг одиночных С-С связей. Энергетически наиболее выгодной является транс-конфигурация. Ненасыщенные жирные кислоты имеют жесткую структуру, поскольку вращение вокруг двойных связей невозможно. Они существуют либо в транслибо в цис-конфигурации. Ненасыщенные жирные кислоты содержат двойные связи почти всегда в цис-конформации (Рис. 13), транс-ненасыщенные жирные кислоты в природе почти не встречаются. Исключение составляет лишь вакценовая кислота – конформационный антипод олеиновой кислоты. Температура плавления ее 44ºС, в то время как олеиновая кислота плавится при температуре 13,5ºС.
Цис-конфигурация двойной связи обусловливает изгиб цепи под углом приблизительно 30º. По этой причине цис-ненасыщенные жирные кислоты с одной двойной связью вызывают локальные возмущения бислоя. При этом длина такой цепи уменьшается, а занимаемый ею объем возрастает (рис. 13). В области локализации двойных цис-связей образуются изгибы (так называемая гошформа).
При повышении температуры тепловая подвижность жирнокислотных цепей приводит к спонтанному возникновению изгибов. Если изгибы, соответствующие гош-конформации, появляются на близлежащих участках жирнокислотной цепи, эта область может принимать вид петли или полости (кинк). В результате взаимопревращения транс- и гош-конформаций (так называемого трансгош-перехода) кинки могут «скользить» вдоль цепи, обеспечивая перемещение их содержимого поперек мембраны. Таким образом, может осуществляться диффузия захваченной воды через гидрофобный бислой.
При повышении плотности упаковки бислоя конфигурационная подвижность С-С-связей ограничивается. В таком бислое подвижность цепей ограничена согласованными колебаниями или вращательной подвижностью около точки прикрепления жирнокислотных радикалов к полярной «головке» фосфолипида. В этой ситуации в бислое наиболее предпочтительны две конформации цепи: когда вся цепь находится в транс-конфигурации или когда имеется «двойной гош», то есть изгибы, возникающие на двух соседних участках цепи вследствие образования гош-конформации, компенсируют друг друга, и вся цепь в целом не имеет изгибов.
У бактерий полиненасыщенные жирные кислоты, как правило, отсутствуют. Для их мембран также характерно более высокое содержание свободных жирных кислот, которые в мембранах растений и животных содержатся в исчезающе малых количествах. Синтез 16–18-углеродных жирных кислот осуществляется в цитоплазме. Удлинение жирнокислотных цепей осуществляется ферментными системами эндоплазматического ретикулума при участии НАДФН и малонил-КоА. Процесс удлинения может протекать также и в матриксе митохондрий. Образование двойных связей происходит при участии десатураз. У животных превращения олеил-КоА в олеинол-КоА (необходимых для вторичной десатурации) не происходит, вследствие чего линолевая, линоленовая и арахидоновая (полиненасыщенные) кислоты являются для них незаменимыми.
Ввиду высокой скорости обмена мембранных липидов синтез мембранных компонентов постоянно требует большого количества жирных кислот для образования диацилглицеридов. Из них образуются фосфатидная кислота, лежащая в основе обмена фосфолипидов, или галактозилдиглицерид, приводящий к гликолипидам. Жирные кислоты включаются также в обмен сфинганиновых соединений, приводящий к образованию церамида и сфингозина. В обмен стероидов жирные кислоты вступают на последних стадиях, когда становится возможным образование эфиров холестерина и его аналогов.
Жирнокислотный состав мембранных липидов животных, в отличие от бактериальных и растительных организмов, не так своеобразен, но более вариабелен. Разные липиды обладают различным жирнокислотным составом (табл. 4). Специфика этого состава сохраняется при условии неизменности среды обитания, преимущественного характера питания и т.д.
Таблица 4. Жирнокислотный состав фосфолипидов эритроцитов человека
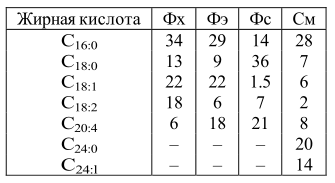
Поскольку все фосфолипиды являются продуктами обмена фосфатидной кислоты, можно заключить, что именно жирнокислотный состав ее молекул будет определять, какой вид фосфолипида образуется из этого предшественника в данных условиях. Но изменение состава диеты, особенно ее липидной части, быстро приводит к изменению липидного состава мембранных структур. Смена условий среды обитания, например, при переходе к зимней спячке у животных, при изменении солености у проходных рыб (смолтификация) и т. д., также изменяют жирнокислотный состав мембранных липидов, приспосабливая свойства мембран к условиям среды и новым потребностям организма.
Гипотеза адаптационной роли мембранных липидов была выдвинута и обоснована Е.М. Крепсом. Согласно этой гипотезе при сравнении мембран мозга рыб разных сред обитания наиболее резкие различия в жирнокислотном составе обнаруживают ганглиозиды (гликолипиды). В этой же фракции наиболее быстро обнаруживаются изменения в наборе жирных кислот при смене температур и глубины обитания, а именно: понижение температуры и увеличение глубины синергично повышают содержание полиненасыщенных жирных кислот в составе ганглиозидов. Цереброзиды и сульфатиды (другие гликолипиды) адаптационной изменчивости не проявляют.
