8.1. Производные пиримидин-2,4,6-триона (барбитураты)
8.2. Производные 1,4-бензодиазепина
8.3. Производные фенотиазина
8.4. Производные пиразола
8.5. Производные пурина
8.6. Производные фенилалкиламина
8.7. Каннабиноиды
8.8. Производные индола и некоторые галлюциногены
8.8.1. Алкалоиды чилибухи
8.8.2. Производные индола — галлюциногены
8.8.3. Фенциклидин и его аналоги (галлюциногены)
8.9. Опиаты и опиоиды
8.9.1. Алкалоиды мака снотворного и их синтетические аналоги
8.9.2. Опиоиды
8.9.3. Количественное определение опиатов и опиоидов
8.10. Производные тропана
8.11. Производные пиридина и пиперидина
8.12. Производные хинолина
8.13. Производные п-аминобензойной кислоты
8.1. Производные пиримидин-2,4,б-триона (барбитураты)



Токсикологическое значение. Впервые снотворное действие барбитуратов было обнаружено в начале XX в. Э.Фишером и Ф.Мерингом. В 1904 г. Э.Фишером был получен барбитал. В последующие годы было синтезировано большое число производных бар- битуровогцшслоты и изучена связь между химическим строением и действием на организм.
Важным действием барбитуратов на организм является угнетение центральной нервной системы. Этот процесс избирательно захватывает кору головного мозга и центры ствола мозга. С лечебной целью производные барбитуровой кислоты находят применение в медицинской практике в качестве снотворных и успокаивающих средств. По продолжительности сна, вызываемого барбитуратами, их делят на 3 группы: длительного действия (барбитал, фенобарбитал); средней продолжительности действия (бутобарбитал, барбамил, этаминал-натрий); короткого действия (гексенал).
В настоящее время в медицинской практике находят применение барбитал и фенобарбитал. Барбитал назначают внутрь перед сном по 0,25-0,5 г, фенобарбитал — по 0,1-0,2 г. Фенобарбитал в качестве снотворного средства применяется редко. Его чаще используют как противосудорожный препарат в дозе 0,01-0,03 г 2-3 раза в день. Фенобарбитал входит в состав некоторых готовых лекарственных форм «Пенталгин», «Андипал», «Беллатаминал», «Теофедрин», «Корвалол», «Валокордин», «Барбовал» и др.
Этаминал-натрий и барбамил исключены из Государственного реестра лекарственных средств РФ и перенесены в «Список наркотических и психотропных средств, оборот которых в РФ ограничен».
Бутобарбитал, барбитал и некоторые другие барбитураты используются как вспомогательные средства при общей анестезии и при судорожных состояниях. Бутобарбитал входит в состав сложной лекарственной формы «Беллоид».
Известно развитие пристрастия к барбитуратам и синергизма при приеме их с другими препаратами. Злоупотребление барбитуратами приводит к наркомании (особенно барбамила и этаминал-натрия). Картина опьянения напоминает по внешним признакам алкогольное опьянение: приятное ощущение состояния эйфории, общего благополучия. Позже наступает оглушенность, сонливость, вплоть до комы. Состояние барбитуровой абстиненции развивается на следующие сутки и характеризуется мрачным настроением, тревогой, кишечными коликами, атаксией, тремором рук, судорогами, психической опустошенностью. Резко меняется соматическое состояние, наступает одряхление, снижается давление. Характерны неврологические расстройства — дрожание, атакси- ческая походка, ослабление многих рефлексов.
При барбитуровой наркомании возникают психозы, подобные алкогольным, с наплывом зрительных и слуховых галлюцинаций угрожающего характера. Длительность стадии — 2-3 сут. Возможны сумеречные расстройства сознания, связанные с абстиненцией, судорожные припадки, доходящие до эпилептического статуса при отнятии барбитуратов. Отравления барбитуратами встречаются относительно редко. Чаще эти препараты используются с целью самоубийства. Большинство острых отравлений барбитуратами имеют сходную клиническую картину и характеризуются незначительными морфологическими изменениями. Клиническое течение отравления связано с принятой дозой вещества и чувствительностью организма.
Токсические дозы барбитуратов вызывают первоначально наркотическое опьянение, затем коматозное состояние, которое осложняется сердечно-сосудистой или дыхательной недостаточностью. Тяжелые отравления характеризуются глубокой комой, редким поверхностным дыханием, слабым пульсом, цианозом. Зрачки у пострадавшего узкие, не реагирующие на свет. В заключительной стадии отравления, вследствие поражения дыхательного цетра, дыхание становится неравномерным, после чего наступает его остановка.
Токсическое действие барбитуратов усиливают наркотики, алкоголь, транквилизаторы. Токсическими дозами для барбитала считают 3—4 г, для барбамила — 1-3 г, для фенобарбитала — 0,6-1 г; смертельными — 6-10, 4-6 и 4-10 г соответственно (М.Д.Швайкова).
Патологоанатомическая картина при отравлении барбитуратами нехарактерна. При вскрытии в головном мозге обнаруживают точечные кровоизлияния, дегенеративные изменения и некрозы в подкорковых центрах. В ряде случаев на коже обнаруживают характерные пузырьки различной величины с резко очерченными границами, наполненные желтовато-коричневой жидкостью. Эти пузырьки появляются в течение 24 ч после приема яда, что связано с токсическим поражением капилляров кожи.
Данные о сохраняемости барбитуратов в трупе разноречивы. Часть авторов считают, что барбитал способен сохраняться в трупе около 1 мес., другие утверждают, что этот срок составляет 1-2 г. Н.А.Горбачева и А.Ф.Рубцов указывают, что барбитал способен сохраняться в трупном материале до 3 лет.
Обычно барбитураты принимают перорально в виде таблеток, порошков, Большинство барбитуратов всасываются в ЖКТ достаточно быстро, фенобарбитал всасывается относительно медленно, его биодоступность составляет 80%. Барбитураты способны кумулироваться в организме, и их длительное применение может привести к острым отравлениям, особенно при недостаточной функции почек.
В организме человека барбитураты подвергаются различным процессам метаболизма. Барбитал, бутобарбитал и фенобарбитал метаболизируют на 15%, этаминал и барба- мил — на 90%. Остальная часть выводится почками в неизмененном виде.
В I фазе метаболизма барбитал отщепляет этильный радикал и окисляется с образованием спиртового гидроксила у алкильного радикала в 5 положении. Фенобарбитал 1 в I фазе метаболизма окисляется с образованием парагидроксипроизводного фенильного
радикала. Этаминал-натрий, бутобарбитал и барбамил окисляются в I фазе метаболизма с образованием гидрокси- и карбоксипроизводных в алкильных радикалах в положении 5.
Во II фазе метаболизма образуются конъюгаты нативных барбитуратов и их окисленных производных с глюкуроновой кислотой.
Пути метаболизма производных барбитуровой кислоты




Методы определения барбитуратов в биологических объектах
Объекты анализа:
- трупный материал (внутренние органы);
- биологические жидкости (кровь, моча);
- лекарственные препараты.это свойство.
Свойства барбитуратов. Барбитураты — белые кристаллические вещества без запаха. Они практически нерастворимы или малорастворимы в воде, растворимы в этиловом спирте, диэтиловом эфире, этилацетате, в растворах щелочей, мало растворимы в хлороформе. Барбитураты обладают слабыми кислотными свойствами. Значения показателя константы ионизации представлены в таблице 15. Некоторые барбитураты выпускаются в виде натриевых солей, которые по растворимости отличаются от других барбитуратов, но условия извлечения из кислой или щелочной среды обычно уравнивают
Таблица 15. Значения рКа для производных барбитуровой кислоты
|
Барбитурат |
рКа |
|
Барбитал |
7,97 |
|
Барбамил* |
7,96 |
|
Фенобарбитал |
7,45 |
|
Этаминал* |
8,20 |
* В виде кислотной формы.
Характерным свойством барбитуратов является их способность возгоняться без разложения, что часто используется с целью очистки извлечений из биологических объектов (см. раздел 6.4).
Для анализа используют хлороформный (эфирный) экстракт, полученный из водной вытяжки из объекта при рН=2. Анализ на производные барбитуровой кислоты проводят, если при ТСХ-скрининге на пластинке получены пятна сине-фиолетового цвета при детектировании солями ртути (II) и раствором дифенилкарбазона в хлороформе (см. раздел 7.1.2).
Для обнаружения индивидуальных веществ используют тонкослойную хроматографию в частной системе растворителей, химический метод, высокоэффективную жидкостную хроматографию, УФ-спектрофотометрию, ИК-спектроскопию, газовую хроматографию и сочетание газовой хроматографии с масс-спектрометрией.
Химический метод основан на применении реакций комплексообразования и микро- кристаллоскопических реакций.
Реакция с аммиачным раствором нитрата кобальта. К части остатка после испарения хлороформного (эфирного) экстракта, помещенного в фарфоровую чашку, добавляют с помощью стеклянной палочки смесь из 1% спиртового раствора ацетата кобальта и 25% раствора аммиака в соотношении 1:1. При наличии в остатке производных барбитуровой кислоты появляется красно-фиолетовое окрашивание.
Оценка. Реакция чувствительна. Имеет судебно-химическое значение при отрицательном результате.
Реакция обнаружения кислотной формы барбитуратов. На предметное стекло наслаивают экстракт путем его последовательного испарения. Полученный сухой остаток растворяют в капле концентрированной серной кислоты. Рядом наносят 1 каплю воды очищенной, после чего обе капли осторожно соединяют с помощью тонкой стеклянной палочки. Через 10-20 мин (иногда через 60 мин и даже через 3 сут.) при хранении стекла во влажной камере наблюдают образование кристаллического осадка (под микроскопом) с характерной для каждого барбитурата формой кристаллов.


Барбитал кристаллизуется в виде бесцветных прозрачных прямоугольных призм (рис. 28). Фенобарбитал образует сфероиды и сростки в виде «снопов», «ежей», состоящих из тонких бесцветных игольчатых кристаллов (рис. 29). Барбамил образует прозрачные шестиугольные пластинки и длинные призмы, группирующиеся в сфероиды (см. рис. 30). Этаминал кристаллизуется в виде характерных сростков из призматических кристаллов (см. рис. 31). Бутобарбитал образует осадок, состоящий из прозрачных призм и сростков из них.
Эта реакция характеризуется высокой специфичностью, но низкой чувствительностью (табл. 16).
Таблица 16. Пределы обнаружения барбитуратов по реакции выделения кислотной формы
|
Барбитурат |
Предел обнаружения, мкг |
При разведении или в пробе |
|
Барбамил |
21,0 |
6.10 000 |
|
Барбитал |
80,0 |
6:1000 |
|
Бутобарбитал |
16,0 |
в пробе |
|
Фенобарбитал |
41,0 |
3:1000 |
|
Этаминал |
50,6 |
5:1000 |
Таблица 17. Предел обнаружения барбитуратов по реакции с хлорцинкйодом
|
Барбитурат |
Предел обнаружения, мкг |
При разведении или в пробе |
|
Барбамил |
7,0 |
1:5000 |
|
Барбитал |
4,0 |
3:10 000 |
|
Бутобарбитал |
6,0 |
в пробе |
|
Этаминал |
4,0 |
4:10 000 |
Оценка. Реакция приемлема при относительно больших количествах барбитуратов. Кроме того, по данным некоторых авторов, многие барбитураты могут находиться в нескольких полиморфных модификациях. Поэтому необходимо учитывать возможность появления нескольких кристаллических форм одного и того же барбитурата.
Реакция с хлорцинкйодом. На предметное стекло наносят экстракт и испаряют досуха. К сухому остатку прибавляют 1 каплю раствора хлорцинкйода. Стекло помещают во влажную камеру. Через 10-15 мин наблюдают под микроскопом характерную форму образовавшихся кристаллов.
С хлорцинкйодом этаминал образует сростки из окрашенных в коричневый или оранжево-коричневый цвет призматических кристаллов (см. рис. 32). Барбитал образует прямоугольные пластинки темно-красного, зеленого, фиолетового, серо-розового цветов (см. рис. 33). Барбамил образует пластинки, окрашенные в красный, оранжевый цвет, или сростки из них (см. рис. 34). Бутобарбитал образует сростки из кристаллов в виде темно-коричневых ромбов.
Фенобарбитал с хлорцинкйодом кристаллов не образует.
Данные по чувствительности реакции с хлорцинкйодом представлены в таблице 17.
Оценка. Реакция чувствительна, является подтверждающей.
Реакция с подкисленным спиртовым раствором йодида калия (по Г.Ф.Лозовой). На сухой остаток на предметном стекле наносят каплю реактива и помещают во влажную камеру. Через 5-10 мин наблюдают образование характерного кристаллического осадка.
Барбитал образует прямоугольные пластинки, окрашенные в красный, зеленый, серозеленый цвет, часто с рассеченными концами (рнс. 35А). ЭтаминалГобразует оранжевые призматические кристаллы, собранные в сростки (рис. 35Б). Бутобарбитал также образует кристаллический осадок.
Оценка. Реакция чувствительна, позволяет обнаружить в пробе до 0,5 мкг барбитуратов, является подтверждающей.
Фенобарбитал и барбамил с подкисленным спиртовым раствором йодида калия кристаллического осадка не образуют.

Реакция со смесью растворов хлорида железа (III) и йодида калия (железойодидной комплексной солью). На сухой остаток на предметном стекле наносят каплю реактива и стекло выдерживают во влажной камере 10-15 мин. Под микроскопом наблюдают образование кристаллов в виде призм и сростков из них. Кристаллы характерной формы образуют барбамил, этаминал, фенобарбитал и бутобарбитал (см. рис. 36).
Барбитал с железойодидным реактивом характерных кристаллов не образует. Чувствительность данной реакции представлена в таблице 18.
Таблица 18. Чувствительность реакции со смесью растворов хлорида железа (III) и йодида калия для барбитуратов
|
Барбитурат |
Предел обнаружения, мкг |
Разведение или в пробе |
|
Барбамил |
1,8 |
1:20 100 |
|
Бутобарбитал |
5,9 |
в пробе |
|
Этаминал |
0,5 |
1:20 000 |
|
Фенобарбитал |
4,1 |
3:10 000 |
Оценка. Реакция чувствительна, является подтверждающей.
Реакция с меднопиридиновым реактивом (реакция Цвиккера). К сухому остатку на предметном стекле прибавляют каплю 25% раствора аммиака и каплю меднопиридинового реактива. Стекло помещают во влажную камеру. Через 10-15 мин наблюдают образование сиреневого осадка. Под микроскопом наблюдают кристаллы в виде простых и сложных крестов, друз, звездочек и прямоугольников при наличии барбитала (рис. 37). Бутобарбитал образует сфероиды фиолетового цвета.

Чувствительность реакции для барбитала составляет 13,7 мкг при разведении 8:10 ООО, для бутобарбитала — 16,5 мкг в пробе.
Фенобарбитал, барбамил, этаминал характерных кристаллов с меднопиридиновым реактивом не образуют.
Оценка. Реакция чувствительна, является подтверждающей.
Хроматография в тонком слое сорбента в частной системе растворителей.
Проводится в присутствии «стандартов», в качестве которых используют спиртовые растворы барбитала, фенобарбитала, барбамила, этаминал-натрия и бутобарбитала. Обнаружение ведут в условиях, описанных ранее (см. раздел 7.1.5). Идентифицируют барбитураты на хроматографической пластинке по месторасположению, окраске и значению Rf анализируемого вещества и «стандарта».
Таблица 19. Характерные частоты барбитуратов в ИК-спектре
|
Барбитурат |
Характерные волновые числа в ИК-спектре, см-1 |
|
Барбамил |
1716, 1689, 1745 |
|
Барбитал |
1674, 1754, 1380, 1707 |
|
Бутобарбитал |
1683, 1712, 1745 |
|
Фенобарбитал |
1703, 1756, 1406 |
|
Этаминал |
1685, 1719, 1744 |
Таблица 20. Индексы удерживания и предел обнаружения барбитуратов методом ГЖХ
|
Барбитурат |
Индекс удерживания |
Предел обнаружения в моче, мкг/мл |
|
|
NPD |
ТАД |
||
|
Барбамил |
1732 |
0,6 |
0,10 |
|
Барбитал |
1490 |
0,6 |
0,10 |
|
Бутобарбитал |
1680 |
0,6 |
0,10 |
|
Фенобарбитал |
1974 |
0,8 |
0,15 |
|
Этаминал |
1743 |
0,6 |
0,10 |
УФ-спектрофотометрия. Для регистрации УФ-спектра поглощения остаток после испарения экстракта из водной вытяжки со значением рН=2 растворяют в 5 мл воды очищенной, к которой была добавлена 1 капля 2 М раствора аммиака (рН=10), и измеряют величину светопоглощения полученного раствора в интервале длин волн 210-320 нм. В спектре обнаруживают максимум при 240 нм (лактимная форма барбитурата). При добавлении к этому раствору 1-2 капель 4 М раствора гидроксида натрия (рН=13) в спектре поглощения обнаруживают максимум при 255-260 нм (дилакгимная форма барбитурата). Этот метод чувствителен, но требует тщательной очистки извлечений от присутствующих эндогенных примесей (см. разделы 6.4 и 7.2.2).
ИК-спектрометрия. Для регистрации ИК-спектра остаток после испарения хлороформа (диэтилового эфира) растирают с бромидом калия и после прессования помещают в прибор для снятия спектра. Производные барбитуровой кислоты имеют основные характерные для каждого барбитурата волновые числа в ПК спектре (табл. 19).
ГЖХ-анапиз. Проводится в условиях, описанных ранее (см. раздел 7.1.6.1). Для обнаружения барбитуратов используют индексы удерживания для каждого барбитурата, представленные в таблице 20.
Газовая хроматография в сочетании с масс-спектрометрией используется для обнаружения нанограммовых количеств барбитуратов и позволяет вести анализ на фоне эндогенных соединений, выделенных из исследуемого объекта. Для выделения барбитуратов из объекта после гидролиза используют жидкость-жидкостную или твердофазную экстракцию (см. разделы 6.4 и 6.4.4).
Концентрирование извлечений проводят упариванием при температуре 40-60°С. В ряде случаев для повышения летучести проводят дериватизацию с уксусным ангидридом в безводном пиридине (фенобарбитал). Идентифицируют барбитураты по времени удерживания (для барбитала — 5,18 мин) и по отношению массы ионов к заряду (204 для фенобарбитала).
ВЭЖХ при обнаружении барбитуратов. Барбитураты извлекают из биологических объектов при рН=1-2 хлороформом, смесью хлороформ — изопропанол 9:1 или диэтиловым эфиром. Предварительно рекомендуется при анализе мочи провести кислотный гидролиз для разрушения метаболитов — глюкуронидов.
Для обнаружения с помощью ВЭЖХ рекомендованы следующие условия: хроматограф «Милихром», хроматографическая колонка (62х2 мм), заполненная обращеннофазовым сорбентом «Сепарон» С18 (5 мкм), подвижная фаза — смесь 0,05 М водного раствора гидрофосфата аммония и метанола (60:40), скорость элюирования равна 100 мкл/мин. Сухой остаток растворяют в 100 мкл подвижной фазы и вводят в хроматограф 4 мкл.
Для обнаружения барбитуратов в исследуемой пробе сравнивают время (объем) удерживания и коэффициент емкости определяемого вещества с образцом сравнения в тех же условиях; сравнивают УФ-спектры поглощения с образцом сравнения, а также сопоставляют УФ-спектры исследуемого компонента и образца сравнения при 2 и более длинах волн и оценивают их спектральные отношения (табл. 21).
Таблица 21. Хроматографические характеристики барбитуратов
|
Барбитурат |
Объем VR, мкл |
Спектральные отношения (S1/S210) |
||||||
|
220 |
230 |
240 |
250 |
260 |
280 |
300 |
||
|
Барбитал |
933 |
0,615 |
0,088 |
0,027 |
0,010 |
0,007 |
0,000 |
0,001 |
|
Барбамил |
1753 |
0,576 |
0,076 |
0,03 |
0,014 |
0,011 |
0,003 |
0 |
|
Фенобарбитал |
1394 |
0,506 |
0,194 |
0,113 |
0,062 |
0,039 |
0,003 |
0 |
В таблице представлены данные, полученные с помощью «Милихром А-02».
Количественное определение барбитуратов проводится прямым фотометрическим методом, с помощью дифференциальной спектрофотометрии и высокоэффективной жидкостной хроматографии.
Фотометрический метод основан на взаимодействии барбитуратов с раствором ацетата кобальта в присутствии изопропиламина и метанола (метод предложен В.И.Поповой). Барбитураты из биологического материала извлекают водой, подкисленной серной кислотой. После очистки с помощью гель-хроматографии проводят концентрирование путем экстракции хлороформом. Хлороформный экстракт выпаривают до сухого остатка. Сухой остаток, в зависимости от обнаруженного барбитурата, растворяют в хлороформе (барбитал, фенобарбитал) или метиловом спирте (барбамил, этамииал). К полученным растворам добавляют по 5 мл 0,125% раствора ацетата кобальта в метиловом спирте и по 1 мл 50% изопропиламина в метиловом спирте. Оптическую плотность растворов, окрашенных в фиолетовый цвет, измеряют с помощью фотоэлектроколориметра ФЭК-М при зеленом светофильтре в кювете 20 мм. В качестве раствора сравнения применяют смесь реактивов.

Предел обнаружения составляет 0,04-0,08 мг барбитурата в 1 мл исследуемого раствора.
Дифференциальная спектрофотометрия. Хотя этот термин принят в аналитической химии, его правильнее назвать разностной фотометрией. Количественное определение проводят в этом случае по разности величины оптической плотности исследуемого и контрольного опытов. Методы дифференциальной фотометрии разрабатывались длительное время в Пятигорской фармацевтической академии под руководством В.Г.Беликова.
Особый интерес вызывает так называемая химическая дифференциальная спектрофотометрия. Этот метод приемлем в том случае, когда при различных значениях pH среды изменяется спектр поглощения исследуемого вещества, а спектр поглощения примесей (посторонних экстрактивных веществ) остается без изменений. Такая методика предложена для определения производных барбитуровой кислоты.
Барбитураты изолируют из биологических объектов общими (Стаса-Отто, Васильевой) или частными (Валова, Поповой) методами. Для экстракции барбитуратов из водной фазы при рН=2-2,5 применяют диэтиловый эфир или хлороформ.
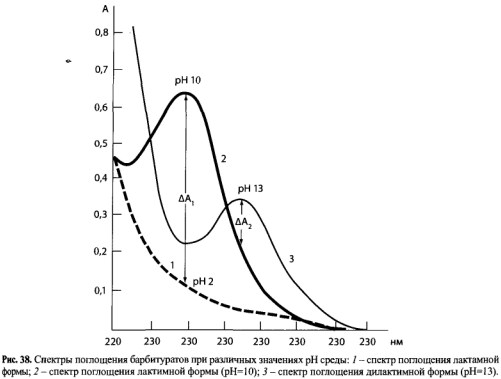
В основу метода дифференциальной спектрофотометрии положена способность барбитуратов к лактим-лактамной (имидо-имидольной) таутомерии. В органическом растворителе после экстракции барбитураты находятся в лактамной форме.

В этом случае спектр поглощения барбитурата представляет собой ниспадающую кривую 1 (рис. 38) в области 220-320 нм. Это связано с тем, что в лактамной форме в молекуле барбитурата отсутствуют сопряженные двойные связи.
При значении рН=10 барбитураты перейдут в лактимную форму.
При регистрации спектра такого раствора обнаруживается максимум свегопоглоще- ния при 240 нм (см. рис. 38, кривая 2).
При значении рН=13 барбитураты перейдут в дилактимную форму.

Спектр поглощения барбитурата в этом случае имеет полосу с максимумом 260 нм (см. рис. 38, кривая 3).
Для расчета количества барбитурата в извлечении из объекта используют метод, ференциальной спектрофотометрии. При исследовании внутренних органов определяют разницу в оптической плотности при рН=10 и рН=2 при длине волны 240 нм.
ΔА1 = АрН=10 — АрН=2
При исследовании биологических жидкостей определяют разницу в оптической плотности при рН=13 и рН=10 при длине волны 260 нм.
ΔA2 = ApH=13 — АрН=10
Расчет содержания барбитуратов проводят по удельному показателю поглощения, который рассчитывают при тех же значениях pH для раствора стандартного образца.
Е1%1см = ΔA/(C·l)
Более воспроизводимые результаты получаются в том случае, когда расчеты проводят по стандартному образцу.
Cx = [ΔAx·Cст] / [ΔAст]
Использование дифференциального варианта спекгрофотометрического определения барбитуратов позволяет получить достаточно надежные результаты и исключить влияние посторонних веществ, экстрагируемых в процессе анализа вместе с барбитуратами из раствора при рН=2-2,5.
Метод высокоэффективной жидкостной хроматографии. Для количественного определения барбитуратов и других токсических веществ высокоэффективная жидкостная хроматография находит применение в трех вариантах: метод добавок, метод внешнего стандарта и метод внутреннего стандарта.
Метод добавок. Для выделения токсических веществ из мочи используют жидкость- жидкостную экстракцию. Анализ ведут с двумя пробами мочи. С помощью ВЭЖХ проводят анализ экстракта из одной пробы мочи и экстракта из второй пробы мочи с добавлением в нее определенного количества вещества (эталонного раствора), обнаруженного при качественном анализе. Расчет количества найденного вещества в экстракте из мочи ведут по формуле:
Cx = [(CdVd)/(Vx+Vd)] / [hx+d/hx — 1]
где Сх — концентрация найденного вещества в экстракте из мочи; Сd — концентрация добавленного вещества в растворе подвижной фазы; Vd — объем добавленного эталонного раствора; Vx — объем экстракта мочи с обнаруженным веществом; hx — высота сигнала определяемого вещества в экстракте из мочи; hx+d — высота сигнала экстракта измочи с добавкой эталонного раствора.
Метод внешнего стандарта. Он основан на линейной зависимости выходного сигнала от массы вещества. В этом случае параллельно с анализом экстракта из мочи в тех же условиях проводят анализ эталонного раствора найденного вещества приблизительно той же концентрации. Расчет ведут по формуле:
Cx = (Cdhx) / hd
где Сх — концентрация определяемого вещества; hх — высота сигнала в растворе экстракта из мочи; hd — высота сигнала эталонного раствора; Cd — концентрация добавленного вещества в растворе подвижной фазы.
Метод внутреннего стандарта. К пробе мочи до операции пробоподготовки добавляют определенное количество вещества, которое является стандартом. Стандарт и определяемое вещество должны хорошо разделяться в процессе анализа. При анализе барбитуратов в качестве внутренних стандартов рекомендуется использовать одно из следующих веществ: апробарбитал, метилфенобарбитал, фенилгидантоин, которые при хроматографировании полностью отделяются от компонентов образца. Концентрацию определяемого вещества рассчитывают по формуле:
Cx = [Cстhх / hст] ·[1 / FCx/Cст]
где Сх — концентрация определяемого вещества; Сст — концентрация внутреннего стандарта; hx, — высота (или площадь Sx) пика определяемого вещества; hст — высота (или площадь Sст) пика стандарта; FCx/Cст — относительный калибровочный фактор.
FCх/Cст определяется предварительно по формуле:
Fcx/Cст = [hxCст] / [Cxhст]
где hx — высота (или площадь) пика анализируемого вещества с известной концентрацией; Сх — концентрация калибровочного раствора анализируемого вещества; hст — высота (или площадь) пика внутреннего стандарта; Сст — концентрация внутреннего стандарта.
Методы добавок и внешнего стандарта для барбитуратов хорошо сопоставимы. Например, при определении в крови фенобарбитала при проведении химикотоксикологического анализа по методу добавок концентрация составила 0,03 мг/мл, по методу внешнего стандарта 0,041 мг/мл (С.К.Еремин).
8.2. Производные 1,4-бензодиазепина
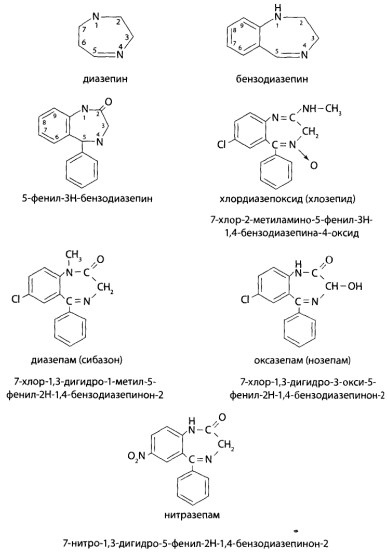
Токсикологическое значение. Производные 1,4-бензодиазепина внедрены в медицинскую практику с начала 1960-х годов как транквилизаторы. Препараты этой группы находят применение в психиатрической практике как нейролептики, но отличаются отсутствием антипсихотической активности. Действие бензодиазепинов обусловлено уменьшением возбудимости миндалевидных образований передних отделов височных долей на диэнцефальном и лимбическом уровнях.
Применяют производные бензодиазепина в виде таблеток по 0,005-0,01 г. В связи с распространяющимися фактами злоупотребления соединениями данной группы. Комиссия ООН по наркотикам в 1984 г. включила их в список соединений, находящихся под международным контролем.
При злоупотреблении транквилизаторами однократная доза достигает 10 таблеток и более на прием. Больные испытывают чувство умиротворения, расслабленности. Внешне такие больные выглядят, как находящиеся в легкой стадии опьянения: неуверенная походка, беззаботность, блаженная улыбка. При длительном злоупотреблении развивается абстинентный синдром, выражающийся в тревоге, беспокойстве, страхе, бессоннице, повышенной потливости, тахикардии. Абстинентный синдром протекает относительно легко без мучительных соматических и психических расстройств. Чаще всего при злоупотреблении используют хлозепид, тазепам и др. Особенно опасно их сочетание с анальгетиками и антигистаминными препаратами, которое приводит к возникновению делириозных психозов и психоорганического синдрома.
Бензодиазепины обладают выраженными токсическими свойствами. Описаны случаи отравлений в отечественной и зарубежной литературе в результате несчастных случаев (чаще всего с маленькими детьми) или с целью самоубийства. Смертельная доза для взрослого человека 0,1-0,15 г на 1 кг массы тела (68-120 таблеток хлозепида), для детей — 0,02—0,15 г на 1 кг массы тела (29 таблеток хлозепида для детей 7-14 лет).
Препараты хорошо всасываются из пищеварительного тракта. Клиническая картина отравления зависит от принятой дозы. При легкой степени отравления хлозепидом проявляется вялость, сонливость, заторможенность, расширение зрачков, снижение мышечного тонуса. При отравлениях средней тяжести признаки отравления, указанные выше, выражены более четко. Добавляется гиперемия лица, сухость кожных покровов, тахикардия, тремор конечностей, отсутствие многих рефлексов. При тяжелой форме отравления сознание спутано, наблюдается психомоторное возбуждение, клонические судороги или галлюцинаторный синдром, развивается дыхательная и сердечная недостаточность.
Диазепам по действию на организм сходен с хлозепидом, но его токсическое действие проявляется в меньших дозах.
Оксазепам (тазепам) менее токсичен, чем хлозепид.
Нитразепам оказывает более выраженное успокаивающее и снотворное действие. Картина отравления сходна с хлозепидом.
При патологоанатомическом исследовании трупа отмечают кровоизлияния в слизистую оболочку желудка и тонкого кишечника, острую эмфизему легких, полнокровие внутренних органов, расширение зрачков.
Пути метаболизма
Производные бензодиазепинов в организме быстро подвергаются метаболизму. Через несколько минут после приема в крови обнаруживаются метаболиты хлозепида.
В I фазе метаболизма характерны процессы деметилирования (диазепам, хлозепид) в положении 1 и 2, окисления в положении 3 с образованием гидроксильной группы, восстановления нитрогруппы в положении 7 (нитразепам).
Во II фазе метаболизма происходит конъюгация с глюкуроновой или серной кислотами самих препаратов, имеющих гидроксил в 3 положении, и продуктов их метаболизма.
Метаболит нитразепама (аминозепам) образует конъюгат с уксусной кислотой. Метаболиты, конъюгаты с кислотами и нативные соединения производных бензодиазепина выводятся из организма почками.
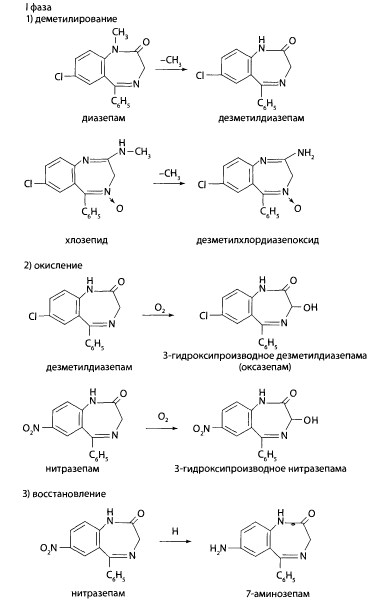

Методы определения производных 1,4-бензодиазепина в биологических объектах
Объекты анализа:
- желудок с содержимым;
- тонкий кишечник с содержимым;
- головной мозг;
- печень, почки;
- кровь, моча;
- лекарственные препараты.
Свойства производных 1,4-бензодиазепина. Оксазепам, диазепам, хлордиазепоксид — белые кристаллические вещества. Допускается желтоватый, зеленовато-желтый или кремовый опенок. Нитразепам имеет светло-желтую с зеленым опенком окраску за счет наличия в молекуле нитрогруппы.
Производные бензодиазепина практически нерастворимы в воде, мало растворимы в этаноле и эфире, но хорошо растворимы в хлороформе. Они обладают слабоосновными свойствами за счет гетероатома азота в положении 4 и слабокислотными свойствами за счет имидо-имидольной таутомерии в положении 1-2.
В электронных спектрах производных 1,4-бензодиазепина наблюдаются 3 полосы поглощения с характерными максимумами в области 200-215, 220-260, 280-360 нм.
При ненаправленном анализе на производные 1,4-бензодиазепина исследование проводится после изолирования из биологического материала подкисленным спиртом или подкисленной водой с хлороформным экстрактом из водной фазы с рН=2 и рН=10. При рН=2 хлордиазепоксид полностью экстрагируется хлороформом, диазепам — частично, нитразепам и оксазепам экстрагируются хлороформом при рН=10.
При проведении общего ТСХ-скрининга (см. раздел 7.1.2) производные 1,4-бензодиазепина могут быть обнаружены на хроматографической пластинке в виде светящихся в УФ-свете пятен. При обработке реактивом Драгендорфа светящиеся пятна окрашиваются в оранжевый цвет.
С осадительными реактивами (см. раздел 7.1.8) производные 1,4-бензодиазепии дают аморфные осадки.
При исследовании извлечений из биологических объектов на производные 1,4-бензодиазепина используют 2 направления в анализе.
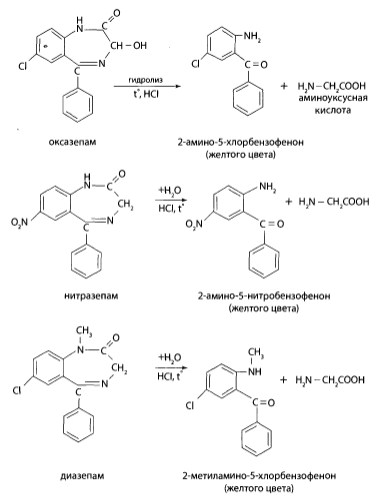
- направление основано на гидролизе бензодиазепинов до 2-аминобензофенонов. Данный способ позволяет обнаружить и определить в извлечении нативные соединени и их метаболиты. Этому направлению придают судебно-химическое значение при отрицательном результате.
- направление используется, если в процессе исследования обнаружены бензофеноны по 1 направлению анализа. Этот способ позволяет точно установить природу 1,4-бек- зодиазепина по нативным соединениям и их метаболитам.
Определение 1,4-бензодиазепинов после гидролиза
Для проведения гидролиза могут быть использованы непосредственно ткани органов, хлороформные экстракты из подкисленных вытяжек и элюаты при применении сорбционного метода.
Определенный объем элюата или экстракта выпаривают досуха. К сухому остатку, навеске ткани органа, к 10 мл мочи или 2 мл крови прибавляют 2 мл 6 М раствора хлороводородной кислоты. Смесь нагревают на кипящей водяной бане в течение 1 ч или 5-10 мин на глицериновой (песчаной) бане при 120°С. При наличии в объекте производных 1,4-бензодиазепина раствор окрашивается в желтый цвет за счет образования бензофенонов.
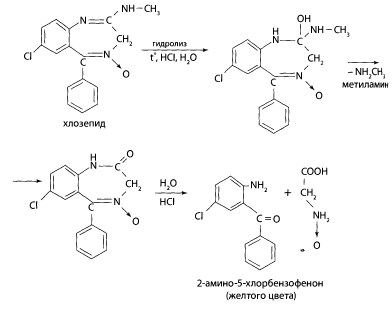
К части гидролизата после охлаждения добавляют каплю 5% раствора нитрита натрия, перемешивают. Несколько капель полученного раствора вносят в 2 мл свежеприготовленного 2% щелочного раствора резорцина или р-нафтола — наблюдают образование вишнево-красного окрашивания или оранжево-красного осадка.
Продукт гидролиза диазепама (2-метиламино-5-хлорбензофенон) не образует азокрасителя, так как имеет заместитель — метальную группу в положении 1. В присутствии диазепама раствор может сохранить желтую окраску.

Вторую часть гидролизата осторожно подщелачивают 50% раствором гидроксида натрия до рН=10-11 и экстрагируют гексаном. Гексановые экстракты выпаривают досуха при комнатной температуре, остаток растворяют в небольшом объеме этанола и исследуют с помощью ТСХ- и УФ-спектрофотометрии.
Хроматографию проводят на пластинках «Силуфол». В качестве подвижной фазы используют бензол, которым предварительно насыщают хроматографическую камеру в течение 10 мин. Раствор экстракта из гидролизата наносят на стартовую линию пластинки и одновременно в качестве «свидетелей» — бензофеноны, полученные при гидролизе стандартных веществ — бензодиазепинов (по 10-15 мкг каждого). После хроматографирования бензофеноны первоначально фиксируют на пластинке по собственному желтому окрашиванию. При просматривании пластинки в УФ-свете бензофеноны обнаруживают характерную флуоресценцию. Затем проводят непосредственно на пла- стинке реакцию Браттона-Маршалла. Хроматографическую пластинку последовательно опрыскивают 0,1% раствором нитрита натрия, 2 М раствором хлороводородной кислоты. Через 1-2 мин обрабатывают 2% щелочным раствором β-нафтола. Флуоресцирующие пятна на пластинке окрашиваются в оранжево-красный цвет. Пятна 2-метиламино-
4-хлорбензофенона не переходят в красно-оранжевый цвет, но при обработке хроматограммы 10% раствором хлорной кислоты дают яркую флуоресценцию в УФ-свете при 254 и 360 нм.
Предел обнаружения производных бензодиазепина составляет 1-5 мкг исследуемого вещества в пробе, нанесенной на пластинку.
УФ-спектрофотометрия используется после проведения ТСХ и элюирования бензофенонов с пластинки спиртом или ацетоном. Бензофеноны имеют характерную абсорбцию в области 230-240 и 390—410 нм.
Оценка. Описанное исследование по 1 направлению имеет судебно-химическое значение при получении отрицательного результата.
При получении положительных испытаний по 1 направлению проводят дальнейший анализ.
Определение индивидуальных производных 1,4-бензодиазепина и их метаболитов
Для обнаружения отдельных веществ и их метаболитов изолирование проводят путем настаивания слолярным растворителем и экстрагируют из водного раствора хлороформом при рН=2 и рН=10 или используют сорбционный метод на полимерных сорбентах с последующим элюированием исследуемых соединений с сорбента. Полученные экстракты (элюаты) упаривают до небольшого объема ~ 0,5-1 мл (концентрирование). Для обнаружения производных 1,4-бензодиазепина и их метаболитов в полученном концентрате используют хроматографию в тонком слое сорбента, УФ-спектрофотометрию, газожидкостную, высокоэффективную жидкостную хроматографию и химический метод.
Хроматография в тонком слое сорбента. Часть раствора наносят в виде точки на стартовую линию хроматографической пластинки «Силуфол УФ-254». В качестве «стандартов» на пластинку наносят по 10-15 мкг растворов хлозепида, диазепама, нитразепама и оксазепама. Пластинку помещают в одну из систем растворителей: хлороформ — ацетон (90:10) или этилацетат — 25% раствор аммиака — уксусная кислота (26:1,6:3,3), позволяющих разделить бензодиазепины.
Для обнаружения бензодиазепинов на пластинке ее обрабатывают реактивами в определенной последовательности. Пластинку опрыскивают раствором нингидрина и затем 5 мин нагревают при 100°С. Образуются пятна желтого цвета. При последующей обработке реактивом FNP (смесь хлорида железа (III), хлорной и азотной кислот) желтые пятна приобретают голубой цвет. Эту же пластинку опрыскивают подкисленным йодплатинатом — пятна приобретают темный цвет.
Пластинку можно обработать реактивом Марки. Пятна бензодиазепинов окрашиваются в желтый цвет.
Кроме того, можно дополнительно провести химическую реакцию образования азокрасителя после гидролиза бензодиазепинов и метаболитов на пластинке до аминобензофенонов.
Заключение о нахождении в извлечении конкретного производного 1,4-бензодиазепина по результатам ТСХ можно сделать, если цвет и Rf исследуемого вещества и «стандарта» полностью совпадают.
УФ-спектрофотометрия проводится после очистки экстрактов с помощью ТСХ, элюирования веществ с пластинки этиловым спиртом, 0,1 М раствором серной (хлороводородной) кислоты или смесью 1 М раствора хлороводородной кислоты и метилового спирта (1:9).
При регистрации спектра поглощения производные 1,4-бензодиазепина и их метаболиты определяют по характерным максимумам и минимумам в спектре. Например, в растворе 0,1 М серной кислоты хлозепид обнаруживает 2 максимума при 245 и 306 нм, диазепам при 241, 284 и 359 нм, нитразепам при 277 нм.
Газожидкостная хроматография проводится с использованием колонок длиной 2 м и диаметром 4 мм на хромосорбе Q (80-100 меш.) с покрытием SE-30. Обнаружение бензодиазепинов и их метаболитов проводят по соответствующим индексам удерживания (см. табл. 22).
ИК-спектроскопия. Сухой остаток после испарения хлороформного экстракта или элюата растирают с кристаллами бромида калия и прессуют в виде диска. В ИК- спектре бензодиазепинов появляются интенсивные полосы за счет валентных колебаний ОН-, NH-, СО-, С-С- групп (см. табл. 23).
Высокоэффективная жидкостная хроматография (ВЭЖХ). Обнаружение производных 1,4-бензодиазепина предложено проводить по нативным соединениям или бензо- фенонам. Методика включает следующие условия разделения веществ: жидкостный хроматограф «Милихром»; хроматографическая колонка 62*2 мм; подвижные фазы -2- смесь 0,05 М водного гидрофосфата аммония и ацетонитрила 65:35 (для бензодиазепинов) и 45:55 (для бензофенонов); детектирование при 230 нм (для бензодиазепинов) и при 220 нм (для бензофенонов); скорость потока (элюирования) 100 мкл/мин.
Таблица 22. Индексы удерживания бензодиазепинов и их метаболитов при обнаружении методом ГЖХ
|
Бензодиазепииы и их метаболиты |
Индексы удерживании |
|
Диазепам |
2425 |
|
Дезметилдиазепам |
2496 |
|
Хлозепид |
2453 |
|
Демоксепам |
2529 |
|
Оксазепам |
2336 |
|
Нитразепам |
2885 |
|
7-ацетамидонитразепам |
-3263 |
|
7 -аминонитразепам |
2900 |
|
7-амиио-Зтидроксинитразепам |
2890 |
Таблица 23. Обнаружение производных 1,4-бензодиазепина по ИК-спектрам
|
Производное 1,4-бензодиазепина |
Характеристические полосы в ИК-спектре, см-1 |
|
Хлозепид |
1625, 1458, 760 |
|
Диазепам |
1681, 1484, 1313 |
|
Оксазепам |
1687, 1706, 693, 830 |
|
Нитразепам |
1692, 1615, 1352, 702 |
Таблица 24. Данные хроматографического анализа веществ методом ВЭЖХ*
|
Анализируемое вещество |
Объем VR, мкл |
Спектральные отношения R= S1 / S210 нм |
||||||
|
220 |
230 |
240 |
250 |
260 |
280 |
309 |
||
|
Хлозепид |
1662 |
0,600 |
0,391 |
0,591 |
0,944 |
0,332 |
0,046 |
0,095 |
|
Диазепам |
1910 |
0,749 |
0,990 |
1,097 |
0,776 |
0,409 |
0,388 |
0.298 |
|
Оксазепам |
1824 |
1,125 |
1,327 |
0,917 |
0,634 |
0,407 |
1,176 |
0,090 |
|
Нитразепам |
1624 |
0,919 |
0,653 |
0,541 |
0,616 |
0,808 |
0,843 |
0,620 |
|
5-хлор-2-аминобензофенон |
2643 |
0,870 |
1,285 |
1,402 |
0,958 |
0,641 |
0,193 |
0,025 |
|
5-хлор-2-метиламинобензофенон |
3049 |
0,948 |
1,369 |
1,515 |
1,091 |
0,779 |
0,273 |
0,025 |
|
7-хлор-2-амино-5-фенил-1,2-дигидро- ЗН-1,4-бензодиазепина-4-оксид |
1601 |
0,854 |
1,109 |
1,415 |
1,434 |
1,164 |
0,499 |
0,416 |
*Данные представлены по результатам, полученным на «Милихроме А-02».
В указанных условиях удается четко разделить между собой все производные бензодиазепинов и бензофеноны. Для обнаружения исследуемых веществ сопоставляют время (объем) удерживания и коэффициенты емкости определяемых веществ и образцов сравнения — эталонных растворов бензодиазепинов и бензофенонов, а также УФ-спектры исследуемого компонента и образца сравнения при двух и более длинах волн, и оценивается их спектральное отношение (табл. 24).
Предел обнаружения бензодиазепинов методом ВЭЖХ составляет для оксазепама 3,4-10”6 мг, нитразепама 11,1 • КН мг, хлозепида 17,8-10 6, диазепама 15-10 6 мг в вводимой пробе.
Химический метод основан на использовании реакций, в результате которых образуются окрашенные продукты.
Реакция с нингидрином. К 2-3 мл раствора остатка или элюата в этиловом спирте прибавляют 10 мг нингидрина и 2 мин нагревают на водяной бане. Раствор окрашивается в синий цвет. При добавлении 1% раствора сульфата меди (II) окраска переходит в красную или оранжево-красную (диазепам), в желто-коричневую (нитразепам), в коричневую (хлозепид).
Реакция гидролиза амидокарбинолъной группы. Эта реакция используется для обнаружения оксазепама (нозепама). К сухому остатку прибавляют 5 мл 96% этилового спирта и 4 капли концентрированной фосфорной кислоты. Смесь нагревают на кипящей водяной бане не менее 5 мин. Раствор охлаждают. К 1 мл полученного раствора добавляют 5 мл воды очищенной и 1 мл фуксинсернистой (хромотроповой) кислоты — наблюдают появление фиолетового окрашивания. В результате гидролиза амидокарбинольной группы образуется формальдегид, который с фуксинсернистой кислотой (или хромотроповой кислотой) дает характерное окрашивание.
Уравнения реакций между формальдегидом, фуксинсернистой и хромотроповой кислотами приведены в разделе 9.4.2.
Реакция с реактивами Марки и Фреде. При нанесении на сухой остаток в фарфоровой чашке, полученный при испарении хлороформного экстракта или элюата, реактива Марки или реактива Фреде, хлозепид образует желтое окрашивание.
Количественное определение
Для количественного определения бензодиазепинов предложены методы ВЭЖХ и фотометрии.
Метод ВЭЖХ. Для количественного определения бензодиазепинов и бензофенонов используют метод добавок, методы внешнего и внутреннего стандарта.
Метод добавок. Анализ проводят с экстрактом из биологического объекта или с элю- атом после проведения твердофазной экстракции с добавлением в него определенного количества (эталонный раствор) обнаруженного бензодиазепина или бензофенона. Концентрацию исследуемого соединения рассчитывают по формуле (см. раздел 8.1).
Метод внешнего стандарта. Вслед за анализом с помощью ВЭЖХ исследуемого экстракта или элюата проводят определение в тех же условиях эталонного раствора, концентрация которого близка к концентрации анализируемого соединения в извлечении из объекта. Расчет концентрации бензодиазепина или бензофенона проводят по формуле, приведенной в разделе 8.1.
Метод внутреннего стандарта. В биологический объект до начала его пробоподго- товки к анализу добавляют известное количество вещества, принятого за стандарт. После исследования с помощью ВЭЖХ расчет концентрации определяемого соединения проводят, используя ранее приведенную формулу (см. раздел 8.1).
Фотоколориметрия по реакции образования азокрасителя (реакция Браттона- Маршалла). Метод основан на гидролизе бензодиазепинов до аминобензофенонов. Сухой остаток хлороформного экстракта или элюата растворяют в 5 мл 2 М раствора хлороводородной кислоты, добавляют 1 мл 0,1% раствора нитрита натрия, через 5 мин — 0,5 мл 1% раствора сульфамата аммония (или насыщенного раствора мочевины). Полученный раствор встряхивают до полного удаления пузырьков газа, после чего добавляют 1 мл 0,1% раствора N-1-нафтилэтилендиаминдихлорида. Оптическую плотность окрашенного раствора измеряют через 15 минут на ФЭК-56 М в кювете с толщиной слоя 10 мм и зеленым светофильтром. Раствор сравнения — смесь реактивов.
Токсикологическое значение. Производные фенотиазина в медицинской практике применяют более 50 лет. Многие производные фенотиазина проявляют специфическое действие на центральную нервную систему и психическую сферу. Испытания зависимости между химическим строением и фармакологическим действием показали, что сильнейшее действие на психическую сферу проявляют соединения, у которых третичный азот в боковой цепи отделен от атома азота фенотиазинового ядра тремя метиленовыми группами. Меньшее число метиленовых групп приводит к появлению противогистамин- ной активности. Кроме того, для производных фенотиазина выявлена способность снижать температуру тела, уменьшать позывы к рвоте у беременных, снимать зуд и т.д. Все указанное говорит о большом медицинском значении производных фенотиазина. Следует подчеркнуть, что все производные фенотиазина обладают высокой фармакологической активностью.
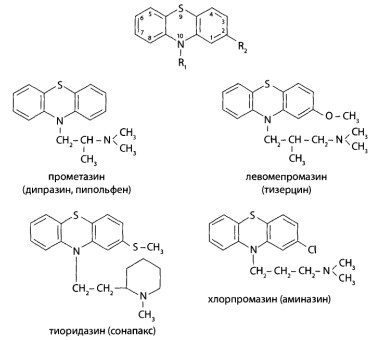
В лечебной практике препараты применяют в дозе 0,025 г (аминазин, дипразин); 0,005-0,01 г (тиоридазин); 0,025-0,075 г (тизерцин). Выпускаются препараты в виде таблеток и растворов для инъекций.
Производные фенотиазина быстро всасываются и медленно выводятся из организма, обладают кумулятивным действием (аминазин). При приеме терапевтической дозы аминазин полностью выводится из организма в течение 14-20 дней. При длительном употреблении аминазин накапливается в волосах, ногтях, печени и других тканях.
Наибольшее токсикологическое значение из этой группы препаратов имеет аминазин. В отечественной литературе описаны случаи отравления аминазином при передозировке, несчастных случаях с детьми, при приеме его с целью самоубийства. Известно, что для взрослых смертельная концентрация аминазина составляет 0,03-0,12 г/л крови. Для детей смертельная доза аминазина — 0,25 г. В больших дозах аминазин вызывает ; состояние, близкое к физиологическому сну. При отравлении отмечается резкая слабость, головокружение, сухость во рту, тошнота, судороги, потеря сознания, учащение пульса, падение давления, наблюдаются кожные аллергические реакции. При острых отравлениях — коматозное состояние, зрачки расширены и на свет не реагируют, резко угнетается дыхательный и сосудодвигательные центры, дыхание по типу Чейна-Стокса, кожные покровы цианотичны, развивается непроходимость кишечника, появляются тахикардия, эпилептические судороги. Смерть наступает при явлениях нарастающей легочносердечной недостаточности.
При патологоанатомическом исследовании трупа картина вскрытия неспецифична. Отмечают нризнаки быстро наступившей смерти с отеком и набуханием головного мозга, очаговые кровоизлияния в селезенке, надпочечниках и полнокровие поджелудочной железы, а также некротический нефроз почек: дряблость, широкий, бледный и мутный корковый слой.
Пути метаболизма
ВI фазе метаболизма происходит гидроксилирование фенотиазинового ядра в положениях 3 и 7, деалкилирование у атома азота в положении 10, деметилирование у атома азота в алкильном радикале и окисление с образованием S- и N-оксидов.


Обнаружение производных фенотиазина в биологических объектах Объекты анализа:
- желудок с содержимым;
- мозг;
- почка, моча;
- печень с желчным пузырем;
- кровь;
- лекарственные препараты.
Физико-химические свойства. Производные фенотиазина представляют собой белые (или со слабым желтоватым, сероватым, кремовым оттенком) кристаллические вещества. Они легко окисляются (даже кислородом воздуха) и темнеют. Соли производных фенотиазина хорошо растворимы в воде, этаноле, практически нерастворимы в диэти- ловом эфире. Основания представляют собой сиропообразную массу, которая плохо растворима в воде, но хорошо — в этаноле, хлороформе, диэтиловом эфире, этилацетате. Производные фенотиазина — вещества основного характера, который обусловлен наличием в структуре молекулы гетероциклического атома азота и третичного атома азота в алифатическом радикале. В таблице 25 представлены значения показателя ионизации для некоторых производных фенотиазина.
При нецеленаправленном анализе производные фенотиазина изолируют из биологических объектов путем настаивания с подкисленной водой (метод Васильевой) или подкисленным спиртом (метод Стаса-Отто). Производные фенотиазина обнаруживают в хлороформном экстракте, полученном из водной вытяжки при рН=8-10.
Таблица 25. Показатели ионизации производных фенотиазина
|
Производное фенотиазина |
Значение рКа |
|
Аминазин |
9,3 |
|
Дипразин |
9,1 |
|
Тиоридазин |
9,5 |
|
Левомепромазин |
9,3 |
При направленном анализе для производных фенотиазина используют частный метод, разработанный Е.М.Саломатиным. Производные фенотиазина экстрагируются диэтиловым эфиром при рН=13 (схема метода см. раздел 6.4.1).
При проведении общего ТСХ-скрининга производные фенотиазина могут быть обнаружены на хроматографической пластинке при ее обработке хлоридом железа (III) в виде окрашенных пятен, которые при дальнейшей обработке реактивом Драгендорфа окрашиваются в оранжевый цвет (см. раздел 7.1.2).
С осадительными реактивами производные фенотиазина образуют аморфные осадки (см. раздел 7.1.8).
Для обнаружения индивидуальных соединений производных фенотиазина используют реакции окрашивания, УФ-спектрофотометрию, ГЖХ, ИК-спектроскопию и ВЭЖХ.
Реакции окрашивания. Для получения окрашенных продуктов используют следующие химические реакции:
- реакции окисления (при использовании хлорной кислоты, нитрита натрия, реактивов Фреде, Манделина, концентрированной серной кислоты);
- реакция с формальдегидом в присутствии концентрированной серной кислоты (реактив Марки);
- окисление соединениями, содержащими металлы с высшей степенью окисления [хлорид железа (III) (FeCl3), платинохлороводородная кислота (H2PtCl6)].
Для проведения реакций хлороформный экстракт испаряют в фарфоровых чашках и на сухие остатки наносят соответствующие реактивы — наблюдают появление характерного окрашивания.
Эти реакции малоспецифичны, так как образуются смеси продуктов окисления и первоначальная окраска быстро переходит в красное, вишнево-красное, красно-оранжевое, малиновое, бурое или фиолетовое окрашивание (табл. 26).
Наибольшей реакционной способностью в молекулах производных фенотиазина обладает атом серы. Он способен окисляться с образованием сульфоксидов и сульфонов.
Микрокристаллоскопические реакции. Для производных фенотиазина эти реакции немногочисленны и малохарактерны. Аминазин, дипразин с 5% раствором золотохлороводородной кислоты образуют кристаллические осадки (как пример приведена форма кристаллов, которые образует аминазин, см. рис. 39).
С солью Рейнеке также образуются кристаллические осадки, но по их форме отличить производные фенотиазина друг от друга невозможно.
УФ-спектрофотометрия. В УФ-области спектра производные фенотиазина обнаруживают два максимума светопоглощения при 250-255 и 300-315 нм. Для основных метаболитов производных фенотиазина (сульфоксидов) в УФ-области характерны 4 максимума светопоглощения при 239, 274, 300 и 341 нм. Анализ по УФ-епектрам поглощения проводят после очистки извлечений из объектов с помощью хроматографии в тонком слое сорбента. Измерения проводят в 0,5 М растворе серной кислоты и фиксируют характерные полосы поглощения.
Таблица 26. Результаты реакций на произодные фенотиазина с окислителями
|
Добавляемый реактив |
Производные фенотиазина |
|||
|
Аминазин |
Дипразин |
Тизерцин |
Тноридазин |
|
|
конц. H2SО4 |
малиновое |
малиновое |
фиолетовое |
бледно-голубое |
|
конц. HNO3 |
малиновое |
малиновое |
фиолетовое |
зеленое |
|
Br2-H2O |
малиновое |
малиновое |
фиолетовое |
голубовато-зеленое |
|
реактив Марки |
малиновое |
желто-оранжевое |
фиолетовое |
бирюзовое |
|
реактив Эрдмана |
малиновое |
оранжевое |
фиолетовое |
зеленое |
|
реактив Манделина |
малиновое |
оранжевое |
фиолетовое |
зеленое |
|
FeCl3 |
малиновое |
желто-оранжевое |
фиолетовое |
зеленое |
|
НСlO4 и NaNO2 |
малиновое |
розово-малиновое |
фиолетовое |
зелено-голубое |
|
H2PtCl6 |
сиреневое с фиолетовым осадком |
серо-синее с розовым осадком |
ярко-зеленое |
бледно-сиреневое |
* В таблице приведена первоначально фиксируемая окраска.

Таблица 27. Основные характеристические полосы ИК-спектров производных фенотиазина
|
Вещество |
Характеристические полосы, см -1 |
|
Аминазин |
1455, 747, 1240, 1402, 1561 |
|
Дипразин |
1259, 1287, 1229, 758 |
|
Левомепромазин |
1580, 1270, 1205, 1030, 752 |
|
Тиоридазин |
1248, 1281, 1234,754 |
Газожидкостная хроматография. Производные фенотиазина разделяют с использованием фазы средней полярности OV-225 (3-5% на хроматоне). Микроколонки стеклянные длиной 1-2 м при 200-300°С. Детектор беспламенный азотно-фосфорный (NPD), его чувствительность составляет 0,006 мкг/мл, для хлорсодержащих фенотиази- нов используют детектор по захвату электронов, его чувствительность — 0,001 мкг/мл. Обнаружение производных фенотиазина проводят по параметрам удерживания (времени или объему удерживания или относительному времени удерживания). В качестве внутреннего стандарта используют имизин.
ИК-спектроскопия. В ИК-спектрах производных фенотиазина обнаруживают определенные характеристические частоты, отражающие типы связей и функциональные группы в молекулах. Для проведения анализа очищенный остаток после испарения экстракта из биологического объекта растирают с кристаллами бромида калия, прессуют и полученный диск помещают в прибор. ИК-спектр сравнивают со спектрами, имеющимися в специальных справочниках. Основные характеристические цолосы для производных фенотиазина приведены в таблице 27.
Метод тонкослойной хроматографии в частной системе растворителей
На две хроматографические пластинки наносят исследуемое извлечение из объекта и растворы «стандартов» (спиртовые растворы аминазина, дипразина, левомепромази- на и тиоридазина по 10-15 мкг). Для обнаружения аминазина и дипразина используют систему растворителей бензолдиоксан — 25% раствор аммиака в соотношении компонентов 75:20:5. Хроматографирование для обнаружения левомепромазина и тиоридази- на проводят в системе растворителей: смесь 25% раствора аммиака и этилового спирта (1:1) — этилацетат — ацетон в соотношении 4:90:45. Для обнаружения веществ на пластинках их опрыскивают смесью концентрированной азотной кислоты и этилового спирта 9:1 или смесью 50% раствора серной кислоты и этилового спирта. Пятна исследуемых веществ и «стандартов» должны иметь одинаковую окраску и значение Rf.
Таблица 28. Хроматографические характеристики производных фенотиазина
|
Производное фенотиазина |
Время удерживания, мин |
Спектральные отношения R=A1/A210 |
|||
|
220 |
240 |
250 |
280 |
||
|
Аминазин |
18,44 |
0,874 |
0,839 |
0,984 |
0,083 |
|
Дипразин |
16,01 |
1,045 |
1,406 |
0,635 |
0,259 |
|
Тиорндазин |
20,18 |
0,557 |
0,429 |
0,571 |
0,164 |
|
Тизерцин |
17,45 |
0,926 |
0,843 |
0,996 |
0,085 |
Метод высокоэффективной жидкостной хроматографии
Предложены следующие условия обнаружения производных фенотиазина с помощью ВЭЖХ: жидкостный хроматограф «Милихром А-02» производства ЗАО «ЭкоНова», хроматографическая колонка 2х?5 мм, сорбент — обращенно-фазовый — «Силасорб С18», подвижная фаза: элюент А — 0,1% раствор трихлоруксусной кислоты, элюент Б — ацетонитрил, скорость потока — 100 мкл/мин, аналитические длины волн — 210, 220, 240, 250 и 280 нм, температура термостата колонки — 35°С, градиент — от 10% элюента Б до 80% за 30 мин, объем вводимой пробы — 2 мкл.
Спиртовые растворы исследуемых веществ вводят в хроматограф. Вещества идентифицируют по времени удерживания и по спектральным отношениям (табл. 28).
Количественное определение. Для количественного определения производных фенотиазина предложены методы ВЭЖХ и фотоколориметрическое определение в видимой области спектра.
Метод ВЭЖХ используется после тщательной очистки извлечений из биологических объектов с помощью ТСХ или путем реэкстракции. Рекомендованы метод добавок, методы внешнего и внутреннего стандарта. Расчеты концентрации производных фенотиазина в исследуемом объекте проводят по соответствующим формулам (см. раздел 8.1).
Фотометрия в видимой области спектра. Для фотоколориметрического метода количественного определения производных фенотиазина предложено использовать реакцию с концентрированной серной кислотой (для аминазина и дипразина), реакцию с реактивом Манделина (для тиоридазина и левомепромазина) и реакцию со смесью растворов 18% хлороводородной кислоты и 1 М мышьяковой кислоты (для тиоридазина). Недостатком методов, проводимых в присутствии концентрированной серной кислоты, является возможность обугливания соэкстрактивных веществ, особенно при анализе гнилостно-разложившихся объектов. По этим причинам основным методом количественного определения производных фенотиазина в извлечениях из биологических объектов является метод ВЭЖХ.
Токсикологическое значение. Производные пиразола (анальгин, антипирин, про- пифеназон) применяются в качестве болеутоляющих, жаропонижающих и противовоспалительных средств. Их назначают внутрь при головных болях, невралгиях, артритах и других заболеваниях по 0,25-0,50 г на прием индивидуально или в смеси с другими лекарственными веществами (комбинированные препараты). За счет хорошей растворимости в воде анальгин вводят также в виде 50% раствора.

Производные пиразола вызывают ряд нежелательных эффектов, связанных с гиперсенсибилизацией: поражение кожи (популезные, эритематозные сыпи) и гематологические нарушения (лейкопения, агранулоцитоз). Гематологические осложнения могут быть настолько тяжелыми, что иногда приводят к смерти.
Типичными последствиями систематического приема анальгетиков являются соматические заболевания. Это токсическая анемия, нефрит, пиелонефрит, лекарственные сыпи. Из неврологических расстройств отмечают дрожание кистей рук, атаксическую, неуверенную походку, нарушение артикуляции речи. Больные не выносят шума, раздражительны, ощущают частые головные боли, умирают преимущественно при явлениях уремии.
При злоупотреблении анальгетиками характерно опьянение, приподнятое настроение, повышенная двигательная активность, многословие. Состояние абстиненции протекает с тяжелыми соматическими и психическими расстройствами: выраженная тревога, расстройство сна, сильные головные боли, чередование обильных поносов и запоров, иногда (до 20% случаев) — судорожные припадки. При длительной токсикомании, связанной с приемом анальгетиков группы пиразола, наблюдаются выраженные изменения личности. Больные медлительны, слабо соображают, угрюмы, недоверчивы, напоминают эпилептиков. Судорожные припадки могут носить постоянный характер. Считается, что злоупотребление анальгетиками является причиной развития эпилепсии.
Случаи острого отравления производными пиразола редки и встречаются, как правило, среди детей младшего возраста. При отравлении наиболее характерно поражение ЦНС. Через 5-10 мин после приема наблюдают потерю сознания, цианоз кожных покровов и слизистых оболочек, клонико-тонические судороги. Смерть наступает через 1-3 часа после приема вещества вследствие остановки дыхания. Патологоморфологическая картина неспецифична. В диагностике острого отравления иногда отмечают красноватый цвет мочи из-за наличия в ней рубеановой кислоты.
Пути метаболизма
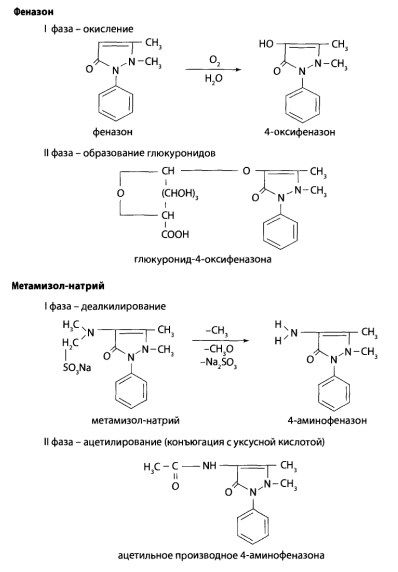
Метаболизм производных пиразола проходит по 2 фазам. В I фазе происходит окисление феназона с образованием гидроксипроизводного в положении 4, деалкилирование в положении 4 у метамизола с образованием аминогруппы.
Во II фазе деалкилированное производное метамизола конъюгирует с уксусной кислотой, гидроксипроизводное феназона образует конъюгат с глюкуроновой кислотой.
Пропифеназон метаболизируется таким же образом и выводится в виде конъюгатов с глюкуронодрй кислотой.
Выводятся производные пиразола и их метаболиты с мочой.
Физико-химические свойства. Производные пиразола — это белые или бесцветные кристаллические вещества (метамизол может иметь желтоватый оттенок), без запаха, хорошо растворимые в воде. В этиловом спирте феназон и пропифеназон хорошо растворимы. Метамизол-натрий в этаноле трудно растворим. Все производные пиразола растворимы в хлороформе, диэтиловом эфире (кроме метамизол-натрия).
Феназон проявляет слабые основные свойства (рКа=1,5). Пропифеназон также обладает слабыми основными свойствами. Оба эти соединения способны экстрагироваться органическими растворителями из растворов со значением рН=2-3.
Метамизол проявляет амфотерные свойства: по замещенному атому азота у С4 основные и кислотные как замещенная метансульфоновая кислота. Он способен в процессе экстракции практически полностью переходить в органический растворитель при
рН=8-10.
Общие методы обнаружения. Анализ на производные пиразола проводится с остатками, полученными после испарения хлороформных экстрактов из водных вытяжек при значениях рН=2 и рН=8-10.
При проведении ТСХ-скрининга в общей системе растворителей производные пиразола обнаруживаются в виде окрашенных пятен при обработке пластинки хлоридом железа (III) или реактивом Драгендорфа (см. раздел 7.1.2).
Производные пиразола дают осадки с общими осадительными реактивами.
Для обнаружения индивидуальных веществ используют реакции окрашивания, УФ- спектрофотометрию, ИК-спектроскопию и ВЭЖХ.
Производные пиразола постепенно теряют свое значение. В настоящее время наибольшее применение находит метамизол и в сложных лекарственных формах — пропифеназон.
Обнаружение метамизола. Метамизол обладает выраженными восстановительными свойствами. Для него характерны реакции окисления. В качестве окислителей могут быть использованы йодат калия, хлорид железа (III), нитрат серебра, нитрит натрия и др. Характерное окрашивание появляется в первые минуты после добавления реактива. При стоянии окраска изменяется или исчезает. Реакции окисления сопровождаются гидролитическим расщеплением молекулы метамизола, особенно при нагревании. Образующиеся продукты (оксид серы (IV), формальдегид) обнаруживаются по запаху или соответствующими реакциями.
Реакция обнаружения диоксида серы с йодатом калия. Сухой остаток переносят в пробирку, добавляют 1,5 мл воды очищенной, 1,5 мл 10% раствора хлороводородной кислоты. Над горлышком пробирки располагают фильтровальную бумагу, пропитанную раствором йодата калия и крахмалом (20 мг в 2 мл раствора крахмала). При нагревании пробирки наблюдают посинение бумаги.
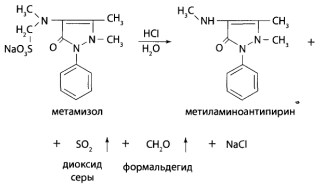
Окрашивание в реакции возникает при взаимодействии диоксида ceры (IV) с йодатом калия и крахмалом.
5SO2 + 2КIO3 → 4SO3 + I2 + K2SO4
Реакция с хлоридом железа (III). К сухому остатку прибавляют 2 капли воды очищенной, 5 мл 96% спирта, 0,5 мл 10% раствора хлороводородной кислоты и перемешивают. Смесь нагревают на водяной бане в течение 5-10 мин. После охлаждения прибавляют раствор хлорида железа (III). Через 2-3 мин наблюдают появление синего окрашивания, которое постепенно переходит в желтое, а затем окраска исчезает.
Реакция образования ауринового красителя. К сухому остатку прибавляют 4-5 капель концентрированной серной кислоты, несколько кристалликов салицилата натрия. Смесь нагревают. Появляется красное окрашивание.

Реакция с хромотроповой или фуксиш ернистой кислотами после гидролитического расщепления метамизола. К сухому остатку прибавляют 1,5 мл воды очищенной, 2 мл 10% раствора хлороводородной кислоты и нагревают на водяной бане 5-10 мин. К охлажденному раствору добавляют 1 мл концентрированной серной кислоты и раствор фуксинсернистой или хромотроповой кислот. Наблюдают сине-фиолетовое окрашивание за счет образующегося формальдегида при расщеплении молекулы метамизола.
Уравнения реакций формальдегида с фуксинсернистой и хромотроповой кислотами приведены в разделе 9.4.2.
Лигниновая проба. 1-2 капли водного раствора остатка наносят на газетную бумагу (без печатного текста) — наблюдают образование желтого окрашивания.
Реакция с концентрированными растворами серной кислоты и пероксида водорода. На сухой остаток или порошок лекарственного препарата наносят по 1-2 капли концентрированных растворов серной кислоты и пероксида водорода. При нагревании появляется голубое окрашивание, которое постепенно переходит в интенсивно-красное. Реакция требует присутствия в остатке значительных количеств метамизола.
Реакция с реактивом Миллона (раствор ртути в азотной кислоте). При добавлении к остатку, содержащему метамизол, реактива Миллона при нагревании возникает темносинее окрашивание.
Реакция с нитритом натрия. При добавлении к остатку, содержащему метамизол, нитрита натрия, хлороводородной кислоты при нагревании появляется темно-синее окрашивание.
Обнаружение феназона (антипирина)
Реакция комплексообразования с хлоридом железа (III). К сухому остатку прибавляют каплю 5% раствора хлорида железа (III). Наблюдают образование комплексной соли 3C11H12ON2 · 2FeCl3 кроваво-красного цвета.
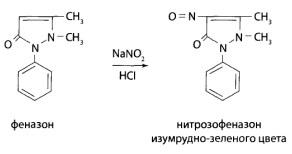
Реакция образования нитрозофеназона. Для выполнения реакции 3-5 мл хлороформного экстракта из объекта выпаривают досуха. Сухой остаток растворяют в 3-5 каплях воды очищенной, добавляют 2-3 капли 10% раствора серной кислоты и 2-3 капли насыщенного раствора нитрита натрия. Наблюдают появление зеленого окрашивания.
Реакция образования пиразолонового красителя. Для выполнения реакции часть хлороформного экстракта из объекта испаряют досуха. К сухому остатку добавляют 1-2 капли воды очищенной, каплю ледяной уксусной кислоты и каплю 5% раствора нитрита натрия. Затем в смесь вносят азид натрия (NaN3) для связывания избытка азотистой кислоты и 3—4 кристаллика 1-нафтиламина или 1-нафтола. Наблюдают появление характерного окрашивания. При взаимодействии феназона с нитритом натрия в кислой среде образуется нитрозофеназон, который с 1-нафтиламином образует азокраситель красного цвета.

При добавлении 1-нафтола образуется индофеноловый краситель.

Окраска индофенолового красителя зависит от pH среды: в кислой среде — красная, в щелочной среде — синяя.
Пропифеназон проявляет выраженные восстановительные свойства и способен окисляться даже слабыми окислителями.
Реакция с хлоридом железа (III). К сухому остатку после испарения хлороформного экстракта добавляют несколько капель воды очищенной, 1 мл спирта, каплю 5% раствора хлорида железа (III) — наблюдают красно-коричневое окрашивание, которое при добавлении хлороводородной кислоты переходит в желтое.
Реакция с нитратом серебра. Сухой остаток растворяют в нескольких каплях воды очищенной, добавляют 2-5 капель 1% раствора нитрата серебра и нагревают 3-5 мин. Наблюдают фиолетовое окрашивание, затем образуется серо-коричневый осадок серебра.
Хроматография в тонком слое сорбента
Феназон. Для обнаружения феназона используют хроматографические пластинки со слоем оксида алюминия и систему растворителей ацетон — циклогексан 5:1. На пластинку наносят исследуемый раствор (извлечение из объекта) и «стандарт» (феназон). Пластинку после прохождения системы растворителей на расстояние 10 см и высушивания обрабатывают реактивом Драгендорфа или 5% раствором хлорида железа (III). Феназон в извлечении из объекта и «стандарт» должны проявиться в виде оранжевых (реактив Драгендорфа) или красных (хлорид железа (III)) пятен и иметь значение R, 0,6±0,02.
Пропифеназон. Для обнаружения пропифеназона с помощью ТСХ используют хроматографические пластинки «Сорбфил УФ-254» и систему растворителей гексан — толуол — диэтиламин при соотношении компонентов 37,5:7,5:5. Обнаружение ведут в присутствии «стандарта». На пластинку наносят спиртовый раствор пропифеназона в количестве 3-5 мкг и извлечение, полученное из объекта. После прохождения системы растворителей на высоту 10 см пластинку вынимают, высушивают. Пропифеназон на пластинке обнаруживают, используя следующие реактивы-проявители: хлорид железа (III), родамин С и УФ-облучение, реактив Драгендорфа (приготовленный по Мунье), пары йода. В указанных условиях Rf для пропифеназона равно 0,54±0,01. Чувствительность обнаружения составляет 1-3 мкг пропифеназона в исследуемой пробе.
Спектрофотометрия. УФ-спектрофотометрия. Для обнаружения производных пиразола с помощью УФ- спектрофотометрии сухой остаток после испарения хлороформного извлечения из объекта очищают, используя ТСХ. Исследуемые вещества с пластинки элюируют 0,1 М раствором серной (хлороводородной) кислоты, водой или спиртом. В полученных элюатах регистрируют спектр поглощения в области 210-320 нм. Феназон образует характерный максимум в растворе 0,1 М серной кислоты при 230 нм, метамизол в водном растворе — при 237 и 270 нм, в спиртовом — при 236 и 264 нм. Пропифеназон в водном растворе имеет характерный максимум при 240 нм, в спиртовом — при 246 и 278 нм, в 0,1 М растворе хлороводородной кислоты — при 238 нм.
Таблица 29. Хроматографические характеристики производных пиразола
|
Производное пиразола |
Время удерживания, мин |
Спектральные отношения R=A1/A210 |
|||
|
220 |
240 |
250 |
280 |
||
|
Метамизол |
5,54 |
0,623 |
0,531 |
0,557 |
0,217 |
|
Феназон |
7,95 |
0,817 |
0,809 |
0,584 |
0,177 |
|
Пропифеназон |
15,22 |
0,672 |
0,732 |
0,722 |
0,526 |
ИК-спектроскопия. Для регистрации ИК-спектра сухой остаток после испарения хлороформного экстракта из объекта растирают с бромидом калия, помещают в матрицу, прессуют и полученный диск помещают в прибор. Феназон имеет характерные волновые числа в ИК-спектре при 1660, 770 и 1486 см-1.
Высокоэффективная жидкостная хроматография
Обнаружение производных пиразола проводят с использованием «Милихром А-02» производства ЗАО «ЭкоНова» в условиях, описанных для производных фенотиазина (см. раздел 8.3). Полученные на хроматограмме пики идентифицируют по времени удерживания и по спектральным отношениям (табл. 29).
Для обнаружения пропифеназона при отравлении сложными смесями («Каффетин», «Саридон») Т.Х.Вергейчик с соавторами предложены следующие условия при использовании ВЭЖХ.
Хроматограф «Милихром-4», колонка 8 см с обращенно-фазовым сорбентом «Сепарон С-18», детектор — УФ, подвижная фаза — ацетонитрил — вода — диэтиламин (60:40:4), масштаб регистрации — 2,0, скорость расхода элюента — 50 мкл/мин, объем вводимой пробы — 3 мкл, детекция пиков при длинах волн — 238 и 276 нм.
Время удерживания компонентов указанных смесей составило для парацетамола — 3,08, пропифеназона — 5,73, кофеина — 4,0, кодеина — 4,67 мин. Чувствительность методики для пропифеназона — 0,03 мкг, для парацетамола и кофеина — по 0,02 мкг, для кодеина — 0,20 мкг вещества в пробе.
Количественное определение. Для количественного определения производных пиразола предложены фотоколориме- трические методы, УФ-спектрофотометрия и ВЭЖХ.
Фотоколориметрические методы основаны на получении окрашенных продуктов по реакциям образования пиразолонового красителя (феназон) и ауринового красителя (метамизол).
УФ-спектрофотометрия. Этот метод сочетают с хроматографической очисткой (ТСХ) извлечений с последующим элюированием с пластинки производных пиразола раствором 0,1 М серной кислоты или спиртом. Оптическую плотность растворов (элю- атов) определяют в максимуме светопоглощения для каждого вещества. Расчет содержания ведут по калибровочному графику или с использованием стандартного раствора определяемого вещества и его удельного показателя поглощения.
ВЭЖХ используют после очистки экстрактов из биологических объектов с помощью ТСХ. Для расчета количества производных пиразола в исследуемом объекте используют метод добавок, метод внутреннего стандарта или метод внешнего стандарта и формулы, приведенные ранее (см. раздел 8.1).
Из производных пурина наибольшее токсикологическое значение имеет кофеин (1,3,7-триметилксантин).

Токсикологическое значение. Главной особенностью кофеина как лекарственного препарата является его возбуждающее влияние на ЦНС. Кофеин содержится в листьях чая (Thea sinensis, Camellia sinensis, семейство Theaceae), орехах кола (Cola nitida, Cola acuminata, семейство Sterculiaceae), в зернах кофейного дерева (Coffea arabica, семейство Rubiaceae).
В медицинской практике используют кофеин и кофеин-бензоат натрия. Применяют препараты внутрь 2-3 раза в день по 0,05-0,1 г в качестве стимулятора ЦНС, кардиотонического средства, при спазмах сосудов. Для инъекций кофеин используют в виде кофеин-бензоата натрия.
Токсикомании, связанные со злоупотреблением стимуляторов ЦНС, имеют общие черты с наркоманиями амфетаминового ряда и эфедроновой наркоманией, но протекают мягче и без тяжелых последствий. Острая интоксикация вызывает эйфорию, ощущение бодрости, прилива сил, ясности мышления, стремление к активной деятельности. Для достижения желаемого эффекта требуется постоянно увеличивать дозу. Это приводит к резкому возрастанию толерантности. В результате прием кофеина может достигать 100-200 таблеток в сутки. Длительный прием истощает организм, ощущается разбитость, усталость, повышенная сонливость, вялость, фон настроения снижен, возникают мысли суицидального характера. Одновременно отмечается стойкая бессонница, что влечет наркомана к приему снотворных.
Хроническая интоксикация крепко заваренным чаем носит название «чифиризма». Чифирь — заварка чая, при которой 50 г чая настаиваюг с 200-300 мл горячей воды.
Для острых отравлений кофеином (чаще всего детей) характерно поражение желудочно-кишечного тракта, возбуждение ЦНС. За счет сильной стимуляции желудочной секреции возникает боль в эпигастрии, чувство жжения, иногда рвота. Артериальное давление падает, наблюдаются эпилептоидные и клонико-тонические судороги. Смерть наступает в течение 1-2 ч после отравления.
Патологоморфологическая картина при вскрытии погибших неспецифична. Отмечают увеличение массы и объема органов за счет сосудорасширяющего действия, резкий отек легких, головного мозга и его оболочек.
Пути метаболизма кофеина
Для кофеина характерна 1 фаза метаболизма, включающая деметилирование и окисление.

Физико-химические свойства. Кофеин — белый кристаллический порошок без запаха, на воздухе способен выветриваться, при нагревании — возгоняться. Кофеин медленно растворим в холодной воде (1:60), легко растворим в горячей воде, малорастворим в этаноле, но легко в хлороформе, практически нерастворим в диэтиловом эфире.
Кофеин обладает слабыми основными свойствами (рКа=0,6). Устойчивых солей кофеин не образует.
При изолировании из биологических объектов общими методами (Стаса-Отто, Васильевой) кофеин экстрагируется хлороформом из растворов с рН=2.
При проведении ТСХ-скринннга (см. раздел 7.1.2) кофеин на пластинках фиксируется реактивом Драгендорфа в виде оранжевого пятна.
При использовании в процессе аналитического скрининга (см. раздел 7.1.8) осадительных реактивов кофеин образует аморфные осадки с большинством из них.
Для обнаружения кофеина используют цветные, микрокристаллоскопические реакции, хроматографию в тонком слое сорбента, УФ-спектрофотометрию, ИК-спектроско- пию, ГЖХ и ВЭЖХ.
Обнаружение кофеина с помощью ТСХ проводят на пластинках «Силуфол УФ-254» со слоем силикагеля. Хроматографируют в системе растворителей хлороформ — ацетон (9:1) или толуол — ацетон — этанол — 25% раствор аммиака (45:45:7,5:2,5).
Сухой остаток растворяют в 3—4 каплях хлороформа, наносят на стартовую линию хроматографической пластинки. Рядом наносят «стандарт» (8-10 мкг) — раствор кофеина. Пластинку после окончания хроматографирования высушивают и обрабатывают реактивом Драгендорфа — образующиеся оранжевые пятна по цвету и значению Rf должны быть идентичны пятну «стандарта» (Rf для кофеина в первой системе растворителей составляет 0,25±0,02, во второй — 0,65±0,02).
Реакция образования мурексида. Для проведения реакции часть хлороформного экстракта из объекта испаряют в фарфоровой чашке досуха, добавляют 0,5-1,0 мл насыщенного раствора брома в воде и выпаривают досуха. Остаток при наличии кофеина приобретает красную или красно-бурую окраску, которая от капли 25% раствора аммиака переходит в пурпурную или фиолетовую.

Реакция с хлоридом ртути (II). На сухой остаток на предметном стекле наносят каплю 5% раствора хлорида ртути (II). Через 10-15 мин наблюдают образование крупных шелковистых бесцветных иглообразных кристаллов. Осадок представляет собой комплексное соединение состава C8H10N4O2 · HgCl2 (рис. 40).

Таблица 30. Хроматографические характеристики кофеина
|
Вещество |
Время удерживания, мин |
Спектральные отношения R=A1/A210 |
|||
|
220 |
240 |
250 |
280 |
||
|
Кофеин |
7,25 |
0,443 |
0,156 |
0,158 |
0,390 |
Реакция с золотобромоводородной кислотой. На сухой остаток на предметном стекле наносят каплю реактива, состоящего из 5% раствора хлорида золота, концентрированной хлороводородной кислоты и ацетона (1:1:1). К образовавшемуся осадку добавляют несколько кристаллов бромида калия — осадок окрашивается в оранжево-красный цвет. При рассматривании осадка под микроскопом наблюдают крупные желтовато-коричневые и бесцветные иглы (см. рис. 41).
Обнаружение кофеина по УФ- и ИК-спектрам. Часть остатка растворяют в этиловом спирте или в 0,1 М растворе хлороводородной кислоты и регистрируют спектр поглощения полученного раствора. Спектр кофеина имеет полосу поглощения с максимумом при 272-273 нм.
Часть остатка растирают с бромидом калия, прессуют, помещают полученный диск в прибор и регистрируют ИК-спектр. При наличии в остатке кофеина обнаруживаются основные характеристические полосы при 1695, 1658 и 745 см4.
Высокоэффективная жидкостная хроматография. Исследование рекомендовано проводить на жидкостном хроматографе «Милихром А-02» производства ЗАО «ЭкоНова». Методика основана на градиентном хроматографировании анализируемого соединения в строго стандартных условиях с детектированием при 4-5 длинах волн. Условия проведения анализа описаны ранее (см. раздел 8.3). Для идентификации пиков на хроматограмме определяют время удерживания вещества и спектральные отношения (табл. 30).
Газожидкостная хроматография. Для анализа используют газожидкостный хроматограф «Кристалл-2000М» с кварцевой капиллярной колонкой и неподвижной жидкой фазой НР-5. Детектор пламенно-ионизационный. Газ-носитель — азот, давление — 110 кПа, деление потока — 1:15, расход водорода — 20 мл/мин, воздуха — 200 мл/мин, температура детектора — 300°С, испарителя — 250°С, колонки — 220°С. Время анализа — 20 мин. Объем вводимой пробы — 0,5-1 мкл очищенных спиртовых растворов остатков, полученных при испарении хлороформных экстрактов из биологических объектов. Одновременно в хроматограф вводят спиртовые растворы в том же объеме веществ-«реперов», которые позволяют идентифицировать исследуемые вещества без применения стандартов, используя справочные данные. Для обнаружения ядовитого вещества в исследуемой пробе фиксируют время удерживания определяемого соединения и логарифмический индекс удерживания (для кофеина он равен 2232).
Количественное определение. Проводится с помощью газожидкостной хроматографии и высокоэффективной жидкостной хроматографии.
При определении с помощью ГЖХ используют условия, описанные выше при качественном обнаружении кофеина. После хроматографирования измеряют высоту (площадь) пика исследуемого вещества и высоту (площадь) пика стандартного раствора кофеина. Расчет концентрации кофеина в исследуемом объекте проводят по калибровочному графику.
При определении с помощью ВЭЖХ рекомендуется использовать метод добавок, метод внутреннего стандарта и метод внешнего стандарта. Расчет концентрации проводят по соответствующим формулам (см. раздел 8.1).
8.6. Производные фенилалкиламина
В токсикологической химии в этой группе рассматривают природный алкалоид эфедрин, его диастероизомер псевдоэфедрин, а также синтетические производные фенилалкилами- нов: эфедрон, амфетамин и метамфетамин. Наибольшее медицинское применение имеет эфедрин. Он используется в качестве сосудосуживающего и бронхорасширяющего средства. Амфетамин является психостимулятором. Его применение возможно при астенических явлениях после черепно-мозговых травм, после длительного постельного режима.
Применение производных фенилалкиламинов, особенно амфетамина и близких ему по химическому строению соединений, ограничено. Это связано с тем, что побочным эффектом их действия является эйфорическое состояние, т.е. эти производные имеют высокий наркоманический потенциал. В данном разделе остановимся на наиболее известных соединениях, имеющих токсикологическое значение.
Амфетамин в виде таблеток по 0,01 г применяется в настоящее время очень редко, что связано с побочными влияниями (нарушение высшей нервной деятельности, повышение артериального давления, аритмии, сонливость, апатия вместо возбуждения, потеря работоспособности, формирование зависимости, увеличение вероятности мозговых кровоизлияний, параноидные психозы). Амфетамин используется с такими же ограничениями, как и любое наркотическое средство. Благодаря стойкости в организме его действие длится от 2 до 8 ч.
За счет повышения настроения, физической активности, работоспособности, снижения усталости амфетамин и метамфетамин использовались в качестве допинговых средств для увеличения споршвных показателей. В настоящее время эти препараты взяты под особый контроль и запрещены для использования спортсменами.
Метамфетамин в РФ перенесен в список № 1 Постоянного Комитета РФ по контролю наркотиков, и оборот его полностью запрещен.
Злоупотребление амфетаминами часто сочетается со злоупотреблением спиртными напитками и снотворными средствами, что приводит к более грубым личностным изменениям, и по клинической картине они близки к кокаинизму. По данным Н.В.Веселовской, амфетамины вначале вызывают прилив сил, эйфорию, потерю аппетита, учащение пульса и дыхания, расширение зрачков. Длительный прием амфетаминов приводит к быстрому снижению веса, иммунитета, разрушению легких, печени, почек, ухудшению зрения, головокружению, потере координации и коллапсу. Психическая зависимость развивается очень быстро — после 3-5 внутривенных инъекций и через 2-3 нед. нерегулярного орального приема. Физическая зависимость характеризуется признаками синдрома отмены. Абстинентный синдром возникает через 9 ч после отмены препарата и может длиться до 10 нед. За счет развивающейся толерантности разовая доза амфетамина может доходить до 1 г, метамфетамина — до 0,8 г.
Прием больших доз («сверхдоза») сопровождается увеличением кровяного давления, появлением лихорадочного состояния, токсическими («амфетаминовыми») психозами, подобными параноидной шизофрении, сердечными приступами и инфарктом. Картина острого отравления амфетамином похожа на острое смертельное отравление кофеином и дополняется нарушением сердечной проводимости.
Эфедрин — алкалоид, содержащийся в различных видах эфедры (Ephedra, семейство Ephedraceae). Он применяется в медицинской практике в виде гидрохлорида. Его назначают для стимулирования а- и (3-адренорецепторов, ЦНС, для сужения сосудов и уменьшения воспалительных процессов при ринитах, для повышения артериального давления, при оперативных вмешательствах, при травмах, кровопотерях, при миастении, нарколепсии (непреодолимого желания спать), отравлении снотворными и наркотическими средствами, местно — как сосудосуживающее средство, при бронхоспазмах и для расширения зрачка с диагностической целью. Применяют эфедрин в виде порошка, таблеток, инъекционных растворов. Эфедрина гидрохлорид входит в состав комбинированных лекарственных препаратов («Теофедрин», «Солутан», «Бронхолитин», «Эфатин») и назначается при бронхоспазмах.
К эфедрину может быть привыкание, что приводит к нарушению психики, слуховым и обонятельным галлюцинациям.
В судебно-медицинской практике отравления эфедрином встречаются при использовании его в качестве гипертензивного препарата для искусственного повышения артериального давления. Клиника острого отравления (1-5 мг/кг) характеризуется вначале бессонницей, головокружением, тремором конечностей, сердцебиением, повышением артериального давления, аритмией, затем возникают тошнота, рвота, задержка мочеиспускания, возбуждение ЦНС, резкое психическое и двигательное беспокойство, отек легких, повышенная возбудимость дыхательного центра и его истощение.
Эфедрон (марчефаль, джеф) — продукт окисления эфедрина. Его использование наблюдалось в основном в России. Злоупотребление этим веществом носит название «эфедроновой наркомании». Эфедрон отнесен Постоянным Комитетом РФ по наркотикам к списку №1 и оборот его в нашей стране запрещен.
Эфедроном начинают злоупотреблять подростки. Вводится эфедрон с наркотической целью от 2 до 80 мл кустарно изготовленного средства в сутки неопределенной концентрации. С повышением толерантности число инъекций может доходить до 10 раз в сутки и более. Наркотический эффект развивается сразу или через 15-20 мин и длится 6-8 ч. Состояние опьянения характеризуется чувством эйфории, прилива энергии, легкости тела, ясности мысли, повышенной трудоспособности. Больные многословны, суетливы, деятельность их непродуктивна, свое состояние они оценивают как «состояние счастья, безмерной радости». При введении наркотика наблюдаются вегетативно-сосудистые изменения: возникает ощущение ползанья мурашек, «волосы встают дыбом на голове», развивается тахикардия, сухость во рту, повышается артериальное давление. У больных наблюдаются тяжелые неврологические и психические расстройства. Психозы характеризуются бредом преследования, ревности, тревогой, страхом, больные боятся людных мест, не могут переходить улицу, пользоваться метро и т.д. Одновременно они ищут общения и отличаются многословием, непоследовательностью, суетливостью, неусидчивостью.
Метиленоксипроизводные амфетамина. Эта группа соединений получила широкое распространение в настоящее время во многих странах, в том числе и в РФ, за счет их способности вызывать легкую эйфорию и особое психическое состояние, для которого характерно обострение эмоционального восприятия, возрастание силы эмоций и ощущений. Долгое время считалось, что эти вещества безопасны, их применяли в психиатрии для снятия беспокойства пациентов. При изучении последствий применения этих препаратов появились сообщения о вредных побочных эффектах, психических отклонениях и серьезных мозговых нарушениях. Все соединения этой группы по Конвенции ООН и Постоянным Комитетом по контролю наркотиков РФ запрещены для употребления и введены в список № 1.
Популярным наркотиком в увеселительных заведениях является метилендиокси- мегамфетамин — МДМА («уличное» название «экстази»). Это белые, красные, розовые таблетки круглой формы с вдавленным рисунком (серп и молот, торговый знак «мерседес», стилизованный зайчик и т.д.). У человека, принявшего препарат, сердце бьется быстрее в такт современной музыки, человека переполняет радость и счастье. Молодежь не считает это вещество наркотиком. Чтобы не уставать на дискотеке всю ночь, подростки принимают 3—4 таблетки, через 2 дня организм требует 6, затем 10, 12 таблеток и т.д. В состоянии эйфории человек теряет потребность в пище, он живет за счет внутренних резервов. За ночь человек худеет примерно на 6 кг.
Последствия применения таблеток «экстази» — психозы, депрессии, необратимое разрушение личности, отмечены многочисленные случаи тяжелых психических заболеваний. Этому способствует окружающая обстановка дискотек и вечеринок, большое скопление людей, повышенная температура помещений, длительная и интенсивная физическая нагрузка. При незначительной передозировке возможен летальный исход. Смерть наступает в результате осложнений сердечно-сосудистой системы, острой сердечной недостаточности, остановки сердца, отказа почек, гипертермии (до 40-42°С). При патологоанатомическом исследовании погибших отмечают значительные изменения печени, почек, мозга.
Пути метаболизма. Препараты группы фенилалкиламинов быстро всасываются из ЖКТ после орального применения. Они легко преодолевают гематоэнцефалический барьер. В метаболизме фенилалкиламинов можно выделить следующие основные процессы. В I фазе метаболизма проходит окислительное дезаминирование, гидроксилирование ароматического кольца, деалкилирование у азота боковой цепи. Во II фазе метаболизма гидроксилированные метаболиты образуют конъюгаты с глюкуроновой и серной кислотами.
В неизмененном виде амфетамин и эфедрон выводятся с мочой в количестве 20-30%, метамфетамин — около 45%, эфедрин — 55-75%, норэфедрин — 90%.
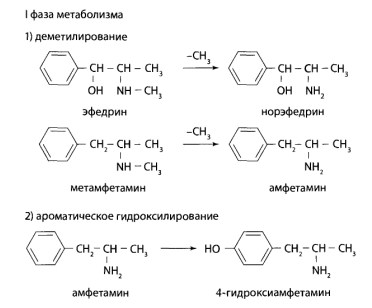
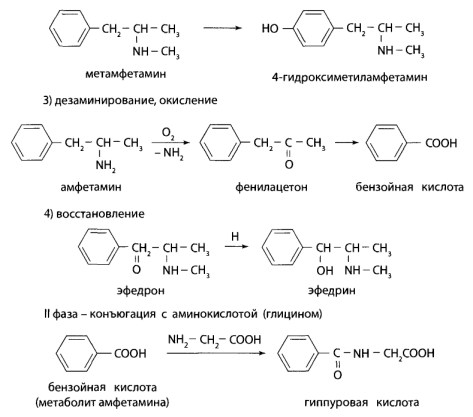
Физико-химические свойства фенилалкиламинов. В виде солей хлороводородной кислоты это белые кристаллические вещества без запаха, легкорастворимы в воде, этаноле, практически нерастворимы в диэтиловом эфире и хлороформе. Все производные фенилалкиламинов — вещества основного характера (табл. 31).
Основания этих веществ, за исключением эфедрина, представляют собой маслянистые, труднолетучие жидкости. Они хорошо растворимы в этаноле, хлороформе, диэтиловом эфире. Основание эфедрина хорошо растворимо в воде.
При изолировании из биологических объектов общими методами (ненаправленный анализ) производные фенилалкиламинов экстрагируются хлороформом в виде оснований из водных вытяжек при рН=8-10. При направленном анализе производные фенилалкиламинов экстрагируют из водных вытяжек при рН=12 диэтиловым эфиром или хлороформом. Рекомендуется для изолирования производных фенилалкиламинов из мочи использовать твердофазную экстракцию. Для очистки извлечений предложена реэкстрация при разных значениях pH.
Таблица 31. Значения рКа для производных фенилалкиламинов
|
Вещество |
рКа |
|
Эфедрин |
9,6 |
|
Эфедрон |
9,0 |
|
Амфетамин |
9,9 |
|
Метамфетамин |
10,1 |
При проведении общего ТСХ-скрининга (см. раздел 7.1.2) фенилалкиламины обнаруживают на хроматографических пластинках с помощью реактива Драгендорфа.
С осадительными реактивами фенилалкиламины образуют аморфные или кристаллические осадки (см. раздел 7.1.8).
Для обнаружения производных фенилалкиламинов используют хроматографию в тонком слое сорбента, УФ-спектрофотометрию и ИК-спектроскопию, ВЭЖХ, ГЖ, ГХ/ МС и химический метод.
Хроматография в тонком слое сорбента. Остаток после испарения экстракта из водной вытяжки при рН=11-12 наносят на пластинки «Сорбфил». Параллельно на стартовую линию наносят спиртовые растворы «стандартов» (по 10-15 мкг) эфедрина, эфедро- на, метамфетамина. Пластинки помещают в системы растворителей бензол — этанол — диэтиламин (9:1:1), хлороформ — ацетон — этанол — 25% раствор аммиака (20:20:3:1) или толуол — этанол — триэтиламин (9:1:1). После пробега фронта растворителя на расстояние 10 см пластинку вынимают, высушивают и фенилалкиламины обнаруживают путем обработки пластинки реактивом Драгендорфа — появляются оранжевые пятна. При опрыскивании пластинки раствором нингидрина в ацетоне (или н-бутаноле) и при нагревании в сушильном шкафу при 70-80°С эфедрин и эфедрон образуют пятна на пластинке, окрашенные в синий или сине-фиолетовый цвет, амфетамин — пятна голубого цвета, метамфетамин — желто-коричневого. При анализе с использованием системы растворителей бензол — этанол — диэтиламин (9:1:1) Rf для эфедрина составляет 0,41 ±0,02, для эфедрона — 0,65±0,02, для метамфетамина — 0,42±0,02.
УФ-спектрофотометрия используется после очистки извлечений (экстрактов) из объектов с помощью хроматографии в тонком слое сорбента и элюировании с пластинки очищенных соединений 0,1 М раствором хлороводородной кислоты. Эфедрин, амфетамин и метамфетамин в среде хлороводородной кислоты имеют три полосы поглощения с максимумами при 251, 257 и 263 нм. В УФ-спектре раствора эфедрона обнаруживается одна полоса с максимумом при длине волны 251 нм.
ИК-спектроскопия. Остаток после испарения хлороформного экстракта очищают с помощью тонкослойной хроматографии, с пластинки фенилалкиламины элюируют этанолом, который испаряют досуха. Сухой остаток растирают с бромидом калия, прессуют и анализируют в ИК-спектрометре. Основные характеристические полосы для производных фенилалкиламинов представлены в таблице 32.
Высокоэффективная жидкостная хроматография. Для обнаружения фенилалкиламинов с помощью ВЭЖХ рекомендуются следующие условия (С.К.Еремин): прибор «Милихром», колонка 62х2 мм, сорбент обращеннофазовый «Сепарон С-18» (5 мкм), подвижная фаза (элюент) — смесь водного 0,2 М раствора ортофосфорной кислоты, метанола и диэтиламина 75:20:1, детектирование при 210 нм, скорость элюирования — 50 мкл/ мин, объем вводимой пробы — 7 мкл, масштаб чувствительности — 0,4 е.о.п.
Обнаружение производных фенилалкиламинов проводят по времени (объему) удерживания (см. табл. 33).
При анализе извлечений в условиях, описанных ранее (см. раздел 8.3), обнаружение производных фенилалкиламинов проводят по времени (объему) удерживания и по спектральным отношениям (см. табл. 34).
Газохроматографический анализ в сочетании с масс-спектрометрией (ГХ/МС). Проводится после получения фторпроизводных с использованием детектора по захвату электронов.
Сухой остаток после испарения экстракта из водной вытяжки с рН= 11-12 растворяют в 0,5-1 мл толуола и добавляют соответствующий реактив для перевода фенилалкиламинов в летучее фторпроизводное по методике, описанной ранее в разделе 7.2.3. Смесь нагревают до 60°С 30 мин. После охлаждения добавляют 5% раствор гидрокарбоната натрия и верхнюю фазу, содержащую фторпроизводные, вводят в газовый хроматограф, соединенный с масс-спектрометром. Обнаружение фенилалкиламинов проводят по времени удерживания и характерным линиям, выражающим отношение m/z в масс-спектре.
Таблица 32. Обнаружение фенилалкиламинов в ИК-спектре
|
Вещество |
Характеристические полосы, см-1 |
|
Амфетамин |
700, 740, 825, 1090, 1495, 1605 |
|
Метамфетамин |
698, 747, 1060, 1085, 1491, 1590 |
|
Эфедрин |
699, 754, 760, 994, 1049, 1242, 1400, 1480, 1605 |
|
Эфедрон |
702, 757, 1510, 1590, 1695 |
Таблица 33. Хроматографические характеристики фенилалкиламинов
|
Вещество |
Объем удерживания, мкл |
Чувствительность, мкг/мл · 106 |
Предел обнаружения, мг |
|
Эфедрин |
383 |
1,7 |
6,0 |
|
Эфедрон |
455 |
1,0 |
10,0 |
|
Амфетамин |
494 |
6,1 |
1,6 |
|
Метамфетамин |
639 |
1,25 |
8,0 |
Таблица 34. Обнаружение фенилалкиламинов по времени (объему) удерживания и спектральным отношениям
|
Вещество |
Объем удерживания, мкл |
Спектральные отношения A1/A210 |
||||||
|
220 |
230 |
240 |
250 |
260 |
280 |
300 |
||
|
Эфедрин |
1088 |
0,164 |
0,004 |
0,009 |
0,018 |
0,021 |
0,001 |
0,001 |
|
Эфедрон |
1064 |
0,148 |
0,436 |
1,068 |
1,526 |
1,076 |
0,182 |
0,088 |
|
Амфетамин |
1198 |
0,114 |
0,002 |
0,007 |
0,017 |
0,021 |
0,000 |
0,000 |
|
Метамфетамин |
1145 |
0,166 |
0,003 |
0,008 |
0,017 |
0,020 |
0,000 |
0,001 |
|
МДМФ (экстазн) |
1280 |
0,365 |
0,487 |
0,461 |
0,119 |
0,073 |
0,438 |
0,094 |
Химический метод. Из химических реакций для обнаружения производных фенилалкиламинов используют реакции окрашивания, комплексообразования и микрокрист аллоскопические.
Реакции окрашивания. Проводятся на фарфоровых чашках с сухими остатками, полученными после испарения экстрактов из биологических объектов.
Реакция с реактивом Марки. На сухой остаток наносят реактив Марки. При наличии амфетамина наблюдают оранжевое окрашивание, переходящее постепенно в коричневое. При наличии метамфетамина образуется желто-зеленое окрашивание.
Реакция с нингидрином. При добавлении к сухому остатку гидроксида натрия до рН=8,5, раствора нингидрина и последующем нагревании эфедрин образует синефиолетовое окрашивание, эфедрон — фиолетовое, амфетамин — розово-оранжевое, метамфетамин — зеленое.
Микрокристаллоскопические реакции. Из производных фенилалкиламинов кристаллические осадки образует с различными реактивами только эфедрин. На сухой остаток наносят каплю 0,1 М раствора хлороводородной кислоты и каплю соответствующего реактива. Через 10-15 мин наблюдают кристаллы характерной формы при рассматривании под микроскопом.
Реакция с реактивом Драгендорфа в модификации А. С. Тищенко. Состав используемого реактива: 1,5 г висмутата натрия (NaBiО3), 7,5 г йодида калия (KJ) растворяют в 100 мл 2% раствора серной кислоты. Эфедрин с данным реактивом образует игольчатые кристаллы и кристаллы в виде пластинок неправильной формы и сростки из них (рис. 42).По этой реакции можно обнаружить 0,5 мкг эфедрина в пробе при предельном разбавлении 1:16 000. По данным М.Д.Швайковой, микрокристаллоскопическая реакция эфедрина с реактивом Драгендорфа специфична.
Реакция с платинохлороводородной кислотой и йодидом калия (А. С. Тищенко). К капле исследуемого раствора на предметном стекле добавляют каплю 0,5% раствора платинохлороводородной кислоты (H2PtCl6) и несколько кристаллов йодида калия. Через 15-20 мин. наблюдают образование красно-фиолетовых кристаллов в виде пластинок неправильной формы, собранных в сростки, напоминающие по форме ветки (рис. 43А) и розетки (рис. 43Б).
Экспресс-анализ производных амфетаминов
Анализ проводится с образцами изъятых вещественных доказательств (таблетки, порошки, капсулы и т.п.).
Обнаружение с реактивом Марки. На исследуемый образец наносят реактив. Наблюдают появление окрашивания (цвета образующихся продуктов описаны ранее).
Реакция с концентрированной серной кислотой. Характерного окрашивания не образуют амфетамин и метамфетамин. Реакция используется для отличия амфетамина и метамфетамина от других производных.
Реакция с реактивом Симона. При добавлении к испытуемому образцу 1 капли смеси равных объемов 10% раствора ацетальдегида и 1% раствора нитропруссида натрия, а затем 2 капель 2% раствора карбоната натрия в присутствии метамфета- мина появляется голубое окрашивание.
Реакция с модифицированным реактивом Симона. При добавлении к образцу 1 капли 1% раствора нитропруссида натрия в 5% водном растворе ацетона и 1 капли 2% раствора карбоната натрия в присутствии амфетамина появляется пурпурная окраска.
Результатам реакций экспресс-анализа можно придать судебно-химическое значение только при получении отрицательного результата в связи с их неспецифичностью. Положительный результат реакций требует подтверждения с помощью физико-химических методов.
Количественное определение
Для количественного определения фенилалкиламинов используют фотометрический метод и высокоэффективную жидкостную хроматографию.
Экстракционно-фотометрический метод используется для определения эфедрина в моче. 5 мл мочи подщелачивают 0,5% раствором гидроксида натрия до рН=12 и экстрагируют 3 раза 20 мл диэтиловош эфира. Эфирные экстракты объединяют и испаряют досуха. Остаток переносят в колориметрическую пробирку, добавляют до насыщения кристаллический сульфат натрия и смешивают с 1 мл аммиачного раствора сульфата меди и 3 мл 5% раствора сероуглерода в бензоле.

Слой бензола окрашивается в желтый цвет. Оптическую плотность измеряют с помощью спектрофотометра или фотоэлектроколориметра при длине волны 440 нм в кювете с толщиной слоя 10 мм. Расчет количества эфедрина в моче проводят по калибровочному графику.
Высокоэффективная жидкостная хроматография. Условия определения описаны в разделе «Обнаружение фенилалкиламинов». Для количественного анализа применяют метод добавок. С этой целью проводят анализ экстракта из биологического объекта с добавлением в него известного количества обнаруженного фенилалкиламина. Расчет ведут по формуле (см. раздел 8.1).
Метод внешнего стандарта. Вначале проводят анализ экстракта из биологического объекта, а затем анализ эталонного раствора обнаруженного вещества с концентрацией, близкой к концентрации исследуемого соединения в экстракте. Расчет ведут по формуле (см. раздел 8.1).
Метод внутреннего стандарта. К объекту добавляют известное количество вещества, принятого за «стандарт». Концентрацию фенилалкиламина рассчитывают по формуле (см. раздел 8.1).
К этой группе относят вещества, находящиеся в различных частях конопли посевной (Cannabis sativa). В конопле идентифицировано более 30 различных каннабиноидов. Наркоманы употребляют препараты конопли чаще всего в виде марихуаны и гашиша. Действие гашиша на организм в 5 раз сильнее, чем действие марихуаны.
Конопля распространена повсеместно. Ее используют с давних пор как сельскохозяйственную культуру. Однако ее эйфоригенное действие известно так же давно. До нашей эры Геродотом было описано это растение и его использование: «В скифской земле произрастает конопля — растение, очень похожее на лен, но гораздо толще и крупнее. Ее таи разводят, но встречается и дикорастущая конопля. Взяв конопляное семя, скифы подлезают под войлочную юрту, бросают его на раскаленные камни. От этого поднимается такой сильный дым и пар, что никакая элинская паровая баня не сравнится с такой баней. Наслаждаясь ею, скифы громко вопят от удовольствия. Это было частью культового обряда. Сжигаемые в юрте стебли конопли и семена производили дым, вызывающий опьянение. Люди и шаманы приходили в экстаз».
С XV до XX века в фармакопеи некоторых стран входили препараты конопли. В Китае смолу каннабиса рекомендовали в качестве анестетика. В Европе и США использовали как лекарственное и психоактивное средство и свободно продавали в аптеках. До 1992 г. в США в медицинской практике марихуана ограниченно использовалась для лечения больных СПИДом, онкологическими заболеваниями и глаукомой. С 1992 г. в США и Германии используется тетрагидроканнабинол для лечения глаукомы и токсикоза раковых больных, прошедших курс химиотерапии.
Основными каннабиноидами являются 5 соединений:

В настоящее время каннабис, его препараты и все изомеры ТГК входят в список № 1 Постоянного Комитета по контролю наркотиков РФ, что запрещает их использование с любыми, в том числе и медицинскими целями.
Токсикологическое значение
В XX столетии (1960-1970-е гг.) употребление марихуаны молодежью США и других стран достигло больших масштабов. Ее курят, смешивая с табаком, принимают внутрь, жуют, добавляют в сладости, напитки. Многими исследованиями было установлено, что марихуана постепенно вызывает наркотическое пристрастие, способствует переходу молодежи к другим «тяжелым» наркотикам: героину, кокаину, опию. В связи с этим отношение общества к проблеме свободного использования марихуаны коренным образом изменилось.
Наибольшее распространение на нелегальном коммерческом рынке получили следующие формы наркотических средств из конопли.
Марихуана — высушенная и измельченная верхняя часть растения с листьями и цветками. Содержание психоактивных веществ в марихуане доходит до 13-15%.
Гашиш (hash) — смола (смолка), производимая каннабисом (Cannabis sativa) в определенный период развития растения. Имеет зеленый, темно-коричневый или черный цвет. Содержание ТГК составляет 2-10%.
Гашишное масло — экстракт растительного материала или смолы каннабиса, полученный извлечением органическими растворителями. Это темная, жидкая, вязкая масса. Содержание ТГК колеблется от 10 до 60%.
В зависимости от способа изготовления полученные наркотические средства из конопли на черном рынке получили названия: «анаша», «харас», «хирус», «марихуана», «травка», «план», «киф», «дагга», «маханга» и др.
Способы употребления наркотических средств из конопли:
- Курение (вдыхание дыма). С этой целью используют сигареты с добавкой гашиша или гашишного масла. Наркотический эффект появляется через несколько минут.
- Оральное употребление. Чаще всего жевание, заварка, напитки, конфеты с добавкой марихуаны и т.д. Наркотический эффект появляется через 0,5-1 ч.
Действие одной дозы длится 3-5 ч, иногда 12 ч и более. При употреблении марихуаны, по описанию Э. А. Бабаяна, физиологическое действие на организм напоминает действие опия. Развивается эйфория, которая сопровождается двигательным и речевым возбуждением (появляется необходимость быстро ходить, прыгать, бегать, танцевать), яркими красочными галлюцинациями, ощущением беззаботности и веселья. В таком состоянии человек высказывает свои сокровенные мысли. Любые действия окружающих вызывают неудержимый смех, внимание отвлекается, ассоциации возникают легко и быстро. Возникает гипертрофия собственного «Я» (субъект считает себя высшим человеческим существом), раздвоение личности. Появляется чувство ужаса перед любым шумом (навязчивое ощущение тиканья часов, жужжания комара). Нарушается представление о времени и пространстве. Расстояние между двумя рядом стоящими предметами кажется настолько огромным, что рука никогда не дотянется до рядом стоящего стакана, а вертикальная лестница у стены «тянется до самого неба». Наблюдается обострение эмоциональных переживаний (давно пережитые сцены прошлого оживают перед глазами в мельчайших деталях с острыми эмоциональными переживаниями). Затем наступает общая слабость, вялость, плаксивость и долгий, глубокий сон с замедлением пульса и понижением температуры тела. Характер действия гашиша зависит от особенностей организма, принятой дозы и активности наркотического средства. Длительное применение наркотических средств из конопли снижает умственные способности человека. Каннабиноиды поражают легкие, сердце, снижают содержание тестостерона (у мужчин), накапливаются в женских репродуктивных органах, вызывают токсическое действие на развитие плода, тяжелое течение родов и раннюю смерть младенцев.
При смертельных отравлениях гашишем (в эксперименте на животных) в мозге выявляются тяжелые деструктивные нарушения (венозный застой, различная деструкция ганглиозных клеток вплоть до их гибели). В сердечной мышце отмечены очаговая дистрофия, кровоизлияния, в легких — полнокровие, массивные кровоизлияния, эмфизема, острая токсическая пневмония, в печени — тяжелая дистрофия.
Биотрансформация и пути метаболизма
При курении каннабиноиды быстро всасываются в кровь. Вследствие разложения веществ возрастает количество физиологически активных соединений КБ и Д9-ТГК. Концентрация ТГК в крови достигает максимума через 5-30 мин.
Метаболитические процессы проходят активно. Известно около 50 метаболитов кан- набиноидов. При введении каннабиноидов через рот за счет плохой растворимости концентрация в крови нарастает медленно и достигает максимума в зависимости от формы приема через 1-3 ч.

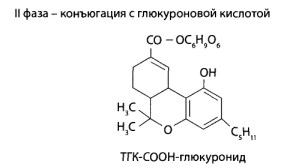
Накапливаются и подвергаются различным процессам метаболизма каннабиноиды в печени. Δ9-ТГК хорошо растворим в жирах, поэтому локализуется, в основном, в печени, почках, легких, мозге, селезенке, костном мозге.
Δ9-ТГК образует неактивный метаболит 11-норкарбокси-Δ9-ТГК, который затем связывается в виде конъюгата с глюкуроновой кислотой. Метаболиты каннабиноидов выводятся с мочой, калом, секретом слюнных и молочных желез. В зависимости от введенной дозы наркотического средства, содержащего Δ9-ТГК, 80-90% выводится за 5 дней, из них 20% с мочой и 65% с калом. Основным метаболитом каннабиноидов является ТГК-кислота, которая на 80% выводится в виде конъюгатов с глюкуроновой и серной кислотами. С калом выводится Δ9-ТГК и ТГК-кислота, конъюгированные с желчными и жирными кислотами.
Физические свойства
Δ9-ТГК и Δ9-ТГК-кислота хорошо растворимы в этиловом спирте и ацетоне, практически нерастворимы в воде. Δ9-ТГК-кислота плохо растворима в хлороформе, диэтиловом эфире и нерастворима в бензоле, петролейном эфире. Это слабая кислота, она имеет рКа=10,6.
Объекты анализа на каннабиноиды и их подготовка к исследованию
Смывы с губ, ладоней, пальцев рук. Для взятия проб с губ, ладоней, пальцев рук их протирают смоченным спиртом тампоном из марли или ваты. Из тампонов исследуемые соединения экстрагируют органическим растворителем (гексаном, этилацетатом или петролейным эфиром). Экстракты упаривают до объема 0,2-0,4 мл и подвергают анализу.
Слюна и смывы со рта. Отбирают 10 мл слюны или ополаскивают рот 50 мл 70% этанола, к которому до насыщения добавлен хлорид натрия (с целью исключения возможности проглатывания). Каннабиноиды повторно экстрагируют этилацетатом. Полученные экстракты упаривают до объема нескольких капель и анализируют.
Плазма. 5 мл плазмы экстрагируют смесью петролейного эфира, содержащего 1,5% пентанола по объему. Экстракт упаривают до нескольких капель и исследуют.
Моча. 50 мл мочи подвергают щелочному гидролизу и образовавшуюся Δ9-ТГК- кислоту после подкисления экстрагируют органическим растворителем, упаривают, переводят в метиловый эфир и анализируют методами ГЖХ и ГХ-МС.
Волосы отбирают и готовят к исследованию, как описано ранее (см. раздел 6.3). Для анализа используют хроматомасс-спектрометрию (см. раздел 7.2,3).
Образцы наркотических средств (гашиш, марихуана, гашишное масло). Навеску образца берут в количестве 0,5-1 г и экстрагируют в течение 1 ч десятикратным количеством 96% этилового спирта, фильтруют, упаривают до небольшого объема и анализируют. Гашишное масло смешивают с 96% этиловым спиртом в соотношении 1:10 и анализируют.
Методы обнаружения каннабиноидов
Для обнаружения каннабиноидов в извлечениях из объектов используют химический метод, хроматографию в тонком слое сорбента, ГЖХ, ВЭЖХ, ГХ-МС и иммуноферментный метод. При анализе образцов наркотических средств анализ сочетается с микроскопическим исследованием.
Таблица 35. Хроматографические характеристики основных каннабиноидов
|
Канндбинонд |
Объем удерживания |
Спектральные отношения S1/S210 |
||||||
|
220 |
230 |
240 |
250 |
260 |
280 |
300 |
||
|
Каннабинол |
3556 |
1,157 |
0,823 |
0,412 |
0,122 |
0,238 |
0,607 |
0,412 |
|
Тетрагидроканнабинол |
3702 |
0,407 |
0,233 |
0,093 |
0,012 |
0,012 |
0,026 |
0,000 |
Реакции окрашивания (предварительное исследование).
- Экстракт из объекта в объеме нескольких капель наносят на фильтровальную бумагу, подсушивают и обрабатывают 0,5% раствором прочного синего Б в 10% растворе гидрокарбоната натрия. Каннабиноиды обнаруживаются на бумаге в виде пурпурнокрасного пятна.
- К части экстракта добавляют ацетальдегид, раствор ванилина в 96% этиловом спирте, концентрированную хлороводородную кислоту и 1 мл хлороформа. При встряхивании слой хлороформа окрашивается в фиолетовый цвет.
Реакциям придают судебно-химическое значение при получении отрицательного результата.
Хроматография в тонком слое сорбента. Анализ проводят на хроматографических пластинках «Силуфол». На стартовую линию хроматограммы наносят экстракт, полученный из слюны, плазмы крови, смывов со рта, мочи и помещают в систему растворителей петролейный эфир — диэтиловый эфир (4:1). Хроматографирование осуществляют двукратно. После подсушивания пластинку обрабатывают 0,5% раствором прочного синего Б в 10% растворе карбоната (или гидрокарбоната) натрия. Каннабиноиды на пластинке проявляются в виде окрашенных полос или пятен красного, пурпурного, оранжевого цвета (каннабинол образует пятно с Rf0,76 пурпурного цвета, тетрагидроканнабинол — с Rf 0,84 красного цвета).
Иммуноферментный метод. Этот метод отличается простотой выполнения и высокой чувствительностью. С его помощью можно обнаружить многие метаболиты каннабиноидов. У лиц, хронически употребляющих каннабиноиды, после последнего употребления этим методом можно их обнаружить в течение 77 дней, а у периодически употреблявших — в течение 29 дней.
Метод ГЖХ. Используется хроматограф Agilent 6890N, с капиллярными колонками длиной до 30 м, режимом постоянного давления 17 пси. Объем вводимой пробы — 1 мкл. Температура термостата колонок программируется от 200 до 280°С (10°С/мин). Температура детектора — 300°С, поток водорода — 30 мл/мин. Температура испарителя — 270°С. Время удерживания Д9-ТГК составляет в данных условиях 7,57 мин.
Метод ВЭЖХ. Этот метод отличается большей селективностью, чем ТСХ и реакции окрашивания. Для обнаружения используется жидкостный хроматограф «Милихром А-02» в условиях, приведенных ранее (см. раздел 8.3). Обнаружение каннабиноидов ведут по удерживаемому объему или времени удерживания и по спектральным отношениям при нескольких длинах волн (табл. 35).
Метод газовой хроматографии в сочетании с масс-спектрометрией. После подготовки пробы мочи к анализу и метилирования Δ9-ТГК-кислоты пробу вводят в хроматомасс-спектрометр. Разделение веществ и их обнаружение проводят по методике, описанной ранее (см. раздел 7.2.3). Метиловый эфир Δ9-ТГК-кислоты имеет характерные отношения масса/заряд (m/z): 372, 357 и 313. Для Δ9-ТГК характерны масс-фрагменты m/z 314, 299, а для метилового эфира Δ9-ТГК — фрагменты с отношением m/z 328, 313.
Анализ образцов наркотических средств (гашиш, марихуана) и частей конопли, изъятых из содержимого желудка
Для отделения твердых включений при осмотре объектов (содержимого желудка) рекомендуется смешать их с водой очищенной, слить в конический сосуд или отцентрифутировать в пробирке и выделившийся осадок подвергнуть микроскопическому исследованию. Характерными признаками присутствия в объекте частей конопли являются наличие нежелезистых волосков, многоклеточных и одноклеточных железистых волосков трех форм: сидящих на одноклеточной ножке, длинных на многоклеточной ножке, небольших железистых с одноклеточной ножкой, пыльцевых зерен округлой формы, скоплений клеток, выделяющих смолу (см. раздел 7.2.7, рис. 27).
Количественное определение
Для количественного определения каннабиноидов в анализируемом объекте предложены методы газовой хроматографии и высокоэффективной жидкостной хроматографии.
Метод газовой хроматографии. Определение проводят по площади или высоте пика анализируемого вещества и внутреннего стандарта. В качестве внутреннего стандарта используют аналог исследуемого вещества, меченного стабильным изотопом, в частности, дейтерированные соединения. Хроматографический внутренний стандарт добавляют в анализируемую пробу непосредственно перед вводом в хроматограф в концентрации, сопоставимой с концентрацией анализируемого вещества. Чтобы контролировать весь процесс пробоподготовки и анализа, внутренний стандарт часто рекомендуют добавлять к аликвоте биожидкости, отобранной для гидролиза или изолирования. В этом случае внутренний стандарт подвергается всем операциям вместе с анализируемым веществом.
В таком варианте использования внутреннего стандарта результаты количественного определения будут более точными и воспроизводимыми.
Содержание каннабиноидов рассчитывают по калибровочному графику, выражающему зависимость высоты (площади) пика ионов анализируемого вещества (внутреннего стандарта) от концентрации в диапазоне 1,0-10,0 мкг/мл.
Высокоэффективная жидкостная хроматография. Определение концентрации каннабиноидов проводят, используя метод добавок, метод внутреннего или внешнего стандарта. Формулы для расчета количества каннабиноидов и методики определения приведены в разделе 8.1.
8.8. Производные индола и некоторые галлюциногены
Производные индола имеют важное токсикологическое значение. На протяжении нескольких столетий были известны две группы ядовитых веществ производных индола: алкалоиды чилибухи и алкалоиды спорыньи. С 1940-х годов стала известна группа галлюциногенов, одним из которых является диэтиламид лизергиновой кислоты. Поэтому производные индола следует рассматривать в двух разделах.
Главными алкалоидами чилибухи (Strychnos пт vomica, семейство Loganiaceae) являются стрихнин и бруцин.

Стрихнина нитрат — бесцветные блестящие игольчатые кристаллы, горького вкуса, растворимые в воде, хлороформе, спирте, почти нерастворимы в эфире. В виде основания стрихнин растворим в хлороформе, этиловом спирте, слаборастворим в диэтиловом эфире и воде.
Бруцин — кристаллическое вещество. Он трудно растворим даже в горячей воде, легко растворим в спирте, хлороформе и почти нерастворим в эфире.
В медицинской практике применяют стрихнина нитрат в качестве средства, возбуждающего ЦНС, особенно спинной мозг, при параличах мышц, вялости кишечника, сердечной слабости по 1-1,5 мг, в виде подкожных инъекций по 0,5-1,0 мл 0,1% раствора. В терапевтических дозах стрихнин оказывает стимулирующее действие на органы чувств (обостряет зрение, вкус, слух, тактильное чувство), возбуждает сосудодвигательный и дыхательный центры, тонизирует скелетную мускулатуру, а также мышцу сердца, стимулирует процессы обмена. Формы выпуска препаратов: 0,1% раствор стрихнина нитрата в ампулах, экстракт чилибухи сухой, настойка чилибухи, препарат «Дуплекс», содержащий раствор стрихнина нитрата и арсенат натрия.
Токсикологическое значение
Стрихнин как стимулятор ЦНС относится к числу допинговых средств — веществ, способных улучшить спортивные показатели, работоспособность, силу мышц. Зарегистрированы случаи дисквалификации и гибели спортсменов при применении допинговых препаратов. Стрихнин неоднократно служил орудием убийства. Стрихнин используется также в приманках для борьбы с грызунами и дикими животными. Средства для истребления грызунов и животных являлись источником отравления в результате несчастных случаев или суицидов.
Стрихнина нитрат легко всасывается через слизистую ЖКТ. Летальная доза для взрослых — 0,1-0,3 г, для детей — 0,005 г.
Токсическое действие стрихнина связано с поражением спинного и продолговатого мозга, повышением рефлекторной возбудимости спинномозговых центров. Отравление развивается быстро. Вначале больной ощущает онемение шейной и лицевой мускулатуры. Затем появляются мышечные подергивания, а через короткое время — типичные спинномозговые судороги. Тело отравленного изгибается дугообразно и касается кровати только теменем и пятками. Конечности вытянуты, и иногда руки прижаты к грудной клетке. Жевательные и лицевые мышцы сокращены, и лицо выражает неестественную улыбку. Больной не дышит, так как сокращена диафрагма и межреберная мускулатура. Судороги при полном сознании длятся 1-2 мин, при более продолжительных судорогах больной теряет сознание. Затем наступает депрессия и расслабление мускулатуры. Следующий приступ судорог наступает через 8-15 мин и может закончиться параличом дыхательного центра.
Патологоморфологическая картина при отравлении стрихнином нехарактерна. Наблюдается картина быстро наступившей смерти с полнокровием внутренних органов, жидкой темной кровью в сердце и сосудах, а также мелкие кровоизлияния в слизистой оболочке желудка и внутренних органах. Стрихнин длительно сохраняется в трупном материале, по данным М.Д.Швайковой, до 6 лет.
Бруцин имеет токсикологическое значение при отравлении семенами чилибухи или препаратами из них.
Пути метаболизма
В I фазе метаболизма стрихнин окисляется с образованием фенольного гидроксила в положении 2. Во II фазе метаболизма 2-гидроксистрихнин присоединяет глюкуроновую кислоту.

У бруцина происходит деметилирование в положении 2 и 3. В дальнейшем за счет гидроксильных групп образуются глюкурониды. Конъюгаты метаболитов стрихнина и бруцина с глюкуроновой кислотой выводятся с мочой.
Объекты анализа:
- желудок с содержимым;
- тонкая и толстая кишка с содержимым;
- почка, моча;
- печень с желчным пузырем;
- кровь;
- селезенка.
При изолировании из биологических объектов стрихнин и бруцин экстрагируются органическим растворителем как из кислых, так и из щелочных растворов. В большем количестве они экстрагируются из щелочных растворов.
При проведении ТСХ-скрининга в общих системах растворителей (см. раздел 7.1.2) стрихнин и бруцин обнаруживаются на пластинках с помощью реактива Драгендорфа.
При анализе с использованием общеалкалоидных (осадительных) реактивов стрихнин и бруцин образуют аморфные осадки (см. раздел 7.1.8).
Для обнаружения стрихнина и бруцина используют цветные, микрокристаллоскопические реакции, фармакологические пробы, ТСХ, ВЭЖХ, УФ- и ИК-спектроскопию.
Стрихнин
Реакция окисления дихроматом калия в среде концентрированной серной кислоты.
Несколько капель хлороформного экстракта испаряют в фарфоровой чашке до сухого остатка, добавляют 3-4 капли концентрированной серной кислоты и в полученный раствор вносят 1-2 кристаллика дихромата калия. При осторожном перемещении кристаллов по раствору с помощью стеклянной палочки наблюдают появление быстро исчезающих сине-фиолетовых струек.
Реакция неспецифична. Предел обнаружения составляет 1 мкг стрихнина в исследуемой пробе.

Реакция с реактивом Манделина. При добавлении к сухому остатку, содержащему стрихнин, реактива Манделина (смесь концентрированной серной кислоты и ванадата аммония) наблюдают образование сине-фиолетового окрашивания, переходящего постепенно в пурпурное, а затем в красное
Реакция нитрования. Сухой остаток, содержащий стрихнин, обрабатывают концентрированной азотной кислотой и выпаривают досуха При последующем действии на остаток раствора аммиака образуется оранжевое окрашивание, а при добавлении спиртового раствора гидроксида калия образуется красно-фиолетовое окрашивание (реакция Витали-Морена).
Хроматография в тонком слое сорбента. При проведении хроматографии в тонком слое сорбента с целью обнаружения стрихнина извлечение из объекта наносят на пластинку со слоем силикагеля КСК и одновременно наносят «стандарт» — раствор стрихнина. Пластинку помещают в систему растворителей хлороформ — диэтиламин (9:1). Для обнаружения места расположения на пластинке пятен стрихнина ее обрабатывают реактивом Драгендорфа. Стрихнин обнаруживается в виде пятна оранжевого цвета с Rf 0,73 и должен соответствовать по цвету и месторасположению пятну-«стандарту».
Микрокристаллоскопические реакции. Стрихнин образует кристаллические осадки с солью Рейнеке, платинохлороводородной, пикриновой кислотами, с нитритом натрия и гидроксидом калия, с хлорпалладиевой и пикролоновой кислотами (см. рис. 44^49).
Фармакологическая проба. Очищенный остаток извлечения из объекта, содержащий стрихнин, наносят на спинку лягушки. Наблюдают появление характерных судорог (см. раздел 7.2.6, рис. 24).
Бруцин
Вопрос об обнаружении бруцина возникает, если произошло или подозревается отравление экстрактом или настойкой из семян чилибухи.
Реакция с реактивами, содержащими концентрированную серную или азотную кислоту. При добавлении к сухим остаткам извлечений из объекта, содержащего бруцин, реактивов Манделина, Фреде, Эрдмана появляется во всех случаях красное окрашивание, переходящее в желтое. Стрихнин не образует окрашивания с реактивом Эрдмана и с азотной кислотой.
Реакция с азотной кислотой и хлоридом олова (II). При добавлении к сухому остатку нескольких капель концентрированной азотной кислоты при наличии бруцина появляется красное окрашивание, переходящее в желтое. При добавлении 5% раствора хлорида олова (II) в 2% растворе хлороводородной кислоты желтая окраска переходит в фиолетовую Стрихнин не дает окраски при проведении этой реакции.

Таблица 36. Хроматографические характеристики бруцина
|
Вещество |
Объем удерживания, мкл |
Спектральные отношения S1/S210 |
||||||
|
220 |
230 |
240 |
250 |
260 |
280 |
300 |
||
|
Бруцин |
1248 |
0,815 |
0,289 |
0,173 |
0,320 |
0,499 |
0,321 |
0,341 |
Таблица 37. Максимумы поглощения стрихнина и бруцина в УФ-области спектра
|
Вещество |
Максимумы светопоглощеиия, им |
|
|
В этиловом спирте |
В 0,1 М растворе серной кислоты |
|
|
Бруцин |
267,3 |
265, 300 |
|
Стрихнин |
255 |
255 |
Таблица 38. Характеристические волные числа стрихнина и буцина
|
Вещество |
Характеристические полосы в ИК-спектре, см -1 |
|
Бруцин |
1500, 1649, 1190, 1285, 1400, 1450 |
|
Стрихнин |
1664, 764, 1392, 1480 |
Микрокристаллоскопические реакции. Бруцин образует кристаллы характерной формы с пикролоновой, стифниновой, нитраниловой кислотами (рис 50-52).
Хроматография в тонком слое сорбента. Для обнаружения бруцина с помощью ТСХ извлечение из объекта наносят на стартовую линию пластинки с силикагелем Анализ проводят в присутствии «стандарта» — раствора бруцина, который наносят также на стартовую линию. Пластинку помещают в систему растворителей хлороформ — ацетон — 25% раствор аммиака в соотношении 30:30.2. Для обнаружения бруцина пластинку обрабатывают реактивом Драгендорфа, модифицированным по Мунье Бруцин обнаруживается в виде розово-бурых пятен с Rf 0,21.
Высокоэффективная жидкостная хроматография. Для анализа используют «Милихром А-02» и условия, описанные ранее (см раздел 8.3). Обнаружение бруцина проводят по величине удерживаемого объема (времени удерживания) и спектральным отношениям при нескольких длинах волн (табл 36)
Обнаружение стрихнина и бруцина с помощью УФ-спектрофотометрии. Остаток после испарения органического экстракта из объекта, очистки его с помощью хроматографии в тонком слое сорбента растворяют в этиловом спирте или 0,1 М растворе серной кислоты В полученных растворах регистрируют спектр поглощения в области длин волн 220-320 нм. Стрихнин и бруцин обнаруживают в спектре максимумы при определенных длинах волн (табл. 37).
Обнаружение стрихнина и бруцина с помощью ИК-спектроскопии. Сухой остаток после испарения органического растворителя и очистки растирают с бромидом калия, прессуют и регистрируют ИК-спектр. Основные волновые числа в ИК-области спектра для бруцина и стрихнина представлены в таблице 38.
Количественное определение. Для количественного определения стрихнина и бруцина используют колориметрический метод. Метод основан на восстановлении стрихнина и бруцина водородом в момент выделения. При добавлении окислителя (нитрита натрия) образуется красное окрашивание при наличии стрихнина и желто-зеленое — при наличии бруцина.
К сухому остатку добавляют 2-3 мл воды очищенной, 2-3 мл раствора хлороводородной кислоты и 0,3 г цинковой пыли. Через 30 мин смесь нагревают до кипения. После охлаждения раствор отделяют от цинковой пыли декантацией. К раствору добавляют 5-7 капель 0,1% раствора нитрита натрия. Появляется соответствующее окрашивание. Объем раствора доводят до 10 мл и определяют оптическую плотность с помощью фотоэлектроколориметра. Расчет концентрации ведут по калибровочному графику.
8.8.2. Производные индола — галлюциногены
В группу галлюциногенов включены вещества различного химического строения, объединенные по признаку токсического воздействия на организм человека, главньм образом по их влиянию на ЦНС. Галлюциногены способны вызвать изменение настроения и характер мышления человека. Возбуждение ЦНС, приводящее к сдвигу сознания, эйфории, неадекватному восприятию окружающей среды, нарушению логического мышления, сильной депрессии и деперсонализации, может быть причиной несчастных случаев и даже самоубийства.
По химической классификации галлюциногены можно разделить на производные индола, фенциклидин и близкие по структуре соединения, являющиеся производными амфетамина.
К галлюциногенам относят диэтиламид лизергиновой кислоты (LSD), бутофенин, псилобицин, псилоцин и др.
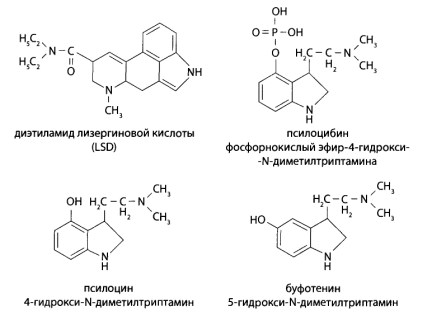
Для России наибольшее токсикологическое значение имеет диэтиламид лизергиновой кислоты, поэтому остановимся на рассмотрении его токсикологического значения и анализа.
Токсикологическое значение и анализ LSD
LSD — бесцветное кристаллическое вещество без запаха и вкуса, нерастворимо в воде, растворимо в органических растворителях, химически стабильно. При кипячении в течение 1 ч в 7% водном растворе щелочи гидролизуется до лизергиновой кислоты и диэтиламина. Обладает основными свойствами, образует соли с неорганическими и органическими кислотами.
Диэтиламид лизергиновой кислоты (LSD) был синтезирован в 1938 г. Ф.Гофманом как средство для стимуляции кровообращения и дыхания. Многочисленные попытки применить его для лечения психических нарушений не привели к его использованию в качестве терапевтического средства, так как уже в 1943 г было обнаружено его галлюциногенное действие.
Употребление LSD в качестве наркотического средства началось с 1960-х годов. К концу 1960-х годов применение LSD приняло массовый характер В Российской Федерации распространение и применение LSD и других производных лизергиновой кислоты запрещено. Нелегально LSD распространяется в виде различных его субстратов с сорбентами. Обычно употребляемая доза LSD составляет 30-50 мкг Однако доза в 10 мкг уже может вызвать эйфорию Доза 50-200 мкг вызывает галлюцинации При повторных употреблениях развивается толерантность Пероральный прием LSD приводит к быстрому всасыванию в кровь, проникновению через гематоэнцефалический барьер и достижению мозга Длительность действия 8-12 ч. Максимальная концентрация в крови при приеме 50-70 мкг достигается в течение 1 ч . Через 6 ч концентрация снижается до 1,0—1,2 нг/мл и через 24 ч до 0,2 нг/мл крови
Метаболизм LSD. Метаболизм LSD в организме человека изучен недостаточно Известно, что около 1% LSD из организма человека выводится с мочой в неизмененном состоянии
Пути метаболизма LSD

Метаболизм LSD изучался на животных и in vitro с микросомами печени человека. В основном метаболизм LSD происходит по пути деалкилирования и гидроксилирования ароматического кольца.
Гидроксипроизводные LSD образуют конъюгаты с глюкуроновой кислотой и в основном так выводятся из организма.
Изолирование, обнаружение и количественное определение LSD. Объектами анализа являются кровь и моча. Время анализа ограничено 72 ч. Основной объект анализа — кустарно изготовленные образцы LSD. Содержание LSD в биологических жидкостях и органах незначительно и составляет десятые доли нанограмма.
Из биологических объектов (крови, мочи) можно экстрагировать следы LSD и его метаболитов не позднее, чем через 72 ч после приема наркотика. После этого времени результаты анализа малодостоверны. Из кустарно изготовленных препаратов и биологических объектов LSD экстрагируют органическим растворителем (хлорбутаном или метиленхлоридом в смеси с толуолом). Органический растворитель испаряют и с остатком проводят следующие реакции.
Реакция с реактивом Марки. К части сухого остатка добавляют 2-3 капли реактива Марки. Образуется оранжево-коричневое окрашивание, переходящее в фиолетовое.
Реакция с п-днметиламинобензальдегидом в присутствии серной кислоты и хлорида железа (III) (реактив ван-Урка) — образуется красно-фиолетовое или фиолетовое окрашивание. Это групповая реакция на алкалоиды спорыньи.
Менее специфичны реакции с концентрированной серной кислотой, с реактивом Фреде, которые также могут быть использованы для подтверждения наличия LSD.
Тонкослойная хроматография. Анализ проводится с извлечением из биологического объекта или из кустарно изготовленного препарата LSD. Сухой остаток после испарения органического растворителя растворяют в метаноле и наносят на стартовую линию пластинки «Силуфол». Хроматографируют в системе хлороформ — ацетон — этанол — 25% раствор аммиака (20:20:3:1). Пластинку высушивают и детектируют в УФ- свете (366 нм), а затем обрабатывают реактивом Эрлиха (п-диметиламинобензальдегид в кислой среде). Пятно LSD проявляется со значением Rf 0,57.
УФ — спектрофотометрия. Раствор остатка после испарения экстракта из объекта в растворе 0,1 М хлороводородной кислоты обнаруживает максимум при 315 нм; в 0,1 М растворе гидроксида натрия — при 310 нм.
ИК-спектроскопия. Остаток после испарения экстракта из объекта растирают с кристаллами бромида калия и регистрируют ИК-спектр. LSD обнаруживает характеристические полосы с волновыми числами 1626, 1307, 1136, 1066, 1212 и 749 см%
Газовая хроматография в сочетании с масс-спектрометрией. Анализ проводят на кварцевой колонке длиной 25 мм и диаметром 0,2 мм с диметилсиликоновой стационарной фазой (хроматограф фирмы «Хьюлетт Паккард») и ионизацией электронным ударом (детектор масс-селективный). LSD обнаруживает характерные пики при соотношении m/z 44, 72, 207, 221, 280, 323.
Метод ВЭЖХ. Этот метод используется для обнаружения и количественного определения LSD. Хроматографирование проводят на колонках КАХ-4 80х2, заполненных сепароном С-18 в приборе «Милихром». Элюентом служит смесь фосфатного буфера и ацетонитрила в соотношении 70:30. Скорость элюирования 120 мкл/мин. Идентификацию проводят по отношению оптической плотности при длинах волн 230, 270, 304, 350 нм к оптической плотности при длине волны 210 нм. Объем вводимой пробы 10 мкл. Время удерживания LSD — 6 мин, лизергиновой кислоты — 2,5 мин. Расчет содержания проводят по внутреннему стандарту.
Менее чувствительным и поэтому все реже используемым является фотометрический метод по реакции с реактивом Эрлиха (п-диметиламинобензальдегид в растворе серной или хлороводородной кислоты).
8.8.3. Фенциклидин и его аналоги (галлюциногены)
Фенциклидин синтезирован как средство для внутривенного наркоза. В отличие от опиатов, он не оказывает отрицательного действия на сердечно-сосудистую и дыхательную системы. Однако сильные токсические побочные эффекты, в том числе галлюцинации, ментальные расстройства, депрессии закрыли путь применения фенциклидина в терапевтаческой практике. В настоящее время в Российской Федерации препарат запрещен к применению. Пути его поступления нелегальны. Наряду с фенциклидином запрещены некоторые его аналоги. Все препараты находятся под международным контролем. Препарату этой группы соединений синтезируются только в подпольных лабораториях Следует отметить, что фенциклидин рассматривается в некоторых зарубежных армиях как возможное боевое отравляющее вещество.
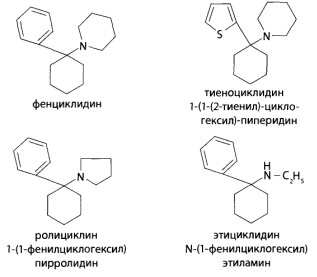
Токсикологическое значение
Фенциклидин — это белый кристаллический порошок, легко растворимый в воде, обладает слабыми основными свойствами (рКа=8,5). На подпольном рынке фигурирует в виде серовато-белой, коричневой сыпучей или вязкой массы.
Фенциклидин наркоманы принимают орально, путем вдыхания или курения. Более 70% фенциклидина применяется путем курения с табаком, марихуаной или другими растениями. При попадании в кровь дозы 1 мг наблюдается эйфория, напоминающая алкогольную интоксикацию. Внутривенное введение фенциклидина в дозе 0,075-0,1 мг/кг вызывает чувство отчужденности, путаницу мыслей, апатию, сонливость, аналгезию. Доза около 1 мг вызывает чувство эйфории, которое длится обычно до 10-12 ч.
Токсическое действие наблюдается при вдыхании и курении 5-15 мг, тяжелые отравления — при дозе 25 мг фенциклидина. При хроническом употреблении наблюдается толерантность и привыкание. Синдром отмены продолжается несколько дней и сопровождается тяжелой депрессией
Метаболизм фенциклидина. В организме фенциклидин метаболизируетея по пути гидроксилирования циклогексанового и пиперидинового колец с образованием биологически активных метаболитов. Далее гидроксипроизводные фенциклидина связываются с глюкуроновой и серной кислотами и в таком виде удаляются из организма через почки.
При метаболизме может происходить разрыв пиперидинового кольца с образованием фенилциклогексиламиновалериановой кислоты. Число идентифицированных метаболитов фенциклидина достигает 10 и более.
Основное количество фенциклидина выводится в виде конъюгатов (более 70%), часть в виде исходного соединения. В течение 7 ч выводится до 50% начальной дозы. Однако фенциклидин может находиться в крови до 10 и более суток.
Схема метаболизма фенциклидина:

В качестве объектов исследования на фенциклидин могут быть направлены образцы наркотического средства, моча, кровь или плазма.
Экспресс-анализ наркотического средства на фенциклидин проводят с использованием реакции окрашивания.
К анализируемому образцу добавляют каплю 16% раствора хлороводородной кислоты и каплю 2,5% раствора тиоцианата кобальта (II) — появляется голубое окрашивание Реакция неспецифична, такую же окраску дают кокаин и метаквалон.
Изолирование фенциклидина из мочи и плазмы крови проводят с помощью специальных пробирок, содержащих экстрагент для веществ основного характера и электролит как высаливающий агент. Слой органического растворителя отделяют, упаривают до небольшого объема и анализируют.
Обнаружение фенциклидина проводят с помощью химических реакций и физикохимическими методами.
Хроматография в тонком слое сорбента. Используют пластинки со слоем силикагеля или со слоем силикагеля, импрегнированного 0,1 моль/л раствором гидроксида калия, и высушенные. В качестве системы растворителей рекомендованы две: этилаце- тат — метанол — 25% раствор аммиака (85:10:5) и хлороформ — метанол (9:1) для импрег- нированных пластинок. Проявителем служит реактив Драгендорфа. Фенциклидин и его аналоги образуют окрашенные в оранжевый цвет пятна и имеют разные значения Rf.
Реакция с реактивом Марки. На сухой остаток наносят каплю реактива Марки. В присутствии фенциклидина появляется слабо-розовое окрашивание.
Таблица 39. Хроматографические характеристики фенциклидина
|
Вещество |
Объем удерживания, мкл |
Спектральные отношения S1/S210 |
||||||
|
220 |
230 |
240 |
250 |
260 |
280 |
300 |
||
|
Фенциклидин |
1920 |
0,351 |
0,006 |
0,008 |
0,023 |
0,036 |
0,001 |
0,000 |
Реакция с реактивом Манделина. На сухой остаток наносят каплю реактива Манделина — наблюдают появление оранжевого окрашивания.
Реакция с реактивом Эрлиха (смесь диметиламинобензальдегида с хлороводородной кислотой). При добавлении к сухому остатку реактива Эрлиха наблюдают красное окрашивание.
Обнаружение с помощью ГЖХ. При проведении общего ГЖХ-скрининга на наркотические и одурманивающие вещества фенциклидин обнаруживают по индексу удерживания (см. раздел 7.1.6.1).
Для фенциклидина и его аналогов разработана частная методика газожидкостной хроматографии в следующих условиях: газожидкостный хроматограф «Аджилент» или «Кристалл-2000М»; колонка кварцевая капиллярная 30х0,32 мм с фенилметилси- ликоновой стационарной фазой НР-5; температура испарителя — 240°С; температура детекгора — 290°С; температура колонки программируется от 100°С по 15°С в минуту до 280°С; газ-носитель — гелий; детектор — пламенно-ионизационный.
Идентификация веществ проводится по индексам удерживания, равным для этици- клидина — 1587, для теноциклидина — 1881, для фенциклидина — 1900, для ролициклидина — 1795.
Обнаружение с помощью масс-спектрометрии. В условиях, описанных ранее (см. раздел 7.2.3), фенциклидин обнаруживает следующие характеристические ионы с соотношениями m/z 243, 214, 200, 186, 166, 158, 84, 77.
Обнаружение с помощью ГХ/МС. При использовании этого метода 1 мл мочи или плазмы крови подщелачивают раствором аммиака до рН=9,6 и экстрагируют гексаном. К экстракту добавляют диметилформамид, упаривают и анализируют Чтобы определить фенциклидин и его метаболит моногидроксипроизводное, объекты (мочу и плазму крови по 1 мл) подвергают гидролизу, затем доводят pH до 11,8 и экстрагируют 2 мл смеси бутилхлорида и метанола (9:1). Органический растворитель упаривают и проводят дериватизацию с помощью БСТФА — N,O-бис- (триметилсилил) — трифторацетамида. Полученные дериваты анализируют. Время удерживания фенциклидина — 3,17 мин. Получаемые характеристические ионы с соотношениями m/z, приведенными выше. Предел обнаружения фенциклидина — 0,58 нг/мл.
Высокоэффективная жидкостная хроматография. Идентификацию фенциклидина проводят с помощью ВЭЖХ по удерживаемому объему и спектральным отношениям при нескольких длинах волн. Полученные данные сравнивают с таковыми стандартных растворов (табл. 39).
Количественное определение
Для количественного определения фенциклидина используют метод ВЭЖХ. Определение проводят методом добавок, внешнего или внутреннего стандарта. Расчет содержания фенциклидина проводят по формулам, приведенным ранее в разделе 8.1.
8.9.1. Алкалоиды мака снотворного и их синтетические аналоги
Термин «опиаты» объединяет природные алкалоиды мака снотворного: морфин, кодеин — и полусинтетические производные морфинанового ряда: этилморфин, героин и др.
В группу опиоидов относят различные синтетические вещества, оказывающие однотипное действие с опиатами, причем механизм действия является сходным. Однако наряду с индивидуальными субстанциями опийных алкалоидов или полусинтетических производных морфинанового ряда химику приходится анализировать случаи отравления исходным сырьем, вытяжками из маковой соломки, маковых семян и опия В этих случаях много информации могут дать результаты определения сопутствующих алкалоидов и других веществ, поэтому в данном разделе рассмотрены не только опиаты, но и другие вещества.
Производящее растение — мак снотворный (Papaver sommferum, семейство Papaveraceae) содержит несколько десятков алкалоидов, главными из которых являются морфин, кодеин, наркотин, папаверин и тебаин.
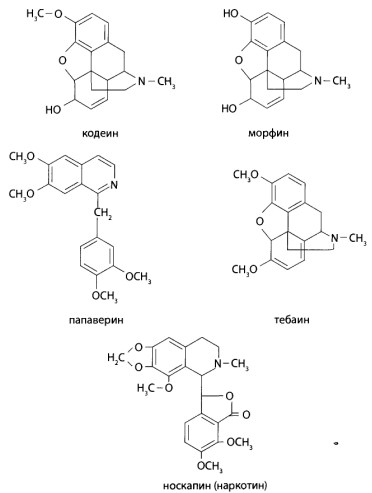
Кроме того, в составе опия характерным компонентом является меконовая кислота, которая в химико-токсикологическом анализе служит основным критерием выявления причины отравления: опием, омнопоном или индивидуальным алкалоидом.

Полусинтетические производные морфина — героин, этилморфин (дионин), орипавин

Токсикологическое значение опиатов
Прежде всего, необходимо остановиться на токсикологическом значении опия. Опий, наиболее доступный для наркоманов продукт, представляет собой сгущенный млечный сок, получаемый из недозревших головок мака снотворного. Высушенный сок является опием-сырцом. В состав опия-сырца входиг более 50 алкалоидов, содержание которых доходит до 20% общей массы. Остальную часть составляют углеводы, кислоты, жиры, аминокислоты.
Опий как таковой принимают в виде смеси для курения. Чаще всего из него готовят вытяжки для внутривенного введения. Опий действует на организм подобно омнопону.
Омнопон получают следующим образом. Водную вытяжку из опия обрабатывают раствором щелочи. При этом часть алкалоидов выпадает в осадок, который отделяют и обрабатывают хлороводородной кислотой. Щелочной фильтрат экстрагируют органическим растворителем и органическую фазу взбалтывают с хлороводородной кислотой. Обе кислые вытяжки объединяют, выпаривают досуха.
Таким образом, омнопон представляет собой смесь гидрохлоридов алкалоидов опия В его состав входят 48-50% морфина и 32-35% других алкалоидов Это порошок от кремового до желто-коричневого цвета, хорошо растворимый в воде. Водный раствор при взбалтывании сильно пенится. Медицинские показания для применения омнопона такие же, как и для морфина. При отравлении опием и омнопоном проявляются признаки, характерные для морфина.
Острое отравление опием и омнопоном развивается постепенно, так как эти препараты медленно всасываются. Появляется головокружение, тошнота, рвота, наступает сонливость, а затем непробудный сон. Зрачки узкие, не реагирующие на свет. Дыхание поверхностное, замедленное, иногда Чейна-Стокса. Пульс малый, еле прощупывается. Лицо бледное с синюшным оттенком. Глубокое угнетение ЦНС заканчивается параличом дыхательного центра. Смертельный исход наступает при явлениях нарастающего отека легких Дифференциальная диагностика отравления опием и омнопоном с отравлением морфином затруднена.
При судебно-химическом анализе, в случае обнаружения в исследуемом объекте морфина, меконовой кислоты, наркотина и других алкалоидов делают заключение об отравлении опием. Иногда в содержимом желудка и в кишечнике обнаруживают семена опийного мака. При обнаружении в исследуемых объектах только морфина, наркотина и других алкалоидов опия делают заключение об отравлении омнопоном.
Объектами исследования при отравлении опием (омнопоном) являются: желудок с содержимым, почки, моча, печень с желчным пузырем, селезенка, легкие в случае ингаляционного отравления.
Морфин — наиболее фармакологически активный алкалоид опийного мака. Содержащиеся в маке алкалоиды представлены солями меконовой, яблочной и серной кислот. Опий был известен уже за много веков до нашей эры. Название «опион» по-гречески означает «растительный сок». Первые справки о маковом соке «меконион» восходят к Теофрасту (III век до н.э.). До XIX в. употребляли только экстракты опия и сырец опия. В 1805 г. Сертюрнер выделил морфин в чистом виде.
Морфин — один из основных представителей группы наркотических анальгетиков, используемых в медицинской практике. Это сильное болеутоляющее средство, действие которого обусловлено стимуляцией р-, 8-, и %-опиатных рецепторов. Морфин оказывает противошоковое действие при травмах, которое объясняется понижением возбудимости болевых центров. Снотворное действие морфина проявляется при принятии больших доз. Медицинская промышленность выпускает морфин в виде порошка во флаконах по 0,3 г, таблеток по 0,01 г, 1% раствора в ампулах и шприц-тюбиках по 1 мл. При длительных болевых симптомах применяют пролонгированные лекарственные формы, содержащие морфина сульфат. Это таблетки по 0,01, 0,03, 0,06, 0,1 и 0,2 г («МСТ Континус») и капсулы «М-Эсчон».
Морфин способен вызвать эйфорию. При повторном применении развивается пристрастие (морфиномания). Морфинизм имеет судебное и судебно-медицинское значение Наркоманы начинают с дозы 0,01-0,02 г и постепенно увеличивают ее до 0,3-0,5 г и даже 3-10 г в сутки. Для здорового человека, не употребляющего наркотики, токсическая доза составляет при подкожном введении 0,1 г, а смертельная при приеме внутрь 0,3-1,4 г.
Морфин понижает возбудимость кашлевого центра, тормозит секреторную активность ЖКТ. Одним из характерных действий морфина является угнетение дыхательного центра, что ограничивает его применение как анальгетика.
Малые дозы морфина (5-10 мг) урежают и повышают глубину дыхания, возникает эйфория, оживляются фантазии, острее становится восприятие, выполнение умственной и физической работы сопровождается иллюзией легкости, затрудняется концентрация внимания, уменьшается двигательная активность. Внешний вид морфиниста характеризуется преждевременным старением, трофическими расстройствами, кожа становится сухой, землисто-серого цвета, зубы лишаются эмали, появляется кариес, зрачки сужаются, вместо вен определяются плотные тяжи, лицо одутловатое, нарушается функция желудочно-кишечного тракта.
Постоянное употребление препаратов опийной группы приводит к психической и физической деградации и ранней гибели больных. При внезапном прекращении приема морфина развивается коллаптоидное состояние, опасное для жизни, которое длится от нескольких часов до 5-6 сут.
При остром отравлении морфином подавляются болевые ощущения, исчезает чувство страха, дыхание замедляется, затем угнетается с переходом в дыхание Чейна-Стокса, нарушается сердечная деятельность, артериальное давление падает, парализуется функция капилляров. Причина смерти — паралич дыхания. Патологоанатомическая картина при остром отравлении морфином мало характерна, обнаруживают застойное полнокровие внутренних органов, отек легких и мозга, мелкие множественные кровоизлияния.
Объектами судебно-химического анализа на морфин являются желудок с содержимым, печень, селезенка, почки, легкие, кровь, моча, головной и спинной мозг.
Кодеин — алкалоид, содержащийся в опийном маке. Он выделен из растительного сырья в 1852 г. Его получают также полусинтетическим путем из морфина. По характеру действия на организм кодеин близок к морфину, но болеутоляющий эффект у него выражен слабее. Кодеин способен уменьшать возбудимость кашлевого центра, он в меньшей степени угнетает дыхание, слабее тормозит деятельность ЖКТ, но может вызывать запоры.
В медицинской практике кодеин назначают для подавления возбуждения кашлевого центра и реже при диарее. Его часто сочетают в лекарственных формах с анальгином, кофеином, фенобарбиталом. Кодеин способен усилить действие жаропонижающих и аналгезирующих средств. Такие комбинированные лекарственные препараты применяют при головных болях, невралгиях, мигренях и т.п. Максимальные дозы кодеина: разовая — 0,05 г, суточная — 0,2 г. Выпускают кодеин в виде порошка и таблеток (с гидрокарбонатом натрия) по 0,015 г. Кодеин входит в состав комбинированных препаратов «Коделак», «Терпинкод», «Кодтерпин», «Таблетки от кашля», «Пенталгин», «Кодипронт», «Седалгин».
Кодеина фосфат по характеру действия и показаниям аналогичен кодеину (содержит 80% кодеина основания). Он применяется при лечении детей раннего возраста.
При повторном применении кодеина иногда наблюдается пристрастие (кодеинома- ния). Вначале проявляется психическое влечение к препарату, возрастание толерантности, наркотическая мотивация приема, затем эйфорический эффект препарата падает и наступает общее психическое истощение и социальная деградация личности. Для абстинентного синдрома характерно развитие нервно-сосудистых реакций вплоть до возникновения коллапса.
При приеме больших доз кодеина (0,2-0,3 г) отмечается угнетение дыхательного центра, возбуждающий эффект с подъемом нервно-психического тонуса. Смертельная доза кодеина 0,5 г. Признаки отравления проявляются через 30-40 мин после приема симптомами сонливости, головной боли, шума в ушах, тошноты, жжения в подложечной области, сухости во рту, заторможенности.
При тяжелом отравлении развивается глубокая кома с полной потерей рефлексов. Смерть наступает от остановки дыхания.
Объектами анализа при отравлении кодеином являются желудок и толстая кишка с содержимым, почки, моча, мозг, печень с желчным пузырем, кровь.
Папаверин — алкалоид опийного мака. В настоящее время его получают синтетическим путем и применяют в виде гидрохлорида. Папаверин оказывает сосудорасширяющее и спазмолитическое действие. В больших дозах уменьшает возбудимость сердечной мышцы и замедляет внутрисердечную проводимость, проявляет слабый седативный эффект. Имеет небольшое токсикологическое значение.
Наркотин (носкапин) — алкалоид, входящий в состав опия и омнопона. Наркотин в медицинской практике применения не находит. Он не обладает наркотическим и аналге- зирующим эффектом, не вызывает привыкания. Имеет судебное и судебно-медицинское значение. Обнаружение его во внутренних органах, биологических жидкостях или в кустарно изготовленных наркотических средствах является одним из доказательств отравления опием или омнопоном.
Полусинтетические опиаты
Этилморфин (дионин). Этот лекарственный препарат по действию близок к кодеину Этилморфин применяют (редко) внутрь для уменьшения возбуждения кашлевого центра при хронических бронхитах, туберкулезе легких и как болеутоляющее средство. Его назначают по 0,01—0,03 г на прием. Максимальные дозы: разовая — 0,03 г, суточная — 0,1 г Иногда этилморфин используют в офтальмологической практике. Препарат оказывает аналгезирующее действие на глаза при кератите, ирите, инфильтратах роговой оболочки, конъюнктивите, воспалении радужной оболочки и других заболеваниях глаз. В глазной практике применяют этилморфин в виде 1-2% растворов или мази. Формы выпуска — порошок и таблетки по 0,015 г. Этилморфин оказывает слабое действие на ЦНС, Картина отравления этилморфином напоминает картину отравления кодеином.
Героин (Smack, Junk, Horse, Stuff). Это быстродействующий наркотический анальгетик с малым периодом полувыведения. Он относится к числу наиболее опасных наркотических средств. Героин является синтетическим веществом, изготовляемым в подпольных лабораториях. Его получают по реакции ацетилирования из морфина и морфинсодержащего сырья, к числу которого относится морфин-сырец, экстракционный опий, экстракт маковой соломки и др. Продуктом реакции является диацетилморфин Полученный таким образом героин содержит примеси алкалоидов, не подвергшихся ацетилированию, ацетилкодеин, носкапин, меконин (продукт восстановительного разложения носкапина) и др.
На нелегальный рынок героин часто поступает с добавками (с целью разбавления) прокаина или в виде смеси с кокаином основанием (спидболл), которая предназначена в основном для курения. Героин используют в виде раствора для подкожных или внутривенных инъекций, порошкообразную форму курят, вдыхают или втягивают носом. Применение героина часто сочетается с приемом алкоголя или депрессантов.
Последствием действия героина на организм является привыкание, которое наступает быстро, иногда с первого раза. Героин вызывает расстройство пищеварения, деятельности внутренних органов. Наблюдается нарушение эндокринного баланса, снижение иммунитета, импотенция, опасное подавление многих реакций организма. Развивается безразличие, депрессия, раздражительность, истерия, психопатические реакции, склонность к гневу, агрессии, суициду. Ухудшается работа мозга, наблюдаются отек мозга, судорожные припадки, необратимые изменения личности, умственная, психическая и физическая деградация, остановка дыхания, потеря сознания, перебои в работе сердца и смерть.
После прекращения приема наркотика характерно эмоциональное напряжение, раздражительность, зрачки расширяются, глаза слезятся, наблюдается слюнотечение, потливость, «гусиная кожа», мышцы спины, рук и ног напрягаются, возникает физическая слабость, аритмия, тахикардия, тошнота, рвота, тремор, появляются выламывающие боли мышц рук, ног, сведение жевательных мышц, икр, нестерпимые боли в животе, пояснице, в области сердца, зуд, жжение
Смесь героина с кокаином (спидболл) используют для внутривенного введения и курения. Присутствие двух веществ усиливает действие на организм каждого из них. Постоянное курение спидболла вызывает болезнь горла, эмфизему легких, бронхиты, респираторные заболевания, теряется интерес к еде и сну, привыкание к наркотику очень быстрое.
Следует отметить, что группа морфинановых анальгетиков постоянно расширяется, и в ближайшем будущем химику, возможно, придется решать новые задачи с новыми опиатами.
Пути метаболизма
Превращение опиатов и их синтетических аналогов в живом организме проходит несколькими путями и включает обе фазы метаболизма.
Морфин, кодеин, этилморфин в I фазе метаболизма подвергаются деалкилированию у атома азота с образованием норпроизводных или у фенольного гидроксила в положении 3 (кодеин, этилморфин).
Морфин
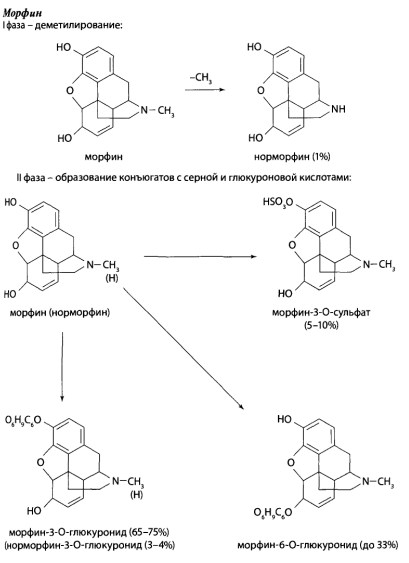
Кодеин, этилморфин
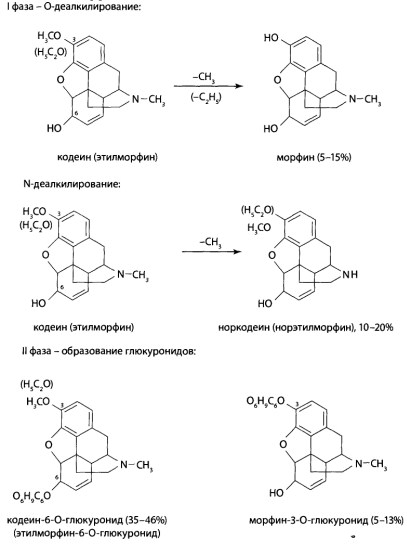
При метаболизме папаверина вначале отщепляется метальная группа в положении 4 бензольного кольца. Во II фазе метаболизма образуются конъюгаты с глюкуроновой кислотой.

Наркотин подвергается восстановлению с образованием меконина и деметилированию в положениях 4 и 8 (1 фаза), а затем присоединяет глюкуроновую кислоту к деметилированным продуктам (II фаза).

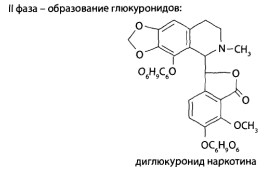
Героин в крови в I фазе метаболизма гидролизуется, образуя 6-моноацетилморфин и морфин, и затем к свободному гидроксилу присоединяется глюкуроновая кислота (II фаза)

Физические свойства
Морфин. Основание морфина — белое или желтоватое вещество, слабо растворимое в воде, эфире, спирте, хлороформе. Соли морфина (ацетаты, гидрохлориды, сульфаты, тартраты) растворимы в спирте и воде, нерастворимы в эфире.
Кодеин. Основание кодеина хорошо растворимо в воде, эфире, хлороформе, спирте. Соли кодеина (гидрохлорид, фосфат, сульфат) хорошо растворимы в воде и плохо растворимы в спирте.
Папаверин. Основание папаверина — белый порошок, хорошо растворим в спирте и хлороформе. Соли папаверина (гидрохлориды) растворимы в воде и хлороформе, нерастворимы в эфире. Сульфат папаверина растворим в воде и спирте.
Наркотин. Основание наркотина нерастворимо в воде, но хорошо растворимо в хлороформе Соли наркотина способны легко гидролизоваться.
Героин — это белая или коричневая пудра, хорошо растворимая в воде и спирте.
Этилморфина гидрохлорид — это белый кристаллический порошок без запаха, горького вкуса. Он хорошо растворим в воде и этиловом спирте и плохо растворим в хлороформе и эфире.
Все вещества проявляют основные свойства (см. табл. 40).
При изолировании из биологических объектов в хлороформный экстракт из водной вытяжки при рН=2-3 переходят частично папаверин, наркотин. Хлороформом из раствора с рН=8-10 экстрагируются морфин, кодеин, этилморфин, наркотин и папаверин. Общими методами, из-за плохой растворимости в хлороформе, морфин изолируется в количестве 1-2%. При анализе трупного материала на морфин был предложен хроматографический метод, основанный на использовании катионита СДВ-3 и элюировании сорбированного морфина 5% раствором аммиака (изолируется до 20% морфина), и метод Крамаренко (можно изолировать до 50% морфина).
При проведении общего ТСХ-скрининга (см. раздел 7.1.2) извлечений из кислого и щелочного растворов папаверин, наркотин, морфин, кодеин, этилморфин, героин обнаруживаются в виде оранжевых пятен при обработке пластинки реактивом Драгендорфа.
При проведении аналитического скрининга с использованием общеалкалоидных осадительных реактивов вещества данной группы образуют аморфные осадки (см. раздел 7.1.8).
С реактивом Марки на хроматографической пластинке или в фарфоровой чашке с сухим остатком все вещества дают характерное окрашивание.
Для обнаружения конкретного соединения из группы производных фенантренизохиноляна. бензилизохинолина используют реакции окрашивания, микрокристаллоскопические реакции, хроматографию в тонком слое сорбента, методы ГЖХ, УФ-спектрофотометрию, НК-спекгросшпию, хроматомасс-спектрометрию, ВЭЖХ, иммунохимические методы и др
Хроматография в тонком слое сорбента. Остаток после испарения экстракта из водной вытяжки при рН=2 и рН=8-10 наносят на стартовые линии хроматографических пластинок марки «Силуфол», «Сорбфил», «Кизельгель-60 (G)», содержащие флуоресцирующую добавку. Одновременно на пластинку наносят растворы «стандартов» в метаноле с концентрацией 1 мг/мл морфина, кодеина и других опиатов в количестве 5-10 мкл В качестве частных систем растворителей для опиатов чаще всего используют системы толуол — ацетон — этанол — 25% раствор аммиака (45:45:7:3) или этилацетат — метанол — 25% раствор аммиака (85:10:5). Камеру насыщают парами системы путем обертывания внутренней ее части смоченной в системе фильтровальной бумагой. После подъема системы на высоту 10 см пластинку высушивают и выдерживают в термостате при 120°С в течение 10 мин с целью удаления следов аммиака.
Для проявления пятен на пластинке используют (последовательно):
— освещение УФ-светом при длине волны 254 нм — регистрируют пятна по отсутствию флуоресценции;
— обработку реактивом Драгендорфа — обнаруживают оранжевые пятна на желтом фоне;
— обработку подкисленным раствором йодплатината калия — пятна опиатов темнеют, а пятна морфина переходят в сине-фиолетовый цвет.
Таблица 40. Значения рКа производных изохинолина, бензилизохинолина
|
Вещество |
рКа |
|
Морфин |
6,17 и 10,0 |
|
Кодеин |
6,05 |
|
Папаверин |
8,09 |
|
Наркотин |
7,83 |
|
Героин |
7,80 |
|
Этилморфин |
8,20 |
Таблица 41. Результаты реакций опиатов со специальными реактивами
|
Исследуемое вещество |
Окраска, возникающая при добавлении реактива |
|||
|
Манделина |
Марки |
Фреде |
Эрдмаиа |
|
|
Героин |
фиолетовая |
красная → фиолетовая |
фиолетовая → грязно-зеленая → розовая |
|
|
Морфин |
фиолетовая |
красно-фиолетовая |
фиолетовая |
красная → желтая |
|
Кодеин |
зеленая → синяя |
сине-фиолетовая → зеленая |
зеленая → синеватая |
— |
|
Этилморфин |
зеленая |
синяя → сине-фиолетовая |
зеленая → синяя |
— |
|
Наркотин |
красная → бурая → фиолетовая |
фиолетовая → зеленая → желтая |
сине-зеленая, при t° → вишнево-красная |
красная → фиолетово-красная |
|
Папаверин |
снне-фиолетовая |
розовая → фиолетовая |
зеленая |
красная |
В указанных условиях опиаты, их метаболиты и аналоги хорошо разделяются между собой. Значение величин Rf зависит от лабораторных условий (температуры, влажности и др. параметров).
Реакции окрашивания. Часть хлороформных экстрактов, полученных из объектов исследования, распределяют на фарфоровых чашках, испаряют до получения сухих остатков и наносят по 2-3 капли реактивов, образующих характерное окрашивание с большинством опиатов. Полученную окраску фиксируют сразу и затем наблюдают ее изменение (переход в другое окрашивание).
Основными реактивами окрашивания для опийных алкалоидов и их аналогов являются реактивы Манделина, Марки, Фреде, Эрдмана (табл. 41).
Кроме использования специальных реактивов проводят характерные реакции окрашивания на отдельные вещества.
Морфин
- При добавлении к остатку, содержащему морфин, хлорида железа (III) наблюдают синее окрашивание за счет свободного фенольного гидроксила в положении 3.
- При добавлении к остатку 1-2 капель концентрированной азотной кислоты морфин дает кроваво-красное окрашивание, переходящее в оранжево-желтое.
- Часть экстракта из объекта испаряют до сухого остатка, который растворяют в 1 мл 10% раствора гидроксида натрия. Полученный щелочной раствор осторожно по стенкам пробирки переливают в раствор диазотированной сульфанидрвой кислоты На месте соприкосновения двух растворов появляется красное окрашивание.
Героин (субстанция)
- При добавлении к наркотическому средству концентрированной серной кислоты наблюдают образование синего окрашивания
- При добавлении к наркотическому средству концентрированной азотной кислоты наблюдают образование желтого окрашивания.
- Реакция этерификации. К части исследуемого наркотического средства добавляют 1 мл концентрированной серной кислоты, несколько капель этилового спирта и нагревают — ощущают характерный запах уксусноэтилового эфира (яблочной эссенции)

Микрокристалл оскопические реакции. Для проведения реакций хлороформный экстракт из объекта испаряют на предметных стеклах до сухого остатка, добавляют.
- 2 капли 0,1 М раствора хлороводородной кислоты и каплю соответствующего реактива. Смесь выдерживают во влажной камере 10-15 мин — наблюдают образование кристаллического осадка с характерной формой кристаллов для каждого вещества. В качестве реактивов используют хлорид ртути (II), хлорид кадмия, соль Рейнеке, пикролоновую кислоту, цианид натрия и др. (см. рис. 53-58).
Высокоэффективная жидкостная хроматография. Преимуществом метода ВЭЖХ для анализа опиатов (особенно в моче) является возможность определения основных метаболитов — глюкуронидов и исключения стадии гидролиза при пробоподготовке.
проводят в условиях прямого и обращеннофазового анализа в режиме изократического и градиентного элюирования. Например, в варианте прямофазного анализа в режиме градиентного элюирования используют прибор «Милихром А-02» и исследование проводят в условиях, описанных ранее (см. раздел 8.3). Идентифицируют вещества по удерживаемому объему (времени удерживания) и по спектральным отношениям с использованием нескольких длин волн (см. табл. 42).


Таблица 42. Хроматографические характеристики опиатов
|
Вещество |
Объем удерживания, мкл |
Спектральные отношения S1/S210 |
||||||
|
220 |
230 |
240 |
250 |
260 |
280 |
300 |
||
|
Морфин |
739 |
0,596 |
0,233 |
0,164 |
0,077 |
0,021 |
0,058 |
0,006 |
|
Кодеин |
1013 |
0,667 |
0,234 |
0,195 |
0,114 |
0,027 |
0,062 |
0,005 |
|
Этилморфин |
1243 |
0,701 |
0,249 |
0,198 |
0,116 |
0,028 |
0,063 |
0,006 |
|
Папаверин |
1689 |
0,894 |
1,174 |
1,598 |
2,603 |
1,134 |
0,278 |
0,335 |
|
Героин |
1502 |
0,365 |
0,218 |
0,110 |
0,020 |
0,027 |
0,077 |
0,001 |
Полученные параметры удерживания и спектральные отношения должны совпадать с параметрами стандартных образцов веществ.
ИК-спектроскопия в анализе опиатов. Остаток после испарения экстракта органического растворителя из объекта, очистки с помощью ТСХ растирают с кристаллами бромида калия и регистрируют ИК-спектр. Для каждого из веществ наблюдают несколько наиболее важных характерных полос поглощения (табл. 43). Полосы поглощения исследуемого вещества должны совпадать с полосами поглощения стандартных веществ, приведенных в специальных атласах ИК-спекгров
Иммунные тесты для опиатов и других наркотических веществ. Используются для быстрого обнаружения опиатов в моче. Они представляют собой наборы полосок, на которых меченый антиген ковалентно связан с бумажной полоской в тестовой зоне Для анализа требуется небольшой объем мочи (достаточно 150 мкл). В настоящее время используется более 10 видов иммунных тестов. Анализ может проводиться вне лаборатории. Он получил название «on-line» или «оn-site», т.е «на месте». Тестовая полоска опускается в образец мочи, и через несколько минут фиксируется результат.
Таблица 43. Характеристические волновые числа в ИК-спектрах опиатов
|
Вещество |
Полосы поглощения, см—1 |
|
Морфин |
805, 1243, 1448, 945, 1086, 833 |
|
Кодеин |
1052, 1268, 1500, 1111, 793, 934 |
|
Героин |
1245, 1764, 1178, 1215, 911, 1736 |
|
Папаверин |
1507, 1068, 1273 |
|
Наркотин |
1745, 1276, 1038 |
Таблица 44. Индексы удерживания опиатов
|
Вещество |
Индекс удерживания |
Вещество |
Индекс удерживания |
|
Этилморфин |
2410 |
Морфин |
2450 |
|
Папаверин |
2848 |
Наркотин |
3165 |
Этот способ анализа прост в выполнении и показывает большой процент сходимости с лабораторными имунными методами анализа — ПФИА, ИФА и ГХ/МС. Однако они,
I как и лабораторные методы, неспецифичны и требуют подтверждения другими методами.
УФ-епектрофотометрия. Остаток после испарения хлороформного экстракта очищают с помощью тонкослойной хроматографии, как описано в разделе 6.4. Очищенные вещества элюируют с пластинки этиловым спиртом или 0,1 М растворами гидроксида натрия, серной или хлороводородной кислот. Регистрируют спектры поглощения элюатов с помощью спектрофотометра в области 200-320 нм. Опиаты обнаруживают максимумы светопоглощения в интервале д лин волн 281-313 нм. Например, в этанольном растворе у морфина максимум светопоглощения обнаруживается при 287 нм, у кодеина — при 286 нм, у героина- при 281 нм, у наркотина — при 291 и 310 нм. В растворе морфина в 0,1 М хлороводородной кислоте максимум светопоглощения обнаруживают при 285 нм, у кодеина — при 211 и 285 нм, у героина — при 278 нм, у папаверина — при 250,284 и 310 нм. При проведении анализа результаты сравнивают со спектрами поглощения растворов стандартных веществ,
Газожидкостная хроматография. Анализ проводят после очистки извлечений из объекта с помощью ТСХ. Обнаружение опиатов и их аналогов основано на измерении соответствующих параметров — времени и индекса удерживания (табл. 44).
При анализе извлечений из мочи после гидролиза глюкуронидов и сульфатов (в процессе пробоподготовки) и экстракции проводят дериватизацию путем ацетилирования или силилирования. Полученные дериваты анализируют. Разделение проводят на кварцевых капиллярных колонках с неполярными или слабополярными фазами, реже на набивных колонках также с неполярными (типа SE-30 или OV-1) или среднеполярными (OV-17) фазами. Детектор чаще всего пламенно-ионизационный, газ-носитель — азот. В качестве внутреннего стандарта рекомендован налорфин.
ГХ/МС в анализе опиатов (по Е.К.Еремину). Метод используется для идентификации и количественного определения опиатов в варианте масс-спектрометрии электронного удара.
Детектор масс-селективный, колонки кварцевые капиллярные с привитыми неполярными или малополярными стационарными фазами: 100% диметилсиликон, 95% ме- тилсиликон или 5% фенилсиликон. Температура термостата колонок программируется с начальной 50-150°С до конечной 280-300°С. Температура интерфейса — 250-290°С. Газ-носитель — гелий со скоростью 1,8 мл/мин.
Для идентификации анализ ведут в режиме сканирования, для количественного определения — в режиме детектирования выбранных ионов. Для заключения об обнаружении определенного вещества необходимо совпадение времен удерживания всех выбранных ионов, а также соответствие интенсивностей этих ионов величинам, полученным для стандартных веществ (допускается отклонение не более ±20%).
При количественном определении (см. табл. 45) выбирают один «базовый» («характеристический») ион. Расчеты ведут по калибровочному графику, выражающему зависимость отношения площадей «количественного иона» анализируемого вещества (АВ) и внутреннего стандарта (ВС) от отношения концентраций АВ и ВС.
Таблица 45. Характеристические полосы масс-спектра электронного удара
|
Вещество |
m/z* |
|
Морфин |
42, 44, 124, 162, 215, 268, 284, 285, 286 |
|
Кодеин |
42, 59, 69, 124, 162, 229, 299, 300 |
|
Героин |
42, 43, 59, 204, 229, 282, 341, 342 |
|
Норморфин |
81,82, 110, 148, 150, 201, 271, 272 |
|
Норкодеин |
81, 110, 115, 168, 164, 215, 285, 286 |
* «Базовый» молекулярный ион выделен
Анализ биологических объектов на наличие меконовой кислоты и меконина
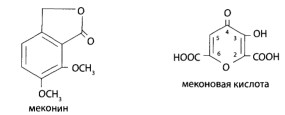
Анализ проводится в том случае, если в процессе исследования объекта (трупного материала, остатков пищи, мочи, рвотных масс) обнаружены морфин, кодеин, другие алкалоиды опия и подозревается отравление опием.
Изолирование из объекта. Биологический объект настаивают со спиртом, подкисленным хлороводородной или серной кислотами. Вытяжку сливают, упаривают до небольшого объема и делят на 2 части. Одну часть исследуют на меконовую кислоту, вторую — на меконин.
Испытание на меконовую кислоту. Раствор выпаривают досуха на водяной бане. Сухой остаток растворяют в воде, нагревают до кипения и добавляют избыток оксида магния, фильтруют и подкисляют 10% раствором хлороводородной кислоты.
Для обнаружения меконовой кислоты используют реакцию с хлоридом железа (III) и УФ-спектрофотометрию.
После изолирования меконовая кислота в растворе будет находиться в виде магниевой соли:

Реакция с хлоридом железа (III). К 1-2 мл полученного раствора прибавляют 2-3 капли 1% раствора хлорида железа (III). Наблюдают появление кроваво-красного окрашивания, которое не исчезает при нагревании, но обесцвечивается при добавлении кислоты.
УФ-спектрофотометрия. После регистрации спектра поглощения раствора, содержащего меконовую кислоту, в спектре обнаруживают 3 максимума светопоглощения при 210, 284 и 303 нм.
Испытание на меконин. 1/2 часть раствора экстрагируют бензолом Бензол отделяют от водной фазы и выпаривают досуха Полученный остаток исследуют на наличие меконина
Реакция с концентрированной серной кислотой. При добавлении к сухому остатку нескольких капель концентрированной серной кислоты появляется зеленое окрашивание, которое в течение суток переходит в красное. Если полученный при добавлении концентрированной серной кислоты зеленый раствор нагреть, сразу появляется изумруднозеленое окрашивание, переходящее в фиолетовое, а затем в красное.
К опиоидным анальгетикам относят фармакологические аналоги морфина: промедол, трамадол, метадон и фенциклидин. Все они обладают сильным анальгетическим действием, но одновременно с этим вызывают привыкание (фенциклидин рассмотрен ранее среди галлюциногенов).
Указанные вещества проявляют аналгезирующую активность в дозах от нескольких мкг до 20 мг.
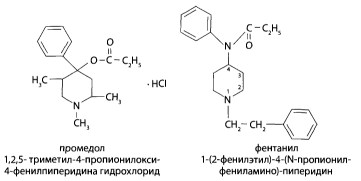
Промедол является опиоидным анальгетиком, активность которого ниже морфина в 2-4 раза. В отличие от морфина он слабее угнетает дыхательный центр. Его используют при травмах и различных заболеваниях, сопровождающихся болевыми ощущениями Применяют промедол в виде таблеток по 0,025 г или в виде 1 % и 2% растворов подкожно.
Фентанил оказывает сильное аналгезирующее действие. Назначают в виде 0,005% раствора по 1-3 мл при сильных болях.

Трамадол (трамал) дает сильный и быстрый анальгетический эффект, продолжающийся 3-5 ч Применяют в капсулах по 0,05 г, в виде суппозиториев по 0,1 г или в виде 5% раствора по 1-2 мл
Метадон существует в двух изомерных формах у левовращающего изомера (левометадона) аналгезирующее действие примерно в 4 раза сильнее, чем у морфина. В некоторых зарубежных фармакопеях приводится рацемический метадон
Токсикологическое значение
При частом применении промедола развивается привыкание и болезненное пристрастие (наркомания). Промедол входит в список №2 Постоянного Комитета по контролю наркотиков, который предусматривает применение промедола с медицинскими целями под особым контролем.
При приеме фентанила в дозе 50-100 мкг наступает аналгезия и потеря сознания. При регулярном применении фентанила развивается толерантность и физическая зависимость. Фентанил и его производные имеют перекрестное замещение с морфином и обладают наркотической активностью. Опийные наркоманы воспринимают фентанил как заменитель героина со сходными эффектами. В подпольных лабораториях синтезированы различные производные фентанила, которые превосходят его по активности в тысячу раз и более
Трамал вызывает развитие толерантности и физиологической зависимости при длительном приеме терапевтических доз. Он имеет низкую наркотическую активность, однако имеются сведения о немедицинском использовании больших доз трамала лицами с опиатной зависимостью При передозировке наблюдаются тахикардия, постуральная гипотензия, коллапс, редко судороги он быстро и полностью всасывается из ЖКТ.
Метадон применяется для лечения лиц с героиновой зависимостью, хотя его использование не является бесспорным и отвергается многими врачами-наркологами. Метадон имеет сильную наркотическую активность, ее потенциал и длительность эйфорического действия сопоставимы с морфином. Смертельные случаи отравления наблюдались при приеме 50 мг метадона
Метаболизм опиоидов
В организме промедол подвергается гидролизу и деметилированию с последующим образованием глюкуронидов
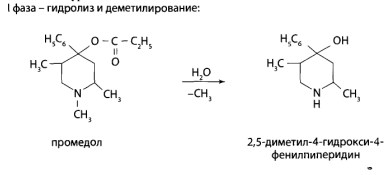

Фентанил является липофильным веществом, поэтому быстро проникает через мембраны и распределяется по всем тканям организма. После внутривенного введения фентанила в плазме крови находится не более 10% введенной дозы. Механизм метаболизма фентанила и его аналогов сходен. На первой стадии происходит отщепление фенилалкильного заместителя от атома азота пиперидинового кольца или гидролиз амидной группы. Частично может происходить гидроксилирование фенильного, пиперидинового или пропионильного радикалов.
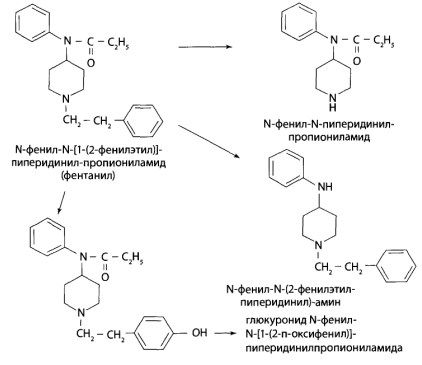
После перорального приема трамала в дозе 100 мг пик концентрации в крови в 260 -410 нг/мл достигается через 30-60 мин (по некоторым данным через 1,6-3 ч). Через 12 ч концентрация уменьшается до 50-80 нг/мл и через 24 ч до 10-15 нг/мл. Метаболизм трамала происходит по пути деметилирования и гидроксилирования. Во второй фазе проходит конъюгация гидроксильных производных с глюкуроновой или серной кислотами.
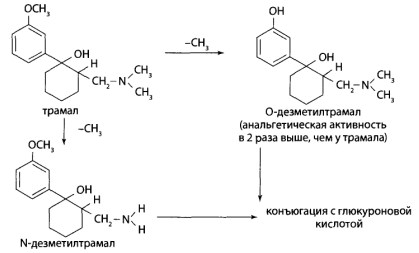
При оральном применении метадона в дозе 15 мг максимальная концентрация в крови обнаруживается в течение 2-4 ч и достигает 70-85 нг/мл. Интервал концентрации в плазме и скорость ее изменения сильно зависят от индивидуальных особенностей организма. Метаболизм метадона происходит по пути деметилирования с последующей циклизацией. Другие пути метаболизма сводятся к гидроксилированию фенильных радикалов. В виде нативного соединения метадон через 24 ч выводится в количестве примерно 33%, в виде основных метаболитов около 50% дозы. Неконьюгированные соединения составляют 75% введенной дозы. Часть метадона выводится через кишечник.
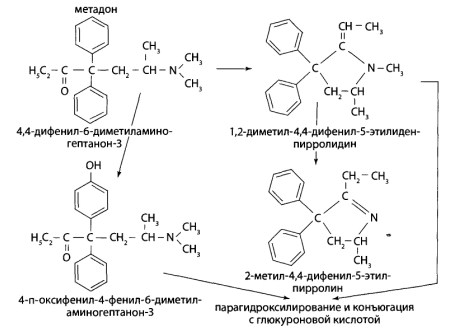
Физико-химические свойства
Промедол выпускается в виде гидрохлорида, представляет собой белый кристаллический порошок без запаха, легко растворим в воде, спирте, хлороформе, нерастворим вдиэтиловом эфире. Промедол является слабым основанием, рКа=5,20.
Фентанил — белый кристаллический порошок, очень мало растворим в воде, растворим в метаноле, этаноле и хлороформе.
Трамал выпускается в виде гидрохлорида, представляет собой белый или кремова- тый мелкокристаллический порошок, легко растворим в воде, растворим также в метаноле, этаноле и хлороформе.
Метадон выпускается в виде гидрохлорида. Это белый кристаллический порошок горького вкуса, растворим в воде, спирте и хлороформе, нерастворим в диэтиловом эфире.
Методы изолирования и определения
Для изолирования опиоидов из биологических жидкостей применяют жидкость- жидкостную экстракцию при значении рН>7, твердофазную экстракцию в специальных патронах. После испарения растворителя-экстрагента проводят исследования с использованием химических и физико-химических методов.
Хроматография в тонком слое сорбента. Для обнаружения промедола рекомендуется система растворителей этилацетат — этанол — 25% раствор аммиака (9:1:0,5). Используют хроматографические пластинки «Сорбфил». Rf для промедола равно 0,69.
Метадон анализируют, используя систему растворителей бензол — этанол — диэтила- мин (9:1:1). Rf для метадона равно 0,80
Для обнаружения трамала рекомендованы системы растворителей: толуол — этанол — триэтиламин (9:1.1), Rf 0,74, и метанол — 25% раствор аммиака (100:1), Rr0,55.
Пятна на пластинках предложено детектировать путем просматривания в УФ-лучах (254 нм) — на месте расположения опиоидов наблюдают гашение флуоресценции. При последующей обработке пластинок реактивом Драгендорфа пятна исследуемых веществ окрашиваются в оранжевый цвет.
Реакции окрашивания. Эти реакции проводят с сухими остатками, полученными после испарения экстракта из объекта. К сухим остаткам добавляют реактив и наблюдают образовавшуюся окраску:
- при добавлении реактива Марки промедол дает красно-пурпурное окрашивание, трамал — грязно-коричневое, переходящее в грязно-зеленое, метадон — розовокрасное, переходящее в интенсивно флуоресцирующее;
- при добавлении концентрированной серной кислоты трамал образует ярко- желтое окрашивание,
- при добавлении реактива Либермана метадон образует оранжевое окрашивание;
- при добавлении реактива Манделина (смесь концентрированной серной кислоты и ванадата аммония) метадон образует зеленое, переходящее в голубое окрашивание;
- при добавлении реактива Фреде (смесь концентрированной серной кислоты и мо- либдата аммония) метадон дает серо-коричневое окрашивание;
- при добавлении 1% раствора лимонной кислоты в уксусном ангидриде и при нагревании на водяной бане фентанил образует красно-фиолетовое окрашивание.
Метод ВЭЖХ. Для анализа используют условия, описанные при обнаружении опийных алкалоидов. Идентификацию веществ проводят по величинам удерживаемого объема и спектральным отношениям при нескольких длинах волн (см. табл. 46).
Газовая хроматография с масс-спектральным детектированием. Для анализа опиоиды изолируют из объекта жидкость-жидкостной экстракцией. После испарения органического растворителя рекомендуется проводить дериватизацию выделенных веществ с помощью уксусного или перфторуксусного ангидрида. Анализ проводят, используя хроматомасс-спектрометрию электронного удара. Сканирование масс-спектров ведут в диапазоне от 31 до 550 дальтон (дальтон — атомная единица массы, которая равна 1/12 массы атома нуклида 12С). В таблице 47 представлены получаемые данные.
Таблица 46. Хроматографические характеристики опиоидов
|
Вещество |
Удерживаемый объем, мкл |
Спектральные отношения S1/S210 |
||||||
|
220 |
230 |
240 |
250 |
260 |
280 |
300 |
||
|
Промедол |
1882 |
0,219 |
0,011 |
0,010 |
0,017 |
0,019 |
0,001 |
0,001 |
|
Трамал |
1566 |
0,442 |
0,416 |
0,028 |
0,040 |
0,11! |
0,185 |
0,003 |
|
Фентанил |
1949 |
0,304 |
0,126 |
0,042 |
0,019 |
0,020 |
0,001 |
0,001 |
Таблица 47. Газохроматографические и масс-спектральные характеристики трамала, метадона и их метаболитов
|
Вещество |
Время удерживания, мин |
Характеристические иоиы, m/z |
|
Трамал |
7,26 |
58, 115, 128, 121,245 |
|
Метаболиты трамала |
7,17; 6,88 |
|
|
Метадон |
6,41 |
57, 72, 86, 165, 223, 294, 309 |
|
Метаболиты метадона |
5,59; 6,11; 5,73; 6,54 |
|

Микрокристаллоскопическая реакция на промедол. Остаток после удаления органического растворителя обрабатывают 1-2 каплями 0,1 М раствора хлороводородной кислоты и смешивают с одной каплей 0,2% водного раствора ализаринового красного. Через 15-20 мин наблюдают образование сростков из игольчатых и узкопластинчатых кристаллов (рис. 59).
8.9.3. Количественное определение опиатов и опиоидов
Для количественного определения опиатов и опиоидов используют методы ВЭЖХ, УФ- спектрофотометрии, ГЖХ, ГХ/МС, иммунохимические и фотоэлектроколориметриче- ские методы.
Метод ВЭЖХ. Анализ проводится в условиях, приведенных ранее для лекарственных и наркотических веществ. Для расчетов содержания исследуемых соединений используют метод добавок, методы внешнего и внутреннего стандарта.
Метод добавок. Проводят анализ экстракта из мочи и параллельно той же пробы с добавкой в нее 0,2 мл 0,11 мкг/мл стандартного раствора соответствующего опиата (морфина, кодеина, папаверина и т.д.). После получения на хроматограмме пиков исследуемого вещества и «стандарта» концентрацию опиата рассчитывают по формуле, приведенной в разделе 8.1.
Метод внешнего стандарта. Параллельно с анализом экстракта из объекта проводят анализ стандартного раствора соответствующего опиата в одном масштабе регистрации.
После получения пиков на хроматограмме концентрацию исследуемого вещества рассчитывают по формуле, приведенной в разделе 8.1.
Метод внутреннего стандарта. К пробе исследуемого объекта до начала пробоподготовки добавляют в качестве «внутреннего стандарта» налорфин. Затем проводят изолирование, очистку извлечений и в полученном остатке определяют опиат с помощью ВЭЖХ по приведенной ранее формуле в разделе 8.1.
УФ-спектрофотометрия. Используется после очистки извлечений из объекта от эндогенных соединений с помощью ТСХ или твердофазной экстракции. Анализ ведут при дайнах волн, соответствующих максимумам светопотощения найденного опиата. Расчет концентрации проводят по калибровочному графику.
ГЖХ Количественное определение опиатов и их аналогов проводят традиционным способом путем измерения высот (площадей) пиков исследуемого вещества и «внутреннего стандарта». Для расчета количества опиата используют калибровочный график.
Иммунохимические методы. Из описанных ранее иммунохимических методов для количественного определения опиатов чаще всего используют поляризационный иммуноанализ на приборах фирмы «Эббот» ТДХ/ТДХ-FL,. Особенностью приборов является автоматический режим расчета концентрации с использованием калибровочных графиков.
Фотоколориметрические методы. Среди фагоколориметрических методов для количественного определения опиатов и их аналогов предложены метод непосредственной н экстракционной фотометрии.
Фотоколориметрический метод определения морфина (метод В. Ф.Крамаренко). Сухой остаток после испарения извлечения из объекта растворяют в 2 мл воды очищенной. В мерной колбе смешивают 3 мл 0,11% раствора силиката калия (K2Si03), 2 мл 0,5 М раствора хлороводородной кислоты и 2 мл 5% раствора молибдата аммония. Через 3 мин к полученной смеси реактивов добавляют исследуемый раствор остатка и 5 мл 6% раствора аммиака. Раствор окрашивается в синий цвет. Оптическую плотность измеряют при красном светофильтре в кювете 3 мм. Расчеты ведут, используя калибровочный график.
Метод позволяет определить от 0,2 до 4 мг морфина в исследуемой пробе.
Экстракционно-фотоколориметрический метод определения кодеина. 1 мл раствора остатка извлечения из объекта вносят в делительную воронку, прибавляют 9 мл ацетатной буферной смеси (рН=4,6), 5 мл 0,1 % водного раствора тропеолина 00 и повторно экстрагируют 5 мл хлороформа. Хлороформные экстракты объединяют и объем доводят до 50 мл. К 5 мл полученного раствора прибавляют 20 мл хлороформа и 2,5 мл 1% раствора концентрированной серной кислоты в метиловом спирте. Оптическую плотность полученного раствора, окрашенного в фиолетово-красный цвет, определяют, используя фотоэлектроколориметр, зеленый светофильтр и кювету 10 мм. Расчет концентрации ведут по калибровочному графику.
Метод позволяет определить от 0,2 до 2,0 мг кодеина в пробе.
Аналогичные методы экстракционной фотоколориметрии предложены для количественного определения этилморфина (с бромфеноловым синим при рН=2,86), папаверина (с эозинатом натрия при рН=4,5), промедола, морфина (с тропеолином 00 при рН=4,6).
Тропан представляет собой конденсированную систему, состоящую из пирролидинового и пиперидинового циклов. Производные тропана распространены в основном в растениях семейства пасленовых и эритроксиловых. Природные алкалоиды подразделяют на производные спиртов тропина (3-гидрокситропан), скопина (6,7-эпокси-З-гидрокси- тропин) и экгонина (3-гидрокси-2-карбокситропан).
В медицинской практике применяют «Атропина сульфат» и различные препараты красавки.
Из листьев и травы красавки производят настойку, густой и сухой экстракты, входящие в различные лекарственные формы (таблетки, свечи) и комбинированные препараты («Бекарбон», «Бесалол», «Белалгин», «Бепасол», «Белластезин», «Таблетки желудочные с экстрактом красавки», «Беллатаминал», «Беллоид», «Бетиол», «Анузол», препарат «Солутан»). Порошок листьев красавки входит в состав «Астматола» и «Астматина».
Атропина сульфат применяют в качестве антагониста холиноэргетиков. Он способен блокировать М- и Н-холинорецепторы. Блокируя М-холинорецепторы, атропин делает их нечувствительными к ацетилхолину. Атропина сульфат также находит применение в качестве активного антидота при отравлении холиномиметическими и антихолинэстеразными веществами, в том числе и фосфорорганическими соединениями.
Атропина сульфат применяют широко в глазной практике для расширения зрачка с диагностической целью (исследование глазного дна, определение истинной рефракции и т.д.), а также при паркинсонизме, при различных патологических состояниях, сопровождающихся повышением тонуса блуждающего нерва, при болях, связанных со спазмами гладкой мускулатуры.
Атропин оптически неактивен, так как является рацематом. Левовращающий изомер — гиосциамин активнее атропина в 2 раза.
Скополамин — алкалоид, содержащийся вместе с гиосциамином в красавке, белене, дурмане, скополии.
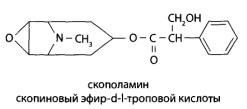
Применяется в медицинской практике в виде скополамина гидробромида в качестве спазмолитического средства. Скополамин действует на периферические холинреактивные системы: вызывает расширение зрачков, паралич аккомодации, учащение сердечных сокращений, расслабление гладких мыщц (бронхов, ЖКТ), уменьшение секреции пищеварительных и потовых желез. Он способен за счет центрального холиномиметического действия давать седативный эффект, уменьшать двигательную активность, проявлять снотворное действие. Его используют в психиатрической практике как успокаивающее средство, в неврологии для лечения паркинсонизма, как противорвотное и успокаивающее средство при морской и воздушной болезни. Применяется внутрь в растворах, подкожно, местно в разовых дозах 0,00025-0,0005 г. Известны таблетки «Аэрон», содержащие скополамин камфорнокислый. Кроме того, в медицинской практике находят применение синтетические производные тропана: гоматропина гидробромид, тропацин и тропафен. Их токсикологическое значение значительно меньше по сравнению с указанными выше веществами.
Кокаин (кока, мараф, кокс, благородный, белый) — главный алкалоид листьев Erythroxylon coca (семейство Erythroxylaceae), произрастающего в Перу, Боливии, Эквадоре и других странах. Содержание кокаина в листьях доходит до 1,5%, причем молодые листья его содержат до 2%. Синтетический кокаин был получен из экгонина.

Кокаин — сложный эфир спиртокислоты экгонина с метиловым спиртом и бензойной кислотой. В медицинской практике кокаина гидрохлорид иногда применяют в качестве местноанестезирующего средства для анестезии конъюнктивы глаза, слизистых оболочек гортани, носа, мочевыводящих путей.
Токсикологическое значение
Отравления атропином чаще всего наблюдаются при употреблении частей растений белладонны, белены и дурмана. Ядовиты все части растения: стебли, листья, цветы, семена, корни. Во все времена белладонна была известна как наиболее ядовитое растение. В средние века белладонна считалась, наряду с беленой, волшебной травой и была составной частью колдовских мазей и напитков.
Отравления частями растений чаще всего встречается у детей дошкольного и младшего школьного возраста. 5-20 зерен красавки, дурмана или белены способны вызвать отравление. Мелкие семена этих растений по внешнему виду практически не отличаются от семян мака и поэтому привлекают детей.
Клинические симптомы отравления проявляются в сухости и жжении во рту, в носу, глотке, жажде, расстройстве глотания и речи (охриплость, беззвучность голоса), тошноте, рвоте, резком расширении зрачков, не реагирующих на свет. У пострадавших отмечаются покраснение лица, одышка, кожа становится сухой, красной, горячей со скарлатиноподобной сыпью. Характерно речевое и двигательное возбуждение, атаксия, головная боль, бред, зрительные и обонятельные галлюцинации, неадекватный смех, плач, иногда буйное состояние. Авиценна более 1000 лет назад писал: «Белена — яд, который причиняет умопомешательство, лишает памяти и вызывает удушье и бесноватость». Свойство белены вызывать галлюцинации использовалось в средние века в составе «мази ведьм», в которую она входила в виде экстракта плодов красавки. Ядовитые свойства белены отражены в народной поговорке «что ты, баба, белены объелась», имея в виду возбуждающее действие на организм этого растения.
При попадании токсических доз алкалоидов в организм после возбужденного состояния наблюдаются судорожные приступы, потеря сознания, кома, одышка, сменяющиеся чейн-стоксовым дыханием, цианозом, частым пульсом, понижением артериального давления. Смертельная доза — 0,1 г атропина для взрослого человека. Смерть наступает при явлениях асфиксии от паралича дыхательного центра. Картина вскрытия малохарактерна.
Отравления скополамином в большинстве случаев связаны с приемом лекарственных препаратов. В отличие от атропина стадия возбуждения при отравлении слабо выражена Токсические дозы через несколько минут вызывают потерю сознания и кому. При более умеренных формах наступает помешательство, потеря уверенности в себе, галлюцинации, отсутствует самокритика После выздоровления полная амнезия. Смертельная доза скополамина — 0,1 г. Известны аллергические реакции при введении в организм скополамина и его препаратов.
Кокаин — сильнодействующий стимулятор ЦНС. Он способен изменять сознание, снимать усталость и стимулировать работу различных систем организма (аналогично амфетаминам). В древней цивилизации жрецы использовали листья кока для вхождения в транс при религиозных действах, а позже люди жевали листья кока, чтобы улучшить самочувствие, снять усталость и чувство голода.
Распространение кокаина как наркотического средства приняло угрожающий характер во всем мире в 1986—1999 годы, когда он появился «на улицах» в нелегальной коммерческой торговле За счет передозировки число смертельных исходов значительно возросло. Кокаин был отнесен к числу особо опасных наркотиков. В настоящее время кокаин включен в список №2 Конвенции ООН по наркотикам, что означает возможность его применения по определенным медицинским показателям при международном и внутреннем контроле.
Формы использования кокаина в «уличной» торговле:
- кокаина гидрохлорид;
- кокаин-основание — «крэк»;
- смесь кокаина и героина — «спидболл». Эта смесь обладает особенно высоким наркотическим действием.
Указанные формы использования кокаина могут содержать примеси- сахара, стимуляторов (амфетамин, кофеин), анестетиков (лидокаин, прокаин). В таких формах содержание кокаина может быть менее 10%.
Кокаин в международном обороте наркотиков — продукт высокого качества с содержанием кокаина гидрохлорида 89-90%. При нелегальной продаже он разбавляется до 30% содержания путем смешивания с парацетамолом, кофеином, лидокаином, прокаином, бензокаином, маннитолом, лактозой, глюкозой, крахмалом, содой, борной кислотой и др.
Другим широко используемым наркоманами продуктом является «крэк» (Crack, Rock). Название это средство получило за счет характерного потрескивания кристаллов при нагревании. Он используется для курения. Его получают из кокаина гидрохлорида путем экстракции эфиром подщелоченных растворов. Выделенное кокаин-основание представляет собой кристаллы или гранулы и содержит до 90% кокаина. При высокой температуре испаряется, что и используется для курения.
Основное действие кокаина связано с его местноанестезирующим и сосудорасширяющим свойствами. Кокаин вызывает все виды анестезии — поверхностную, инфильтрационную, проводниковую и спинномозговую. При попадании на слизистые оболочки кокаин быстро достигает нервных окончаний, что способствует утрате болевой, затем тепловой и тактильной чувствительности.
Действие кокаина на ЦНС проявляется в виде опьяняющего веселья, галлюцинаций, позже появляются бред, страх, понижение слуха, вкуса, зрения, конвульсии и паралич. Желание испытать эйфорию и стимулирующее действие приводит к болезненному пристрастию — кокаинизму.
Кокаин принимают обычно путем вдыхания наркотика через нос или внутривенного вливания. Нюханье кокаина влечет за собой вначале катар полости носа, позже — хронические язвенные процессы, доходящие до перфорации носовой перегородки. Состояние опьянения развивается вскоре после введения наркотика и продолжается 1-3 ч. Затем наступает спад активности, выраженные депрессивные переживания, чувство усталости, апатии, опустошенности.
Систематическое применение кокаина истощает организм. Падает трудоспособность, снижаются волевые качества, позже память ослабевает, круг интересов сужается, нарушается сон, который прерывается кошмарными сновидениями. Человек становится раздражительным, отмечены приступы страха, беспокойства, мания преследования. Все это приводит к правонарушениям и суициду.
Особенно опасны кокаиновые психозы, которые протекают по форме кокаинового параноида и характеризуются наплывом зрительных галлюцинаций, упорной бессонницей, помрачением сознания. Организм человека очень чувствителен к кокаину. Доза 0,01-0,03 г вызывает эйфорию, а доза 0,05 г при быстром всасывании — смертельное отравление. Смерть наступает в течение нескольких минут вследствие паралича дыхательного центра.
Всасывание и пути метаболизма
Алкалоиды красавки быстро всасываются слизистыми желудочно-кишечного тракта и другими слизистыми, например конъюнктивой.
Атропин в организме подвергается в I фазе метаболизма гидролизу с образованием спирта тропина и троповой кислоты в присутствии атропинэстеразы. Во II фазе метаболизма образуются глюкурониды. Эти метаболиты выделяются в течение 48 ч. Часть атропина (до 50%) выводится с мочой в неизмененном виде.
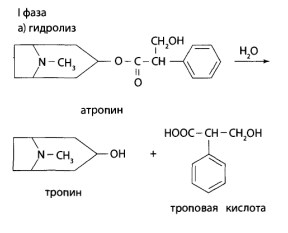

Скополамин в печени подвергается гидролизу до спирта скопина и троповой кислоты. За счет деметилирования у атома азота скополамин образует норскополамин и норскопин. Во II фазе метаболизма метаболиты и скополамин образуют хорошо растворимые глюкурониды.

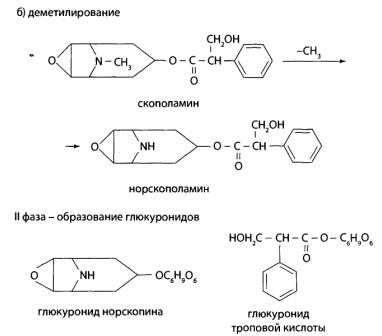
Кокаин. При курении кокаин всасывается быстро. Кокаин и его метаболит норкокаин как липофильные соединения накапливаются в жировых депо. Они легко преодолевают гематоэнцефалический и плацентарный барьеры. Бензоилэкгонин и экгонин — высокополярные соединения.
В организме кокаин почти полностью разрушается. В I фазе метаболизма проходит гидролиз с образованием бензоилэкгонина, а затем экгонина и бензойной кислоты и деметилирование с образованием норкокаина. При курении и употреблении спиртных напитков могут образоваться и ряд других метаболитов. Во II фазе метаболизма образуются глюкурониды — конъюгаты с глюкуроновой кислотой. До 5% введенного в организм кокаина выводится в неизменном виде, а большая часть — в виде метаболитов через почки.
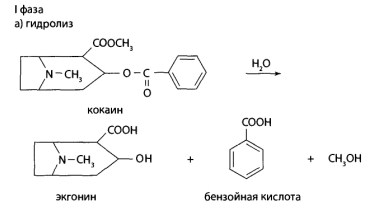
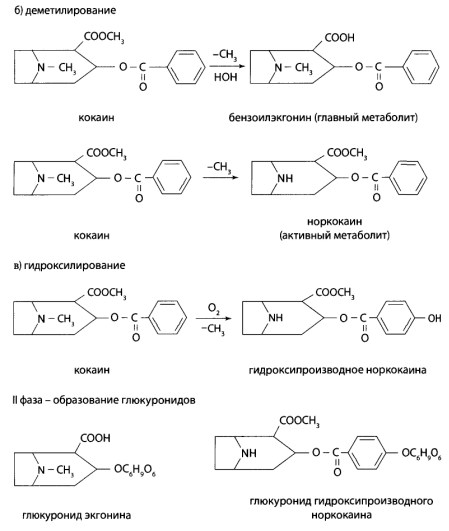
Физико-химические свойства
Соли алкалоидов (сульфаты, гидрохлориды) — белые кристаллические вещества без запаха Они легко растворимы в воде и спирте, малорастворимы в хлороформе. Основания алкалоидов — бесцветные призматические кристаллы, хорошо растворимые в этиловом спирте, бензине, хлороформе, подкисленной воде. Атропин, скополамин и кокаин — вещества со слабо основными свойствами (рКа атропина равно 10,0; рКа кокаина 8,7)
При изолировании из биологических объектов атропин, скополамин и кокаин экстрагируются хлороформом из водных вытяжек из объекта при рН=8-10.
При проведении общего ТСХ-скрининга алкалоиды — производные тропана и экгонина обнаруживаются на хроматографических пластинках в виде оранжевых пятен при обработке их реактивом Драгендорфа (см. раздел 7.1.2).
При проведении реакций с общеалкалоидными осадительными реактивами эти алкалоиды образуют, в основном, аморфные осадки (см. раздел 7.1.8).
Для обнаружения в извлечениях индивидуальных веществ используют химические, микрокристаллоскопические реакции, фармакологические пробы на животных, ВЭЖХ, УФ-спектрофотометрию, ИК-спектроскопию, хроматографию в тонком слое сорбента, газовую хроматографию и ГХ/МС.
Реакция Витали-Морена на атропин и скополамин. Для проведения реакции часть хлороформного извлечения из объекта испаряют в фарфоровой чашке, добавляют 1 мл концентрированной азотной кислоты и нагревают. При этом образуются 4'-нитропроизводные, которые под влиянием раствора щелочи в ацетоне приобретают фиолетовое окрашивание.

Реакция неспецифична, кроме атропина и скополамина эту реакцию дают вератрин, стрихнин, аминазин и другие вещества, но при их наличии в объекте окраска имеет иной оттенок и исчезает быстрее, чем окраска за счет атропина. Предел обнаружения — 1 мкг атропина в пробе.
Реакция с п-диметиламинобензалъдегидом и серной кислотой. К исследуемому раствору добавляют 3-5 капель 0,5% раствора п-диметиламинобензальдегида в концентрированной серной кислоте. При взбалтывании и последующем нагревании на водяной бане в течение 5-10 мин появляется красное окрашивание, переходящее в вишневокрасное, а затем в фиолетовое.
При наличии в извлечении морфина и кодеина также появляется красное окрашивание, но окраска не переходит в фиолетовую
Эту реакцию используют для отличия атропина и скополамина от кокаина, особенно в случае исследования наркотических средств.
Реакция Скотта на кокаин. При добавлении к остатку после испарения извлечения из объекта или к образцу наркотического средства 5 капель 2% раствора тиоцианата кобальта, смешанного с глицерином (1:1) — появляется синее окрашивание, которое исчезает при добавлении 1-2 капель концентрированной хлороводородной кислоты. Если к окрашенному раствору добавить несколько капель хлороформа, его слой окрашивается при встряхивании в синий цвет.
Реакция с молибдатом аммония на скополамин. При добавлении к остатку после испарения извлечения из объекта молибдата аммония и серной кислоты появляется темно-синее окрашивание.
Реакция образования бензойно-этилового эфира характерна для кокаина. К нескольким крупинкам исследуемого вещества или к сухому остатку экстракта из объекта прибавляют 2 мл концентрированной серной кислоты и 2 мл этилового спирта. Смесь нагревают на водяной бане 5 мин. Появляется характерный запах бензойно-этилового эфира. Этот запах ощущается более четко, если полученную жидкость разбавить 5-10 кратным объемом холодной воды очищенной.
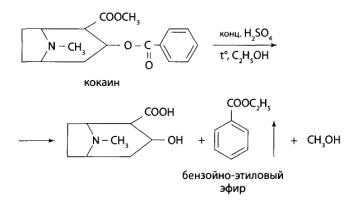
Эту реакцию не дают атропин и скополамин.
Реакция с солью Рейнеке на атропин. К сухому остатку извлечения из объекта добавляют каплю 0,1 М раствора хлороводородной кислоты и рядом каплю 1% свежеприготовленного раствора соли Рейнеке. При соединении этих растворов образуется осадок сиреневого цвета. Под микроскопом видны сростки кристаллов с ромбовидными концами (рис. 60).
Предел обнаружения — 0,1 мкг атропина в пробе.
Реакция с пикриновой кислотой на атропин. При добавлении к сухому остатку капли 0,1 М раствора хлороводородной кислоты и капли 0,5% раствора пикриновой кислоты через 15-20 мин образуются кристаллы светло-желтого цвета в виде пластинок и сростков из них (рис. 61).
Предел обнаружения — 5 мкг атропина в пробе.
Реакция с перманганатом калия на кокаин. К сухому остатку добавляют каплю 10% хлороводородной кислоты и выпаривают досуха, а затем наносят на остаток каплю 1% раствора перманганата калия Через 10-20 мин наблюдают появление красно-фиолетовых кристаллов в форме прямоугольных пластинок и сростков из них (рис 62)
Предел обнаружения — 4 мкг кокаина в исследуемой пробе


Реакция с платинохлороводородной кислотой на кокаин. К сухому остатку, полученному после выпаривания хлороформного экстракта, прибавляют каплю 0,1 М раствора хлороводородной кислоты и каплю 10% раствора платинохлороводородной кислоты Кокаин образует светло-желтые кристаллы, имеющие форму перистых дендритов (рис 63)
Предел обнаружения — 3,3 мкг кокаина в исследуемой пробе
Реакция со стифниновой кислотой на атропин. К сухому остатку, полученному после выпаривания хлороформного экстракта, прибавляют каплю 0,1 М раствора хлороводородной кислоты и каплю 5% раствора стифниновой кислоты Атропин образует характерные кристаллы из прямоугольных пластинок и сростки из них (рис 64)
Хроматография в тонком слое сорбента. На хроматографическую пластинку наносят извлечение из объекта и рядом по 7-10 мкг «стандартов» атропина, скополамина и кокаина Пластинку помещают в систему растворителей хлороформ — ацетон — диэтиламин в соотношении 50 30 2 После продвижения системы растворителей на 10 см выше стартовой линии пластинку вынимают, высушивают на воздухе и обрабатывают реактивом Драгендорфа, модифицированным по Мунье Кокаин, атропин и скополамин проявляются на пластинке в виде розово-бурых пятен со значениями Rf=0,64±0,01, 0,26±0,01 и 0,44±0,01 соответственно Окраска пятен и их положение на пластинке должны полностью совпадать с таковыми «стандартов»
ИК-спектроскопия. К остатку после испарения хлороформного экстракта из объекта или к нескольким мг исследуемого образца наркотического средства добавляют 1 каплю 25% раствора аммиака и 1 мл диэтилового эфира (или пентана) В агатовую ступку помещают порошок бромида калия и добавляют к нему эфирный экстракт. Затем смесь высушивают в сушильном шкафу при 50-60°С досуха. Остаток прессуют и используют для регистрации ИК-спектра, В ИК-спектре обнаруживают характерные волновые числа для атропина, скополамина или кокаина (табл. 48).
Полученные значения волновых чисел должны соответствовать стандартным образцам
Таблица 48. Волновые числа в ИК-спектре производных тропана н экгонина
|
Вещество |
Волновые числа ИК-спектра, см-1 |
|
Атропин |
1720, 1035, 1153 |
|
Скополамин |
1725, 1041, 1165, 1060 |
|
Кокаин |
1275, 1700, 1106, 1728, 710, 1040, 1280 |
Таблица 49. Хроматографические характеристики
|
Вещество |
Объем удерживания, мл |
Спектральные отношения S1/S210 |
||||||
|
220 |
230 |
240 |
250 |
260 |
280 |
300 |
||
|
Атропин |
1333 |
0,464 |
0,151 |
0,031 |
0,020 |
0,022 |
0,000 |
0,001 |
|
Кокаин |
1651 |
2,244 |
4,115 |
3,200 |
0,772 |
0,257 |
0,287 |
0,002 |
|
Бензоил — экгонин (метаболит) |
1327 |
2,215 |
3,973 |
3,061 |
0,761 |
0,245 |
0,269 |
0,002 |
Высокоэффективная жидкостная хроматография. Остаток после испарения хлороформного экстракта растворяют в подвижной фазе и вводят в хроматограф Анализ проводят по методике, описанной в разделе 8.3. Обнаружение атропина, кокаина и бензо- илэкгонина проводят по времени удерживания (объему удерживания) и по спектральным отношениям при нескольких длинах волн (табл. 49)
Полученные результаты сравнивают с данными по атласам ВЭЖХ-спектров и при совпадении параметров удерживания делают вывод об обнаружении определенного соединения
Газожидкостная хроматография. Для обнаружения производных тропана и экгонина предложена методика, описанная С.К.Ереминым при ГЖХ-скрининге веществ кислотного, нейтрального и слабоосновного характера из мочи (3% SE-30 на хромосорбе W-HP-80-100 меш). Идентификацию веществ ведут по времени удерживания или по индексам удерживания. В приведенных автором условиях индекс удерживания для атропина-2173, для кокаина — 2175. Полученные при анализе исследуемого объекта результаты должны совпадать с индексами удерживания в соответствии с приложением к данному хроматографу.
УФ-спектрофотометрия. Проводится после очистки извлечений (чаще всего с помощью ТСХ, раздел 6.4) Исследуемые вещества элюируют с пластинки с помощью 0,1 М раствора серной кислоты. В УФ-спектре в области 200-320 нм обнаруживают следующие максимумы светопоглощения: для атропина — 252, 258, 264 нм; для скополамина — 251, 257, 263 нм; для кокаина — 233, 275 нм.
Хроматомасс-спектральный анализ. Обнаружение проводится по времени удерживания и характеристическим ионам для каждого соединения. Время удерживания может колебаться в зависимости от условий опыта, поэтому перед каждым анализов проводят исследование растворов стандартных веществ. Например, по методикам и на оборудовании фирмы «Хьюлетт Паккард» для кокаина характеристические ионы при ГХ/МС 303, 272, 181 m/z. При анализе волос и ногтей данным методом можно надежно выявить кокаин на уровне 0,5 нг/мг.
Фармакологические пробы на животных. Атропин, скополамин и кокаин способны расширить зрачок при закапывании в глаз животных. Извлечение из объекта, после очистки и переведения оснований алкалоидов в соли, закапывают в один глаз кошки (второй глаз является контрольным) Через 20-60 мин наблюдают расширение зрачка, особенно при ярком освещении (см. раздел 7 2.6, рис. 21). Это исследование имеет подтверждающее значение.
Анализ изъятых частей растений из содержимого желудка. При обнаружении в содержимом желудка частей растений (корешки, частички листьев, стеблей) их исследуют методом фармакогностического анализа с использованием микроскопии по соответствующим методикам Под микроскопом обнаруживают характерные признаки для каждого вида растений, содержащих тропановые алкалоиды (как пример — см. раздел 7 2 7, рис 26) Этот вид анализа для данной группы соединений является подтверждающим при построении заключения об обнаружении в исследуемом объекте производных тропана
Анализ трупного материала на кокаин
Кокаин можно обнаружить в трупном материале только при приеме значительных количеств вещества и в том случае, когда исследование проводится вскоре после смерти По данным некоторых авторов, им удавалось обнаружить кокаин спустя 14 дней (но не более) после гибели организма. Это связано с тем, что кокаин в организме легко гидролизуется В результате гидролиза образуется бензоилэкгонин, который под влиянием ферментов печени переходит в экгонин и бензойную кислоту
При изолировании алкалоидов объекты подкисляют щавелевой или серной кислотами до рН=2-3. В этих условиях экгонин существует в форме цвиттер-иона. Последующее под- щелачивание на второй фазе изолирования раствором аммиака перед экстракцией хлороформом до рН=8-10 приводит к образованию аммонийной соли по карбоксильной группе Соли экгонина нерастворимы в хлороформе, поэтому в процессе экстракции они не извлекаются ни при рН=2-3, ни при рН=8-10. Это позволяет отделить алкалоид от продуктов деструкции.
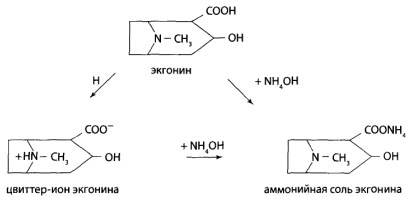
Для изолирования экгонина перед проведением экстракции его переводят в метиловый эфир, экстрагируют его хлороформом и проводят исследование.


Для обнаружения экгонина используют микрокристаллическую реакцию.
Реакция с фосфорно-молибденовой кислотой. При добавлении к остатку, полученному после испарения хлороформного экстракта, раствора фосфорно-молибденовой кислоты Н7[Р (Мо2О7)6] · nH2O образуются сферические сростки из желто-зеленых призматических кристаллов (рис. 65).
Предел обнаружения — 0,05 мг экгонина в исследуемой пробе.
Количественное определение
Для количественного определения атропина, скополамина и кокаина используют ВЭЖХ, ГЖХ, ГХ/МС. При больших количествах может быть использован один из фотометрических методов.
Метод ВЭЖХ проводится в условиях, описанных ранее. Используют метод добавок, методы внутреннего и внешнего стандарта. В качестве внутреннего стандарт применяют их изомеры или гомологи. Расчет концентрации атропина, кокаина проводят по формулам, приведенным в разделе 8.1.
Метод ГЖХ проводится в условиях, описанных ранее в разделе 7.1.6.1. Расчет концентрации атропина, скополамина или кокаина проводят по высоте или площади полученных пиков на хроматограмме исследуемого вещества и внутреннего стандарта с использованием калибровочных графиков.
Метод ГХ/МС. В качестве внутренних стандартов используют аналоги, меченные изотопами, и расчеты ведут по отношению m/z анализируемого вещества к ш/z стандарта по калибровочным графикам.
8.11. Производные пиридина и пиперидина
В этой группе веществ, имеющих токсикологическое значение, наряду с двумя лекарственными веществами, будет рассмотрен природный алкалоид никотин, который не имеет особого медицинского значения. Формулы веществ приведены ниже.
Пахикарпин является правовращающим изомером, [λ]д = +17°.
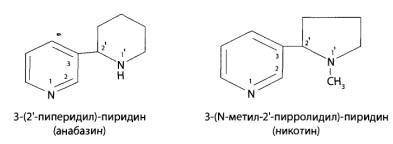
Медицинское применение
Анабазин применяется в виде гидрохлорида. В малых дозах анабазина гидрохлорид предложен в качестве средства, облегчающего отвыкание от курения. Выпускается в таблетках по 0,003 г, которые рекомендуют принимать по одной таблетке 8 раз в день.
Пахикарпин применяют в виде гидрохлорида, главным образом при спазмах периферических сосудов. Одной из важных особенностей пахикарпина является его способность повышать тонус и усиливать сокращение мускулатуры матки. При облитери- рующем эндартериите применяют по 0,05-0,1 г 2-3 раза в день. В случае применения пахикарпина для стимулирования родовой деятельности применяют внутримышечно или подкожно по 2—4 мл 3% раствора. Выпускают в таблетках по 0,1 г и 3% раствор в ампулах по 2 мл.
Никотин в медицинской практике не используется, но иногда находит применение в сельском хозяйстве в виде различных препаратов.
Токсикологическое значение
Раствор анабазина сульфата (40%) используют для опрыскивания растений (виноградники, лесные, плодово-ягодные, овощные, бобовые культуры), а также для борьбы с вшивостью и стригучим лишаем у животных. Анабазин способен сохранять токсическое действие длительное время (до 16 лет).
Анабазин токсичен для теплокровных животных и человека. Он относится к соединениям н-холиномиметического действия. Он поражает центральную и вегетативную нервную системы, сначала возбуждает, затем парализует. При попадании анабазина per os возникают головные боли, одышка, понос, желтуха, выпадение волос, тахикардия, расстройство слуха. Затем — потеря сознания, судороги и остановка дыхания. Известны случаи смертельного отравления анабазином при всасывании его через неповрежденную кожу. Патологоанатомическая картина отравления анабазином нехарактерна.
Пахикарпин — алкалоид, содержащийся в софоре толстоплодной (Sophora pachycarpa). Пахикарпин легко всасывается из кишечника. В токсических дозах блокирует передачу импульсов в вегетативных узлах и нервно-мышечную передачу на уровне синапсов поперечно-полосатой мускулатуры. Признаки отравления проявляются через 0,5-3 ч: слабость, головокружение, тошнота, рвота, боли в нижней части живота, помрачение сознания, похолодание рук и ног, ортостатический коллапс, тахикардия, клонико- тонические судороги, остановка дыхания и сердечной деятельности. Смерть наступает через 2-10 ч. Смертельная доза — 1-2 г. Известны случаи использования пахикарпина при проведении криминальных абортов. Патолого-морфологическая картина неспецифична. На вскрытии обнаруживают неравномерное полнокровие внутренних органов, признаки асфиксии, дистрофические изменения в миокарде, печени, почках.
Никотин — алкалоид, содержащийся в листьях табака (Nicotiana tabacum). В различных сортах табака никотин содержится в количестве от 0,3 до 7%.
Никотин стимулирует центральные и периферические н-холинреактивные системы организма. При курении быстро всасывается и оказывает ряд н-холинстимулирующих эффектов, способствующих привыканию к курению табака. Табакокурение человечеству известно давно. В России оно получило распространение в конце XVII — начале XVIII века. В настоящее время сотни миллионов людей подвержены этому виду токсикомании. В табачном дыме содержится до 2% оксида углерода (II), пиридин, производные фенола, а также канцерогенные соединения и смолы. Число больных с раковыми и предраковыми состояниями среди курильщиков в 20 раз больше по сравнению с остальным населением. В среднем количество никотина в папиросе — 4-7 мг. В дыхательные пути попадает 2 -3 мг и всасывается при курении ~1 мг никотина, который оказывает заметное пагубное воздействие на центральную нервную, периферическую системы и сосуды сердца. Мотивом к началу курения у подростков является подражание. Обычно первые затяжки сопровождаются неприятными ощущениями, исчезновение которых считают началом никотиновой токсикомании. Очень быстро у курящих возникает толерантность и курение доходит до 1-2 пачек сигарет в день. Отмечено появление психической зависимости, физическая зависимость выражена слабо. Абстинентный синдром сопровождается нарушением сна, изменением настроения с преобладанием вспыльчивости, раздражительности, потливости, тахикардией, кашлем. Явления абстиненции проходят в течение 3-7 дней, а психическая зависимость сохраняется долгое время (несколько месяцев).
При длительном воздействии никотина курильщики испытывают неприятные ощущения в области сердца, боли в надчревной области. У них возникает бронхит, склонность к простудным заболеваниям, повышается предрасположенность к раку легких, развитию склероза сосудов сердца, головного мозга, инфаркта миокарда. За счет попадания слюны со следами никотина в желудок возникают изжога, гастриты, язвы, боли. Все это значительно сокращает продолжительность жизни.
В 1970 г. ВОЗ обратилась к национальным органам здравоохранения с призывом более активно вести борьбу с табакокурением. Это обращение поддержали большинство государств, в том числе и Россия. Во многих странах реклама табачных изделий и курение в общественных местах запрещены, на пачках с сигаретами указывают вредные последствия курения. В результате таких мер в мире значительно снизилось число курящих
Никотин в виде основания хорошо всасывается через слизистые оболочки и кожу. Он является одним из самых ядовитых растительных алкалоидов. Смертельные исходы возможны при попадании в организм для взрослых около 40-50 мг, для детей — 10 мг. При приеме токсических доз внутрь отмечают головокружение, головную боль, расстройство зрения и слуха, бледность лица, расширение зрачков, онемение кожных покровов, зуд кожи, повторную рвоту, понос, тахикардию, подергивание мышечных групп, переходящее в клонико-тонические судороги. Смерть наступает быстро, сердце останавливается в диастоле. На посмертном обследовании обнаруживают явления асфиксии, расширенные зрачки, цианоз лица и слизистых, признаки спазма бронхов. Никотин в органах сохраняется довольно долго. Хронические отравления отмечены на предприятиях при вдыхании воздуха, содержащего табачную и махорочную пыль при производстве и сушке табака.
Пути метаболизма
Из препаратов группы пиридина и пиперидина пути метаболизма приводятся на примере никотина.
В I фазе метаболизма никотин подвергается метилированию (атом азота в положении 1 пиридинового кольца), деметилированию у атома азота пироллидинового кольца (положение 1), окислению до котинина и с разрывом пироллидинового кольца и образованием карбоксильной группы.
Во II фазе метаболизма продуктов окисления образуются конъюгаты с глюкуроновой кислотой.
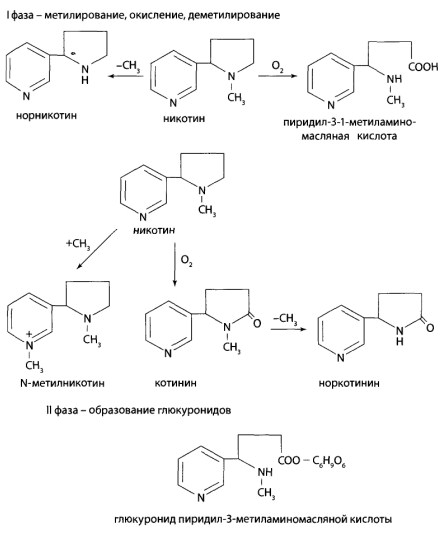
Физико-химические свойства. Основания анабазина, никотина и пахикарпина — бесцветные, маслянистые жидкости, растворимые в воде и в большинстве органических растворителей. С кислотами эти алкалоиды образуют соли, хорошо кристаллизующиеся и растворимые в воде. Основания анабазина, никотина и пахикарпина летучи. Они способны перегоняться с водяным паром (см. раздел 6.6.1)
Изолирование и анализ
При целенаправленном анализе используют метод перегонки с водяным паром (см. раздел 6.6.1). При ненаправленном анализе изолирование проводят общими методами (Стаса-Отто, Васильевой). Никотин, анабазин и пахикарпин экстрагируются в виде оснований хлороформом из водных вытяжек, имеющих рН=8-10. При проведении ТСХ-скрининга (см. раздел 7.1.2) никотин, анабазин и пахикарпин обнаруживаются на хроматографических пластинках в виде оранжевых пятен при обработке реактивом Драгендорфа.
С общеалкалоидными, осадительными реактивами алкалоиды, производные пиридина и пиперидина образуют аморфные или кристаллические осадки.
При проведении аналитического скрининга используют реакции с ванилином или пероксидом водорода.
Реакция с ванилином. К раствору остатка, после испарения хлороформного экстракта из щелочного раствора, добавляют кристаллик ванилина и 1-2 капли концентрированной хлороводородной кислоты. При наличии в остатке анабазина или никотина наблюдают появление красной или вишнево-красной окраски.
Реакция с пероксидом водорода. К раствору остатка, после испарения хлороформного экстракта, добавляют 1 мл пероксида водорода и 2-3 капли концентрированной серной кислоты. При наличии в остатке анабазина или никотина появляется красное или шоколадно-коричневое окрашивание.
Для обнаружения индивидуальных веществ используют хроматографию в тонком слое сорбента, микрокристаллоскопические и цветные реакции, УФ-спектрофотометрию и фармакологические испытания.
Обнаружение анабазина и никотина
Реакция с реактивом Драгендорфа. На предметное стекло наносят несколько капель хлороформного экстракта из объекта и выпаривают досуха. К сухому остатку прибавляют каплю 0,1 М раствора хлороводородной кислоты и каплю реактива Драгендорфа. Предметное стекло выдерживают во влажной камере в течение 20-30 мин. Появляется осадок оранжевого цвета и под микроскопом (рис. 66) сростки, состоящие из оранжевокрасных кристаллов с остроконечными концами (анабазин) или сростки кристаллов, напоминающих по виду летящих птиц, букву К или X (никотин).
Эту реакцию некоторые авторы предлагают выполнять, используя летучесть никотина (Ю.А.Горный). Остаток после удаления хлороформного экстракта из щелочного раствора переносят в тигель и закрывают стеклом с висячей каплей реактива Драгендорфа. Тигель подогревают. Основание никотина за счет летучести взаимодействует с реактивом Драгендорфа. Наблюдают кристаллы в виде сростков, напоминающих букву X или летящих птиц (рис. 66А).
Кристаллы с реактивом Драгендорфа образуют другие азотсодержащие вещества. Йодвисмутат анабазина отличается по форме от кристаллов других веществ. Предел обнаружения анабазина по реакции с реактивом Драгендорфа — 1 мкг препарата в исследуемой пробе.
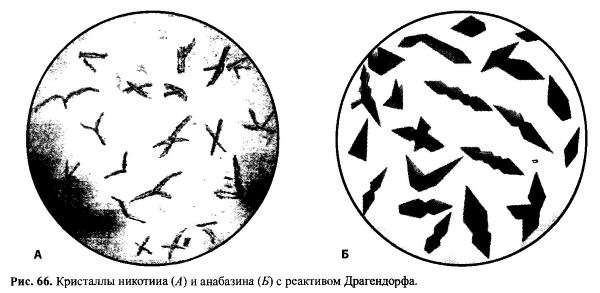

Реакция с солью Рейнеке. На предметное стекло наносят часть хлороформного экстракта из объекта и испаряют досуха. К сухому остатку добавляют каплю 0,1 М раствора хлороводородной кислоты и каплю 1% раствора соли Рейнеке. Через несколько минут под микроскопом наблюдают сростки, состоящие из мелких игольчатых кристаллов (анабазин) или сростков призматических кристаллов (никотин, рис. 67). Реакция неспецифична.
Реакция с золотохлороводородной кислотой на анабазин. На предметном стекле испаряют несколько капель хлороформного экстракта из объекта, остаток растворяют в капле 0,1 М раствора хлороводородной кислоты и прибавляют каплю золотохлороводородной кислоты. Через несколько минут наблюдают образование призматических кристаллов, собранных в сростки (рис. 68).
Реакция с пикриновой кислотой. К нескольким каплям раствора остатка после испарения хлороформного экстракта прибавляют 2 капли насыщенного раствора пикриновой кислоты. Наблюдают образование желтого кристаллического осадка (анабазин) и сростки кристаллов из тонких игл (никотин) (рис. 69). Реакция неспецифична.
Хроматография никотина и анабазина в тонком слое сорбента. Для обнаружения анабазина и никотина с помощью ТСХ рекомендованы Е.А.Грязновой пластинки со слоем силикагеля, импрегнированного 0,5 М раствором гидроксида калия и система растворителей хлороформ — этанол (9:1). На пластинку наносят извлечение из объекта и растворы стандартных веществ (анабазина и никотина). После проявления в системе растворителей и высушивания пятна на пластинке обнаруживают путем опрыскивания реактивом Драгендорфа. Цвет пятен и значения величин Rf (для анабазина 0,58±0,02, для никотина 0,76±0,02) должны совпадать с таковыми «стандартов».
УФ-спектрофотометрия для обнаружения анабазина и никотина. Методика обнаружения предложена Е.А.Грязновой. Для очистки извлечений рекомендуется использовать ТСХ. Анабазин и никотин с пластинок элюируют дважды хлороформом и затем проводят реэкстракцию оснований алкалоидов из элюатов 0,5 М раствором хлороводородной кислоты. Такой вариант очистки извлечений позволяет получить достаточно чистые реэкстракты (фоновое поглощение составляло 0,03-0,05) и четко обнаружить хорошо выраженные максимумы светопоглощения при 256 нм (анабазин) и 260 нм (никотин).
Фармакологическое испытание на никотин. На спинку лягушки наносят очищенное с помощью ТСХ извлечение из объекта. Лягушка через 30-60 мин принимает характерную позу (см. раздел 7.2.6, рис. 22). Используется как подтверждающая проба.
Обнаружение пахикарпина
Реакция с реактивом Бушарда. На предметное стекло наносят несколько капель хлороформного экстракта из раствора с рН=8-10 и выпаривают досуха. Сухой остаток растворяют в 1-2 каплях 0,1 М раствора хлороводородной кислоты и добавляют 1-2 капли реактива Бушарда. Через 5-10 мин под микроскопом наблюдают сростки из золотистозеленых кристаллов (см. рис. 70).
Реакция с тиоцианатом кобальта. На предметное стекло наносят несколько капель хлороформного экстракта из раствора с рН=8-10 и выпаривают досуха. К сухому остатку добавляют 1-2 капли 0,1 М раствора хлороводородной кислоты и 1-2 капли реактива- тиоцианата кобальта. Через несколько минут наблюдают образование голубых кристаллов в виде дендритов (рис. 71).
Предел обнаружения составляет 1,5 мкг пахикарпина в исследуемой пробе.
Реакция с меднойодидной комплексной солью. При добавлении к сухому остатку раствора реактива образуются крупные пучки из желтых кристаллов.
Предел обнаружения — около 25 мкг пахикарпина в исследуемой пробе.
Реакция с пикриновой кислотой. При нанесении на сухой остаток, после испарения хлороформного экстракта из раствора с рН=8-10, капли 0,5% раствора пикриновой кислоты при наличии пахикарпина образуются сростки и призмы желто-зеленого цвета.
Открываемый минимум — 5 мкг пахикарпина в исследуемой пробе.
Реакция с золотохлороводородной кислотой и бромидом калия. К остатку на предметном стекле добавляют каплю реактива, состоящего из 5% раствора золотохлороводородной кислоты (НАuСl4), концентрированной хлороводородной кислоты и ацетона (1:1:1) и 3-4 кристаллика бромида калия. При наличии пахикарпина наблюдают образование красного осадка, состоящего из кристаллических сростков (рис. 72).
Предел обнаружения составляет 20 мкг пахикарпина в исследуемой пробе.

Хроматография в тонком слое сорбента. На хроматографическую пластинку со слоем силикагеля КСК наносят часть хлороформного экстракта и «стандарт» — раствор пахикарпина. Пластинку помещают в систему растворителей хлороформ — диэтиламин в соотношении 9:1. Пахикарпин на пластинке обнаруживают в виде оранжевого пятна после обработки реактивом Драгендорфа. Значение Rf пятен из экстракта и «стандарта» должны совпадать (0,74±0,02).
Количественное определение
Для количественного определения анабазина, никотина, пахикарпина предложены ВЭЖХ, фотоколориметрический и экстракционно-фотоколориметрический методы.
Метод высокоэффективной жидкостной хроматографии. Определение никотина и анабазина проводят после очистки извлечений, используя методы добавок, внутреннего и внешнего стандарта. Расчет количества алкалоидов в извлечении ведут по соответствующим формулам (см. раздел 8.1).
Фотоэлектроколориметрический метод определения анабазина. Часть хлороформного экстракта насыщают газообразным хлороводородом и выпаривают досуха. Сухой остаток растворяют в 1 мл воды, прибавляют 2 мл 1% раствора цианида калия (яд!) и 5 мл 1% водного раствора хлорамина Б. При этом образуется производное глута- конового альдегида.

Жидкость взбалтывают и через 5 мин прибавляют 10 мл 0,5% водного раствора барбитуровой кислоты. Образуется краситель, имеющий желто-оранжевую окраску.

Оптическую плотность окрашенного раствора определяют с помощью ФЭК-М с зеленым светофильтром в кювете 10 мм. Расчет количества анабазина проводят по калибровочному графику.
Экстракционно-фотоколориметрический метод определения никотина и анабазина (предложен Е.А.Грязновой). Остаток после испарения хлороформного экстракта из щелочного раствора растворяют в 9 мл универсального буферного раствора с рН=3,5, добавляют 5 мл 0,1% раствора бромфенолового синего и 10 мл хлороформа. Взбалтывают 3 раза, добавляя каждый раз по 10 мл хлороформа. Хлороформные экстракты, окрашенные в желтый цвет, объединяют и общий объем доводят хлороформом до 50 мл. Оптическую плотность измеряют с помощью фотоэлектроколориметра в кювете с толщиной слоя 10 мм с фиолетовым светофильтром. Расчет концентрации анабазина и никотина проводят по калибровочному графику.
Образующийся в реакции комплекс никотина (анабазина) с бромфеноловым синим можно представить следующей формулой:
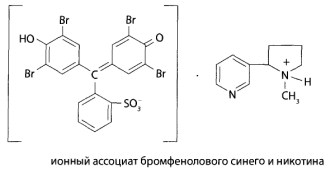
Основным веществом из группы производных хинолина, имеющим токсикологическое значение, является хинин.
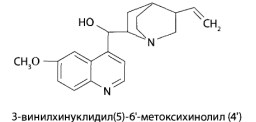
Источником получения алкалоидов производных хинолина является кора хинного дерева (виды Cinchona, семейство Rubiaceae), содержащая около 25 алкалоидов. Хинное дерево произрастает в Южной Америке и культивируется на острове Ява. Хинная кора используется как противомалярийное средство с начала XVII века. Основным алкалоидом хинной коры является хинин.
В медицинской практике находят применение соли хинина: хинина гидрохлорид, хинина дигидрохлорид, хинина сульфат. Эти соли содержат 72-82% хинина основания. Препараты хинина назначают как противомалярийные средства в дозе 1,0-2,0 г в сутки (хинина сульфат и хинина гидрохлорид) и по 1-2 мл 25-50% раствора хинина дигидрохлорида парентерально.
Токсикологическое значение. При попадании в организм хинин вызывает изменение состояния ЦНС и сердечно-сосудистой системы, мускулатуры матки. Соли хинина быстро всасываются из ЖКТ, выводятся с мочой и частично с калом.
Токсическое действие хинина проявляется в сильной головной боли, шуме в ушах, поносе, кожных высыпаниях, расстройстве слуха и зрения вплоть до полной слепоты за счет токсического действия на зрительный нерв. Вследствие перегрузки печеночных клеток желчным пигментом (непрямой билирубин), хинин вызывает гемолитический криз и желтуху, особенно у лиц с наследственной недостаточностью глюкозо- 6-фосфатдегидрогеназы в эритроцитах. Хинин обладает кардиотоксическим действием в дозе 2 г и более. Он вызывает замедление проводимости, экстрасистолию и коллаптоидное состояние.
Хинин стимулирует сокращение матки. В количестве 4-6 г и более он использовался для криминального прерывания беременности.
При остром отравлении хинином появляются симптомы расстройства функции желудочно-кишечного тракта, нарушение зрения, поражение сердечно-сосудистой системы. Смерть наступает за счет кардиотоксического действия или угнетения дыхания.
Патологоморфологическая картина при отравлении хинином неспецифична. Обычно отмечают признаки острой смерти с асфиксическими проявлениями: отек и набухание головного мозга, отек легких.
Пути метаболизма хинина
В первой фазе метаболизма проходят реакции окисления и гидроксилирования. Во второй фазе образуются глюкурониды с продуктами окисления хинина за счет карбоксильных групп (хинетин и гемохинная кислота) и гидроксильных групп.
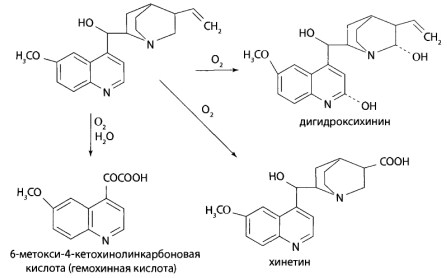
Объекты анализа:
- желудок, тонкий кишечник с содержимым;
- печень, почки;
- кровь, моча.
Физико-химические свойства. Основание хинина — это белый кристаллический порошок, горького вкуса, растворимый в этиловом спирте, хлороформе, диэтиловом эфире, малорастворим в воде. Соли хинина (сульфаты, хлориды) растворимы в этиловом спирте, хлороформе, воде, слабо в эфире.
Изолирование и анализ. Как вещество основного характера хинин экстрагируется хлороформом из растворов с рН=10-12.
При проведении ГЖХ-скрининга лекарственных и одурманивающих веществ в моче хинин обнаруживают по индексу удерживания, который в предлагаемых условиях (см. раздел 7.1.6.1) составляет 2809.
Таблица 50. Хроматографические характеристики хинина
|
Объем удерживания, мкл |
Спектральные отношения S1/S210 |
||||||
|
220 |
230 |
240 |
250 |
260 |
280 |
300 |
|
|
1343 |
0,600 |
0,391 |
0,591 |
0,944 |
0,332 |
0,046 |
0,1 |
При проведении ТСХ-скрининга хинин обнаруживается на хроматографической пластинке в виде светящихся пятен голубого цвета при обработке раствором серной кислоты и облучении УФ-лучами (см. раздел 7.1.2).
При испытании с помощью общеалкалоидных, осадительных реактивов хинин образует аморфные осадки со многими их них.
Для обнаружения хинина используют хроматографию в тонком слое сорбента, ВЭЖХ, ИК-спектроскопию, УФ-спектрофотометрию, химические реакции с образованием окрашенных соединений и микрокристаллоскопический метод.
Хроматография в тонком слое сорбента. Для обнаружения хинина с помощью ТСХ используют пластинки с закрепленным слоем силикагеля КСК, системы растворителей хлороформ — диоксан — ацетон — 25% раствор аммиака (45:47,5:5:2,5) или эфир — ацетон — 25% раствор аммиака (40:20:2). На линию старта хроматографической пластинки наносят несколько капель хлороформного экстракта из раствора с рН=10-12 и каплю раствора «стандарта» (0,01% раствор хинина в хлороформе). После того как система растворителей поднимется на высоту 10 см выше линии старта, пластинку вынимают, высушивают и опрыскивают 10% раствором серной кислоты. При просматривании обработанной пластинки в УФ-лучах отмечают светящиеся голубым светом пятна. Затем пластинку обрабатывают реактивом Драгендорфа. Места светящихся пятен окрашиваются в оранжевый цвет.
Rf хинина в 1-й системе растворителей равно 0,25±0,01, во 2-й системе — 0,39±0,01. Цвет пятен и значения R, должны быть одинаковыми у «стандарта» и извлечения из объекта.
Высокоэффективная жидкостная хроматография. Экстракты из щелочных растворов очищают с помощью ТСХ и хинин элюируют, используя подвижную фазу. Обнаружение хинина в элюатах проводят по времени (объему) удерживания и по спектральным отношениям при нескольких длинах волн (табл. 50).
ИК-спектроскопия. После очистки извлечения из объекта и испарения экстракта остаток растирают с бромидом калия, прессуют и регистрируют ИК-спектр. В спектре обнаруживают характерные для основания хинина пики с волновыми числами 1235, 1510, 1030 и 1619 см. Полученные значения должны совпадать с данными по анализу «стандарта» и с каталогом — атласом ИК-спектров для хинина.
УФ-спектрофотометрия. При наличии хинина в очищенном извлечении из объекта и при растворении его в этиловом спирте обнаруживают максимумы светопоглощения при 236, 278 и 332 нм, в 0,1 М растворе серной кислоты — при 250, 316 и 346 нм.
Реакция флуоресценции. Хлороформный экстракт из объекта выпаривают и остаток растворяют в 4—5 мл 0,1 М раствора серной кислоты. При облучении полученного раствора УФ-лучами наблюдают яркую голубую флуоресценцию, которая может менять цвет в зависимости от pH среды (см. раздел 7.2.4).
Реакция образования эритрохина. Часть хлороформного экстракта из раствора с рН=10-12 выпаривают досуха, прибавляют 1 мл воды очищенной, слабо подкисляют серной или уксусной кислотой, добавляют 1 каплю бромной воды и 1 каплю 10% гексацианоферрата (III) калия. После взбалтывания смесь подщелачивают 25°С, раствором аммиака — наблюдают розовое или красно-фиолетовое окрашивание.
При действии бромной воды хинин окисляется до 5,8-хинолинхинона, который при взаимодействии с неокисленным хинином образует эритрохин через 5 и 7 углеродные атомы. Эта реакция в 10 раз чувствительнее талейохинной, однако окраска быстро исчезает.
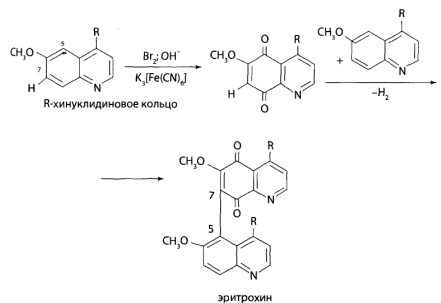
Реакция образования талейохина. Для ее выполнения часть хлороформного экстракта из объекта выпаривают досуха, остаток растворяют в воде очищенной и добавляют по каплям бромную воду до слабого желтого окрашивания. При добавлении к смеси нескольких капель аммиака появляется ярко-зеленая окраска.
Вначале происходит окисление и галогенирование хинолинового кольца. При этом образуется 5,5-дибром-6-оксохинолинпроизводное, которое в дальнейшем подвергается гидратации, изомеризации. В результате получается оксоноловый краситель зеленого цвета.
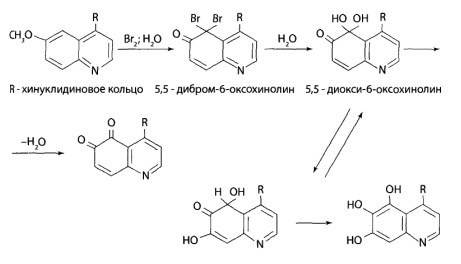

Реакция с тиоцианатом аммония. К сухому остатку после испарения хлороформного экстракта из раствора с рН=10-12 добавляют каплю реактива. Через несколько минут наблюдают образование крупных сростков и пучков из игольчатых кристаллов (рис. 73).
Количественное определение
Для количественного определения хинина в извлечениях из объекта используют ВЭЖХ и люминесцентный анализ.
Высокоэффективная жидкостная хроматография. Определение ведут после очистки извлечений из объекта и используют метод добавок, метод внутреннего стандарта и метод внешнего стандарта. Расчет количества хинина в объекте ведут по соответствующим формулам (см. раздел 8.1).
Люминесцентный анализ. Используют способность хинина флуоресцировать при облучении его сернокислых растворов УФ-лучами при длине волны 254 нм. Часть очищенного хлороформного экстракта выпаривают досуха, очищают с помощью ТСХ и хинин с пластинки элюируют 10% раствором серной кислоты. Интенсивность флуоресценции определяют с помощью флуориметра. Расчет концентрации хинина в объекге проводят, используя калибровочный график.
Оба метода количественного определения хинина отличаются высокой чувствительностью.
8.13. Производные п-аминобензойной кислоты
Производные п-аминобензойной кислоты составляют довольно большую группу лекарственных средств. Однако наиболее широкое применение в практике находят прокаин и прокаинамид. Этим и определяется их токсикологическое значение.
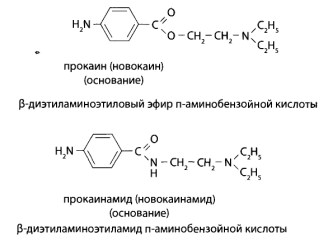
Прокаин относится к числу местноанестезирующих средств. Его применяют в медицинской практике для спинномозговой и инфильтрационной анестезии в виде 0,25- 0,5% водных растворов.
Прокаинамид — антиаритмическое средство. Он способен оказывать местноанестезирующее действие. В медицинской практике прокаинамид применяется при расстройствах сердечного ритма по 0,5-1,0 г внутрь или в вену по 5-10 мл 10% водного раствора.
Токсикологическое значение
Отравления прокаином и прокаинамидом связаны с их медицинским применением (передозировка, аллергические реакции).
Прокаин в токсических дозах вызывает возбуждение, а затем паралич ЦНС. Клиническая картина характеризуется нервно-психическими нарушениями (психомоторное возбуждение, клонико-тонические судороги, паралич поперечно-полосатой мускулатуры, потеря сознания); сердечно-сосудистыми расстройствами (снижение артериального давления, вплоть до коллапса); изменениями дыхания (снижение частоты и амплитуды). Эти явления связаны с усилением центрального стимулирующего действия вещества, его угнетающего влияния на вазомоторные и бульбарные центры. Появляются кожные сыпи, головокружение, диспепсические явления.
В метаболизме прокаина участвует фермент прокаинэстераза печени, при поражении которой время гидролиза увеличивается и возрастает токсичность прокаина.
Прокаинамид более стоек в организме, чем прокаин, и медленнее метаболизируется. При приеме больших доз прокаинамида возникает тошнота, рвота за счет раздражающего действия на слизистую оболочку желудка и двенадцатиперстной кишки, где обычно происходит полная резорбция вещества. Со стороны сердечно-сосудистой системы наблюдается снижение артериального давления. При аллергической реакции возникают кожные сыпи, отек кожи и слизистых оболочек, медимекаментозная лихорадка, явления бронхоспазма, психомоторное возбуждение.
Метаболизм производных п-аминобеизойной кислоты
Прокаин в организме человека в I фазе метаболизма гидролизуется по эфирной группировке. В результате образуются п-аминобензойная кислота и диэтиламиноэтанол. Во II фазе метаболизма образуется конъюгат с уксусной кислотой по аминогруппе.
Прокаин

Прокаинамид
Прокаинамид в I фазе метаболизма в организме человека подвергается деэтилирова- нию у атома азота алкильного радикала. При этом отщепляется одна или две этильных группы. Во II фазе метаболизма прокаинамид и его деэтильные производные образуют конъюгаты с уксусной кислото

Объекты анализа: печень; почки; моча; кровь.
Физико-химические свойства
Прокаин и прокаинамид выпускаются в виде гидрохлоридов. Прокаин — белый или бесцветный кристаллический порошок без запаха, горько-вяжущего вкуса. Прокаинамид — белый или белый с желтоватым или кремовым оттенком кристаллический порошок. Оба вещества хорошо растворимы в воде и спирте, в виде оснований растворимы в хлороформе и других органических растворителях.
Изолирование и определение
При изолировании из биологических объектов производные п-аминобензойной кислоты экстрагируются хлороформом из растворов с рН=8-10.
При проведении ГЖХ-скрининга прокаин обнаруживается по индексу удерживания, который равен 2022 (в условиях, описанных в разделе 7.1.6.1).
При проведении ТСХ-скрининга прокаин и прокаинамид на хроматографических пластинках образуют оранжевые пятна при обработке реактивом Драгендорфа (см. раздел 7.1.2).
При испытании с общеалкалоидными, осадительными реактивами прокаин и прокаинамид образуют осадки — аморфные и кристаллические.
Для обнаружения индивидуальных веществ используют ТСХ, ВЭЖХ, УФ-спек- трофотометрию, ИК-спектроскопию, химические реакции, протекающие с образованием характерного окрашивания или определенной формы кристаллов.
Хроматография в тонком слое сорбента проводится в частной системе растворителей в присутствии «стандартов» — растворов прокаина и прокаинамида. Используют хроматографические пластинки с тонким слоем силикагеля и систему растворителей циклогексан — бензол — диэтиламин (75:15:10). Для обнаружения исследуемых веществ пластинку обрабатывают реактивом Драгендорфа (в модификации Мунье). Оба вещества проявляются в виде пятен оранжевого цвета. Значение Rf и цвет пятен в извлечениях из объекта и «стандартов» должны полностью совпадать.
Высокоэффективная жидкостная хроматография проводится после очистки с помощью ТСХ по общепринятой методике. Для анализа используют условия, описанные ранее для лекарственных и наркотических веществ (см. раздел 8.3). Идентифицируют вещества по времени (объему) удерживания и по спектральным отношениям при нескольких длинах волн (табл. 51).
УФ-спектрофотометрия. Очищенные остатки, после испарения хлороформного экстракта из щелочного раствора, растворяют в воде или 0,2 М растворе серной кислоты. Спектры поглощения растворов прокаина в воде имеют максимум при 290 нм, прокаинамида — при 278 нм; в 0,2 М растворе серной кислоты прокаина — при 228, 272 и 279 нм, прокаинамида — при 224 нм.
ИК-спектроскопия. Очищенный хлороформный экстракт испаряют до сухого остатка, растирают с бромидом калия, прессуют в диск, который используют для регистрации ИК-спектра. Прокаин обнаруживает пики с волновыми числами 1274, 1690 и 1605 см-1.
Обнаружение прокаинамида по реакции с ванадатом аммония. К сухому остатку после испарения хлороформного экстракта из раствора с рН=8-10 добавляют 2-3 капли концентрированной серной кислоты и 0,01 г ванадата аммония. При нагревании смеси наблюдают вишнево-красное окрашивание при наличии в остатке прокаинамида.
Реакция прокаина с перманганатом калия. При добавлении к остатку, после испарения извлечения из объекта раствора перманганата калия, при наличии прокаина фиолетовая окраска исчезает.
Таблица 51. Хроматографические характеристики прокаина и прокаинамида
|
Вещество |
Объем удерживания, мкл |
Спектральные отношения S1/S210 |
||||||
|
220 |
230 |
240 |
250 |
260 |
280 |
300 |
||
|
Прокаин |
1021 |
1,542 |
1,351 |
0,491 |
0,398 |
0,877 |
2,341 |
2,599 |
|
Прокаинамид |
767 |
0,909 |
0,636 |
0,416 |
0,344 |
0,464 |
0,690 |
0,442 |
Обнаружение прокаина и прокаинамида по реакции образования азокрасителя.
Оба вещества содержат первичную ароматическую аминогруппу, за счет которой проходит реакция образования азокрасителя. К раствору остатка, после испарения хлороформного экстракта из щелочного раствора, добавляют 1% раствор хлороводородной кислоты, а затем по каплям прибавляют 1% раствор нитрита натрия до тех пор, пока не начнет окрашиваться в синий цвет йодкрахмальная бумажка. Через 5 мин жидкость подщелачивают 10% раствором гидроксида калия (натрия) до щелочной среды. К полученной смеси добавляют щелочной раствор р-нафтола. При наличии в извлечении прокаина или прокаинамида наблюдают образование красно-оранжевого окрашивания.

Реакция с реактивом Драгендорфа. При добавлении к сухому остатку капли 0,1 М раствора хлороводородной кислоты и капли реактива Драгендорфа образуется осадок, состоящий из характерных кристаллов. Прокаинамид образует кристаллы в виде прямоугольных пластинок светло-оранжевого цвета (рис. 74А), прокаин — сростки кристаллов оранжево-красного цвета (рис. 74Б).
Реакция прокаина с пикриновой кислотой. При добавлении к остатку капли 0,1 М раствора хлороводородной кислоты и 1-2 капель 0,5% раствора пикриновой кислоты при наличии в остатке прокаина образуются призматические кристаллы, которые при стоянии переходят в дендриты желто-зеленого цвета (рис. 75).Рис. 75. Кристаллы прокаина с пикриновой кислотой. Рис. 76. Кристаллы прокаина со стифниновой кислотой.


Реакция прокаина со стифниновой кислотой. При добавлении к сухому остатку капли 0,1 М раствора хлороводородной кислоты и 1-2 капель 5% раствора стифниновой кислоты при наличии в остатке прокаина через 15-20 мин образуются призматические кристаллы с точечным центром кристаллизации (рис. 76).
Количественное определение
Для количественного определения прокаина и прокаинамида в извлечениях из объектов предложены ВЭЖХ и фотоколориметрический метод.
Фотоэлектроколориметрический метод основан на реакции образования азокрасителя. Оптическую плотность измеряют с помощью фотоэлектроколориметра ФЭК-56 в кювете с толщиной слоя 10 мм при зеленом светофильтре. Раствор сравнения — смесь реактивов. Расчет количества прокаина и прокаинамида в извлечении и в объекте исследования проводят по калибровочному графику.
Высокоэффективная жидкостная хроматография. Анализ проводят после очистки извлечений из объекта исследования. Используют метод добавок, метод внутреннего или внешнего стандарта. Расчет концентрации прокаина и прокаинамида проводят по соответствующим формулам (см. раздел 8.1).
