3.1. Доза (концентрация) ядовитого вещества
3.2. Виды, классификация, клинические стадии отравлений
3.3. Пути поступления ядов в организм
3.4. Всасывание ядовитых веществ
3.5. Распределение ядов в организме
3.6. Особенности токсического действия некоторых ядовитых веществ
3.1. Доза (концентрация) ядовитого вещества
Степень опасности ядов для организма человека (животных) определяется конкретными понятиями, характеризующими глубину токсического воздействия, вызывающего нарушения нормального физиологического состояния вплоть до гибели организма. Все степени токсического действия химических веществ на живой организм объединены в раздел «токсикометрия».
Основные параметры токсикометрии
LD50 (LD100) — среднесмертельная (смертельная) доза ядовитого вещества, вызывающая гибель 50 (100%) подопытных животных при определенном способе введения (внутрь, на кожу и т.д., кроме ингаляции) в течение 2 нед. последующего наблюдения. Выражается в мг/кг массы тела животного.
LC50 (LC100) — концентрация (доза) ядовитого вещества, вызывающая гибель 50 (100%) подопытных животных при ингаляционном воздействии. Выражается в мг на 1 м3 воздуха.
ОБУВ — ориентировочно безопасный уровень воздействия вещества. Выражается в мг на 1 м3 воздуха.
Таблица 1. Токсические и смертельные концентрации некоторых чужеродных соединений в плазме крови человека
|
Чужеродное соединение |
Концентрация, мкг/мл |
|
|
токсическая |
смертельная |
|
|
Аминазин |
0,8 — 2,0 |
3,0 — 12 |
|
Барбитал |
20,0 — 100,0 |
>100,0 |
|
Барбамил |
300,0 |
— |
|
Диазепам |
2,0 — 10,0 |
50,0 |
|
Кокаин |
5,2 |
— |
|
Кофеии |
— |
100,0 |
|
Морфии |
1,0 |
— |
|
Мышьяк |
1,0 |
15,0 |
|
Нитразепам |
0,2 |
— |
|
Оксазепам |
2,0 |
— |
|
Салицилаты |
150,0 — 300,0 |
500,0 |
|
Стрихнин |
2,0 |
9,0 — 12,0 |
|
Тиоридазии |
10,0 |
20,0 — 80,0 |
|
Фенобарбитал |
40,0 |
80,0 — 264,0 |
|
Хлороформ |
70,0 — 250,0 |
390,0 |
|
Хлоралгидрат |
100,0 |
250,0 |
|
Элениум |
5,5 |
20,0 |
|
Этаминал-натрий |
100,0 |
— |
LDmin — минимальная токсическая доза. Это наименьшее количество яда, способное вызвать картину острого отравления без смертельного исхода с возможными отдаленными последствиями интоксикации.
Токсическая опасность химического вещества характеризуется величиной зоны острого токсического действия: LD50/LDmin
Чем больше эта величина, тем безопаснее данное вещество.
В таблице 1 приведена концентрация в плазме крови некоторых ядовитых соединений.
3.2. Виды, классификация, клинические стадии отравлений
Комплекс патологических изменений, возникающих в организме под влиянием токсических веществ, называется отравлением или интоксикацией.
Виды отравлений
Острые отравления — это одномоментное поступление в организм токсической дозы вещества. Характеризуется острым началом и проявлением специфических симптомов отравления. Острые отравления могут заканчиваться смертельным исходом в течение нескольких минут (синильная кислота и ее соли), часов или суток.
Хронические отравления возможны при повторном воздействии (в течение длительного периода времени) малых доз кумулирующихся в организме ядовитых веществ, не вызывающих острых отравлений, но достаточных для поражения той или иной функции организма. Они характеризуются медленным течением и неясно выраженными симптомами.
Классификация отравлений
Случайные отравления, возникающие при использовании различных веществ лицами, которым может быть неизвестно их токсическое действие и последствия приема. Эти отравления могут быть при передозировке лекарственных средств и, особенно, содержащих сильнодействующие, наркотические и психотропные вещества. К подобным отравлениям можно отнести отравления алкогольными напитками, а также бытовые отравления и отравления при несчастных случаях на производстве.
Преднамеренные отравления происходят при использовании ядовитых веществ лицами, которые заранее знают последствия их применения. Такие отравления, как правило, преследуют криминальные цели: доведение жертвы до гибели или беспомощного состояния с целью насилия или грабежа. К преднамеренным отравлениям следует отнести и суицидальные отравления — истинные и демонстративные (симуляционные). Следует подчеркнуть, что к суицидальным отравлениям часто приводит алкоголизм. По статистике 40% суицидов дает алкогольное опьянение. Использование некоторых веществ может провоцировать алкогольный психоз (например, барбитураты на фоне хронического алкоголизма).
Производственные отравления, как правило, носят хронический характер. Они имеют место на предприятиях, где работники контактируют с ядовитыми веществами при отсутствии должной охраны труда и техники безопасности.
В токсикологии различают две клинические стадии отравления:
1. Токсикогенная стадия. В этот период токсический агент находится в организме в дозе, способной вызвать специфическое действие.
2. Соматогенная стадия. Она наступает после удаления или разрушения токсического агента в виде «следового» поражения структуры и функций различных органов и систем организма.
Токсикогенная стадия включает 2 фазы распределения ядовитого вещества — резорбцию (до достижения максимальной концентрации яда в крови) и элиминацию (до момента полного выведения яда и его метаболитов из организма). На этой стадии принимаются специальные меры по детоксикации и лечению отравлений. Соматогенная стадия предполагает симптоматическое лечение последствий отравления.
3.3. Пути поступления ядов в организм
Отравляющие вещества могут поступать в организм через желудочно-кишечный тракт, дыхательные пути, кожу, слизистые оболочки, плаценту, а также путем внутривенного, внутримышечного или подкожного введения.
Наибольшее судебно-медицинское значение имеет поступление ядов через рот. Этот путь проникновения ядов в организм является характерным для большинства пищевых и бытовых отравлений.
Через дыхательные пути проникают ядовитые соединения из окружающего воздуха в виде газов, паров, пыли. Это возможно при отравлении бытовым газом, оксидом углерода (II) и различными газообразными веществами в помещениях с плохой вентиляцией.
Через кожные покровы проникают растворимые в липидах вещества. Растворимые в воде яды через кожу могут проникать в незначительных количествах.
Отравления путем парентерального поступления ядов (путем инъекций под кожу, в мышцы, в вену) встречаются редко и характеризуются тем, что вещество, минуя пищеварительный канал, сразу поступает в кровь.
Через плаценту ядовитые вещества поступают от матери к плоду (например, этиловый спирт, лекарственные вещества, хлорсодержащие пестициды, соли тяжелых металлов и др.).
Помимо указанных путей, ядовитые вещества могут поступать в организм через слизистые оболочки глаз, носа, половых органов, прямой кишки, брюшины, плевры и др.
3.4. Всасывание ядовитых веществ
Всякое вещество, в том числе яд, для проявления биологического действия должно пройти через одну или несколько клеточных мембран. Из курса нормальной физиологии студентам известно, что клеточная мембрана обеспечивает проникновение в клетку и из нее молекул и ионов, необходимых для выполнения специфических функций клеток, избирательный транспорт ионов через мембрану для поддержания трансмембранного потенциала и специфических клеточных контактов.
Опуская многие вопросы, касающиеся функции мембран, мы должны остановиться на строении мембран, чтобы понять пути проникновения различных ядов в клетку.
Мембрана клетки — это эластичная структура толщиной 7-11 нм. Она состоит из липидов и белков. До 90% всех липидов составляют фосфолипиды, которые образуют двойной слой фосфолипидных молекул. Эти группы связаны с белковыми молекулами, частично погруженными в липидную мембрану. Липидный бислой представляет собой жидкокристаллическую структуру. Благодаря этому мембраны обладают некоторой подвижностью, что облегчает процессы транспорта через них.
Схема мембраны, постулированная в 1930-е годы Даусоном и Даниелли, представлена на рисунке 1.

Гидрофобная область состоит из двух слоев фосфолипидов. Наружная часть этой области представляет собой полярную головку, образованную за счет одной фосфорилированной гидроксильной группы глицерина. В свою очередь остаток фосфорной кислоты связан со спиртом холином. Неполярная часть образуется за счет остатков жирных кислот, связанных с двумя оксигруппами глицерина. Снаружи фосфолипидная гидрофобная часть мембраны покрыта мукополисахаридами, мукопротеинами или полипептидной цепочкой. Такое представление и в настоящее время имеет основополагающее значение, хотя и не полностью отражает отдельные свойства мембран.
Валлахом и Цалером представлена мозаичная модель мембраны (рис. 2). Согласно этой модели предполагается, что протеины на полярных концах не образуют мономолекулярного слоя, а существуют в виде глобулярных протеиновых клубочков, которые насквозь пронизывают липидный слой или погружены в него.
Основными механизмами транспорта веществ через мембраны являются: пассивная диффузия, облегченная диффузия, активный транспорт, фильтрация и пиноцитоз.
Пассивная диффузия играет важную роль для транспорта веществ в клетку. Она обусловлена физическими закономерностями диффузии веществ, растворимых в липидах и воде. Особенностью этого механизма является то, что транспорт осуществляется только в сторону низкой концентрации и следует до достижения равновесия по обе стороны мембраны. Перенос вещества зависит от градиента концентрации между наружной и внутренней сторонами мембраны. Закон Фика описывает этот процесс следующим уравнением:
q = A/d · D (Ca-Ci),
где q — скорость диффузии; А — площадь мембраны; d — толщина мембраны; D — коэффициент диффузии данного вещества; (Ca—Ci) — градиент концентрации.
Коэффициент диффузии, прежде всего, зависит от коэффициента распределения вещества между водой и липидами:
D = k · VK,
где k — константа диффузии; VK — коэффициент распределения.
Чем выше растворимость вещества в липидах, тем лучше вещество проникает через мембрану. К таким веществам относятся диэтиловый эфир, этиловый спирт, фенол, дихлорэтан, ацетон, четыреххлористый углерод, синильная кислота, некоторые газообразные соединения и др.
Большинство лекарственных веществ являются слабыми электролитами и могут находиться в организме в неионизированной и ионизированной форме. Соотношение этих форм зависит от величины константы ионизации и значения pH среды. Степень диффузии для таких веществ пропорциональна количеству неионизированной формы вещества. Ионизированная форма плохо диффундирует через мембрану.
Облегченная диффузия происходит с участием специфических переносчиков. Как и при пассивной диффузии, вещества транспортируются без расхода энергии по концентрационному градиенту, но скорость ее выше, чем при пассивной диффузии. Примером облегченной диффузии является транспорт витамина В12 с помощью специфического переносчика — гастромукопротеида.
Активный транспорт веществ через мембрану происходит против градиента концентраций и сопровождается затратой метаболитической энергии. С помощью активного транспорта осуществляется всасывание катионов натрия, калия, кальция, аминокислот, сердечных гликозидов, гормонов, витаминов и др. Активный транспорт наиболее часто осуществляется с помощью аденозинтрифосфатаз (АТФазы). В настоящее время достаточно хорошо изучены белковые каналы мембран, через которые происходит активный избирательный транспорт веществ.
Пиноцитоз — это транспорт веществ путем впячивания (инвагинации) поверхности мембраны с последующим образованием везикулы вокруг транспортируемого вещества. Образовавшиеся везикулы мигрируют сквозь мембрану в протоплазму клетки. Путем пиноцитоза через мембрану могут проходить многие крупные молекулы, в том числе пептиды, жирные кислоты и др.
Фильтрация веществ через поры мембран зависит от осмотического давления. Поры в мембране могут иметь небольшой диаметр (около 0,4 нм), поэтому через них возможен перенос некоторых неорганических ионов или небольших гидрофильных молекул (мочевина), а также воды.
Общая скорость всасывания зависит от морфологической структуры органа, в котором находится ядовитое вещество, от величины поверхности всасывания. Наибольшую поверхность всасывания имеет желудочно-кишечный тракт (за счет йикроворсинок) — около 120 м2. Поверхность легких составляет 90-100 м2. Поверхность кожи небольшая — около 1,6-1,8 м2. Это следует учитывать при определении скорости воздействия ядовитого вещества на организм человека. Всасывание отравляющих веществ через слизистую оболочку желудка зависит от многих причин: растворимости вещества в воде или жирах, степени воздействия на вещества желудочного сока, наполнения желудка пищей, характера желудочного содержимого и т.д. Лучше всего в желудке всасываются водо- и липидорастворимые вещества, находящиеся в жидком состоянии, хуже — твердые и малорастворимые соединения.
Кислая среда желудочного сока может изменять химическую структуру, а иногда и растворимость ядов. Прием отравляющего вещества натощак ускоряет процесс интоксикации. Пища и ее характер влияют на процесс всасывания яда. Например, молоко и молочные продукты препятствуют всасыванию солей тяжелых металлов, кислая реакция пищевых масс способствует всасыванию цианидов, дубильные вещества в чае связывают некоторые алкалоиды.
При всасывании в желудке и кишечнике яды проходят через печень, которая задерживает их и обезвреживает. Если барьерная функция печени хорошо выражена, многие яды проявляют себя как малотоксичные вещества.
Водорастворимые соединения при поступлении в прямую кишку (применение клизмы), при подкожном и внутривенном введении, через слизистые глаз, носа, половые органы, брюшину, плевру после всасывания сразу попадают в большой круг кровообращения, минуя печень. В этих случаях действие яда оказывается более быстрым и сильным. Некоторые отравляющие вещества (порошкообразные, газообразные, парообразные) попадают в организм через дыхательные пути и всасываются в легких. Слизистые дыхательных путей обладают значительной всасывающей способностью. Особенно быстро через них всасываются водорастворимые вещества, например, «летучие» яды. Иногда смерть может наступить до того, как концентрация яда в крови достигнет критических значений. В этом случае возможен смертельный исход уже после нескольких вдохов вследствие рефлекторной остановки дыхания и деятельности сердца.
3.5. Распределение ядов в организме
После всасывания ядовитое вещество разносится кровью по всем органам и тканям. Первоначально ядовитого вещества будет больше в тех тканях и органах, которые в большей степени снабжены кровеносными сосудами. Наибольшее количество яда в единицу времени поступает обычно в легкие, почки, печень, сердце, мозг.
Яды, по мере их всасывания в кровь, разносятся по всему организму и на первой стадии распределяются между межклеточной и внутриклеточной жидкостью. Для подавляющего большинства ядовитых веществ характерно неравномерное распределение в организме. Одни вещества проходят через эндотелий капилляров и неспособны проникать через другие биологические мембраны. Такие вещества остаются только в межклеточной жидкости. Другие свободно проходят через цитоплазматические оболочки и распределяются по всему организму. Основным результатом процессов распределения, с точки зрения клинической токсикологии, считается поступ ление ядовитых веществ к месту воздействия, в результате которого проявляется токсический эффект. Содержание токсического вещества в определенной ткани зависит от его количества, поступившего из крови в ткань и из ткани в кровь. Большую роль играет соотношение скорости кровотока и скорости диффузии веществ в ткани.
В крови часть токсических веществ может связаться с белками. В таком состоянии яд плохо проникает через биологические мембраны и не участвует в формировании токсического процесса. Однако по мере снижения концентрации яда в крови и тканях такие комплексы расщепляются, при этом поддерживается равновесие концентрации свободного яда и его комплекса с белками. Это равновесие может сдвигаться в ту или другую сторону в зависимости от интенсивности всасывания яда, метаболических его превращений, дезинтоксикации, выделения из организма.
При обезвоживании организма токсичность яда усиливается за счет увеличения концентрации его в межклеточной жидкости и резкого сокращения «белковогорезерва».
В дальнейшем токсические вещества в различных органах и тканях распределяются неравномерно. Это зависит от их структуры, растворимости в воде, липидах, ионизации, а также функциональных особенностей органов и тканей.
В жировой ткани депонируются жирорастворимые яды (органические растворители, алкилгалогениды, хлорсодержащие пестициды и др.). В костной ткани способны откладываться свинец, барий, фтор и др. В коже накапливаются золото, свинец, серебро. Элементы висмут, ртуть, мышьяк накапливаются в органах и тканях, богатых белками, содержащими сульфгидрильные и другие функциональные группы. Ртуть накапливается в почках и вызывает в них некротические изменения.
Место локализации некоторых токсических веществ зависит от характера отравления. Например, при остром отравлении ядовитые вещества накапливаются в печени и почках, а при хроническом — в ногтях, костях, нервной ткани, волосах. Многие наркотические вещества накапливаются в ногтях, волосах, коже.
Знание распределения чужеродных соединений в организме человека особенно важно при выборе объектов для химико-токсикологического анализа.
З.6. Особенности токсического действия некоторых ядовитых веществ
Острые отравления рассматривают как химическую травму, развивающуюся вследствие попадания в организм токсической дозы чужеродного химического соединения.
Ядовитые вещества могут проявлять местное и резорбтивное действие на организм. Особенно опасны токсические соединения, которые вызывают необратимые поражения клеточных структур.
Ядовитые вещества, действующие местно
К числу таких веществ относятся «едкие яды», оказывающие раздражающее, прижигающее, некротизирующее и расплавляющее действие.
Местное действие является основным и определяющим во вредном воздействии ядовитого вещества и находится в прямой зависимости от его концентрации. Болевые ощущения, возникающие вследствие химического ожога, могут вызвать шок и быструю смерть. При затянувшемся отравлении проявляется общетоксическое, резорбтивное действие яда.
Сильными раздражающими свойствами обладают минеральные кислоты (серная, хлороводородная, азотная), едкие щелочи (гидроксиды калия, натрия, кальция, аммиак, оксид кальция), органические кислоты (уксусная, щавелевая), фенол, формальдегид, «металлические» яды и др.
У кислот степень токсического воздействия зависит от силы кислоты и ее концентрации. Водородные ионы способны обезводить ткани и вызвать свертывание белков с образованием кислых альбуминов, разрушить белок и привести к коагуляционному (сухому) некрозу. Серная и хлороводородная кислоты обуславливают выделение тканями большого количества тепла и «вспенивание» их. При этом гемоглобин расщепляется и образуются его дериваты: гематопорфирин, метгемоглобин, кислый гематин. Ткани приобретают темно-коричневый или буровато-черный цвет.
Возникает сильное раздражение, воспаление, ожог; ткани разрушаются, образуются плотноватые струпы и участки воспаления.
Щелочи — хорошо растворимы в воде. Они также оказывают разъедающий эффект и при всасывании могут вызывать расщепление биологически важных веществ в организме.
При действии щелочи на белок наблюдается его набухание, затем расплавление и разжижение. Образуются щелочные альбуминаты, которые хорошо растворимы в воде. Щелочи легко проникают в глубину тканей, образуя толстый слой влажного некроза.
Они растворяют эпителий, клетки мышц, нервной ткани и даже плотные ткани кожи, волос, ногтей.
Характерно, что кровь на поврежденных участках не свертывается, гемоглобин при этом превращается в щелочной гематин, придавая пораженным тканям зеленовато-бурый цвет.
Таким образом, щелочи вызывают при отравлении более тяжелые местные поражения по сравнению с кислотами. Однако их резорбтивное действие сравнительно невелико. В крови избыток ОН-ионов приводит к повышению щелочности крови и тканей. Нарушается клеточный метаболизм, поражается ЦНС и ослабляется сердечная деятельность. В резорбтивном действии щелочей определяющую роль играют катионы (особенно калий, аммоний), влияющие на сердечную мышцу.
Органические кислоты жирного ряда (кроме НСООН) — слабые кислоты. Их натриевые и калиевые соли в водных растворах за счет гидролиза дают щелочную реакцию. Органические кислоты ароматического ряда более сильные. Местное действие проявляется в разрушающем действии на ткани в результате необратимых изменений в состоянии коллоидов. Такое действие обусловлено водородными ионами, образующимися при диссоциации кислот. В действии большинства органических кислот преобладающим является резорбтивное, а не местное действие.
В качестве примера можно привести уксусную кислоту. Ее местное действие выражено в меньшей степени по сравнению с неорганическими кислотами и щелочами. На месте действия уксусной кислоты образуется поверхностный струп, который препятствует ее более глубокому проникновению. В результате даже высокие концентрации уксусной кислоты в основном оказывают поверхностное действие и практически не вызывают прободений.
Фенол (карболовая кислота) относится к нервно-протоплазматическим ядам. При соприкосновении с тканями фенол сворачивает белок, обезвоживает и образует сухой струп беловатого цвета. Концентрированные растворы фенола способны разъедать кожные покровы, слабые концентрации вызывают более глубокие поражения кожи. Наблюдается бледность кожных покровов, потеря чувствительности, появление признаков гангрены.
Формальдегид способен при местном действии на ткани быстро свертывать белки. При этом образуется хрупкий белый струп. Формальдегид фиксирует эритроциты. Некротизированные ткани не окрашиваются кровяным пигментом. Он оказывает также общетоксическое действие на центральную нервную систему и вызывает дистрофические изменения почек, печени, миокарда.
Местное действие «металлических» ядов на кожу, слизистые желудка, кишечника, носоглотки, легких основано на деструкции ткани, уплотнении, денатурации белка с образованием струпа. Степень деструктивного воздействия зависит от способности соединений металлов к диссоциации. Это заметно при сравнении местного воздействия солей сильных и слабых кислот (соли азотной, хлороводородной, серной кислот действуют сильнее по сравнению с солями уксусной, пропионовой кислот).
Действие ядовитых веществ на рецепторы
В настоящее время при характеристике резорбтивного действия ядовитого вещества на организм многие токсикологи придерживаются теории рецепторов токсичности. Эта теория является скорее попыткой общего и цельного объяснения механизма действия различных соединений. Согласно этой теории условием проявления биологического (токсического) действия веществ является связь молекулы вещества со специфическим для него местом на клеточной мембране или с соответствующей микроструктурой клетки, т.е. с рецептором.
В настоящее время пока не до конца описано, как выглядят рецепторы, каково их физическое и химическое строение, какие физико-химические силы играют роль в процессе связывания химического вещества с рецептором. Можно представить, что рецепторы как белково-липидные структуры являются фрагментами структуры энзимов либо иных соединений, имеющих активные группы, способные связывать химические вещества. Рецепторы имеют настолько специфические свойства, что их вид и пространственное строение активных групп позволяет образовывать ограниченный круг связей и реакций между рецептором и химическим веществом.
Типы возможных связей вещество-рецептор представлены в таблице 2.

Возникновение тех или иных связей зависит как от химической структуры вещества и рецептора, так и от фазы взаимодействия. На первой стадии взаимодействия возможно образование ионной связи, которая может путем химического взаимодействия перейти в ковалентную. Местом непосредственного взаимодействия могут быть остатки аминокислот, ферментов, гормонов.
Например, оксигруппа серина, входящая как составная часть в молекулу фермента ацетилхолинэстеразы (АХЭ), служит местом связи с рецептором для фосфорорганических пестицидов (хлорофос, параоксон и др.), которые фосфорилируют гидроксильную группу серина.
Кинетические исследования показали, что фосфорорганические соединения и фермент за счет ковалентных связей сначала образуют переходное соединение, которое распадается в результате фосфорилирования фермента. Характеристикой этого практически необратимого процесса служит константа фосфорилирования, которая известна для многих фосфорорганических соединений (ФОС) и АХЭ.
Аналогично ведут себя в организме производные карбаминовой кислоты (например, севин — системный инсектицид). Карбаматы вначале образуют соединения включения с ферментом, перенося группу R2NCO на гидроксильную группу серина, а затем его карбамоилируют.
Спонтанный процесс реактивации карбамоильных производных АХЭ идет гораздо быстрее, чем фосфорилированных, что объясняется неустойчивостью N-алкильной группы. Период полураспада карбаматов равен 15 мин, а фосфорсодержащих соединений — 8 ч. Поэтому восстановление организма, пострадавшего после отравления карбаматами, происходит быстрее, чем у ФОС.
В роли рецепторов токсичности могут выступать различные участки медиаторов и гормонов. Например, опиатным рецептором является участок гормона гипофиза р-липотрофина.
Местом первичного действия ядов являются отдельные аминогдислоты. Высокой способностью связывать «металлические» яды обладают две аминокислоты: гистидин и цистеин, которые способны образовывать хелатные комплексы. Сюда можно добавить цистин — эффективный специфически действующий агент, способный связывать медь.
Рецепторами часто выступают наиболее реакционноспособные функциональные группы органических соединений, такие как сульфгидрильные, гидроксильные, карбоксильные, которые играют важную роль в жизнеспособности клетки.
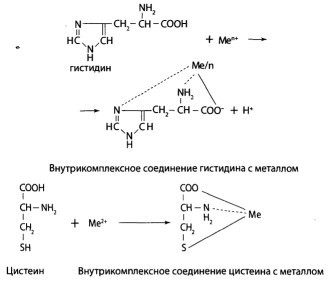
Так, с SH-группами белков и ферментов связаны физиология нервной деятельности, клеточное дыхание, мышечное сокращение, проницаемость клеточной оболочки, в частности, митохондрий, где происходит ряд важных обменных процессов.
Повреждение или инактивация SH-групп металлами ведет к серьезным расстройствам.
Известно более 100 ферментов, активность которых может тормозиться при блокировании в них SH-групп при отравлении металлами.
При этом образуются нерастворимые меркаптиды:
R-SH + Ме+ = R-S-Me + Н+ меркаптид
Это действие неспецифично и является общим для многих металлов (медь, серебро, золото, ртуть, мышьяк, сурьма и др.). Некоторые металлы (железо, таллий, молибден, ванадий и др.) легче соединяются с лигандами, которые содержат кислород. Большинству металлов свойственно специфическое угнетение определенных ферментов в малых концентрациях. Поэтому особенности общетоксического действия этими металлами выявляются при длительном контакте с ними.
Таким образом, по современным представлениям, любое химическое вещество, для того чтобы проявлять токсическое действие, должно обладать, по крайней мере, двумя независимыми признаками: сродством к рецептору и собственной физико-химической активностью. Исходя из этого, токсическое действие вещества пропорционально площади рецепторов, занятой молекулами этого вещества.
Максимальное токсическое действие яда проявляется тогда, когда минимальное количество его молекул способно связывать и выводить из строя наиболее жизненно важные клетки-мишени.Скорость образования комплекса яда с рецепторами, их устойчивость и способность к обратной диссоциации часто играют большую роль, чем степень насыщения ядом рецепторов.В токсическом действии многих веществ отсутствует строгая избирательность. Их вмешательство в жизненные процессы основано не только на специфическом химическом взаимодействии с определенными клеточными рецепторами, но и на взаимодействии с другими частями клетки.
Большинство известных в настоящее время токсических веществ взаимодействуют с рецептором за счет лабильных, легко разрушающихся связей — ионных, водородных, ван-дер-ваальсовых. Это дает возможность их успешного «отмывания» и удаления из организма. Современные методы детоксикации базируются на возможности разрушения комплекса «яд-рецептор».
