Глава 7. Антибиотики
7.1. Классификация антибиотиков
7.2. Производство антибиотиков
7.3. Частная технология антибиотиков
Антибиотики — специфические продукты жизнедеятельности различных микроорганизмов, низших и высших растений и животных или их модификаций, обладающие высокой физиологической активностью в отношении определённых групп микроорганизмов или злокачественных опухолей, избирательно задерживающие их рост и подавляющие развитие.
Образование антибиотиков — наследственно закреплённая особенность метаболизма организмов. Это проявляется в том, что каждый вид (или даже штамм) способен образовывать один или несколько определенных, строго специфичных для него антибиотических веществ. Вместе с тем одинаковые антибиотики могут образовываться несколькими видами организмов (это свидетельство того, что данные микроорганизмы имеют общего предка). Образование антибиотика обусловлено определённым характером обмена веществ, возникающим и закреплённым в процессе эволюции организма. Эволюционное значение антибиотиков подчёркивается тем, что в антибиотикообразование может быть включено около 1% генов продуцента (род Streptomyces) и эта часть ДНК, несмотря на энергетические затраты при её репликации, не теряется во время селекции в естественных условиях.
Образование антибиотиков — фактор биологический, имеющий адаптационное значение. Для продуцента способность образовывать антибиотики важна, не постоянно, а лишь в неблагоприятных условиях, например, при истощении среды питательными компонентами, при контакте со специфическими продуктами жизнедеятельности другого организма.
Формы взаимодействие между организмами весьма разнообразны — от мирного сожительства до явного антагонизма. Типы связей внутри микробиологических сообществ подразделяют на трофические и метаболические. Трофические связи характерны для метабиоза (последовательное использование субстрата), когда продуты жизнедеятельности одного микроорганизма, содержащие значительное количество энергии, потребляют другие виды микроорганизмов в качестве питательного материала. Метаболические связи выстраиваются, когда одни организмы могут потреблять отдельные продукты метаболизма других микроорганизмов или продукты метаболизма являются их ингибиторами.
Тип связи определяет специфику взаимодействия организмов. Симбиотические взаимоотношения характеризуются тем, что различные виды микроорганизмов создают для себя взаимовыгодные условия. Например, совместное развитие аэробных и анаэробных микроорганизмов: развиваясь в аэробных условиях, микробы поглощают кислород, создавая благоприятные условия для развития анаэробов. Паразитизм — форма взаимоотношений, при которой некоторые микробы развиваются за счет веществ клетки других организмов, например бактерии. Паразиты бывают внеклеточные: (риккетсии) и внутриклеточные (вирусы). Хищничество имеет место, когда некоторые микробы поглощают клетки организмов других видов, используя их в качестве источника питания (преимущественно продукты лизиса живых клеток других бактерий). К числу микроорганизмов-хищников относятся, главным образом, миксоформы (миксобактерии, миксоамебы, миксоммицеты). Антагонизм — это условия, при которых один вид микроорганизмов угнетает или полностью подавляет рост и развитие других видов. Явление антагонизма широко распространено среди бактерий, актиномицетов, грибов и других микроорганизмов. Образование антибиотических веществ — специфическая особенность вида иди даже штамма микроорганизмов, возникшая в результате их эволюционного развития как одна из приспособительных особенностей.
В естественных условиях четко ограниченных форм взаимоотношений не наблюдается. В процессе эволюции на разных этапах роста организмов и в зависимости от условий их развития один тип взаимодействия может смениться другим. Так, ряд бактерий ( E. coli, В. subtilis, В. cereus и др.) образуют фермент пенициллиназу, разрушающий пенициллин, выделяемый Penicillium notatum, Р. chrisogenum и мицелиальными грибами других видов.
Антибиотики — первые лекарственные средства, полученные биотехнологическим способом. С антибиотиками человечество сталкивается с древних времен. Уже. в Библии упоминается использование травы иссоп для лечения кожных заболеваний. Эта трава, как известно, поражается плесенью рода Penicillium и Aspergillus и может быть насыщена метаболитами грибов антибиотического характера.
Основные этапы развития производства антибиотиков
1870 г. — обнаружено, что в среде, содержащей плесень, бактерии не развиваются (Д. Сандерсон);
1872 г. — доказана способность Penicillium glaucum подавлять рост бактерий (Д. Листер);
1871-1872 гг. — показано, что молодая культура зеленой плесени — грибы рода Penicillium способна задерживать развитие возбудителей ряда кожных заболеваний человека (В.А. Манассеин, А.Г. Полотебнов);
1877 г. — опубликовано сообщение о подавлении роста Bacillus anthracis аэробными бактериями (Л. Пастер и С. Джеберт, А.Г. Лебединский);
1929 г. — обнаружены антибиотические свойства Грибов Penicillium (А. Флеминг);
1940 г. — выделена субстанция пенициллина (X. Флори, Е. Чейн);
1942-1956 гг. — коллектив ученых и практиков во главе с академиками Л.А. Зильбером и З.В. Ермольевой провели поиск и отбор штаммов-продуцентов; разработали ферментационные среды и первые регламенты промышленного производства бензилпенициллина. Сравнение двух штаммов (советского и английского) показало, что советский штамм образует 28 ед/мл, английский—20 ед/мл.
Открытие и изучение свойств нового антибиотика, применяемого в медицинской или сельскохозяйственной практике — это огромный труд ученых различных направлений (микробиологов, биохимиков, микологов, химиков, генетиков, фармакологов, биотехнологов, врачей). Со времени открытия пенициллина из разных микроорганизмов были выделены более 6006 антибиотиков, обладающих разной специфичностью и разным механизмом действия. Их широкое применение для лечения инфекционных заболеваний помогло сохранить миллионы жизней.
Основные причины быстрого роста числа антибиотиков:
— многие антибиотические вещества или продукты их модификации являются незаменимыми ЛП при инфекционных заболеваниях, ранее считавшихся неизлечимыми;
— изменилась этиологическая структура инфекционных заболеваний, возросло число видов бактерий, их индуцирующих; широкое распространение получили инфекции, вызываемые грамотрицательным инфекциями, оттеснив стафилококковые заболевания;
— как лечебные средства антибиотики применяют в животноводстве, птицеводстве, пчеловодстве, растениеводстве; отдельные антибиотики являются стимуляторами роста животных;
— проблема резистентности микроорганизмов предполагает замену одних антибиотиков другими, более эффективными; некоторые антибиотики применяют в качестве консервантов в пищевой промышленности;
— развитие химии природных соединений (изучение структуры, их модификация и синтез) способствует появлению новых знаний об антибиотиках;
— антибиотики используют при изучении отдельных сторон метаболизма организмов, расшифровке тонких молекулярных механизмов биосинтеза белка, механизма функционировании мембран, специфических ингибиторов ферментов, в первую очередь, инактивирующие антибиотики.
Подавляющее большинство основных антибиотиков было выделено из грамотрицательной почвенной бактерии Streptomyces, хотя, их продуцируют также грибы и другие грамположительные и грамотрицательные бактерии. Ежегодно во всем мире производится 100000 тонн антибиотиков на сумму около 5 млрд. долларов, в том числе более 10 млн. долларов приходится на долю антибиотиков, добавляемых в корм скоту в качестве пищевых добавок для ускорителей роста.
По оценкам ВОЗ каждый год ученые обнаруживают от 100 до 200 новых антибиотиков, прежде всего в рамках обширных исследовательских программ по поиску среди тысяч различных микроорганизмов таких, которые синтезировали бы уникальные антибиотики. Получение, лабораторные и клинические испытания новых лекарственных средств обходятся дорого, до применения доходят только те из них, которые имеют большую терапевтическую ценность и представляют экономический интерес; на их долю приходится 1-2% всех обнаруживаемых антибиотиков.
Образование антибиотиков — наследственно закреплённая особенность метаболизма микроорганизмов, проявляющаяся в том, что каждый вид (иди даже штамм) способен продуцировать один иди несколько определенных, строго специфичных для него антибиотических веществ, что обусловлено определённым характером обмена, возникающим и закреплённым в процессе эволюции микроорганизма. Метаболиты являются промежуточными продуктами обмена веществ, результатом катаболических и анаболических реакций; конечный, продукт обмена — антибиотики – синтезируются из первичных матаболитов.
Специфичность антибиотиков характеризуется:
— высокой биологической активностью в отношении чувствительных к ним организмов, т.е. способностью; проявлять эффект даже в очень низких концентрациях;
— избирательностью действия, т.е. способностью конкретного антибиотика проявлять свое действие лишь в отношении определенных организмов или групп организмов, не оказывая заметного эффекта на другие формы живых существ.
Величину биологической активности антибиотиков выражают в условных еднищах, содержащихся в 1 мл (ед/мл) или в 1 мг (ед/мл) препарата. 3а единицу антибиотической активности принято минимальное количество антибиотика, способное подавить развитие или задержать рост определенного числа клеток стандартного штамма тест-микроба в единице объема питательной среды. Так, за единицу активности пенициллина приято минимальное количество препарата, способное задерживать рост золотистого стафилококка (штамм 209) в 50 мл питательного бульона; для стрептомицина единица активности — минимальное количество антибиотика, задерживающее рост Е. coli в 1 мл питательного бульона.
Угнетение роста микроорганизмов антибиотиками может осуществляться только при наличии трех условий:
— биологически важная для жизнедеятельности бактерий система должна реагировать на воздействие низких концентраций препарата через определенную точку приложения;
— препараты должны обладать способностью проникать в бактериальную клетку и воздействовать на точку приложения;
— препарат не должен инактивироваться раньше, чем вступит во взаимодействие с биологически активной системой бактерий.
Точки приложения действия антибактериальных препаратов в бактериях различны — большая часть их находится в клеточной мембране и внутри клетки. Для достижения этих точек антибиотики сначала должны проникнуть через поверхностные слои клетки, находящиеся снаружи от цитоплазматической мембраны. Главным барьером на этом пути препарата является клеточная стенка. В клеточной стенке грамположительных бактерий содержится большое количество. мукопептидов, являющихся основной мишенью для антибиотиков. Клеточная стенка грамотрицательных бактерий содержит большое количество липидов, в силу чего она менее проницаема и является надежным барьером для многих антибактериальных средств. Это обстоятельство служит причиной поиска новых антибиотиков (полусинтетические пенициллины и цефалоспорины), которые обладают хорошей проникающей способностью через липополисахаридный слой грамотрицательных бактерий и имеют высокую активность против большинства из них.
7.1. Классификация антибиотиков
Сложилось несколько подходов к классификации антибиотиков:
— по принципу биологического происхождения (предпочтительна для биологов, изучающих организмы-предуценты антибиотических веществ);
— по химическому строению (удобна для химиков, занимающихся изучением строения молекул антибиотиков и путей из синтеза);
— по типу и механизму биологического действия (принята в медицинской практике).
Тип действия антибиотиков бывает цидным (бактерицидным, фунгицидным, вирицидным, протозоацидным), под ним понимают необратимое нарушение жизнедеятельности (гибель) инфекционного агента, и статическим (бактериостатическим, фунгистатическим, виристатическим, иротозоостатическим), при котором прекращается или приостанавливается размножение возбудителя. Такая градация имеет основное практическое значение при лечении тяжелых инфекций, особенно у пациентов с нарушениями иммунитета, когда обязательно назначение «цидных» препаратов.
Связь антимикробного препарата с точками приложения в микробной клетке может быть прочной или непрочной, что, в той или иной мере, определяет степень активности данного препарата. Антибиотики должны обладать высокой избирательной токсичностью, т.е. они должны быть активны по отношению к микробным клеткам и безвредны для клеток больного организма. Подобная избирательная токсичность может быть реализована лишь в том случае, если активные биохимические системы микробных клеток — мишени антибиотиков — отличны от подобных систем клеток макрооргамизма. Селективная токсичность может носить пограничный характер, когда отличия в биохимических структурах клеток организма человека и бактерии заключаются в различном положении фосфолипидов в цитоплазматической мембране. Проблема селективности антибиотиков сложнее по причине того, что для репликации вирусы используют ферменты клеток хозяина.
В зависимости от точки приложения и механизма биологического действия антибиотики делят на:
1. Специфические ингибиторы биосинтеза клеточной стенки (пенициллины, цефалоспорины и цефамицины, ванкомицин, ристомицин, циклосерии, бацитрацин, тиенамицины и др.)
2. Препараты, нарушающие молекулярную организацию и функции клеточных мембран (полимиксины, полиены).
3. Препараты, подавляющие синтез белка на уровне рибосом (макролиды, линкомицины, аминогликозиды, тетрациклины, левомицетин, фузидин).
4. Ингибиторы синтеза РНК на уровне РНК-полимеразы и ингибиторы, действующие на метаболизм фолиевой кислоты (рифампицины).
5. Ингибиторы синтеза РНК на уровне ДНК-матрицы (актиномицины, антибиотики группы ауреоловой кислоты).
6. Ингибиторы синтеза ДНК, на уровне ДНК-матрицы (митомицин С, антрациклины, нитрофураны, налидиксовая кислота).
При выделенном возбудителе назначают антибиотики с максимально узким спектром активности, так как «избыточная» широта спектра не дает преимуществ и опасна с точки зрения подавления нормальной микрофлоры.
Общая стратегия рекомбинантных микроорганизмов, способных синтезировать антибиотики, состоит во введении в организм хозяина специфических генов, клонированных в подходящем векторе, которые кодируют один иди несколько ферментов, катализирующих не свойственные микроорганизму метаболические реакции, или генов, влияющих на осуществляемый им в норме биосинтез определенных соединений.
При создании рекомбинантных штаммов Streptomyces — основного микроорганизма, используемого для получения антибиотиков, важно, чтобы трансформация и отбор трансформированных клеток не должны быть слишком сложны. В отличие от Е. coli, Streptomyces существуют не в виде изолированных клеток, а в виде протяженных мицелл, поэтому перед трансформацией необходимо ферментативное разрушение клеточной стенки мицелл и высвобождение отдельных протопластов. Без этого невозможно отличить трансформированные клетки от не трансформированных, поскольку видимые колонии на твердой среде будут образовываться из группы клеток, а не из индивидуальной клетки. Соответственно, колонии, растущие в присутствии селективного антибиотика, будут представлять собой смесь трансформированных и не трансформированных клеток. Проникновение плазмидной ДНК в протопласты Streptomyces облегчается в прсутствий ПЭГ. После трансформации протопласты высевают на твердую среду, чтобы образовалась клеточная стенка, а затем для отбора трансформированных клеток переносят на селективную среду, обычно содержащею неомицин, где образуется колония, выросшая из трансформированных клеток, способных синтезировать антибиотик.
С помощью генетических или биохимических экспериментов можно идентифицировать, затем выделить один или несколько ключевых ферментов биосинтеза антибиотиков, определить их N-концевые аминокислотные последовательности и, исхода из этих данных, синтезировать олигонуклеотидные комплементарные последовательности.
7.2. Производство антибиотиков
Технологический процесс производства антибиотиков представлен на рис. 20
Биосинтез антибиотика осуществляется микроорганизмами на определённом этапе их развития. Эта закономерность характерна для бактерий, мицелиальиых грибов (Penicillium chirysogenum, Aspergillus fumigatus и др.) и для большинства актиномицетов, образующих такие антибиотики, как стрептомицин, хлортетрациклин, окситетрациклин и другие. Максимально высокую активность штамма-продуцента способна обеспечить технология рекомбинантных ДНК, так как можно создавать новые антибиотики с уникальной структурой, оказывающие более мощное воздействие на определенные микроорганизмы, обладающие минимальными побочными эффектами. Генно-инженерные подходы используются для увеличения выхода антибиотиков и соответственно снижения стоимости их производства. Примеры промышленных продуцентов основных антибиотиков, используемые в РФ, представлены в табл. 3.
При проведении первой стадии технологического процесса (рис. 20) применяют натуральные среды неопределенного состава, к числу которых относят продукты крахмалопаточного производства, агар, желатин, отруби, зерно. Композиция натуральных сред неопределенного состава не является постоянной. Например, агар, получаемый из разных видов морских водорослей, по химическому составу — сложный эфирный комплекс полисахарида с серной кислотой и разнообразными микроэлементами. Агар содержит также жирные кислоты, биотин, тиамин или его компонентов.

Таблица 3. Промышленные продуценты антибиотиков
|
Антибиотик |
Продуцент |
|
Антибиотики, образуемые бактериями |
|
|
1. Грамицидин С |
Bacillus brevis |
|
2. Полимиксины |
Bacillus polymyха |
|
3. Бацитрацины |
Bacillus licheniformis и В. erevis |
|
4. Низин |
Streptococcus lactis |
|
Антибиотики, образуемые актиномицетами |
|
|
1. Стрептомицин |
Streptomyces griseus |
|
2. Неомицин |
Sircpiomyces fradiae |
|
3. Канамицин |
Streptomyces kanamyceticus |
|
4. Гентамицин |
Micronionospora purpurea |
|
5. Сизомицин |
Micronionospora inyoensis |
|
6. Тобрамицин |
Streptomyces tenebraris |
|
7. Хлортетрациклин |
Streptomyces aureofaciens |
|
8. Окситетрациклин |
Streptomyces rimosus |
|
9. Амфотерицин В |
Streptomyces noolosus |
|
10. Тетрациклин |
Streptomyces aureofaciens |
|
11. Хлорамфеникол |
Streptomyces venezuelae |
|
12. Эритромицин |
Saccharopolyspora erythraea |
|
13. Спирамицин |
Streptomyces armbofaciens |
|
14. Тилозин |
Streptomyces fradiae |
|
15. Нистатин |
Streptomyces noursei |
|
16. Леворин |
Streptomyces levoris |
|
Антибиотики, образуемые грибами |
|
|
1. Пенициллины |
Penicillium chrysogenum |
|
2. Цефалоспорин |
Cepholosporium acremonium |
|
3. Циклоспорин |
Trichoderma polysporum |
|
4. Гризеофульвин |
Penicillium griseofulvum |
|
5. Фузидин |
Fusidium coccineum |
В картофельной среде с глюкозой и пептоном, при одной и той, же партии пептона и химически чистой глюкозы, состав картофельного экстракта зависит от сорта картофеля, места его произрастания, времени уборки, срока и режима хранения и других причин. Поэтому для получения, сопоставимых результатов, особенно при изучении физиологических и биохимических особенностей микроорганизма, применяют синтетические среды, в состав которых входят определенные химически чистые соединения, взятые в точно указанных концентрациях.
Задача второй стадии — создать оптимальные условия для развития продуцента и максимально возможного биосинтеза необходимого антибиотика. Особенность производства антибиотиков — двухфазный характер развития продуцентов. В первой фазе развития культуры, носящей название тропофазы (фазы сбалансированного роста микроорганизма), идет интенсивное накопление биомассы продуцента. Продуцент синтезирует белки, нуклеиновые кислоты, углеводы, ферменты, и другие БАВ, необходимые для роста микроорганизма; наблюдается быстрое потребление основных компонентов субстрата, интенсивное поглощение кислорода. В культуральной среде может снижаться pH, как результат накопления органических кислот. В тропофазе антибиотик, как правило, не образуется или его количество незначительное. Возможно, в этой фазе синтез ферментов, принимающих участие в образовании антибиотика, подавлен. Во второй фазе — идиофазе (фазе несбалансированного роста микроорганизма) — накопление биомассы замедлено. Культуральная среда уже обеднена компонентами, необходимыми для развития продуцента и обогащена продуктами его жизнедеятельности. В культуре преобладают протеолитические процессы, приводящие к её подщелачиванию. Продукты метаболизма микроорганизма частично используются на построение клеток мицелия, частично — на синтез антибиотика. Максимум биосинтеза антибиотика в культуральной среде наступает, как правило, после максимального накопления биомассы, этот максимум неодинаков у разных микроорганизмов и при разных условиях культивирования.
Практика промышленной микробиологии показывает, что процесс получения того или иного продукта жизнедеятельности активнее идет в смешанных культурах, при совместном развитии нескольких видов (чаще двух) микроорганизмов. Совместным культивированием специально подобранных микроорганизмов создают условия, при которых значительно увеличивается образование антибиотиков, как результат активации ряда биохимических процессов. В смешанных культурах ферментативная реакция служит ответом на проявление определенных антагонистических взаимоотношений. При совместном культивировании различных микробов могут возникать своеобразные гибриды этих организмов, обладающие иными свойствами по сравнению с исходными чистыми культурами. С накоплением определенной концентрации антибиотика рост микроорганизмов прекращается (например, Streptomyces griseus прекращает свой рост при концентрации в среде стрептомицина сульфата 0,5%). Из культуральной среды антибиотики выделяют экстракцией органическими растворителями, осаждением, адсорбцией.
Очистку антибиотиков проводят повторной заменой растворителя, адсорбционно-хроматографическими методами, ВЭЖХ. От степени чистоты препарата, влажности, температура, pH растворителя зависит стабильность антибиотика. Затем оценивают антимикробный спектр, стерильность, токсичность, пирогенность, действие на лейкоциты крови и другие показатели. На всех стадиях получения антибиотика строю соблюдается технологическая дисциплина, все процессы осуществляются в асептических, условиях.
7.3. Частная технология антибиотиков
Пенициллины и цефалоспорины — большая группа лекарственных препаратов, имеющих определенное сродство химического строения, механизмы действия, фармакологических, клинических эффектов. Эти препараты называют β-лактамными антибиотиками, что обусловлено наличием в их структуре общего для всей группы четырехчленного лактамного кольца.
Все пенициллины имеют одинаковое строение основной группы, которая представлена тиазолидиноиым кольцом, соединенным с (1-лактамным кольцом, и имеющим аминогруппу — баминопеници лаповая кислота (6-АПК).
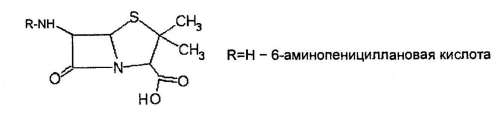
Различный пенициллины (G, X, F, К и др.) отличаются строением радикала молекулы боковой цепи (табл. 4) активностью и спектром действия. Важные, с точки зрения клинического использования, представители пенициллинов можно разделить на несколько групп:
— обладающие наивысшей активностью в отношении грамположительных микроорганизмов и слабой в отношении грамотрицательных видов, а также гидролизуемые β-лактамазам (пенициллин G);
— относительно резистентные к действию β-лактамаз стафилококков, но с более низкой активностью в отношении грамположительных микроорганизмов и не действующие на грамотрицательные (нафициллин, метациллин);
— относительно высокоактивные против грамположигельных и грамотрицательных микроорганизмов, но разрушаемых β-лактамазами (карбенициллин, тикарциллин);
— препараты с относительной кислотоустойчивостыо и пригодные для перорального применения (пенициллин V, ампициллин, клоксациллин).

Структурное единство ядра 6-АПК существенно для проявления биологической активности молекул. При ферментативном расщеплении β-лактамного кольца бактериальными β-лактамазами (пенициллиназами) с образованием неактивной пенициллановой кислоты антибиотик лишается своих антимикробных свойств. Задачей получения новых пенициллинов является разработка препаратов, устойчивых к β-лактамазам или со сниженной способностью к индукции синтеза β-лактамаз. Для предотвращения возникновения резистентных форм бактерий к β-лактамным антибиотикам получены липосомальные формы этих антибиотиков (защита антибиотика происходит в результате включения β-лактама в положительно заряженные липосомы).
Комплекс антибиотик- липосома обладает рядом преимуществ:
— снижается токсичность препарата за счет направленного транспорта;
— повышается проникновение антибиотиков через внешнюю мембрану грамотрицательных бактерий;
— антибиотик, включенный в липосомы, защищен от действия β-лактамоз;
— повышается химическая стабильность антибиотика для промышленного производства антибиотика используют культуру Penicillium chrysogenum и среду, содержащую кукурузный экстракт, гидрол, лактозу и минеральные соли.
Вместо кукурузного экстракта может быть применена арахисовая мука, жмыхи, мука из хлопковых семян и другие источники; возможность широкого использования продуктов растительного происхождения обусловлена тем, что у P. chrysogenum имеются сильные протеолитические ферменты. В качестве углеводов часто используют сахарозу или смесь лактозы с глюкозой в соотношении 1:1. Глюкоза может снижать биосинтез антибиотика; на средах, содержащих лактозу или сахарозу (в условиях депрессии), биосинтез антибиотика идёт активнее. Важную роль в процессе биосинтеза пенициллина играет сера, которая содержится в структуре антибиотика. В качестве источников серы используются натрия сульфат или натрия тиосульфат. Избыток ионов меди не влияет на рост гриба, но подавляет биосинтез пенициллина. Эффект торможения биосинтеза снимается добавлением в среду ионов железа. P. chrysogenum в качестве источника фосфора может использовать не только фосфаты, но и фитаты (соли инозитфосфорных кислот): этот продуцент содержит фермент, разрушающий фитин с освобождением неорганического фосфора.
Температура в период первой фазы, должна быть 30°С, во вторую фазу 20 °С, pH в период роста гриба — ниже 7,0, потребление углеводов должно быть медленным, что достигается использованием лактозы, либо дробным внесением глюкозы.
Синтез того или иного пенициллина зависит от наличия специфичного вещества в среда, иначе говоря, предшественника, который микроорганизм включает в молекулу антибиотика без предварительного расщепления. Следует отметить, что предшественники биосинтеза пенициллина (фенилуксусная кислота, фенилацетамид, феноксиуксусная кислота) при определённых концентрациях и pH среды оказывают токсическое влияние на продуцента. Фенилуксусная кислота наименее токсична. Добавление её в среду в концентрации выше 500 мкг/мл угнетает рост мицелия; особенно в первые 24 ч его развития. Фенилуксусная кислота добавляется в концентрации от 100 до 500 мкг/мл через 24 ч развития P. chrysogenum. При таких условиях обеспечивается наибольший выход бензилпенициллина, который через 72 ч развития может поступать 500-1000 мкг/мл.
При развитии гриба без внесения предшественника образуется около 45% бензилпенициллина (пенициллин G) и около 53% пенициллина К (радикал — n-гептилпенициллин). При добавлении к среде фенилуксусной кислоты (С6Н5СН2СООН) меняется соотношение образующихся компонентов в сторону резкого увеличения бензилпенициллина, количество которого в зависимости от возраста достигает 75-99% от смеси пенициллинов. В процессе культивирования P. chrysogenum в среде, не содержащей фенилуксусной кислоты, в ней накапливаются серосодержащие соединения не β-лактамного характера, близкие к цистеину и метионину. Добавление в среду фенилуксусной собствуетвует более интенсивному метаболизму серосодержащих компонентов в соединения β-лактамного характера.
При развитии продуцента пецициддииов — гриба P. chrysogenum — в кукурузно-лактозной среде выделяют три фазы:
Первая фаза — рост мицелия, выход антибиотика низок. Всегда присутствующая в кукурузном экстракте молочная кислота потребляется продуцентом с максимальной скоростью, лактоза используется медленно. Потребление кислорода высокое. Усиливается азотный обмен, в результате в среде появляется аммиак и резко поднимается значение pH.
Вторая фаза — максимальное образование пенициллина, это связано с быстрым потреблением лактозы и аммонийного азота. pH средя остаётся почти без изменений, увеличение массы мицелия незначительное, потребление кислорода снижается.
Третья фаза — снижение концентрации антибиотика в среде в связи с начавшимся автолизом мицелия и выделением в результате этого процесса аммиака, что сопровождается повышением pH среды.
В настоящее время описано шесть условно выраженных возрастных фаз продуцента пенициллина. Заметное количество пенициллина начинает образовываться с IV возрастной фазы гриба, максимум накопления приходится на VI фазу — в период автолиза.
Определение возрастных фаз путём микроскопического контроля позволяет установить:
1) ход общего темпа развития гриба, его состояние, пригодное для использования посевного материала, контроль за ходом образования антибиотика;
2) дефекты развития и возможные причины этих дефектов;
3) момент окончания развития гриба в реакторе.
По мере развития гриба меняется и химический состав мицелия. Количество общего азота и белка в мицелии уменьшается, содержание моносахаров в период максимального биосинтеза пенициллина (96 ч) увеличивается почти в 6 раз по сравнению с начальным периодом, количество дисахаридов уменьшается. Изменяемся количество отдельных аминокислот.
Процесс биосинтеза пенициллина ведётся при самом тщательном соблюдении стерильности всех операций, так как загрязнение культур посторонней микрофлорой резко снижает накопление антибиотика. Это связано с тем, что многие бактерии воздуха способны образовывать пенициллнназу. Особенно активно продуцируют этот фермент В. subtilis и В. cereus. Одним из активных продуцентов пеницидлиназы является туберкулёзная палочка (Mycob. tuberculosis). Предположительно именно с этим свойством связана резистентность этого микроорганизма к пенициллину.

Современная промышленная микробиология получает культуральные жидкости, содержащие свыше 55 тыс. ед/мл. Выделение пенициллина начинается с фильтрации или центрифугирования (отделения мицелия гриба).
Из культуральной жидкости антибиотик, где он находится в виде кислоты, выделяют путём экстракции неполярными органическими растворителями (амилацетатом, хлороформом, бутилацетатом, бутанолом и др.). Очистку антибиотика проводят путём замены растворителей, поскольку соли пенициллина плохо растворимы в органических растворителях. Экстрагированный пенициллин в виде кислоты переводят в водный раствор в виде соли, добавляя щелочь. Повторяя эти операции, пенициллин концентрируют и очищают. Большинство пенициляинов производят в виде натриевых или калиевых солей. Новокаиновые и бензатиновые солия являются основой пролонгированных препаратов пенициллина для внутримышечного введения.
В сухой кристаллической форме пенициллиновые соли достаточно стабильны в течение длительного времени при темяературе 4 °С. Растворы быстро теряют активность (в течение 24 часов при температуре 20 °С), их готовят непосредственно перед введением.
В настоящее время большое практическое значение имеет полусинтетический (биологический + химический) способ получения аналогов природного пенициллина. Исходным продуктом служит 6-аминопенициллановая кислота (6-АПК).
6-АПК получают в результате биосинтеза при развитии P. chrysogenum при отсутствии предшественника в среде или путём ферментативного дезацилирования бензилпенициллина или феноксиметилпенициллина при участии фермента пенициллииацилазы (пенициллинамидазы). Второй способ наиболее перспективен. Используется иммобилизованная пенициллинацилаза, которая гидролизует бензилпенициллин с образованием 6-АПК и фенилуксусной кислоты. Пенициллинацилаза образуется различными группами микроорганизмов, в том числе она образуется всеми продуцирующими пенициллин грибами. В настоящее время предложен способ получения иммобилизованных клеток Е. coli с высокой пенициллинацилазной активностью, пригодных для многократного применения.
Сама по себе 6-АПК не активна. Её подвергают химическому ацилированию и получают аналоги пенициллина с улучшенными или новыми свойствами, некоторые из них: оксациллин, ампициллин, метициллин, амоксициллин и другие. Всего в настоящее время используется порядка четырёх десятков таких препаратов.
В настоящее время бензилпенициллин необходим не только как медицинский препарат, но и как вещество, являющееся исходным продуктом для получения 6-АПК и в дальнейшем полусинтетических пенициллинов. Из общего количества природных пенициллинов примерно 35% используется как медицинские препараты, а 65% — для получения 6-АПК.
В начале 60-х гг. были предприняты попытки химического синтеза пенициллинов, в частности был синтезирован феноксиметилпенициллин, но практического значения эти попытки не имели.
Большинство пенициллинов производят в виде натриевых и калиевых солей. Новокаиновые и бензокаиновые соли являются пролонгированными формами для внутримышечного введения. В сухой кристаллической форме пенициллиновые соли достаточно стабильны при температуре 4 °С. Растворы быстро теряют активность (в течение 24 ч при температуре 20 °С), их готовят непосредственно перед введением. Пероральные пенициллины применяют за 1 ч до или через 2 ч после приема пищи, чтобы снизить связывание компонентами пищи и кислотную инактивацию препаратов.
Цефалоспорин — антибиотик из грибов рода Cepholosporium. Основным продуцентом является С. acremonium. Впервые сообщение было сделано Джузеппе Бротцу в 1948 г. В культуральной жидкости было обнаружено несколько цефалоспоринов, основной из которых — цефалоспорин С. На основе этого антибиотика в дальнейшем были созданы многочисленные полусинтетические цефалоспорины с ценными свойствами.
По химическому строению цефалоспорин принадлежит к β-лактамным соединениям, но β-лактамное кольцо конденсировано не с пяти, а с шестичленным гетероциклом. Цефалоспорины в отличие от пенициллинов устойчивы к β-лактамазе, подавляют развитие и грамположительных и грамотрицательных бактерий, но активность этого антибиотика ниже пенициллина.
Цефалоспорин не инактивируется пенициллиназой. Но имеется аналогичный фермент, гидролизующий β-лактамное кольцо цефалоспорина — цефалоспориназа.
В процессе развития С. acremonium наряду с цефалоспорином С синтезируется и пенициллин N. Его образование идёт тем же путём, что и образование изопенициллина N в процессе биосинтеза бензилпени- циллина. Через ряд стадий из изопенициллина N образуется цефалоспорин С.
Все пенициллины и цефалоспорины являются селективными ингибиторами синтеза клеточной стенки. Первый этап действия препаратов заключается в их связывании с клеточными рецепторами; такими рецепторами являются пенщиллинсвязывающие протеины (ПСП), количество которых составляет от 3 до 6 тыс. у различных бактерий. Отдельные ПСП могут иметь неодинаковый аффинитет к препарату, и каждый из них может опосредовать различное действие. Так, присоединение пенициллина к одному ПСП может вызывать аномальное увеличение клетки, присоединение к другому — приводить к дефекту на поверхности клеточной стенки без последующего лизиса клетки. ПСП контролируется хромосомами, мутации могут изменить их количества и аффинитет к отдельным β-лактамным препаратам. После связывания β— лактамнного препарата с рецепторами ПСП ингибируется реакция транспепдидирования и останавливается синтез пептидогликана. Следующий этап — устранение или инактивация ингибитора аутолитических энзимов (гидролаз) в клеточной стенке, что сопровождается активизацией литического фермента у некоторых микроорганизмов и может привесити к лизису клетки.
В последние года методом смешанного (биологического и химического) синтеза удалось получить около 50 тыс. аналогов цефалоспорина. Примерно 50 антибиотиков имеет практическое клиническое значение. Цефалоспорины традиционно делят на четыре поколения по спектру действия и антимикробной активности (табл.5)
Таблица 5. Характеристика цефалоспоринов различных поколений
|
Поколение |
Препараты |
Спектр активности |
|
I |
Цефадроксил, цефазолин, цефалексин, цефалотин, цефапирин, цефрадин |
Стафилококки, стрептококки, пневмококки, энтеробактерии |
|
II |
Цефаклор, Цефамандол, Цефоницид, Цеокситин, Цефметазол, Цефотетан, Цефуроксим, Цефпрозил, Лоракарбеф, Цефподоксим |
Грамотрицательные бактерии, устоичивые к действию β-лактамаз |
|
III |
Цефаперазон, цефотаким, цефазидим, цефтизоксим, цефтриаксон, цефиксим, максалактам |
Энтеробактерии, в т.ч. устойчивые к другим антибиотикам. Устойчивы к действию β-лактамаз, образуемых грамотрицательными бактериями. |
|
IV |
Цефипин |
Низкое сродство к β-лактамазам, быстро проникает в перплазматическое |
Стрептомицин принадлежит к группе аминогликозидных антибиотиков. Актиномицет, синтезирующий стрептомицин Streptomyces griseus впервые был выделен в лаборатории микробиологии Ратжерского университета в 1943 г. С появлением стрептомицина медицина получила мощное оружие для борьбы с таким тяжёлыми и достаточно широко распространенным заболеванием, как туберкулёз. Поэтому детально разрабатывались вопросы применения стрептомицина в терапии различных инфекционных заболеваний и его промышленного производства. Стрептомицин продуцируют ряд видов актиномицетов рода Streptomyces. Однако основным продуцентом стрептомицина признан S. griseus, способный синтезировать до 10-20 тыс мкг/мл антибиотика. Культуры актиномицетов весьма вариабельны и каждому штамму должна соответствовать определённая среда и свой режим для развития микроорганизма. На их изменчивость влияют условия культивирования и особенно состав сред (на более богатых по составу средах наблюдается и более быстрая изменчивость). Изменчивость продуцентов стрептомицина — результат генетической нестабильности этих микроорганизмов, обусловленный существенными перестройками ДНК, которые затрагивают многие гены, в том числе и гены биосинтеза антибиотиков и гены устойчивости к ним.
Для стабилизации признаков, связанных с антибиотикообразованием, при хранении и поддержании штамма иногда в среды добавляют антимутагены — вещества, способные стабилизировать процессы, приводящие к хромосомным перестройкам и регуляции экспрессии генов. Среди антимутагенов — пуриновые нуклеотиды, ионы марганца, L-метионин, гистидин, полиамины, кофеин и другие соединения. В контроле биосинтеза стрептомицина S. griseus принимает участие плазмидная ДНК, в процессе биосинтеза — 20-30 генов.
При промышленном производстве стрептомицина используются штаммы, хорошо развивающиеся на соевых средах, их основными компонентами является соевая мука, гидрол, аммонийные соли. Существенную роль в биосинтезе стрептомицина играют жиры соевой муки и её минеральный состав. Белок сои и его кислотный гидролизат малопригодны для биосинтеза антибиотика.
Аэрация среды имеет существенное значение, так как S. griseus — высокоаэробный организм и поглощает значительное количество кислорода, которое зависит от состава среды и стадии развития продуцента. В ранний период развития актиномицета потребление кислорода воздуха более интенсивное, а затем оно падает до нуля. Увеличение степени аэрации повышает выход стрептомицина. В анаэробных условиях продуцент стрептомицина развивается слабо. Мицелий, выращенный в аэробных условиях и перенесённый затем в анаэробные, стрептомицина не образует. Для максимального накопления антибиотика культура должна находиться в условиях непрерывной аэрации.
Оптимальная температура для развития антибиотика 27-29 °С. Повышение её до 30 °С и выше резко снижает и даже прекращает его образование. Оптимальную температуру меняют в зависимости от штамма продуцента и состава среды.
Лучшим начальным pH для развития актиномицета является 7,0. Стрептомицин образуется при значении pH от 7,5 до 8,5. В кислых средах активность стрептомицина снижается, в щелочных — максимальная. Так, активность стрептомицина при pH 5,8 в 20-80 раз меньше, чем при pH 8,0. Для проявления максимальной антимикробной активности стрептомицина оптимальное значение pH 7,5-8,0.
Наличие некоторых веществ в среде влияет на антибиотическую активность стрептомицина. Если к этой среде прибавить 0,5-3% натрия хлорида, калия хлорида или натрия сульфата E. coli развивается в присутствии 10 мкг/мл стрептомицина. Имеется два объяснения этому факту: в присутствии натрия хлорида уменьшается скорость и степень диффузии стрептомицина или натрия хлорид снижает адсорбцию антибиотика бактериальной клеткой. При концентрации пировиноградной, фумаровой кислот до 1% продуцент развивается в присутствии 10 мкг/мл стрептомицина, если концентрацию солей повысить до 3%, рост бактерий наблюдается при концентрации антибиотика 150 мкг/мл. Защитные свойства, этих кислот по-разному проявляются по отношению к различным микроорганизмам. В отношении Е. coli защитные свойства проявляются в большей степени, в отношении Staph. aureus защитных свойств не наблюдается. Сильно снижается активность в присутствии цистеина и гидроксиламина (цистеин полностью инактивирует антибиотик в течение нескольких часов).
При развитии продуцента различают две основные стадии. На первой стадии идёт быстрый рост и развитие микроорганизма с энергичным использованием основных компонентов субстрата, максимальное потребление кислорода. В цитоплазме высокое содержание РНК, ДНК вначале отсутствует и обнаруживается только через 12 ч развития. В среде происходит некоторое увеличение аммонийного азота, связанное с разложением белков соевой муки. pH вначале несколько снижается, затем повышается с 6,8 до 7,9. Образование стрептомицина незначительное.
Через 28 ч масса мицелия прекращает увеличиваться, начинается вторая стадия — процесс образования стрептомицина. На третьи сутки pH с 7,9 падает до 6,7, а на четвёртые и пятые — возрастает до 7,7. Вторая стадия характеризуется медленным потреблением оставшихся в среде питательных веществ, замедлением роста актиномицета, снижением потребления кислорода, автолизом мицелия, максимальным образованием стрептомицина. Максимальное накопление стрептомицина наблюдается, когда автолитические процессы начинают преобладать над процессами роста. Естество аммонийного азота продолжает возрастать, что, по всей вероятности, связано с разложением белков соевой муки и автолизом мицелия. В культуральной жидкости находятся минеральные вещества, белки, нуклеиновые кислоты, аминокислоты, полисахариды, жиры, стрептомицин и другие вещества.
S. griseus при определённых условиях развития культуры образует ещё один антибиотик — маннозидострептомицин (стрептомицин В), в чистом виде выделенный в 1947 г. из культуры актиномицета методом противоточной хроматографии. Маннозидострептомицин отличается от стрептомицина наличием в молекуле маннозы, он менее активен, чем стрептомицин. Культуры S. griseus содержат фермент, превращающий маннозидострептомицин в стрептомицин. При соответствующем контроле развития культуры актиномицета можно добиться минимального образования маннозидострептомицина.
Основная часть стрептомицина выделяется в культуральную среду, но часть его остаётся в мицелии и на его поверхности, с целью извлечения стрептомицина из микроорганизма культуральную жидкость вместе с биомассой обрабатывают минеральной кислотой, при этом весь антибиотик переходит в раствор. Мицелий отделяют прессованием или центрифугированием, свободную от мицелия культуральную жидкость обрабатывают щавелевой кислотой — этим достигается удаление белков и органических оснований, ионов металлов (кальция, магния, железа), далее ведется выделение стрептомицина в чистом виде.
Стрептомицин — сильно полярное соединение и его основание и соли неорганических кислот хорошо растворимы в воде. Соли же органических кислот стрептомицина нерастворимы почти во всех органических растворителях. Для выделения стрептомицина из культуральной жидкости в чистом виде используются методы адсорбции на активированном угле и метод ионообменной хроматографии.
В основу первого метода положена адсорбция стрептомицина на активированном угле при нейтральном или слабощелочном pH среды. При pH 2-4 стрептомицин остаётся в растворе, в то время как примеси адсорбируются на сорбент. После удаления примесей на активированный уголь адсорбируют из подщелоченной среды антибиотик, его десорбцию осуществляют этанолом, подкисленным кислотой хлороводородной, далее в раствор добавляется диэтиловый эфир — стрептомицин выпадает в осадок.
Стабильность стрептомицина имеет значение для производства и хранения антибиотика. Она зависит от чистоты препарата, влажности, температуры, pH растворителя. Химически чистый стрептомицин устойчив в сухом состоянии и в виде растворов. Соли стрептомицина при хранении при комнатной температуре инактивируются лишь в незначительной степени на протяжении нескольких лет. Максимальная стабильность растворов стрептомицина сульфата и гидрохлорида находится при pH от 3,0 до 7,0 при температуре от 7 до 25 °С.
По отношению к стрептомицину микроорганизмы условно делятся на 3 группы:
1. Чувствительные, рост которых подавляется при концентрации стрептомицина 10 мкг/мл, это роды Bacillus, Bordetella, Brucella, Klebsiella, Mycobacterium, Staphylococcus и некоторые другие.
2. Умеренно чувствительные, для подавления которых in vitro необходима концентрация антибиотика от 10 до 100 мкг/мл, сюда относят многие бактерии из родов Enterobacter, Corinebacterium, Diplococcus, Proteus, Streptococcus, Vibrio.
3. Устойчивые, для подавления которых необходима концентрация стрептомицина, превышающая 100 мкг/мл. К этой группе относят роды Bacteroides, Clostridium, некоторые виды Proteus, многие виды грибов, дрожжей, риккетсии, вирусы.
К стрептомицину легко возникает вторичная резистентность. Повышение устойчивости к нему в 1000 раз возникает у золотистого стафилококка всего лишь через три пассажа на бульоне с возрастающими концентрациями антибиотика, а у Salmonella typhi повышение устойчивости после 14 пассажей наблюдается в 22600 раз.
При лечении стрептомицином необходимо учитывать его побочные эффекты, могут появиться глухота, вестибулярные и другие нарушения функций. Их развитие определяется длительностью периода лечения, дозой антибиотика, методами введения, степенью очистки. Токсичность менее очищенных препаратов стрептомицина первого периода получения и применения стрептомицина была более высокой, что связано с наличием в препаратах гистаминоподобных веществ, которые сами достаточно токсичны.
Грамицидин С. Продуцент Bacillusbrevis способен синтезировать полипептидные антибиотики, к числу которых относят грамицидины А, В, СD, D, С. Последний иногда обозначают как грамицидин S (советский грамицидин). Все они отличаются как по аминокислотному составу, так и по пространственной структуре молекулы. Для производства грамицидина С (S) предложены среды на основе мясного и дрожжевого гидролизатов, содержащие сбалансированный набор минеральных и органических солей.
В процессе культивирования необходимо подобрать сбалансированное сочетание интенсивности аэрации среды (от 0,38 до 4,31 г О2 л/ч) концентрации входящих в неё веществ, температура культивирования — 40 °С. Развитие продуцента и синтез антибиотика может идти и при температуре 28 °С, но в этом случае максимальный биосинтез антибиотика наблюдается в первые 24 ч, в то время, как при температуре 40 °С — между 24 и 48 ч.
При выделение грамицидина С культуральную жидкость подкисляют кислотой хлороводородной до pH 4,5-5,0. В осадок выпадает дихлоргидрат грамицидина С вместе с бактериальными клетками продуцента, из осадка антибиотик экстрагируют этанолом. Концентрат, содержащий 4 % грамицидина, используется в медицинской практике.
Неомицины. В 1949 р. 3. Ваксман и Ж. Лешевалье из культуры Streptornyces fradiae выделили неомицин. В дальнейшем было установлено, что это комплекс, состоящий из семи антибиотиков аминогликозидного строения.
На синтетической среде актиномицет развивается лучше, чем на среде с соевой мукой, но биосинтез неомицина на синтетической среде почта в 8 раз ниже, чем на натуральной среде неопределённого состава. Некоторые вещества способствуют повышению выхода неомицина на 50%, к ним относятся ауксин, α-нафтилуксусная кислота. Наиболее эффективная доза ауксинов — семь частей на миллион, внесённая в среду перед стерилизацией. Стимулирующий эффект ауксинов проявляется при продолжительности процесса 138-162 ч, в ранние сроки развития культуры эффект отсутствует.
В процессе образования антибиотика существенную роль играет цинк. Степень аэрации культуры должна быть несколько ниже, чем при выработке стрептомицина.
Неомицины — основания, хорошо растворимые в воде и нерастворимые в органических растворителях, наибольшая их антибиотическая активность проявляется в щелочной среде. Неомициновый комплекс не теряет антимикробных свойств при длительном хранении (до 2-х лет) как в виде растворов, так и в твёрдом состоянии.
Антимикробный спектр сходен со спектром стрептомицина, но неомицин подавляет развитие устойчивых к стрептомицину штаммов Mycobacterium tuberculosis. Он малоактивен в отношении большинства видов Clostridium, Streptococcus, грибов, а также против вирусов и протозоа.
Чувствительные к неомицину микроорганизмы приобретают устойчивость к нему в меньшей степени, чем к стрептомицину. При использовании неомицина следует учитывать его токсичность. Для человека неомицин более токсичен, чем стрептомицин. Степень токсичности колеблется в зависимости от состава неомицинового комплекса и чистоты препарата
