Глава 6. Лекарственные средства, полученные на основе рекомбинантных микроорганизмов
6.1. Моноклональные антитела как лекарственные средства
6.2. Тромболитики и антикоагулянты
6.3. Аминокислоты
6.4. Синтез L-аскорбиновой кислоты
6.5. Гормональные препараты
6.5.1. Инсулин
6.5.2 Соматотпропный гормон (СТГ) или гормон роста человека
6.5.3. Эритропоэтин
6.6. Вакцины
6.7. Цитокины
В настоящее время с помощью рекомбинантных ДНК клонировано более 400 генов (в основном в виде кДНК) различных белков человека, которые являются или могут стать ЛС. По подсчетам специалистов ВОЗ, ежегодный объем мирового рынка ЛП на основе белков человека составляет около 150 млрд. долларов и постоянно растет.
Развитие технологии рекомбинантных ДНК, разработка способов получения моноклональных антител, установление структуры и функции иммуноглобулинов привело к использованию специфических антител для лечения различных заболеваний. Работа с генами антител облегчатся тем, что отдельные молекулы антитела выполняют разные функции. Привлекательность применения в качестве терапевтических средств специфических антител объясняется тем, что их можно использовать для нейтрализации токсинов; борьбы с бактериями, вирусами, для лечения онкологических заболеваний. Антитело можно уподобить самонаводящейся ракете, которая или нейтрализует «нарушителя» — чужеродного агента, или, если она оснащена «боеголовкой», разрушает клетку-мишень.
6.1. Моноклональные антитела как лекарственные средства
Молекула антитела (иммуноглобулина) состоит из двух «легких» (L) и двух «тяжелых» (Н) белковых цепей, которые соединены водородными связями и дисульфидными мостиками, расположенными в строго определенных местах. N-концевые участки L- и Н-цепей образуют антигенсвязывающий сайт, отдельные области (домены) молекулы антитела выполняют разные функции. Антигенсвязывающие сайты состоят из трех участков, определяющих комплементарность антител к антигену (CDR) и образующих вариабельные области (VH и V1) на N-концах Н- и L-цепей. Кроме вариабельных (VH и V1) каждая L-цепь содержит одну константную область или домен (С1), каждая Н-цепь три константных области или домена (СН1, С Н2, С Н3). При обработке антитела протеолитическим ферментом — папаином — образуются три фрагмента: два идентичных (Fab), каждый из которых содержит интактную L-цепь, связанную дисульфидным мостиком с VH и СН1 — доменами Н-цепи, и один Fс фрагмент, состоящий из двух соединенной дисульфидной связью с С Н2 и С — доменов Н-цепи. Fab-фрагмент, точнее его N-концевая часть, называемая Fv-фрагментом, обладает атигенсвязывающей активностью, присущей интактной молекуле антитела.
После связывания антигена с интактным антителом запускаются реакции иммунного ответа:
1. Активируется система комплемента; компоненты этой системы разрушают клеточные мембраны, активируют фагоциты и генерируют сигналы, мобилизующие другие компоненты системы иммунного ответа
2. В результате связывания Fc-участка антитела с Fc — рецептором эффекторной клетки, запускается реакция опосредованной антителами клеточной цитотоксичности. Активированная эффекторная клетка высвобождает вещества, лизирующие чужеродную клетку, с которой связан Fab-участок молекулы антитела.
3. После связывания Fab-участка с растворимым антигеном, Fc — участок антитела может присоединиться к рецепторам фагоцитов, которые захватывают и разрушают комплекс антиген — антитело.
Для облегчения доставки лекарственного вещества (ЛВ) к месту его действия используют несколько приемов:
— Заключают в липосомы, липидная оболочка которых имеет высокое сродство к клеткам нужных органов.
— Встраивают гены специфических токсинов в инфильтрующие опухоль лимфоциты, которые высвобождают эти токсины непосредственно в опухоли.
— Присоединяют молекулы ЛB к моноклональным антителам или их Fv-фрагментам, специфичным по отношению к белкам, находящимся на поверхности строго определенных клеток, например, опухолевых (рис. 13, А).
— Используют ЛВ в неактивной форме, переводя их в активное состояние при помощи ферментов. Чтобы такое превращение происходило только вблизи клетки-мишени, фермент присоединяют к моноклональному антителу, специфичному к поверхностному антигену этой клетки (рис. 13, Б).

В обоих случаях моноклональное антитело связывается с одним специфическим белком на поверхности клетки-мишени.
6.2. Тромболитики и антикоагулянты
Система свертывания крови состоит из тромбоцитов и содержащихся в них пластиночных факторов (аденозиндифосфата), тканевого тромбопластика, серотонина, антиплазмина, фибронектина, тромбоспондина и др.), плазменных белков, синтезирующихся в клетках печени (протромбина, проконвертина, антигемофильных глобулинов, тромботропина, фибриногена и др.).
Антисвертывающая система представлена плазмином (фибринолизином) — протеолитическим ферментом, находящимся в крови в неактивном состоянии (плазминоген), белками плазмы крови (протеинами С, S, антитромбином III, тормозящими процесс образования фибрина, а также веществами, продуцируемыми (простациклин, тромбомодулин и др.) или фиксированными на эндотелиальных клетках (гепарин). При нарушении равновесия между этими двумя системами может возникать повышенная кровоточивость, тромбообразование или сочетание того и другого.
Наиболее частой причиной смерти являются тромбоэмболия мозговых или сердечных артерий. Известно, что тромб состоит из молекул фибрина, фактора свертывающей систему крови, образующего сеть в ответ на повреждение сосудистой стенки. В норме молекулы фибрина в образовавшемся тромбе расщепляются ферментом, способствующим растворению фибрина in vivo – сериновой протеиназы плазмина, который образуется из плазминогена под действием активатора (рис. 14).
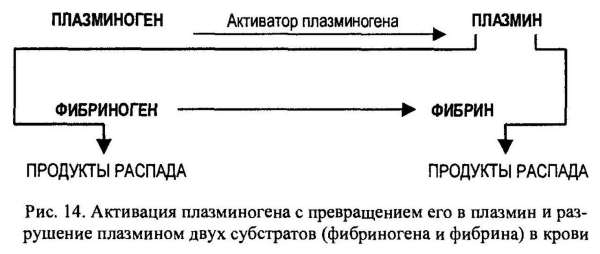
Нередко эта биологическая система работает недостаточно эффективно, что приводит к закупорке артерий. В таких ситуациях для повышения уровня плазмина в крови было предложено использовать активатор плазминогена (АПг) в качестве терапевтического средства. Однако плазмин способен разрушать и предшественник, фибрина — фибриноген (рис. 15), и если уровень фибриногена в результате терапии с использованием АПг значительно снизится, могут произойти обширные внутренние кровотечения.
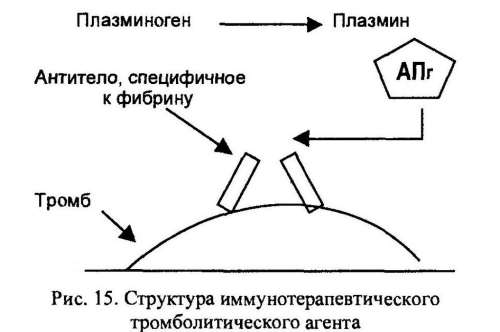
К моноклональному антителу, специфичному к фибрину, присоединен AПг. Этот комплекс связывается с фибрином, находящимся в тромбе, АПг вызывает скопление плазмина вблизи тромба, и плазмин лизирует тромб.
Тромболитическая терапия, осуществляемая активаторами плазминогена тканевого типа (ТАПг), широко используется при лечении острого инфаркта миокарда, закупорки мозговых и коронарных артерий, эмболии легких.
Плазминоген человека представляет собой одноцепочечный гликопротеин м.м. 90000; его содержание в плазме составляет примерно 2 мкмоля/л. Плазминоген обладает способностью превращаться в плазмин с помощью природных, активаторов плазминогена, находящихся в небольшом количестве в органах и тканях, либо с помощью бактериальной стрептокиназы. Одно из основных свойств АПг — способность участвовать в процессе фибринолиза. Эти ферменты, представляющие робой естественные тромболитические агенты, имеют огромное значение в борьбе с коронарными и церебральными тромбозами и тромбозами сосудов легких.
Активирование плазминогена стептокиназой заключается в образовании на начальной стадии комплекса плазминоген — стрептокиназа, обладающего способностью активировать молекулу плазминогена; этот комплекс затем с помощью ферментативного механизма обеспечивает превращение плазминогена в плазмин.
Плазмин (фибринолизин) является эндопептидазой широкого спектра действия. Как плазминоген, так и плазмин содержат по пять дисульфидных мостиков, за счет которых формируются специфические домены. Препарат является протеолитическим ферментом, образующимся при активации трипсином содержащегося в крови человека плазминогена. Он вызывает только наружный лизис тромба (преимущественно в венах), так как быстро нейтрализуется антиплазмином, в избытке циркулирующим в крови.
Плазмин обладает свойствами активатора, переводящего эндогенный плазминоген в плазмин. Продукты деградации фибрина, образующиеся при его разрушении, препятствуют полимеризации мономеров фибрина и образованию тромбопластина.
Однако плазмин может вызвать активацию свертывающей системы крови и повысить антифибринолитические свойства крови, поэтому его вводят с гепарином.
Генерируемый активатором плазминогена плазмин кроме растворения тромбов способен стимулировать деление клеток, видоизменять клеточные поверхности, активировать специфические протеазы, превращать проинсулин и проадренокортикотропин в инсулин и АКТГ соответственно.
С учетом молекулярной массы, энзиматических и серологических свойств, способности связывать фибрин плазмы крови АПг принято делить на активаторы тканевого и урокиназного типов.
Активаторы плазминогена тканевого типа. Содержание ТАПг широко варьирует в различных органах: тканей: препарат, полученный из ткани матки человека, характеризуется м.м. 69000 и состоит из двух полипептидных цепей с м.м. 31000 и 38000; фермент, экстрагированный из клеток сосудов трупа человека, имеет м.м. 60000 и состоит из двух близких по размеру полипептидов. Природный ТАПг может существовать как в виде протеолитически деградируемой двухцепочечной, так и одноцепочечной формы.
Получают природный ТАПг методом культивирования клеток. Основной источник получения препарата — линия клеток меланомы человека; такой фермент — мТАПг характеризуется м.м. 72000 и, в зависимости от условий культивирования и очистки, может быть получен в одно- и двухцепочечной форме. Для очистки ТАПг, полученного из клеток меланомы, применяют аффинную хроматографию с использованием пяти аффинных сорбентов: конканавалина А, n — аминобензамидина, имидинодиуксусной кислоты, борной кислоты, лизина — все марки 5PW.
Метод получения рекомбинантного ТАПг (рТАПг) разработан в 80-х гг.. 20 в. Ген ТАПг расположен у человека в хромосоме 8. Технологи клонирования и экспрессии рТАПг в клетках Е. coli, S. cerevisiae и клетках животных позволили получать ТАПг в промышленных масштабах, провести широкое клиническое изучение и выйти на мировой рынок тромболитиков.
Сравнительное изучение мТАПг и рТАПг в отношении тромболизиса при инфаркте миокарда и других типов тромбозов показало полную идентичность их биологических и тромболитических свойств. Лидерами в области разработки рТАПг (альтеплазы) являются фирмы «Genentech» и «Boehringer Ingelheim», выпускающие альтеплазу под торговыми названиями activase и actilyse.
Активаторы плазминогена урокиназного типа. Урокиназа — активатор плазминогена, содержащийся в моче человека, состоит из двух полипептидных цепей (А и В), соединенных между собой дисульфидным мостиком, встречается в высоко- и низкомолекулярной формах (м.м. соответственно 55000 и 34000).
Препарат получают из культуры клеток эмбриона почки человека. Урокиназа активирует плазминоген, превращая его в плазмин. Фибринолитический эффект наступает быстрее, чем от стрептокиназы. Препарат способен активировать фибринолиз внутри тромба (эндотромболиз) и на его поверхности (экзотромболизис). По клинико-фармакологической характеристике урокиназа близка к стрептокиназе. Урокиназа не обладает выраженными антигенными свойствами, поэтому при ее использовании меньшая опасность возникновения аллергических реакций и ее назначают повторно.
Одноцепочечная форма урокиназы получила название проурокиназы. Проурокиназа является проферментом урокиназы, содержится в различных органах и тканях, включая плазму крови. Проурокиназа — одноцепочечный гликопротеин, состоящий из 411 аминокислот. Гидролиз одной из пептидных связей плазмином способствует ее трансформации в урокиназу.
Большое значение имеет получение активаторов плазминогена урокиназного типа методом генной инженерии. Ген урокиназы/проурокиназы локализуется у человека в хромосоме 10; продукт экспрессии гена урокиназы, клонированного в Е. coli, содержит одну или две цепи в зависимости от присутствия ингибиторов протеаз в процессе очистки фермента. Оценка биологических и фибринолитических свойств рекомбинантной урокиназы (р-урокиназы), рекомбинантной проурокиназы (р-проурокиназы) и природной урокиназы, выделенной из мочи, показала, что рекомбинантные урокиназа и проурокиназа обладают лучшей тромбоселективностью и вызывают меньшее число побочных явлений, чем урокиназа.
Стрептокиназа — тромболитик прямого действия, является активатором плазминогена, относится к тромболитикам 1 поколения. В очищенном виде стрептокиназа представляет собой пористую массу белого цвета без запаха, легко растворимую в воде, м.м. 40000-50000.
Препарат получают из β-гемолитического стрептококка группы С — это непрямой фибринолитик. Стрептокиназа стимулирует перевод циркулирующего в крови проактиватора в активатор, трансформирующий плазминоген в плазмин. Препарат способен проникать внутрь тромба и активировать в нем фибринолиз, чем выгодно отличается от плазмина. Продукты распада тромба, циркулирующие в крови, вызывают гипокоагуляцию, блокируют агрегацию эритроцитов и тромбоцитов, снижают вязкость крови.
Среди тромболитических препаратов стрептокиназа занимает прочную позицию, что обусловлено доступностью получения ее из микробного сырья и относительно невысокой реактогенностью (антитела к стрептокиназе исчезают в течение 6 месяцев, иммунологическая реактогенность этого белка обычно проявляется лишь у лиц с отягощенным анамнезом, например, перенесших стрептококковую инфекцию).
На мировом рынке медикаментов лидируют препараты стрептокиназы из микробного сырья: кабиказа (фирма «Kabi Vitrum»), стрептаза (фирма «Hoechst»), стрептокиназа (фирма «Smith Kline»).
Фирма «Phillips Petrolium» (США) запатентовала метод экспрессии стрептокиназы в S. cerevisiae. Экспрессируемый в дрожжах белок по м.м. и активности идентичен стрептокиназе, полученной из Streptococcus equisimilis. Метод рекомбинантных ДНК позволил получить высокий выход искомого продукта — 1г/1л среды.
Методом рекомбинантных ДНК получен вектор, несущий ген стрептокиназы, адаптированный для трансформации в бактериальный геном (патент США).
Запатентован метод (Германия) ферментационного получения стрептокиназы, генноинженерным способом пущена плазмида, содержащая ген стрептокиназы. Экспрессия стрептокиназы получена трансформацией этой плазмиды в клетки Streptococcus. После ферментации таких клеток из культуральной жидкости выделена и очищена стрептокиназа м.м. 42000.
Стрептодеказа — пролонгированный препарат стрептокиназы, относящийся к группе иммобилизованных ферментов, нанесенных на водорастворимую матрицу полисахаридной природы. Однократное введение средней терапевтической дозы обеспечивает повышение фибринолитической активности крови в течение 48-72 ч.
Рекомбинантный тканевой активатор плазминогена (актилизе) является гликопротеином (полным аналогом эндогенного вещества, вырабатываемого эндотелием), который после системного введения находится в плазме в неактивной форме до момента связывания с фибрином. После активации препарата он способствует переходу плазминогена в плазмин и ведет к растворению фибринового сгустка, повышая фибринолиз только в ткани тромба.
Ацилированный комплекс стрептокиназы и плазминогена (торговое название «Эминаза») — тромболитик 2-го поколения, разработан и запатентован английской фирмой «Beecham». Ацильная группа, входящая в состав комплекса, защищает тромболитик от инактивации природным ингибитором L2-антиплазмином. По мере поступления «Эминазы» в кровяное русло начинается быстрое гидролитическое отщепление ацильной группы, высвобождение активированного комплекса происходит с постоянной скоростью. Комплекс действует почти исключительно на фибрин кровяного сгустка, не затрагивая фибриноген. Наиболее грозное побочное действие тромболитиков — возникновение внезапных кровотечений — проявляется при применении «Эминазы» весьма редко. Успех международных клинических испытаний «Эминазы» обеспечил признание этого тромболитического средства на мировом рынке.
В качестве тромболитиков предложены химерные (гибридные) молекулы, содержащие домены ТАПг и урокиназы; эти гибридные молекулы характеризуются таким же сродством к фибрину и способностью к лизису тромбов, как и рТАПг. Химерные молекулы получают методом слияния концевой кДНК, кодирующей концевой аминосодержащий фрагмент ТАПг, ответственный за специфичность в отношении фибрина, с кДНК, кодирующей концевой карбоксисодержащий фрагмент проурониказы, ответственный за ферментативные свойства молекулы. Это соединение обладает специфичностью к фибрину, характерной для обеих молекул; лечебная доза этого препарата может быть в 4 раза меньшей, чем доза ТАПг и урокиназы, вводимых отдельно; прямым следствием снижения дозы является уменьшение вероятности возникновения побочного действия.
Сконструированы химерные молекулы, содержащие фрагменты ТАПг, урокиназы и проурокиназы, клонированные в животных клетках (фирма «Ciba-Geigy», Швейцария).
Разработаны генно-инженерные системы доставки тромболитиков (США). Описано строение моноклонального антитела, способного доставить тромболитический белок к месту образования тромба. Гены, ответственные за образование β-цепи ТАПг, были внедрены в гибридомы, продуцирующие антитела, которые экспрессировали белок, способный избирательно доставляться к месту скопления фибрина, кроме того, такой активированный белок способен активировать плазминоген (фирма «Genentech»).
Антикоагулянты. Гепарин и его производные принадлежат к числу наиболее безопасных препаратов. Гепарин относится к гуморальным факторам регуляции жидкого состояния крови и обладает высокой связующей способностью практически ко всем факторам системы коагуляции. Гепарин нейтрализует действие сериновых протеиназ и фибриновых систем за счет образования комплекса антитромбин III-гепарин (АТ-III-гепарин). Препараты гепарина гетерогенны и содержат фракции с высоким и низким средством связывания с AT-III (AT-III является ингибитором активаторов плазминогена).
В медицинской практике используются препараты низкомолекулярного или фракционного гепарина — логипарин, фраксипарин, далтепарин, кливарин. Их относят к гепаринам II поколения. Получают низкомолекулярные гепарины методом ферментативной деполимеризации высокомолекулярного гепарина с помощью бактериальной гепариназы. Гепарин повышает активность фибринолитической системы за счет образования комплекса с антиплазмином. Гепарин накапливается на поверхности эндотелиальных клеток и клеток крови, создавая на их мембранах концентрацию в 100 раз большую, чем в плазме крови. Этим он придает поверхности эндотелия и тромбоцитов отрицательный заряд, препятствуя их адгезии и агрегации, а также высвобождению из них агрегирующих факторов.
Низкомолекулярные гепарины не влияют на коагуляцию, т.е. они не изменяют время свертывания крови, но их терапевтический эффект больше, чем у высокомолекулярных форм. Это свидетельство того, что основное в действии гепарина — ограничение агрегации и адгезии тромбоцитов. Подтверждением данного механизма является отсутствие корреляции между клинической эффективностью гепарина и увеличением времени свертывания крови.
Антикоагулянт фрагмин (фирма «Kabi Vitrum», Швеция) получают из стандартного гепарина, извлекая из него составную часть, обладающую наибольшей антикоагулянтной активностью. Fragmin имеет достаточно длительный период полураспада, что позволяет применять его в виде однократной подкожной инъекции. Кроме антикоагулянтного и тромболитического действий отмечено его благоприятное влияние на снижение уровня триглицеридов в крови. ВОЗ рекомендовала использовать фрагмин в качестве международного стандарта при оценке лечебного эффекта и безопасности антикоагулянтов нового поколения.
Методом органического синтеза (фирмы «Organon», Нидерланды и «Choy», Франция) получен гепариноид — аналог гепарина; активное начало этого препарата составляют сульфатированные олигосахариды.
Гирудин — антикоагулянт прямого быстрого действия, это белок, вырабатываемый слюнными железами медицинской пиявки (Hirudo medicinalis), которая в течение ряда лет использовалась для предотвращения тромбоэмболий мелких сосудов. Гирудин является сильным и специфичным ингибитором тромбина и относится к группе противосвертывающих препаратов прямого быстрого действия, препятствующих образованию и отложению нитей фибрина. Он инактивирует связанный с фибрином тромбин в тромбах. Существует несколько близкородственных вариантов гирудина (HV1, HV2, HV3). Наиболее изучен HV1, представляющий белок с м.м. около 7000, состоящий из 65 аминокислотных остатков. Гирудин ингибирует только тромбин и неактивен в отношении трипсина и плазмина. Введение гирудина не влияет на работу сердца, органов дыхания, иммунной системы.
В настоящее время гирудин получают с использованием технологии рекомбинантных ДНК. Ген гирудина экспрессирован в S. cerevisiae (фирмы «Francgene», «Sanofi», Франция); для очистки препарата использована ВЭЖХ.
Фирмой «Ciba Geigy» разработан метод экспрессии частично десульфатированного варианта гирудина (десульфатогирудина) в S. cerevisiae. Рекомбинантный гирудин с одной отсутствующей сульфо-группой по антикоагулянтной активности превосходит гепарин.
Белки С и S являются важными факторами антикоагулянтной системы. Белок С был впервые описан в 1960 г. как аутопротромбин II-а и лишь в 1976 г. выделен в чистом виде. Белок С-гликопротеин м.м. 62000 состоит из двух субъединиц, связанных дисульфидным мостиком, содержит около 10 аминокислотных остатков γ-карбоксиглютаминовой кислоты.
Белок С является витамин-К-зависимым ингибитором свертывающей системы. Имеются данные, что снижение уровня белка С в крови связано с риском возникновения тромбозов, причем дефицит этого белка бывает наследственным и приобретенным; так, при недостатке белка С может развиться тромбофлебит. Дефицит белка С наблюдается при заболеваниях печени (возможно, синтез белка С происходит в этом органе).
Белок S является кофактором белка С и образует с последним активированный комплекс на поверхности фосфолипидных мембран тромбоцитов, эндотелиальных и других клеток; в результате каталитическая способность белка С возрастает. Белок S также является витамин-К- зависимым и имеет высокое средство к отрицательно заряженным фосфолипидам. Белок S — гликопротеид с м.м. 69000.
Разработана технология получения рекомбинантного белка С (фирма «Eli Lilly») в культуре клеток почек, трансформированной аденовирусом. Очищенный белок на 90% представлен двухпептидным компонентом и на 10% однопептидным, по активности не уступает белку С, который находится в плазме крови человека. Генноинженерный препарат белка С предложен для лечения последствий ортопедической и абдоминальный хирургии, легочной эмболии.
Два рекомбинантных гибрида белка С (антикоагулянтной и фибринолитической активности) (фирма «Hoechst Japan»), не уступающие белку С из крови человека, предупреждают острый инфаркт миокарда и послеоперационные тромбозы.
В 1982 г. выделен и охарактеризован еще один кофактор активации белка С — тромбомодулин, локализованный в мембране эндотелиальных клеток и являющийся кальций-зависимым ингибитором коагуляции и агглютинации тромбоцитов. Тромбомодулин — неразветвленный гликопротеин с м.м. 68000-77000, содержит 117 аминокислотных остатков. Выделен структурный ген тромбомодулина, ген клонирован с последующей экспрессией в клетках почек обезьяны (фирма «Asahi Chemical», Япония).
Аминокислоты широко применяют в медицине для терапии послеоперационных больных, при лечении заболеваний ЦНС, язвенной болезни желудка и двенадцатиперстной кишки, печени (серотонин, аспарагин, валин, гистидин, глицин, глутамин и глутаминовая кислота, изолейцин, лейцин, метионин, пролин, тирозин, триптофан, фенилаланин, цистеин). В пищевой промышленности в качестве усилителей вкуса и аромата, антиоксидантов и пищевых добавок (аланин, аспарагиновая кислота, глицин, глутаминовая кислота, лизин, цистеин); в сельском хозяйстве — в качестве кормовых добавок (лизин, треонин); в химической промышленности — как исходные вещества при синтезе полимеров и производстве косметических средств.
Ежегодно в мире производится более 800000 тонн аминокислот стоимостью более 5 млрд. долларов; при этом больше половины общего объема производства приходится на долю L-глутаминовой кислоты, которую используют для получения широко известного усилителя вкуса и аромата — натрия глутамата.
В промышленном масштабе аминокислоты получают, в основном, экстракцией из белковых гидролизатов или очисткой продуктов метаболизма двух неспорулирующих грамположительных почвенных бактерий — Corynebacterium или Brevi bacterium spp. Обычно для повышения продуктивности этих микроорганизмов используют мутагенез с последующим отбором штаммов — сверхпродуцентов определенных аминокислот, но такой способ получения штаммов требует много времени и эффективность его невелика. Альтернативные подходы — выделение и изменение специфических генов, кодирующих ключевые ферменты определенных биохимических реакций. Например, генноинженерный способ получения аминокислоты триптофана, синтезируемой C. glutamicum, одного из видов Corynebacterium. Для этого в клетки С. glutamicum дикого типа введена копия гена, кодирующего антранилатсинтазу, фермента, лимитирующего синтез триптофана.
Высокий уровень биосинтеза триптофана достигают введением в клетки С. glutamicum модифицированных генов трех ключевых ферментов: 3-дезокси-Д-арабиногептулозонат-7-фосфатсинтазы, антранилатсинтазы и антранилатфосфорибозилтрансферазы. В качестве альтернативы для синтеза аминокислот можно использовать Е. coli.
Известно, что важным регулятором функций клеток, тканей и органов, осуществляемых через жидкие, среды организма, является α2 — макроглобулин (МГ). Этот белок способен ингибировать активность протеолитеческих ферментов, транспортировать цитокины, регулировать процессы эндоцитоза, кооперации различных клеток крови, презентировать микроорганизмы и гены. Из плазмы крови человека очисткой α2 — макроглобулина, сочетающей дробное осаждение полиэтиленгликолем, анионообменной и металхелатной аффинной хроматографией, получен нативный белок, имеющий уникальные регуляторные свойства — высокую ингибирующую активность в отношении протеиназ, препарат (НПО «Вектор», Новокузнецкий ГИУВ) показан при воспалительных процессах, передозировках протеиназ, септических состояниях, вызванных микроорганизмами. На основе нативного α2 – макроглобулина получены стабильные комплексы, имеющие полную биологическую совместимость с плазмином и интерфероном α-ИФ2. Доставка комплекса α2-МГ- ИФ2 непосредственно в опухоль весьма перспективна в онкологии.
Природные пептиды любого происхождения универсальны, они оказывают защитное действие на организм, стимулируя работу иммунной системы. Ценным сырьем для получения полипептидов являются гидробионты. Первым препаратом гидробионтов был ганглин, полученный в 1981 г.г. НПО «Биомед» из ганглиев тихоокеанских кальмаров методом ультрафильтрационной очистки и выделения пептидов. Ганглин содержит 45 пептидных фракций. Иммуномодулирующие свойства ганглина определили его применение для устранения любых вторичных иммунодефицитов. Препарат оказывает регулирующее влияние на реакции клеточного и гуморального звеньев иммунитета и неспецифическую резистентность организма, усиливает функциональную активность ПМЯЛ и макрофагов, стимулирует образование, дифференцировку и функциональную активность Т-лимфоцитов, синтез специфических антител в сыворотке крови, уменьшает развитие аутоиммунных процессов, обладает антигистаминными, антисеротониновыми, противовоспалительными свойствами.
Ганглин зарегистрирован в качестве пищевой добавки для ветеринарии, корригирующей иммунодефициты и оказывающей положительное влияние на гомопоэз.
Препарат гидробионтов – молокин — получен из молок лососевых рыб; наряду с иммунорегулирующей активностью обладает гонадотропными свойствами.
Препарат вермин (НПО «Биомед») представляет собой очищенную, стерильную, лиофильно высушенную смесь белков и пептидов, экстрагированных из гомогената червей Eisenia foetida; препарат нетоксичен, не проявляет мутагенной активности, обладает ферментативной активностью оксидоредуктаз, трансфераз и гидролаз, оказывает иммуномодулирующее действие. Мазь на основе вермина предложена для лечения длительно незаживающих гнойных ран.
6.4. Синтез L-аскорбиновой кислоты
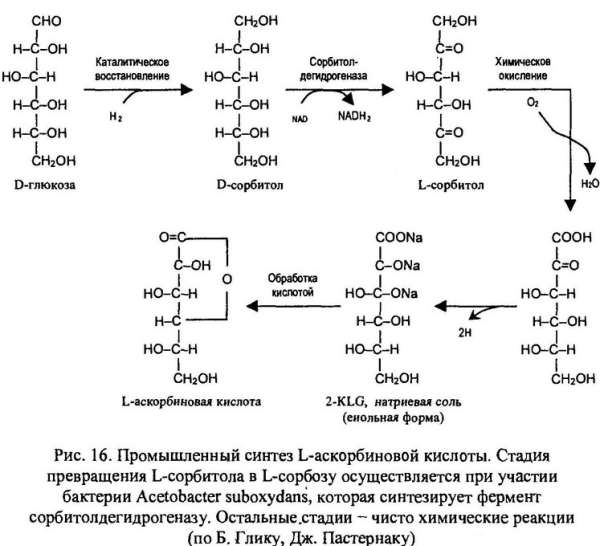
В настоящее время для крупномасштабного производства L-аскорбиновой кислоты (витамина С) используют преимущественно трудоемкий процесс, включающий одну микробиологическую стадию и несколько химических. Исходным субстратом для него является D-глюкоза (рис. 16). На последнем этапе этого процесса 2-кето-L-гулоновая кислота (2- KLG) превращается в кислых условиях L-аскорбиновую кислоту.
Биохимические исследования метаболизма различных микроорганизмов показали, что 2-KLG можно получить, включая совместное культивирование микроорганизмов Corynebacterium и Erwinica herbicola для превращения глюкозы в 2-KLG. Однако условия культивирования, оптимальные для одного организма, неприемлемы для другого, что влечет спонтанное «вымывание» из среды одного из них. В подобных случаях можно культивировать микроорганизмы последовательно, но такой процесс трудно сделать непрерывным, так как для роста микроорганизмов необходимы существенно разные среды (рис. 17).
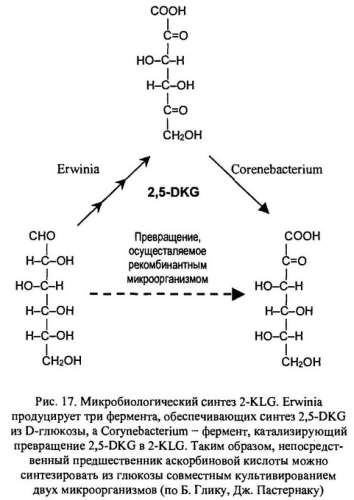
Наиболее простой способ — создание одного микроорганизма, способного превращать D-глюкозу в 2-KLG, состоит в выделении гена 2,5-DKG-редуктазы Corynebacterium и введении его в Erwinica herbicola (рис. 18).

Трансформированные клетки Erwinica herbicola активно превращают D-глюкозу непосредственно в 2-KLG. При этом собственные ферменты Erwinica herbicola, локализованные во внутренней мембране бактериальной клетки, преобразуют глюкозу в 2,5-DKG (2,5-дикетоглюкановая кислота), а 2,5- DKG -редуктаза, локализованная в цитоплазме, катализирует процесс превращения 2,5-DKG в 2-KLG.
Следовательно, с помощью генетических манипуляций удалось в одном организме осуществить метаболические реакции, протекающие в столь разных микроорганизмах. Этот гибрид приобрел способность синтезировать конечный продукт комбинированного метаболического пути. Такой организм используется как фабрика для производства 2-KLG, заменяющая три стадии в том процессе получения L-аскорбиновой кислоты, который доминирует и в настоящее время.
6.5.1. Инсулин
Инсулин синтезируется β-клетками островков Лангерганса поджелудочной железы; 70% мРНК, выделенных из этих клеток, кодируют именно этот белок.
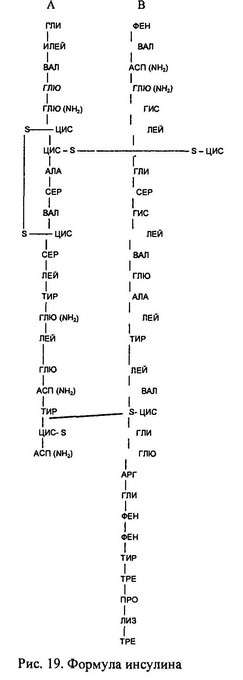
Человеческий инсулин — полипептид с м.м. 5808, состоящий из 51-й аминокислоты, которые образуют две соединенные дисульфидными мостиками полипептидные цепи (одна цепь состоит из 21 аминокислоты, так называемая цепь А; другая — из 30 аминокислотных остатков, так называемая цепь В). Аминокислотный состав цепей видоспецифичен. Предшественник инсулина продуцируется внутри β-клеток посредством ДНК- и РНК — управляемого синтеза. Длинная цепь проинсулина в аппарате Гольджи упаковывается в гранулы, где в результате гидролиза удаляются четыре аминокислоты (обозначенные пунктом на рис. 19) с образованием инсулина и связывающего пигмента, называемого С-пептидом. Инсулин и С-пептид в эквивалентных концентрациях секретируются в ответ на все стимуляторы секреции инсулина (глюкозу, маннозу и некоторые аминокислоты – лейцин, аргинин). Выделяется также небольшое количество нативного или частично гидролизованного проинсулина, который оказывает некоторое гипогликемическое действие. В гранулах β-клеток инсулин депонируется в виде кристаллов, состоящих из двух атомов цинка и шести молекул инсулина. В целом, человеческая поджелудочная железа содержит до 8 мг инсулина, что составляет приблизительно 200 биологических «единиц» (количество единиц определяют по массе препарата; существующий инсулиновый стандарт, используемый в аналитических целях, составляет 28 ЕД/мг).
Инсулин обладает мощным действием, охватывающим биосинтез нуклеиновых кислот, белков, обмен, углеводов, липидов, продукцию высокоэнергетических соединений. Инсулин регулирует углеводный обмен, усиливает усвоение тканями глюкозы и способствует превращению ее в гликоген, облегчает проникновение глюкозы в клетки тканей. Будучи специфическим средством терапии сахарного диабета, инсулин снижает гипергликемию и глюкозурию, пополняет депо гликогена в мышцах и печени, уменьшает образование глюкозы, снимает диабетическую липемию, улучшает общее состояние больного. Единственное отличие больного человека от здорового в том, что здоровые получают этот гормон благодаря собственной поджелудочной железе, больные — из рук государства.
Сахарный диабетом I типа — инсулинзависимым диабетом (ИЗСД) — официально больны свыше 3 млн. российских граждан, «неофициально» — до 10 млн. Известно, что ИЗСД (тяжелая форма, при отсутствии лечения приводящая к кетозу), наряду с сердечно-сосудистыми и онкологическими заболеваниями занимает одно из ведущих мест по медико-социальной значимости и является причиной ранней инвалидности и высокой смертности. Диабет II типа — инсулиннезависимый (ИНЗСД) включает более легкие формы диабета. Диабетом этого типа чаще болеют тучные люди.
История открытия инсулина связана с именем русского врача И.М. Соболева (вторая половина 19 в.), доказавшего, что уровень сахара в крови человека регулируется специальным гормоном поджелудочной железы.
В 1922 г. инсулин, выделенный из поджелудочной железы животного, впервые введён 10-летнему мальчику (Торонто), больному диабетом. Результат превзошёл все ожидания, и уже через год американская фирма «Eli Lilly» выпустила первый препарат животного инсулина. Поджелудочная железа крупного рогатого скота (КРС) и свиней поставляется бойням, где опытный персонал по разработанной методике извлекает железы из туш, их быстро замораживают (оптимальная температура — 70 °С) и в вагонах-рефрежераторах направляют на фармацевтические предприятия, где экстрагируют гормон. Масса поджелудочной железы КРС составляет в среднем 200-250 г, для получения 100 г кристаллического инсулина требуется 1000 — 1200 кг исходного сырья. Бычий (говяжий) гормон, в отличие от свиного, обладает несколько большей антигенностью для человека. После получения первой промышленной партии инсулина в последующие несколько лет пройден огромный путь его выделения и очистки, в результате гормон стал доступен для лечения больных сахарным диабетом I типа. Для адекватного контроля уровня глюкозы в крови инсулин нужно было вводить подкожно 4 раза в сутки.
В 1935 г. датский исследователь Хагедорн оптимизировал действие инсулина в организме, предложив пролонгированный препарат — протамин-цинк-инсулин (вводили один раз в сутки).
Первые кристаллы инсулинабыли получены в 1952 г.; развитие методов очистки гормона (иммуноэлектрофорез, ВЭЖХ) от других гормональных веществ (глюкагона — антагониста инсулина и соматостатина, последний подавляет выделение инсулина и глюкагона) и продуктов деградации инсулина позволили получить гомогенный инсулин, называемый однокомпонентным.
В 1954 г. английский биохимик Г. Сенджер получил Нобелевскую премию за расшифровку структуры инсулина.
Синтез обеих цепей инсулина и соединение их дисульфидными связями был проведён в 1963-1965 гг. В начале 70-х гг. советскими учёными А. Юдаевым и С. Швачкиным был предложен химический синтез инсулина. Осуществить в промышленном масштабе столь дорогостоящий и сложный синтез полипептидного гормона, состоящего из десятков аминокислотных остатков нерентабельно, в том числе и по причине малого выхода.
В 70-е гг. 20 века шло прогрессирующее улучшение степени очистки инсулинов, что уменьшило проблемы, обусловленные инсулиновой аллергией, нарушениями работы почек, расстройством зрения и иммунной резистентностью к инсулину. Со времени открытия и до начала 80-х гг. использовали инсулин, получаемый из поджелудочной железы КРС и свиней. Инсулин КРС отличается тремя аминокислотами, свиной — одной аминокислотой от инсулина человека. Наиболее эффективный, гормон для заместительной терапии при сахарном диабете — гомологичный инсулин, т.е. инсулин человека.
В 1980 г. Датская фармацевтическая компания «Novo» разработала метод превращения инсулина свиньи в инсулин человека ферментативным замещением аланина, последний является 30-й аминокислотой в цепи В, на остаток треонина с последующей хроматографической очисткой продукта, в результате чего получен однокомпонентный инсулин человека 99% чистоты.
Достижения молекулярной биологии позволили установить, что биосинтез инсулина в β-клетках островковой ткани происходит по следующим основным этапам:
— закодированная информация о структуре гормона содержится в инсулиновом гене (участок ДНК) 11-й хромосомы;
— в результате стимулирующего действия, прежде всего глюкозы и некоторых других веществ, эта информация списывается РНК-полимеразой с инсулинового гена в виде мРНК на рибосомах, в которых осуществляется соединение аминокислот с образованием белков. На рибосомах происходит сборка полипептидной цепи из 109 аминокислот с образованием препроинсулина под влиянием рестриктаз, в результате образуются фрагменты от нескольких сотен до нескольких тысяч нуклеотидов; при синтезе препроинсулина в β-клетках поджелудочной железы первые 23 аминокислоты «проводят» молекулу через мембрану клетки. Эти аминокислоты отщепляются рестриктазами и образуется пептид проинсулин, состоящий из 86 аминокислот. Молекула проинсулина сворачивается таким образом, что начальный и конечный её сегменты сближаются, а центральная часть молекулы удаляется под влиянием ферментов рестрикции; роль центральной части сводится к правильному взаимному расположению двух цепей инсулина.
В Великобритании с помощью Е. coli синтезированы обе цепи человеческого инсулина, которые затем были соединены в молекулу биологически активного гормона. Чтобы одноклеточный организм мог синтезировать на своих рибосомах молекулы инсулина, необходимо снабдить его нужной программой, т.е. ввести ему ген гормона. Химическим способом (операцию проводят специалисты биохимики) получают ген, программирующий биосинтез предшественника инсулина или два гена, программирующие в отдельности биосинтез цепей А и В инсулина. Следующий этап — включение гена предшественника инсулина (или гены цепей инсулина порознь) в геном Е. coli — особого штамма кишечной палочки, выращенного в лабораторных условиях; эту задачу выполняет генная инженерия. Из Е. coli вычленяют плазмиду соответствующей рестриктазой. Синтетический ген встраивается в плазмиду (клонированием с функционально активной С-концевой частью β-галактозидазы Е. coli). В результате Е. coli приобретает способность синтезировать белковую цепь, состоящую из галактозидазы и инсулина. Синтезированные полипептиды отщепляют от фермента химическим путём, затем проводят их очистку. В бактериях синтезируется около 100000 молекул инсулина на бактериальную клетку.
Природа гормонального вещества, продуцируемого Е. coli, обусловлена тем, какой ген встраивается в геном одноклеточного организма. Если клонирован ген предшественника инсулина, бактерия синтезирует предшественник инсулина, который подвергается затем обработке рестриктазами для отщепления препептида с вычленением С-пептида, вследствие чего получается биологически активный инсулин. Для получения очищенного инсулина человека выделенный из биомассы гибридный белок подвергают химико-ферментативной трансформации и соответствующей хроматографической очистке (фронтальной, гельпроникающей, анионообменной).
В Институте биоорганической химии РАН получен рекомбинантный инсулин с использованием генно-инженерных штаммов Е. coli. Из выращенной биомассы выделяется предшественник, гибридный белок, экспрессируемый в количестве 40% от всего клеточного белка, содержащий препроинсулин. Превращение его в инсулин in vitro осуществляется в той же последовательности, что и in vivo — отщепляется лидирующий полипептид, препроинсулин превращается в инсулин через стадии окислительного сульфитолиза с последующим восстановительным замыканием трёх дисульфидных связей и ферментативным вычленением связывающего С-пептида. После ряда хроматографических очисток, включающих ионообменные, гелевые и ВЭЖХ, получают человеческий инсулин высокой чистоты и природной активности.
Использование аффинной хроматографии значительно снизило содержание в препарате загрязняющих белков с более высокой м.м., чем у инсулина. К таким белкам относятся проинсулин и частично расщепленные проинсулины, которые способны индуцировать выработку антиинсулиновых антител. Стандартизация инсулина по загрязнению классифицирует препараты на обычные — содержащие проинсулина более 1%, монопиковые — менее 0,3%, улучшенные монопиковые — менее 0,005% и монокомпонентные, содержащие менее 0,001% проинсулина.
Использование человеческого инсулина с самого начала терапии сводит к минимуму возникновение аллергических реакций. Наиболее частые осложнения инсулиновой терапии — гипогликемические состояния, основными признаками избытка инсулина являются нарушения функции ЦНС (спутанность сознания, странное поведение, кома).
Компания «Eli Lilly» в массовом производстве человеческого инсулина использует технологию рекомбинантных ДНК, помещая кДНК гена человеческого проинсулина в Е. coli или S. serevisae и гидролизуя наработанный проинсулин до молекулы инсулина. Человеческие инсулины этой фирмы носят название «Хумулин». В медицинской практике используют рекомбинатные человеческие инсулины из серии Хумулин («Eli Lilly») — регулярный, НПХ, ленте, ультраленте и их комбинированные составы. Человеческий инсулин быстрее абсорбируется и независимо от формы препарата имеет более короткую длительность действия, чем животные инсулины. Человеческие инсулины менее иммуногенны, чем свиные, особенно смешанные бычьи и свиные инсулины.
В молекуле инсулина обнаружены области, играющие повышенную роль в его физико-химических и биологических свойствах. При внесении мутационных изменений в аминокислотную последовательность этих областей, существенным образом изменяются свойства молекулы в целом. Удалось получить аналоги с модификацией В-цепи, что привело к значительному увеличению гормональной активности по сравнению с природным инсулином.
Контроль качества генноинженерного инсулина предполагает контроль дополнительных показателей, характеризующих стабильность рекомбинантного штамма и плазмиды, отсутствие постороннего генетического материала в препарате, идентичность экспрессируемого гена и др. (всего 22 показателя).
В настоящее время в медицинской практике используют инсулины трех типов:
— короткодействующие с быстрым началом эффекта;
— средней продолжительности действия;
— длительного действия с медленным проявлением эффекта.
Инсулин короткого действия — регулярный инсулин — представляет собой короткодействующий растворимый при нейтральном значении pH кристаллический цинк-инсулин, эффект которого развивается в течение 15 мин после подкожного введения и продолжается 5-7 ч.
С целью увеличения длительности действия все другие препараты инсулина модифицированы и при растворении в нейтральной среде образуют суспензию. Они содержат протамин в фосфатном буфере — протамин-цинк-инсулин и НПХ (нейтральный протамин Хагедорна) — НПХ-инсулин или различные концентрации цинка в ацетатном буфере — инсулины ультраленте, ленте, семиленте.
Препараты инсулина средней длительности действия содержат протамин, представляющий белок средней м.м. 4400, богатый аргинином и получаемый из молок радужной форели. Для образования комплекса требуется соотношение протамина и инсулина 1:10. После подкожного введения протеолитические ферменты разрушают протамин, позволяя инсулину всасываться.
НПХ-инсулин не изменяет фармакокинетический профиль смешиваемого с ним регулярного инсулина. НПХ-инсулин предпочтительнее инсулина ленте в качестве компонента средней длительности действия в терапевтических смесях, содержащих регулярный инсулин.
В фосфатном буфере все инсулины (свиной, бычий, человеческий) легко образуют кристаллы с цинком, но только кристаллы бычьего инсулина обладают достаточной гидрофобностью, чтобы обеспечить замедленное и стабильное высвобождение инсулина, характерного для ультраленте. Цинковые кристаллы свиного инсулина растворяются быстрее, эффект, наступает раньше, длительность действия короче. Поэтому не существует препарата ультраленте, содержащего только свиной инсулин. Монокомпонентный свиной инсулин выпускают под названием инсулин-суспензия, инсулан-нейтрал, инсулин-изофан, инсулин-аминохинурид.
Инсулин ленте — это смесь 30% инсулина семиленте (аморфный преципитат инсулина с ионами цинка в ацетатном буфере, эффект которого развеивается относительно быстро) с 70% инсулина ультраленте (плохо растворимый кристаллический цинк-инсулин, имеющий замедленное начало и пролонгированное действие). Эти два компонента обеспечивают комбинацию с относительно быстрой абсорбцией и стабильным длительным действием, делая инсулин-ленте удобным терапевтическим средством.
При введении инсулина в виде аэрозоля на слизистую оболочку носа эффективный уровень препарата в плазме достигается быстро, однако, длительное интраназальное введение инсулина оказывает токсическое действие на слизистую оболочку.
6.5.2 Соматотпропный гормон (СТГ) или гормон роста человека
СТГ — пептидный гормон, состоящий из 191 аминокислоты, секретируется передней долей гипофиза. Впервые гормон был выделен и очищен в 1963 г. из гипофиза, полученного из трупного материала. Дефицит этого гормона приводит к гипофизарной карликовости, частота встречаемости которой оценивается от 7 до 10 случаев на миллион человек (среди детей западных стран она составляет 1 на 5000 человек). Гормон видоспецифичен и является единственным средством лечения детей, страдающих от его недостатка; внутримышечное введение СТГ 10 мг/кт в течение года по три инъекции в неделю увеличивает рост я течение первого года лечения более чем на 6 см. Для достижения более ощутимых результатов введение гормона необходимо продолжать от возраста 4-5 лет до половой зрелости и даже далее. Из одного трупа удается получить 4-6 мг соматотропина в пересчете на конечный фармацевтический препарат.
Общего количества фармацевтического препарата, выпускаемого компаниями крупных производителей СТГ, хватало для лечения лишь одной трети случаев гипофизарной карликовости в развитых странах; недостаток соматотропина оказался ещё более острым с учетом других случаев его применения (незаживающие переломы, ожоги, язвы, нарушение гемопоэза).
К тому же возникли проблемы, связанные с гетерогенностью гормона, выделяемого из трупного материала. Несмотря на совершенствование выделения и очистки гормона, у 5% больных, получавших препарат, вырабатывались антитела, которые сводили на нет его биологическую активность. Кроме того, гипофизарный материал заражён нейротоксическим вирусом с необычайно длительным инкубационным периодом, поэтому дети, получавшие СТГ, нуждались в многолетнем медицинском наблюдении. Вирус, содержавшийся в препаратах СТГ, нередко приводил к летальному исходу. С 1985 г. ВОЗ запрещено применение гормона, выделяемого из человеческих гипофизов.
Рекомбинантный соматотропин, получивший название соматрем, стал вторым (после человеческого инсулина) биосинтетическим фармацевтическим препаратом. СТГ, биологически чистый и свободный от вирусных загрязнений, впервые был получен в 1980 г. фирмой «Genentech». Гормон, синтезированный в генетически сконструированных клетках кишечной палочки, отличается от гормона, выделенного из гипофиза, дополнительным остатком метионина на NH2-конце молекулы (гормон обладает биологической активностью нативного гормона и даже большим эффектом, чем гормон роста из гипофиза, по-видимому, по причине большей чистоты). У детей, страдающих гипофизарной карликовостью, зарегистрирован прирост на 8 – 18 см в год, что несколько больше эффекта гормона, полученного из гипофиза. На первом этапе клонировали двунитевую ДНК-копию мРНК и расщеплением рестрикционными эндонуклеазами получили последовательность, которая кодирует всю аминокислотную последовательность гормона, за исключением первых 23 аминокислот. Затем клонировали синтетический полипептид, соответствующий аминокислотам от 1-й до 23-й. Далее два фрагмента объединяли, затем «подстроили» к паре промоторов (промотор — специфическая последовательность в ДНК, необходимая для инициации транскрипции РНК-полимеразы) и участку связывания рибосом. Коненчный выход гормона составил 2,4 мкг на 1 мл культуры Е. coli (100000 молекул гормона на клетку). СТГ, синтезированный в бактериях, обладал нужной м.м. и не был связан с каким-либо бактериальным белком, от которого его необходимо было бы отщеплять.
Изменяя аминокислотную последовательность СТГ, т.е. его первичную структуру посредством модификации кодирующего его гена, в бактериальных клетках можно синтезировать аналоги гормона, очень важные для изучения активных участков молекулы (например, участков, которые стимулируют рост или оказывают действие на неоглюкогенез) и этиологии карликовости на молекулярном уровне.
Используя методы рекомбинантных ДНК, можно синтезировать и другие факторы роста и факторы дифференцировки тканей, выделив вначале их мРНК, затем получив соответствующие гены. Это относится к соматомедину А, стимулирующему фиксацию серы в хряще, образование которого индуцируется соматотропином.
В 1982 г. выделен и синтезирован полипептид, состоящий из 44 аминокислотных остатков, обладающий полной биологической активностью гипоталамического рилизинг-фактора соматотропина (СТГ- РФ). Введение СТГ-РФ способно компенсировать недостаток соматотропина. Применение СТГ-РФ возможно не только для лечения гипофизарной карликовости, но и при некоторых формах диабета и для ускорения регенерации тканей у людей, получивших сильные ожоги.
6.5.3. Эритропоэтин
Эритропоэтин (греч. eritrhros — красный + poietikos — создающий, производящий) — гормон гликопротеиновой природы, стимулирующий пролиферацию и диффенренцировку эритропоэтин-чувствительных клеток в морфологически распознаваемые эритробласты. Это полипептид, состоящий из 165 аминокислот с м.м. 30400. Эритропоэтин стимулирует пролиферацию и дифференцировку клеток эритроидного ростка, действует на специфические рецепторы эритропоэтина, которые имеются на предшественниках эритроцитов в костном мозге. Эндогенный эритропоэтин выделяется в почках в ответ на тканевую гипоксию. При анемии индукция эритропоэтина повышена, что стимулирует образование эритроцитов в красном мозге и приводит к коррекции анемии. Эритропоэтин показан больным с почечной недостаточностью и выраженной анемией. Он повышает уровень гемоглобина и обычно снимает необходимость переливания крови у этих пациентов; эритропоэтин полезен при СПИДе и раке.
Эритропоэтин выделен первым из всех гемопоэтических факторов (впервые получен из мочи больных тяжелой анемией). Получение значимых количеств эритропоэтина человека из природных источников практически невозможно из-за низкого его содержания в сырье. С использованием генноинженерной технологии в культуре клеток млекопитающих (штамм СНО) получают рекомбинантный человеческий эритропоэтин. Производство препарата основано на комбинации иммуноаффинной и ионно-обменной хроматография и позволяет получать практически гомогенный, мономерный, полностью активный белок, не содержащий значимых примесей. Уже много лет, получаемый по новой технологии, эритролоэтин является, ведущим продуктом предприятия Amgen — Калифорния (США). Годовой оборот от его производства составляет более 3 млрд. долларов.
Эритропоэтин принадлежит к четырем генно-инжёнерным препаратам, производимым в России. В частности, НПО «Микроген» выпускает «Эритростим», представляющий высокоочищенный (99,5 %) рекомбинантный эритропоэтин человека с сывороточным альбумином в виде раствора на изотоническом нитратном буфере.
Вирусы — облигатные (безусловные) внутриклеточные паразиты, чья репликация полностью зависит от процессов синтеза ДНК, РНК и белков в клетке хозяина.
Репликация вирусов включает несколько этапов:
— адсорбция и проникновение в клетку;
— синтез ранних, неструктурных белков, например, полимераз, нуклеиновых кислот;
— синтез РНК или ДНК;
— синтез конечных структурных белков;
— сборка (созревание) вирусных частиц и их выход из клетки.
При многих вирусных инфекциях репликация вируса достигает максимума во времени появления первых клинических признаков заболевания или даже ранее. Формированию у реципиента иммунитета к патогенным микроорганизмам способствует вакцинация. Антитела, вырабатываемые в ответ на введение вакцины в организм, запускают иммунный ответ — вырабатываются антитела, которые при последующей инфекции блокируют пролиферацию патогенного микроорганизма и не позволяют развиться заболеванию.
Эффект вакцинации был открыт более 200 лет назад (1796 г.) врачом Эдвардом Дженнером, доказавшим, что человек, перенесший коровью оспу, не очень тяжелую болезнь крупного рогатого скота, становится невосприимчив к оспе натуральной. Натуральная оспа — высококонтагиозное (заразное) заболевание, с высокой смертностью. Даже, если больной не погибает, у него нередко возникают различные уродства, психические расстройства, слепота. Э. Дженнер публично провел прививку коровьей оспы 8-летнему мальчику Джеймсу Фиппсу, использовав для этого экссудат из пустулы больной коровьей оспой, а затем, через определенное время, дважды инфицировал ребенка гноем из пустулы больного натуральной оспой. Все проявления заболевания ограничились покраснением в месте прививки, исчезнувшим через несколько дней.
Начиная с первой вакцины, созданной Э. Дженнером, большинство человеческих противовирусных вакцин созданы на основе убитых (инактивированных) патогенных микроорганизмов или живых, но не вирулентных (аттенуированных) штаммов. Этот подход достаточно эффективен и предотвращает распространение многих вирусных инфекций, однако его применение ограничено рядом причин:
— невозможностью культивирования всех патогенных микроорганизмов;
— потенциальной опасностью в работе с патогенными микроорганизмами и вирусами;
— возможностью возвращаться к исходному вирулектному штамму аттенуированных штаммов (инактивация часто бывает неполной);
— высокой стоимостью производства традиционных вакцин (титр вирусов животных и человека в культуре и скорость их размножения, как правило, невысоки).
Технология рекомбинантных ДНК позволяет создавать новое поколение вакцин более безопасных и эффективных, менее дорогих, не имеющих ограничений в применении.
При этом используют разные подходы:
1. Патогенный микроорганизм модифицируют, убирая гены, ответственные за вирулентность, при этом сохраняется способность штамма вызывать иммунный ответ. Получаются живые вакцины, содержащие непатогенные микроорганизмы, которые не могут ревертировать и становиться патогенными.
2. Гены или их сегменты, кодирующие основные антигенные детерминанты (белки) патогенных микроорганизмов, экспрессируют в альтернативном хозяине, например Е. coli, получают нужный продукт в большом количестве и используют его как вакцину. Такие вакцины, содержащие лишь отдельные компоненты патогенного микроорганизма, называют субъединичными вакцинами. Достоинства субъединичных вакцин состоят в том, что препарат, содержащий очищенный иммуногенный белок, стабилен и безопасен, его химические свойства известны, в нем отсутствуют дополнительные белки и нуклеиновые кислоты, которые могут быть причиной нежелательных побочных эффектов в организме-хозяине. Недостатки субъединичных вакцин — очистка специфического белка высока по стоимости, его конформация после выделения может отличаться от той, которую он имеет в составе вирусного капсида или оболочки, что может повлечь изменение его антигенных свойств.
3. Клонированные гены, кодирующие основные антигенные детерминанты патогенного организма, встраивают в геном непатогенного носителя (обычно вируса) и получают живую безопасную, не содержащую болезнетворных микроорганизмов вакцину. Живые вакцины, как правило, более эффективны, чем неживые или субъединичные.
Одним из новых направлений создания рекомбинантных вакцин является разработка ДНК-вакцин (так называемых генных, полинуклеотидных вакцин, вакцин из нуклеиновых кислот). Принцип применения ДНК-вакцин заключается в том, что в организм пациента вводят молекулу ДНК, содержащую гены, кодирующие иммуногенные белки патогенного организма и генетические элементы, которые необходимы для экспрессии этого гена в клетках эукариотов (человека). В качестве продуцентов таких генов используют бактериальные клетки, содержащие рекомбинантные плазмиды с соотвествующими генами. После получения достаточной биомассы (количества копий) плазмидную ДНК выделяют из бактерий, очищают от других молекул ДНК и примесей. Полученную ДНК-вакцину вводят парентерально, при этом большая ее часть поступает в межклеточное пространство, после чего включается в клетки.
Противогерпетические вакцины. Вирус простого герпеса (HSV — Herpes simplex virus) вызывает инфекционное заболевание генерализованного или местного характера (характеризуется преимущественно поражением кожи, слизистых оболочек, нервной системы и хроническим рецидивирующим течением, урогенитальными инфекциями, тяжелым поражением глаз, энцефалитом и т.д.). Кроме того, он является онкогенным, поэтому вакцинация убитым или аттенуированным вирусом сопряжена с определенным риском развития рака. Для защиты от HSV- инфекции используют неонкогенную субъединенную вакцину.
Для создания любой субъединенной вакцины, прежде всего, идентифицируют те компоненты патогенного микроорганизма, которые индуцируют выработку антител. В случае HSV-типа таким компонентом является гликопротеин Д-оболочки (gД). В ответ на введение этого гликопротеина мышам у них вырабатываются антитела, нейтрализующие интактный HSV. Ген gД HSV-1 был изолирован, клонирован в одном из экспрессирующих векторов в клетках млекопитающих и введен в яйцеклетки китайского хомячка (СНО), в которых, в отличие от Е. coli, происходит гликолизирование чужеродных белков. Полноразмерный ген gД кодирует белок, в норме называющийся с мембраной клетки млекопитающего. Затем модифицированным геном трансформировали СНО-клетки, которые гликозилировали белковый продукт и секретировали его во внешнюю среду, так как он не мог встраиваться в клеточную мембрану. Антитела, вырабатываемые в ответ на введение модифицированного белка gД, эффективны в отношении вируса простого герпеса.
Противосальмонеллезные вакцины. Разные штаммы Salmonella вызывают острые кишечные инфекции, постнатальную (послеродовую) инфекцию, брюшной тиф, пищевую токсикоинфекцию. Для профилактики всех этих заболеваний у овец, КРС, цыплят и человека эффективные пероральные вакцины созданы методом двойной делеции.
Такой способ получения непатогенных штаммов, пригодных для создания на их основе живых вакцин, состоит в удалении из генома патогенных бактерий хромосомных областей, отвечающих за независимые жизненноважные функции. Лучше делетировать по крайней мере две такие области, так как вероятность их одновременного восстановления очень мала. Штамм с двойной делецией обладает ограниченной пролиферативной способностью и сниженной патогенностью, но обеспечивает выработку иммунного ответа. Штаммы Salmonella с двойной делецией вызывают легкую форму инфекции и обладают в 100000 раз меньшей вирулентностью.
Цитокины — большая гетерогенная группа белков с различными функциями, синтезируемая лимфоретикулярными клетками. Цитокины участвуют во многих видах взаимодействий, обеспечивающих функционирование иммунной системы и контроль гемопоэза. Первая группа цитокинов была представлена интерферонами (ИФН), часть цитокинов была классифицирована как интерлейкины (ИЛ), пронумерованные в порядке их обнаружения.
ИФН — это группа эндогенных гликопротеидов с м.м. около 3000, которые оказывают неспецифическое противовирусное действие, влияя на клеточные метаболические процессы синтеза РНК и белка. Первоначально было установлено, что ИФН вырабатывают клетки, инфицированные вирусами (тип I); в дальнейшем — что ИФН вырабатывают также лимфоциты в ходе иммунной реакции (тип II).
Для получения больших количеств ИФН используют шестидневные однослойные культуры клеток куриного эмбриона или культивируемые лейкоциты крови человека, зараженные определенным видом вируса. Иными словами, для получения ИФН создают определенную систему вирус-клетка.
Из клетки человека изолирован ген, ответственный за биосинтез ИФН. Экзогенный человеческий ИФН получают, используя технологию рекомбинантных ДНК. Процедура выделения кДНК интерферонов состоит в следующем:
— Из лейкоцитов человека выделяют мРНК, фракционируют ее по размерам, проводят обратную транскрипцию, встраивают в сайт модифицированной плазмиды.
— Полученным продуктом трансформируют Е. coli, образовавшиеся клоны подразделяют на группы, которые идентифицируют.
— Каждую группу клонов гибридизируют с ИФН — мРНК.
— Из образовавшихся гибридов, содержащих кДНК и кРНК, выделяют мРНК, проводят ее трансляцию в системе синтеза белка.
— Определяют интерферонную противовирусную активность каждой смеси, полученной в результате трансляции. Группы, проявившие интерферонную активность, содержат клон с кДНК, гибридизировавшийся с ИФН — мРНК; повторно идентифицируют клон, содержащий полноразмерную ИФН — кДНК человека.
ИФН проявляют некоторые виды активности как лимфокины и иммуномодуляторы. ИФН I типа, действующие преимущественно как ингибиторы репликации вирусов в клетке, реализуют свой эффект, стимулируя выработку рибосомами клеток хозяина клеточных ферментов, которые тормозят продукцию вирусов, нарушая трансляцию вирусной мРНК и синтез вирусных белков.
ИФН вырабатывают большинство видов животных, но проявление их активности видоспецифично, т.е. они действуют только у того вида животных, в которых вырабатываются.
Описаны три основных человеческих ИФН:
— ИФН — α, представляющий собой фибробластный ИФН типа I;
— ИФН — β — человеческий фибробластный ИФН типа I;
— ИФН — γ — человеческий иммунный ИФН типа II.
ИФН, вырабатываемые клетками любого типа, различают по химическому строению и виду активности (табл. 2). ИФН являются одним из основных эндогенных факторов, препятствующих поражению организма вирусной инфекцией.
ИФН вызывают индукцию трех ферментов:
— протеинкиназы, нарушающей начальный этап построения пептидной цепи;
— олигоизоаденилатсинтетазы, активирующей РНК-азу, которая разрушает вирусную РНК;
— фосфодиэстеразы, разрушающей конечные нуклеотиды тРНК, что приводит к нарушению элонгации пептида.
С учетом антивирусного и иммуномоделирующего эффектов ИФН в НПО «Биомед» предложены и успешно апробированы суппозитории с ИФН-α и пробиотиками при терапии дисбактериозов вирусной и бактериальной этиологии, кандидозов; в гинекологической практике для лечения эндометритов, кольпитов, вагинитов и гинекологического герпеса.
Побочные эффекты ИФН включают лихорадку, утомляемость, головные боли, слабость, миалгии, анемии, желудочно-кишечные и сердечнососудистые нарушения.
Развитие методов клонирования генов в значительной мере облегчило продукцию высокоочищенных цитокинов всех типов и идентификацию большинства интерлейкинов (ИЛ).
Специфический ген человеческого ИЛ с присоединенным к нему сегментом ДНК, кодирующим маркерный пептид (участок гибридной белковой молекулы, облегчающий идентификацию и очистку белка), переносят в микробные клетки-продуценты, где экспрессируется химерный белок (продукт клонированного гена, защищенный одной или несколькими аминокислотами от расщепления протеиназами клетки- хозяина). Конструирование рекомбинантных молекул ИЛ осуществляется набором специфичных ферментов. Маркерный пептид, входящий в состав химерного белка, очищают иммуноафинной хроматографией.
|
Название препарата |
Подтип ИФН |
Способ получения |
Фармакологическое действие |
Показания к применению |
|
Интерферон |
α |
Биосинтез в культуре лейкоцитов донорской крови под воздействием вирусов |
Антивирусное, иммуномодулирующее, антипролиферативное |
Вирусные заболевания, лейкоз, злокачественная меланома, рак почек, карциноидный синдром |
|
Интерлок |
α |
Биосинтез в культуре лейкоцитов донорской крови под воздействием парамиковирусов |
Подавляет жизнедеятельность ряда вирусов |
Вирусные заболевания глаз, гепатиты |
|
Интерферон альфа-2 |
α2 |
Рекомбинантный |
Антивирусное, иммуномодулирующее, ингибирует пролиферацию большого спектра опухолевых
|
Эпителиальная форма острой и рецидивирующей вирусной инфекции глаз, онкологические заболевания |
|
Интерферон альфа-2а |
α2а |
Рекомбинантный. Белок, содержащий 165 аминокислот |
Противовирусная, противоопухолевая активность |
Лейкемический ретикулоэндотелиоз, саркома Капоши, рак почки, мочевого пузыря, меланома, опоясывающий лишай |
|
Реаферон |
α2 |
Рекомбинантный ИФН, продуцируемый бактериальным штаммом псевдомонады, в генетический аппарат который встроен ген человеческого лейкоцитарного ИФНα2. Идентичен человеческому лейкоцитарному ИФНα2. |
Противовирусная, иммуномодулирующая, противоопухолевая активность |
Вирусные, опухолевые заболевания |
|
Интерферон альфа-n1 |
αn1 |
Высокоочищенный человеческий ИФН |
Противовирусная |
Хронический активный инфекционный гепатит В |
|
Интерферон бета |
β |
Суперпродукция фибробластов человека стимулятором в присутствии ингибиторов обменных процессов |
Противовирусная, иммуномодулирующая, противоопухолевая активность |
Хронические вирусные инфекции в офтальмологии, гинекологии и урологии, дерматологии, онкологии |
|
Интерферон гамма |
γ |
Рекомбинантный |
Противовирусная, иммуномодулирующая, противоопухолевая активность |
Хронические гранулематозные заболевания |
Главным из цитокинов являются ИФН-γ и ИЛ-2. ИФН-γ — ключевой медиатор активации системы естественной цитотоксичности, регулирует процесс дифференцировки естественных киллерных клеток и их цитотоксическое взаимодействие с клетками-мишенями, стимулирует цитотоксические и регуляторные функции макрофагов, активирует цитотоксические лимфоциты. Под действием ИФН-γ повышается продукция цитокинов, таких, как ИЛ-1, ИЛ-2, ИЛ-12, ИФН-β, и фактора некроза опухолей-α. ИЛ реализуют эффект через рецепторы на поверхности соответствующих клеток-мишеней.
Многие ИЛ проходят стадию клинического изучения, другие — нашли разнообразное применение в лечении инфекций, воспалительных, аутоиммунных и неопластических расстройств. Так, ИЛ-1 показан для лечения воспалений и септического шока, ИЛ-2 включен в схемы лечения имуногенных опухолей (меланомы, почечноклеточного рака, рака мочевого пузыря).
