Глава 11. Биодеградация токсических соединений и утилизация биомассы
11.1. Метаболические пути биодеградации ксенобиотиков, созданных методом генной инженерии
11.2. Утилизация крахмала и сахаров
11.3. Основные санитарные и экологические требования к производству биопрепаратов
Еще сравнительно недавно ни у кого не возникало сомнений, что окружающая среда — земля, воздух, вода — всегда будут аффективно перерабатывать бытовые, промышленные, сельскохозяйственные отходы. Человечество столкнулось с двумя фундаментальными проблемами — переработкой отходов, постоянно образующихся в огромном количестве, и разрушением токсических соединений, десятилетиями накапливающихся в воде, почве, на свалках. Отходы сжигают, обрабатывают химикатами, но это лишь усугубляет загрязнение окружающей среды и, к тому же, дорого обходится. Разные страны пытаются решить эти проблемы законодательным путем, однако успеха здесь нет. В условиях НТП экосфера испытывает мощное антропогенное воздействие, в результате нарушается природная гармония, сложившаяся тысячелетиями, происходят заметные сдвиги в экосистемах, приводящие к исчезновению целых видов животных и растений, возникают новые формы микроорганизмов, нарушаются иммунные реакции человека.
В настоящее время проходят проверку многие технологические, в том числе биотехнологические приемы, с помощью которых возможно перерабатывать большие количества отходов и токсических веществ. Правительства многих стран поощряют предприятия, перерабатывающие отходы производства, повторно использующие содержащиеся в них полезнее вещества.
Термин «биодеградация» относится к процессу разрушения загрязняющих веществ, попавших в окружающую среду, с помощью живых микроорганизмов. Термин «биомасса» — к совокупности веществ и материалов, побочных продуктов пищевой, перерабатывающей промышленности, ранее считавшихся отходами, ставших сырьем для производства ряда экономически важных продуктов.
В середине 1960-х гг. были обнаружены почвенные микроорганизмы, деградировать ксенобиотики (гербициды, пеетициды, органические растворители и т.д.). Основную группу почвенных микроорганизмов, разрушающую ксенобиотики, составляют бактерии рода Pseudomonas, разные штаммы которых способны расщеплять более 100 органических соединений.
В биодеградации сложной органической молекулы обычно участвуют несколько разных ферментов. Гены, кодирующие такие энзимы, могут иметь хромосомную локализацию, но чаще всего входят в состав крупных плазмид, иногда локализуются в хромосомной и плазмидной ДНК.
Бактерии, разрушающие негалогенированные ароматические соединения, как правило, превращают их в катехол или протокатехоат. Затем, в ходе нескольких реакций окислительного расщепления — в ацетил-СоА и сукцинат или пируват и ацетальдегид, последние метаболизируют практически все микроорганизмы.
Галогенированные ароматические соединения, основные компоненты большинства пестицидов, гербицидов, с помощью этих же ферментов разрушаются до катехола, протокатехоата, гидрохинона или их галогенированных производных, причем скорость их деградации обратно пропорциональна числу атомов галогена в исходном соединении. Дегалогенирование (отщепление замещенного атома галогена от органической молекулы) необходимо для детоксикации соединения. Дегалогенирование осуществляется по ходу неспецифической диоксигеназной реакции замещением галогена в бензольном кольце на гидроксильную группу.
11.1. Метаболические пути биодеградации ксенобиотиков, созданных методом генной инженерии
Ряд микроорганизмов обладает природной способностью к деградации различных ксенобиотиков, однако:
— ни один из них не может разрушать все органические соединения;
— некоторые органические соединения при высокой концентрации подавляют функционирование или рост микроорганизмов, их деградирующих;
— большинство очагов загрязнения содержат смесь химикатов;
— микроорганизм, способный разрушать один или несколько компонентов этих смесей, может инактивироваться другими компонентами;
— многие неполярные соединения адсорбируются частицами почвы и становятся менее доступными;
— биодеградация органических соединений происходит довольно медленно.
Часть этих проблем решает конъюгированный перенос плазмид в один рецепиентный штамм. Если две плазмиды содержат гомологичные участки, между ними может произойти рекомбинация с образованием гибридной плазмиды, которая имеет больший размер и обладает свойствами исходных плазмид. Если две плазмиды не содержат гомологичных участков и относятся к разным группам несовместимости, они могут сосуществовать в одной бактерии.
В 1970 г. был создан первый бактериальный штамм, обладающий более широкими катаболическими возможностями. Он расщеплял большинство углеводов нефти и был назван «супербациллой». Для его получения использовали плазмиды, каждая из которых кодировала фермент, расщепляющий определенный класс углеводородов (рис. 22).

Конъюгацией была перенесена плазмида САМ в штамм, несущий плазмиду ОСТ. Эти плазмиды несовместимы (не могут существовать в клетке в виде отдельных плазмид), но в результате произошедшей между ними рекомбинации образовалась одна плазмида, объединяющая их функции. Затем плазмиду NAH перенесли в штамм, несущий плазмиду XVL; эти плазмиды совместимы и могут сосуществовать в одной клетке-хозяине. Наконец, гибридную плазмиду перенесли в штамм, несущий плазмиды NAH и XVL. В результате этих манипуляций получили штамм, растущий на неочищенной нефти лучше исходных штаммов, взятых по отдельности или вместе. Этот штамм не использовали для ликвидация нефтяные загрязнений, но он сыграл важную роль в становлении биотехнологической промышленности. Изобретатель «супербациллы» получил патент США, описывающий структуру данного штамма и возможности его применения. Это был первый патент на создание генетически модифицированного микроорганизма.
Большинство разрушающих ксенобиотики бактерий, модифицированных переносом плазмид, являются мезофилами. Вода загрязненных рек, озер обычно имеет низкий диапазон температур, поэтому была создана бактерия, обладающая более широкими катаболическими возможностями, способная расти и развиваться при более низких температурах. Для этой цели плазмида TOL (детерминирует разрущение толуола) методом конъюгации перенесли в психрофильный штамм Pseudomonas putida, утилизирующий салицилат при температуре 0 °С. Трансформированный штамм содержал введенную в него плазмиду TOL и собственную плазмиду SAL, детерминирующую при 0 °С разрушение салицилата и толуола как источников углерода. Психрофильный штамм нетрасформированного типа не мог расти при любой температуре, если единственным источником углерода был толуол. Эта работа показала принципиальную возможность создания психрофильных штаммов бактерий, эффективно разрушающих ксенобиотики в природных условиях.
Объединение разных метаболических путей в одном микроорганизме в помощью конъюгации — это лишь один из способов создания бактерий с новыми свойствами. Можно расширить их катаболические возможности, модифицируя гены, кодирующие ферменты того или иного метаболического пути. Совершенствование того или иного катаболического пути реально с помощью технологии рекомбинантных ДНК, традиционного мутагенеза и соответствующих методов отбора.
Одним из наиболее распространенных веществ, загрязняющих почву и воздух, является трихлорэтилен, широко использующийся в качестве растворителя и обезвоживающего средства. Трихлорэтилен длительное время остается в окружающей среде, считается канцерогенном; к тому же, анаэробные почвенные бактерии дегалогенируют его, превращая в еще более токсичное соединение — винил хлорид.
Некоторые штаммы P. putida, разрушающие такие ароматические соединения, как толуол, разрушают и трихлорэтилен. Генетическими исследованиями установлено, что для полной детоксикации трихлорэтилена не нужны все ферменты расщепления ксилола и толуола, достаточно лишь толуолдиоксигеназы, которая в норме катализирует реакцию окисления толуола до цис-толуолдигидродиола. Образование функциональной толуолдиоксигеназы кодируется четырьмя генами; их выделили и экспрессировали в Е. coli под контролем сильного промотора, который активируется изопропил-β-D-тиогалакто-пиранозидом, в результате трихлорэтилен разлагается до безвредных соединений. Исходная скорость деградации трихлорэтилена в Е. coli ниже, чем Р. putida, но она более длительно сохраняется в Е. coli.
11.2. Утилизация крахмала и сахаров
Крахмал — основной резервный полисахарид растений, представляющий смесь гомополимеров D-глюкозы как линейных (амилоза), так и разветвленных (амилопектин). Крахмал широко используют в пищевой промышленности и пивоварении, при этом его сначала гидролизуют до низкомолекулярных компонентов, затем превращают в другие соединения, преимущественно во фруктозу и этанол. Основные ферменты, необходимые для гидролиза крахмала и дальнейших превращений, — α-амилаза, глюкоамилаза и глюкозоизомераза, стоимость которых составляет около 30% общей стоимости ферментов, применяемых в настоящее время в промышленности.
Промышленное производство фруктозы и этанола из крахмала — многоэтапный процесс, включающий ферментативные и неферментативные стадии (рис. 23).
1. Желирование молотого зерна (содержание крахмала примерно 40%) проводится паром ШД давлением, в результате разрушаются крахмальные зерна и храхмал становится доступен для последующего ферментативного гидролиза. Полученный продукт имеет желеобразную консистенцию.
2. Ожижение желированного крахмала заключается в его охлаждении до 50-60 °С и добавлении α-амилазы, под влиянием которой гидролизуются доступные α-1,4-связи с образованием низкомолекулярных полисахаридов. Высокая температура повышает эффективность проникновения фермента в желированный крахмал и увеличивает скорость гидролиза.
3. Осахаривание (полный гидролиз) низкомолекулярных полисахаридов (как линейных, так и разветвленных) происходит под действием глюкоамилазы.
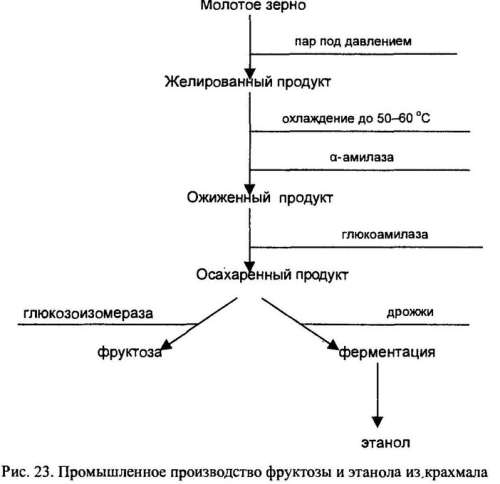
Конечным продуктом такой переработки является глюкоза, из которой с помощью дрожжевой ферментации получают этанол или при участии глюкозоизомеразы — фруктозу, α-амилазу можно выделить из микроорганизмов, для промышленных целей ее обычно получают из Bacillus amyloliquefaciens, глюкоамилазу также синтезируют многие микроорганизмы, но обычно ее получают из грибов Aspergillus niger.
Стоимость производства этанола и фруктозы из молотого зерна, в основном, определяется стоимостью ферментов, используемых однократно. Поэтому разработка недорогого широкомасштабного производства этих ферментов существенно снижает стоимость конечных продуктов.
Для этих целей используют:
— разновидности α-амилазы (встречающиеся в природе или созданные методом генной инженерии), обладающие более высокой активностью, позволяющие проводить ожижение при 80-90 °С, это ускоряет гидролиз желированного крахмала, экономит энергию, расходуемую на охлаждение до температуры, при которой идет гидролиз;
— модифицированные гены α-амилазы и глюкоамилазы, чтобы контролируемые ими ферменты имели одинаковые оптимумы температуры и pH, позволяющие совместить этапы ожижения и осахаривания;
— клонированные бактериальные гены, кодирующие ферменты — термостабильные, обладающие высокой каталитической активностью, устойчивые к действию этанола.
Сбраживание субстрата при промышленном производстве этанола осуществляется в основном S. cerevisiae, но более рационально использовать Zymomonas mobilis, грамотрицательную палочку, сбраживающую глюкозу, фруктозу, сахарозу с относительно большим выходом этанола.
Для расширения спектра утилизируемых субстратов, были выделены и экспрессировны в Z. mobilis чужеродные гены {ферментов, гидролизующих лактозу, крахмал, целлюлозу, ксилозу, целлобиозу, пентозу), в частности ген глюкозо/ксилозоизомеразы и ксилулокиназы — ферментов, необходимых для утилизации ксилозы. На следующем этапе в Z. mobilis имплантировали плазмиду, несущую два оперона, один из которых кодировал два фермента, метаболизирующих пентозу. Затем эти два оперона встраивали в челночный вектор Е. coli — Z. mobilis, которые трансформировали Z. mobilis. Трансформированные клетки утилизировали ксилозу и перерабатывали пентозы до этанола, причем продуценты эффективно росли, используя в качестве источника углерода побочные продукты деревообрабатывающей и целлюлозно-бумажной промышленности.
При переработке растительного материала образуется большое количество лигноцеллюлозных отходов, годовое производство их огромно, поэтому идет интенсивный поиск эффективных способов ферментативного расщепления. Комплекс лигноцеллюлозы подвержен совместному действию целлюлолитических микроорганизмов только после предварительной обработки сильной кислотой или щелочью, или высокой температурой под давлением, что существенно сказывается на стоимости конечного продукта.
Целлюлазные гены (эндо- и экзоглюканаза, β-глюгазидаза, целлобиогидролаза, целлобиза) клонировали и экспрессировали в Е. coli или другие микроорганизмы и получали новые штаммы с полезными свойствами. Так, S. cerevisiae и Z. mobilis, эффективно преобразующие в этанол простые сахара, после введения им целлюлозных генов могли превращать целлюлозу непосредственно в этанол.
Целлюлазы возможно использовать для промышленной биопереработки бумажных отходов в этанол. Для этого отходы частично расщепляли целлюлазами при 45 °С, затем, не удаляя целлюлаз, проводят ферментацию освободившейся глюкозы S. cerevisiae при 37 °С. Этот подход позволяет получить 400 л этанола из 1 т бумажных отходов, используя его в качестве топлива, экономя, примерно, 16% бензина.
Созданы штаммы Lactobacillus plantarum, способствующие более эффективному образованию силоса из сельскохозяйственных культур, которые содержат много крахмала, например люцерны.
Белок одноклеточных организмов (БОО) — этот термин принят для белковых продуктов, синтезируемых монокультурой Methylophiius methylotrophus (в качестве основного субстрата эти бактерии используют метан) на некоторых видах биомассы (целлюлозные отходы, продукты переработки нефти). Предполагалось, что БОО можно использовать в качестве пищевых добавок или корма для скота благодаря высокому содержанию метионина, лизина, витаминов, микроэлементов. Производство БОО оказалось экономически нецелесообразным по причинам высокой стоимости получаемых продуктов, сомнительного вкусового качества и токсичности. Для того чтобы разработать экономичный процесс производства БОО из отходов, необходимо изучить кинетику роста, метаболизма, возможность генетического манипулирования и безопасность многих микроорганизмов.
11.3. Основные санитарные и экологические требования к производству биопрепаратов
Продукция биопредприятий на всех этапах — от исследования и лабораторных испытаний до производства и упаковки конечного продукта — требует строгих правил к качеству, чистоте, безопасности лекарственных препаратов.
Производство стерильных препаратов особо точно регулируется национальными руководствами и Правилами; производства и контроля качества лекарственных средств good manufacturing practice for medicinal products (GMP) ГОСТ P 52249-2004.
Предприятия медицинской и микробиологической промышленнасти классифицируют согласно международному стандарту ИСО 14694-1 «Классификация чистых помещений и чистых зон загрязнениями», 1998 (от ИОС-1 до ИОС-9 — класс чистоты ПДК). Этой классификации соответствует российский стандарт ГОСТ Р 50766-95 «Чистые помещения. Классификация. Методы аттестации. Основные требования». Стандарт отличается только тем, что вместо ИСО указано обозначение Р (российский), в скобках — класс чистоты по американскому стандарту.
Каждое биопроизводство должно обеспечить защиту:
— сырья, промежуточных и конечных продуктов от любого загрязнения;
— персонала от субстанций, с которыми они работают;
— окружающей среды от веществ, которые при отсутствии соответствующих мер и контроля могут потоком воздуха выйти наружу с биопредприятия.
При неосторожной работе с рекомбинантными штаммами не исключено их попадание в окружающую среду, где они могут вызвать неконтролируемые мутации не только у микроорганизмов, но и у других видов живых существ. Это требует от персонала, занятого в разработке и реализации биотехнологических процессов с использованием приемов генной инженерии, большей ответственности и производственной дисциплины.
Перед окончательным удалением из установки все рекомбинантные микроорганизмы должны быть инактивированы в соответствии с определенными инструкциями. Отработанную культуральную среду тщательно проверяют на наличие в ней жизнеспособных микроорганизмов, чтобы исключить их попадание в окружающую среду.
Серьезные экологические проблемы возникают в связи с защитой водоемов от сточных вод, образующихся в больших объемах при биотехнологическом процессе. Основа очистки сточных вод и защити от них водоемов — дорогостоящие специальные очистные сооружения, а также замкнутые системы судооборота. Перед спуском вточных вод в очистные сооружения отработанные нативные растворы подвергают предварительно УФ-облучению с одновременным введением окислителя, что позволяет разрушить высокомолекулярные органические соединения с образованием низкомолекулярных веществ, поддающихся биологическому окислению в системе очистных сооружений. В «часы пик» предпочтительно эпизодическое использование коммерческих препаратов — генно-инженерных штаммов-деструкторов, например бактерий рода Pseudomonas, в плазмидах которых имеются гены окислительных ферментов. Постоянное присутствие щтаммов-деструкторов в промышленных стоках считается малоэффективным по причине малой стабильности плазмид.
Затем идут следующие этапы очистки:
— первичная обработка (удаление легко отделяющихся загрязнений — крупных, легко осаждающихся частиц, масляных плёнок);
— вторичная обработка (удаление суспендированных твёрдых частиц, как правило, органической природы, для этой цели исльзуют биологическое окисление — аэрацию);
— третичная обработка (полное отделение всех оставшихся примесей методами электродиализа, обратного осмоса, фильтрации, адсорбции).
Используют биологические фильтры, но предпочтительны биологические окислительные пруды с природным комплексом микроорганизмов (активный ил), напоминающие естественные водные экосистемы, где в процессе фотосинтеза водоросли выделяют кислород, поддерживая аэробный режим, который необходим для бактерий, утилизирующих органические загрязняющие вещества. При этом чётко отслеживается баланс роста и продуктивности бактерий различных групп.
Важной задачей защиты окружающей среды является сокращение выбросов вредных веществ в атмосферу. Ее решение связано с глубокой очисткой дымовых газов с исключением рассеивания в атмосфере конечного продукта.
Рациональное решение проблемы защиты окружающей среды должно базироваться на современных принципах разработки биотехнологических производств, основанных на безотходной или малоотходной технологии. Это наиболее прогрессивный путь решения экологических проблем, в том числе в области медицинской биотехнологии.
