Важнейшие аналитические реакции катионов
При контроле качества лекарственных препаратов требуется определение подлинности содержания в них компонентов, в том числе и катионов металлов, т.е. их идентификация. Почти для каждого катиона известно значительное число разнообразных аналитических реакций. Ниже охарактеризованы только те аналитические реакции, которые чаще применяются в анализе лекарственных средств.
1. Аналитические реакции катионов первой аналитической группы: Li+, Na+, K+, NH4+
Аналитические реакции катиона лития Li
1.1. Реакция с гидрофосфатом натрия Na2HPO4
Гидрофосфат натрия в нейтральной или слабощелочной среде образует с катионом лития белый осадок ортофосфата лития:
3Li+ + НРO42- = Li3PO4↓+ Н+
Реакцию проводят обычно в аммиачной среде для связывания выделяющихся ионов водорода. Для увеличения полноты осаждения при проведении реакции добавляют этанол (при этом растворимость фосфата лития уменьшается). Осадок Li3PO4 растворим в кислотах и растворах солей аммония.
Предел обнаружения катионов лития данной реакции составляет 5 мкг. Мешают все катионы, образующие нерастворимые фосфаты.
Методика. В пробирку вносят 10 капель раствора солей лития, добавляют столько же капель концентрированного раствора аммиака, несколько капель этанола и 15 капель раствора гидрофосфата натрия. Через 5 минут выпадает белый мелкокристаллический осадок, растворимый в уксусной кислоте. Прибавление большого количества этанола следует избегать во избежание выделения осадка Na2HPO4.
1.2. Реакция с фторидом аммония NH4F
Из водных растворов солей лития осаждают белый осадок фторида:
Li+ + F" = LiF↓
Растворимость фторида лития в воде уменьшается в присутствии аммиака. Предел обнаружения 50 мкг. Мешают катионы, дающие осадки фторидов: Са2+, Сu2+, РЬ2+и др.
Методика. В пробирку вносят 3-4 капли раствора солей лития, 1-2 капли концентрированного раствора аммиака и 4-5 капель раствора фторида аммония NH4F. Смесь нагревают. Медленно выпадает аморфный осадок фторида лития (осадок растворяется в уксусной кислоте).
Аналитические реакции катиона Na+
1.3. Микрокристаллическая реакция с раствором калия гексагидроксостибата (V) Na[Sb(OH)6]
В нейтральной среде (рН 7) на холоду катионы натрия образуют с гексагидроксостибат-ионом белый микрокристаллический осадок натрия гексагидроксостибата (V):
Na+ + [Sb (OH)6]— = Na[Sb(OH)6] ↓
Из разбавленных растворов осадок выпадает медленно или вообще не выпадает. В сильно-щелочной среде осадок не образуется, а из сильно-кислых растворов выделяется белый аморфный осадок метасурьмяной кислоты HSbО3, который можно ошибочно принять за осадок Na[Sb(OH)6]. В присутствии нитрат-ионов NО—3 выделение осадка замедляется. Реакция малочувствительна и удается лишь при больших концентрациях катионов натрия.
Мешают катионы Li+, Mg2+ и NH4+.
Методика. На предметное стекло наносят каплю концентрированного раствора NaCl и одну каплю концентрированного раствора К[Sb (OH)6].
Через 3-5 минут наблюдают под микроскопом образование кристаллов.
Аналитические реакции катионов калия К+
1.4. Реакции с раствором натрия гексанитрокобалъта (III) Na3[Co(NO3)2]
В концентрированных уксусно-кислых растворах (рН = 3) и нейтральной среде катионы калия образуют желтый кристаллический осадок натрия и калия гексанитрокобальта (III)
2K+ + Na3[Co(NO2)6] = NaK2[Co(NO2)6] ↓+ 2Na+
Реакция идет медленно, при стоянии раствора. Для ускорения формирования осадка стенки пробирки потирают стеклянной палочкой.
Для проведения реакции используют свежеприготовленный водный раствор Na3[Co(NO2)6], так как со временем этот реагент разлагается.
В сильно кислой среде образуется нестойкая, быстро распадающаяся кислота H3[Co(NO2)6]. В щелочной среде выпадает бурый осадок гидроксида кобальта (III) Со(ОН)3. Наличие катионов серебра в растворе повышает чувствительность реакции.
Предел обнаружения 4 мкг; мешают катионы Li+, NH4+ образующие такие же осадки.
Методика. В пробирку вносят 2 капли концентрированного раствора соли калия и 2 капли свежеприготовленного концентрированного раствора Na3[Co(NO2)6]. Выпадает желтый осадок NaK2[Co(NO2)6]. Если осадок не образуется, потирают стенки пробирки стеклянной палочкой.
1.5. Реакция с гидротартратом натрия NaHC4H4O6
При взаимодействии с гидротартратом натрия или с винной кислотой Н2С4Н4О6 в присутствии ацетата натрия катионы калия образуют белый кристаллический осадок гидротартрата калия:
K+ + NaHC4H406= KHC4H4O6↓ + Na+
Образование осадка ускоряется при потираний стенок пробирки стеклянной палочкой. Осадок растворяется в кислотах с образованием винной кислоты и в щелочах с образованием средних тартратов.
Предел обнаружения 50 мкг; мешают катионы NH4+, образующие осадок состава NH4HC4H4O6.
Методика. В пробирку вносят 2-3 капли раствора соли калия, 2-3 капли раствора гидротартрата натрия и потирают стенки пробирки стеклянной палочкой. Через некоторое время выделяется белый кристаллический осадок.
Аналитические реакции катионов аммония NH4+
1.6. Реакция разложения солеи аммония щелочами
При нагревании раствора соли аммония с щелочью выделяется аммиак:
NH4+ + ОН— = NH3 ↑+ H2O
Выделившийся газ обнаруживают с помощью влажной фенолфталеиновой бумаги, которая в парах аммиака окрашивается в малиновый цвет.
Реакция специфична и высокочувствительна: предел обнаружения 0,01 мкг, а предельная концентрация 2*10-7 г/мл
Методика. В пробирку вносят 8-10 капель раствора соли аммония, прибавляют такой же объем раствора NaOH и осторожно нагревают раствор, не допуская его кипения и разбрызгивания. Над раствором помещают влажную красную лакмусовую бумажку, не касаясь ею стенок пробирки во избежание попадания на бумажку капелек щелочного раствора. Выделяющиеся пары аммиака окрашивают бумагу в малиновый цвет.
1.7. Реакции с реактивом Несслера — смесью калия тетраиодомеркурата (II) K2[HgJ4] с КОН
Катионы аммония образуют с реактивом 11есслера аморфный красно-бурый осадок:
NH4+ + 2[Hgl4]2- + 4OН— = [OHg 2NH2]I + 7I— + 3H2О
Реакция высокочувствительна: предел обнаружения 0,05-0,25 мкг. Позволяет открыть следы катионов аммония — наблюдается окрашивание раствора в желтый или бурый цвет. Мешают все катионы, дающие со щелочами окрашенные осадки: (Cr3+, Fe3+, Co2+, Ni2+ и др.) и ионы, разлагающие реактив Несслера (Ag+, Hg2+ и др.)
Методика. К 1-2 каплям раствора соли аммония прибавляют 2 капли раствора реактива Несслера. Выпадает аморфный красно-бурый осадок.
В таблице 1 охарактеризованы продукты нескольких аналитических реакций катионов первой аналитической группы по кислотно-основной классификации.
2. Аналитические реакции катионов второй аналитической группы: Ag+, Hg2+, Pb2+.
Аналитические реакции катиона серебра Ag+.
2.1. Реакция с растворимыми хлоридами, бромидами и иодидами.
При взаимодействии с растворами хлоридов, бромидов, иодидов катионы Ag+ образуют осадки:
Ag+ + Cl— →AgCl↓ (белый)
Ag+ + Br— → AgBr↓ (желтоватый)
Ag+ + J— → AgJ↓ (желтый)
Осадок хлорида серебра растворяется в концентрированном аммиаке с образованием комплекса [Ag(NH3)2]Cl. При подкислении раствора этого комплекса снова выпадает осадок:
AgCl + 2NH3 = [Ag(NH3)2]Cl(p.p)
[Ag(NH3)2]CI(p.p) + 2H+ = AgCl ↓ + 2 NH4+
При прибавлении к раствору комплекса раствора иодида калия образуется осадок иодида серебра AgJ:
[Ag(NH3)2]CI(p.p) + KI = AgJ ↓+ КСl + 2NH3
Кроме того осадок AgCl растворяется в концентрированной соляной кислоте и концентрированных растворах тиосульфата натрия с образованием растворимых комплексов:
AgCl↓+ Cl— → [AgCl2] —
AgCl↓ + 2 Na2S2O3 → Na3[Ag(S2O3)2] + NaCl
Осадок AgBr малорастворим, a Agl — нерастворим в концентрированном аммиаке.
Открытию катионов Ag+ мешают катионы Pb2+, Hg22+, также образующие малорастворимые осадки хлоридов.
Методика. В одну пробирку вносят 2-3 капли раствора NaCl, в другую — столько же капель раствора NaBr, а в третью — столько же раствора К1. В каждую пробирку добавляют по 3-5 капель раствора нитрата серебра AgNО3 и наблюдают помутнение растворов и выпадение осадков AgCl, AgBr и Agl. Испытывают растворимость осадков, добавляя в каждую пробирку по 5-10 капель концентрированного аммиака. При этом осадок AgCl растворяется полностью, AgBr — частично, Agl — не растворяется.
Аналитические реакции катиона ртути (I) Hg2 2+
2.2. Реакция с хлорид-ионами.
Катионы Hg22+ при взаимодействии с хлорид-ионами Сl— в растворе образуют белый осадок каломели Hg2Cl2:
Hg22+ +2 Сl— → Hg2Cl2↓
Осадок на свету постепенно чернеет с выделением тонкодисперсной Hg:
Hg2Cl2 → HgCl2 + Hg
Осадок не растворяется в разбавленной, но растворяется в концентрированной азотной кислоте:
Hg2Cl2 + 8HNO3 →3HgCl2 + 3Hg(NO3)2 + 2NO + 4H2O
При прибавлении к осадку каломели раствора аммиака он темнеет вследствие выделения тонкодисперсной металлической ртути:
Hg2CI2 + 2NH3 → NH2 HgCl + Hg + NH4 Cl
Реакции образования каломели и ее взаимодействие с аммиаком используются при дробном открытии ртути (I).
Методика. В пробирку вносят 4-5 капель раствора нитрата ртути (I) и прибавляют такое же количество раствора хлорида натрия. Выпадает белый осадок каломели. К осадку прибавляют несколько капель раствора аммиака — осадок чернеет.
Аналитические реакции катиона свинца Рb 2+.
2.3. Реакция с хлорид-ионами (Сl—)
В кислых растворах (при рН< 7) катионы свинца образуют хлорид-белый осадок хлорида свинца РbСl2 (II):
Рb2+ + 2Сl— → РbСl2 ↓
Осадок хлорида свинца растворяется в горячей воде, но при охлаждении раствора из него снова выпадает хлорид свинца, но уже в форме игл. В разбавленных щелочных растворов вместо осадка РЬС12 выпадает осадок гидроксида свинца (II).
Методика. В пробирку вносят 3-4 капли раствора нитрата свинца Pb(NO3)2 и прибавляют 3-4 капли раствора хлорида натрия. Выпадает белый осадок РЬС12. К полученной смеси приливают — 1,5 мл дистиллированной воды и нагревают до растворения осадка. При охлаждении раствора из него снопа выпадает осадок PbС12 в виде игл.
2.4. Реакции с хромат ионами и дихромат-ионами (CrO42- и С2О72-).
В уксуснокислой среде катионы свинца образуют желтый кристаллический осадок хромата свинца (II):
Рb2+ + CrO42- →РbCrO4 ↓
Рb2+ + С2О72- + 3СН3СООН + Н2О →2PbCrО4↓ + 2CH3COOH
Осадок хромата свинца не растворяется в уксусной и разбавленной азотной кислотах, в водном аммиаке, но растворяется в щелочах с образованием комплекса:
РbCrO4 ↓ + 4NaOH → Na2[Pb(OH)4] + Na2CrO4
Мешают катионы, образующие нерастворимые хроматы: Ва2+, Hg2+, Bi3+.
Методика. В пробирку вносят 2-3 капли раствора Pb(NО3)2, 2-3 капли раствора ацетата натрия и 3 капли раствора хромата К2СгО4 или дихромата К2Сг2О7 калия. Выпадает желтый кристаллический осадок.
2.5. Реакция с сульфат-ионами (SO42-).
Катионы свинца Рb2+ образуют белый осадок сульфата свинца (II):
Рb2+ + SO42- → PbSО4↓
В отличие от осадков CaSO4, SrSO4, BaSO4 осадок PbSO4 при нагревании растворяется в щелочах:
PbSO4↓+ 2NaOH → Na2[Pb(OH)4] + Na2SO4
Открытию свинца мешают катионы, образующие малорастворимые сульфаты (Са2+ , Sr2+ , Ва2+ , Hg22+ и др.).
Методика. В пробирку вносят 5 капель раствора РЬ(NО3)2 и прибавляют столько же капель раствора сульфата натрия или калия, выпадает белый осадок сульфата свинца. К осадку добавляют раствор щелочи и осадок растворяется.
В таблице 2 охарактеризованы продукты нескольких аналитических реакций катионов второй аналитической группы по кислотно-основной классификации.
3. Аналитические реакции катионов третьей аналитической группы: Са2+, Sr2+, Ва2+.
Аналитические реакции катиона кальции Са2+.
3.1. Реакции с сульфат-ионами (SO42-).
Катионы кальция образуют с сульфат-ионами белый осадок, который при медленной кристаллизации выделяется в форме игольчатых кристаллов гипса — дигидрата сульфата кальция:
Са2+ + SO42- + 2H2O → CaSO4*2H2O
Для увеличения полноты осаждения к раствору добавляют равный объем этанола.
Осадок сульфата кальция нерастворим в кислотах и щелочах, но растворяется в насыщенном водном растворе сульфата аммония с образованием комплекса:
CaSO4 + (NH 4)2SO4 → (NH4)2[Ca(SO4)2], что позволяет отделить катионы Са2+ от катионов Sr2+ и Ва2+
При нагревании с растворимыми карбонатами, например, раствором соды, белый осадок сульфата кальция переходит в белый же осадок карбоната кальция:
CaSO4 + Na2CО3 → Са CО3 + Na2SО4
Карбонат кальция растворим в кислотах, поэтому нагревание CaSО4 с последующим растворением образующегося осадка карбоната кальция используют для отделения катионов кальция (вместе с катионами стронция и бария) от других катионов и перевода их в раствор.
Реакцию катионов кальция сульфат-ионами можно провести как микрокристаллическую. Предельное разбавление равно 2,5*10-4 мл/г.
Методика. Каплю раствора хлорида кальция СаС12 наносят на предметное стекло, прибавляют каплю раствора серной кислоты и слегка упаривают смесь. Под микроскопом наблюдают образовавшиеся игольчатые кристаллы гипса CaSО4*2H2О в виде красивых сросшихся пучков или звездочек.
3.2. Реакция с оксалатом аммония (NH4)2C2О4.
Катионы кальция образуют с оксалатом аммония белый кристаллический осадок оксалата кальция:
Ca2+ +C2О42- → CaC2О4↓
Реакцию проводят в слабокислой среде (рН = 6-6,5) в присутствии уксусной кислоты, в которой оксалат кальция не растворяется.
Осадок СаС2О4 нерастворим в растворе аммиака, но растворяется в разбавленных минеральных кислотах с образованием щавелевой кислоты, например:
СаС2О4↓ + 2HCI → СаС12 + Н2С2О4
Открываемый минимум — около 100 мкг. Мешают катионы стронция, бария и другие, дающие такие же осадки.
Методика. В пробирку вносят три капли раствора СаСl2, прибавляют каплю раствора уксусной кислоты и 3 капли раствора оксалата аммония. Выпадает белый кристаллический осадок оксалата кальция.
Аналитические реакции катиона стронция Sr2+.
3.3. Реакция с сульфат-ионами (SO42-).
Катионы Sr2+ образуют с сульфат-ионами белый кристаллический осадок сульфата стронция SrSO4:
Sr2+ + SO42- →SrSO4↓
Мешают катионы бария Ва2+, Са2+, Рb2+.
Осадок нерастворим в кислотах и щелочах, в отличие от сульфата кальция нерастворим в растворе сульфата аммония.
Осадок сульфата стронция образуется при нагревании раствора стронция с "гипсовой водой" (насыщенным водным раствором сульфата кальция). Реакция Sr2+ + CaSO4(гипсовая вода) →SrSO4↓+ Ca2+ идет, т. к. растворимость сульфата стронция ниже растворимости сульфата кальция.
При нагревании осадка SrSО4 с раствором соды он, как и сульфат кальция, переходит в осадок SrCO3, растворимый в кислотах:
SrSО4↓ + Na2CО3 →SrCО3+ Na2SО4
SrCО3↓ + 2 HCl → SrCl2 + CО2 + H2О.
Методика. а) Реакция с "гипсовой водой". В пробирку вносят 4 капли раствора хлорида стронция SrCl2, прибавляют 5-6 капель "гипсовой воды'", нагревают на водяной бане и оставляют на 10-15 минут. Постепенно выделяется белый осадок сульфата стронция.
б) Реакция с серной кислотой. В пробирку вносят 1-2 капли раствора SrCl2, прибавляют 2-3 капли раствора серной кислоты. Выпадает белый кристаллический осадок сульфата стронция.
Аналитические реакции катионов бария Ва2+.
3.4. Реакция с сульфат ионами (SO42-).
Катионы бария Ва2+ образуют с сульфат-ионами SО42- белый кристаллический осадок сульфата бария: Ва2+ + SO42- → BaSО4↓
Мешают катионы Ca2+, Sr2+, Pb2+
Осадок нерастворим в щелочах и кислотах. При нагревании с растворами карбонатов (например, соды) сульфат бария превращается в малорастворимый карбонат бария, который растворяется в кислотах:
BaSО4↓ + Na2CО3 → ВаСО3 ↓+ Na2SО4
BaCО3↓ + 2НС1 → BaС12 + CО2+ H2О.
Методика. В пробирку вносят 2-3 капли раствора ВаСЬ и прибавляют по каплям раствор H2SО4. Выпадает белый мелкокристаллический осадок сульфата бария.
3.5. Реакция с дихромат-ионами (С2О72-).
В присутствие ацетат-ионов ионы Ва2+ образуют с дихромат-ионами желтый осадок хромата бария:
2Ва2+ + Сг2О72- + 2СН3СОО— + Н2О → 2ВаСrO4 ↓ + 2CH3СООН
Образование осадка хромата ВаСrO4 , а не дихромата бария ВаСг2O7 объясняется меньшей растворимостью хромата в воде.
В водных растворах дихроматов устанавливается равновесие:
Сг2O72— + H2O → 2СrO42— + 2Н+
Для нейтрализации ионов водорода в раствор вносят ацетат натрия. Ацетат-ионы СН3СОО— связывают иолы водорода в слабую уксусную кислоту CH3СООН, и равновесие образования хромат-ионов из дихромат-ионов смещается вправо. Полнота осаждения хромата бария возрастает.
Осадок хромата бария растворяется в сильных кислотах, но не растворяется в уксусной кислоте.
Мешают Ag+, Pb2+, Cd2+, Со2+, Ni2+ и другие катионы, дающие осадки хроматов. Катионы Са2+, Sr2+ не мешают открытию катионов бария.
Методика. В пробирку вносят 5 капель раствора ВаСl2 и прибавляют 5 капель раствора дихромата калия К2Сг2O7 и 4-5 капель раствора ацетата натрия CH3COONa. Выпадает желтый кристаллический осадок хромата бария.
В таблице 3 охарактеризованы продукты некоторых аналитических реакций катионов третьей аналитической группы по кислотно-основной классификации.
4. Аналитические реакции катионов четвертой аналитической группы: Zn2+, Al3+, Sn2+, Cr3+.
Аналитические реакции катиона цинка Zn2+.
4.1. Реакция с щелочами (NaOH, КОН и. др.).
Катионы цинка Zn2+ образуют с гидроксидами щелочных металлов белый осадок, растворяющийся в избытке щелочи с образованием бесцветного гидрокомплекса:
Zn2+ + 2OH— → Zn(OH)2↓
Zn(OH)2↓+ 2OH—→ [Zn(OH)4] 2-
Методика. В пробирку вносят 5-6 капель раствора хлорида цинка, прибавляют 1-2 капли раствора NaOH. Выпадает белый осадок гидроксида цинка. Продолжают прибавлять по каплям раствор NaOH при перемешивании. Осадок растворяется.
4.2. Реакция с сульфид-ионами (S2-).
В нейтральной, слабокислой или слабощелочной среде (4<рН<9) катионы цинка образуют с сульфид-ионами белый осадок сульфидацинка:
Zn2++ S2- → ZnS↓
Осадок не растворяется в уксусной кислоте, но растворяется в растворах минеральных кислот. Реакцию часто проводят в уксуснокислой среде, так как в этих условиях открытию Zn2+ не мешают остальные катионы четвертой аналитической группы, за исключением олова (II).
Методика. К 2-3 каплям раствора ZnCl2 прибавляют 1-2 капли свежего раствора сульфида аммония (NH4)2S. Выпадает белый осадок сульфида цинка.
4.3. Реакция с дитизоном (дифенгштиокарбазоном).
При смешении хлороформного раствора дитизона (экстракционный реагент) с водным щелочным раствором, содержащим катионы Zn2+, образуется дитизонатный комплекс цинка красного цвета, экстрагирующийся из водной фазы в органическую. Хлороформный слой принимает более интенсивную красную окраску, чем водный. Протекание реакции предположительно можно описать следующей схемой:
Zn2+ + H2D → [Zn(HD)2] + 2Н+

2* означает, что ион цинка связывается с двумя остатками дитизона. Наличие щелочи способствует протеканию реакции.
Реакция высокочувствительна: предел обнаружения 0,025 мкг. Мешают катионы, образующие дитизонатные комплексы (Cd2+, Pb2+, Sn2+).
Методика. В пробирку вносят 5-10 капель раствора ZnCl2, прибавляют постепенно несколько капель раствора NaOH до растворения выпавшего осадка и около 5 капель хлороформного раствора дитизона. Пробирку встряхивают несколько раз. Хлороформный слой окрашивается в красный цвет.
Аналитические реакции катиона алюминия AI3+.
4.4. Реакция с щелочами.
Катионы AI3+ при реакции с щелочами в растворах дают белый осадок гидроксида алюминия А1(ОН) 3, который растворяется в избытке щелочи с образованием гидрокомплекса [Аl(ОН) 4]— :
Аl3+ + 3ОН— → Аl(ОН)3↓
Аl(ОН)3↓ + ОН— → [Аl(ОН) 4] —
Наиболее полное осаждение происходит при рН = 5-6. Осадок Аl(ОН) 3 растворяется в кислотах, но не растворяется в аммиаке.
При нагревании щелочного раствора комплексной соли с хлоридом аммония гидроксокомплексы алюминия разрушаются и снова выпадает осадок гидроксида алюминия:
[Аl(ОН) 4] — + NH4+→ Аl(ОН)3↓ + NH3 ↑ + Н2O
Методика. В пробирку вносят 3-5 капель раствора соли алюминия, по каплям добавляют раствор NaOH. Выпадает белый осадок. Продолжают прибавление NaOH, осадок растворяется. При добавлении к полученному раствору несколько кристаллов NH4C1 и нагревании осадок А1(ОH)3 выпадает вновь.
4.5. Реакция с ализарином (1,2-диоксиантрахинон).
Ализарин в реакциях с катионами алюминия Аl3+ в аммиачной среде образует малорастворимые комплексные соединения ярко-красного цвета, называемые "алюминиевыми лаками":
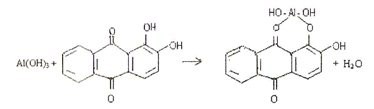
Комплекс устойчив в уксуснокислой среде. Реакция высокочувствительна: предел обнаружения 0,5 мкг. Мешают катионы, образующие комплексы с ализарином: (Zn2+, Sn2+, Cr2+, Mn2+, Fe3+ и др.).
Методика. В пробирку вносят 2-3 капли раствора соли алюминия, 2-3 капли раствора щелочи (появляется белый осадок). Добавляют 1-2 капли раствора ализарина и 1-2 капли уксусной кислоты. Раствор окрашивается в красный цвет, возможно помутнение раствора.
4.6. Реакция с алюминоном (аммонийной солью ауринтрикарбоиовой кислоты).
В уксуснокислой или аммиачной среде катион Al3+ при взаимодействии с алюминоном (для краткости обозначим NH4L), образует комплекс красного цвета, по-видимому, состава Al(OH)2L.
Реакция высокочувствительна. Метают катионы Са2+, Сu2+, Сг3+, Fe3+, также образующие окрашенные комплексы с алюминоном.
Методика. В пробирку вносят 3-4 капли раствора соли алюминия, 2-3 капли раствора уксусной кислоты и 3-5 капель 0,01%-го раствора алюминона. Смесь нагревают на водяной бане, прибавляют несколько капель раствора аммиака до щелочной реакции (по лакмусовой бумаге) и 2-3 капли раствора карбоната аммония. Выпадает красный хлопьевидный осадок.
Аналитические реакции катиона олова (II) Sn2+ .
4.7. Реакция с щелочами.
Соединения олова (II) при взаимодействии с щелочами выделяют из раствора белый осадок гидроксида олова Sn(OH) 2, растворимый в избытке реагента с образованием гидроксокомплекса [Sn(OH)4]2- :
Sn2+ + 2OН— →Sn(OH)2 ↓
Sn(OH)2↓ + 2OH— → [Sn(OH)4]2-
Осадок Sn(OH)2 растворяется в кислотах.
Методика. В пробирку вносят несколько капель раствора соли олова (II), прибавляют по каплям раствор NaOH: вначале до выпадения белого осадка Sn(OH)2, а затем — до его растворения.
4.8. Реакция с солями висмута (III).
Олово (II) — хороший восстановитель. Так, при взаимодействии с висмутом (III) в сильно-щелочной среде оно восстанавливает висмут до металла, окисляясь до олова (IV):
2Bi3+ + 3[Sn(OH)4] 2- + 6ОН— → 2 Bi ↓ + 3[Sn(OH)6] 2-
Металлический висмут, выделяясь в тонкодисперсном состоянии, образует осадок черного цвета.
Методика. В пробирку вносят 3-5 капель раствора олова (II) и прибавляют по каплям раствор NaOH. Вначале выпадает белый осадок гидроксида олова, который при дальнейшем прибавлении NaOH растворяется. К полученному щелочному раствору прибавляют 1-2 капли раствора нитрата висмута (III). При перемешивании смеси выпадает черный осадок металлического висмута.
Если осадок не образовался, скорее всего, неправильно создана среда (проверьте характер среды по индикаторной бумаге) или же приготовьте свежий раствор олова.
Аналитические реакции катиона хрома (III) Сг3+.
4.9. Реакции со щелочами и аммиком.
Катионы Сг3+ с растворами щелочей или аммиака образуют осадок гидроксида хрома (III) серо-зеленого или сине-фиолетового цвета:
Сr3+ + 3ОН— → Сr(ОН) 3 ↓
Сr3++ 3NH3*H2O → Сr(ОН) 3 ↓+ 3NH4+
Осадок Сг(ОН) 3 обладает амфотерными свойствами, т.е. растворяется как в щелочах, так и в кислотах:
Сr (ОН) 3 ↓+ 3ОН— → [Cr(OH)6] 3-
Сr (ОН) 3 ↓+ 3HCl + 3H2O → [Сг(Н2O)6]3- + 3Сl—
В растворе аммиака гидроксид хрома (III) растворяется лишь частично с образованием фиолетового комплекса [Сr(NН3) 6] 3+
Сr (ОН) 3 ↓+ 6NH3*H2O → [Сr (NН3)6] 3+ + 3ОН— + 6Н2O
Методика. В две пробирки вносят по несколько капель соли хрома (III). В них добавляют по каплям: в первую — раствор NaOH, во вторую — раствор аммиака до выпадения серо-зеленого (или сине-фиолетового) осадка. При прибавлении в первую пробирку (по каплям) раствора NaOH и перемешивании осадок растворяется с образованием раствора зеленого цвета. Добавление (по каплям) во вторую пробирку раствора аммиака приводит лишь к частичному растворению осадка. Раствор над осадком становится фиолетовым.
4.10. Реакции окисления катионов хрома пероксидом водорода и другими окислителями
Катионы Сг3+ при взаимодействии с окислителями (пероксидом водорода, перманганатом калия и др.) окисляются до хромат-ионов СrO42- (желтая окраска) или до дихромат-ионов СrO72- (желто-оранжевая окраска):
а) Окисление пероксидом водорода.
Окисление пероксидом водорода Н2O2 проводят обычно в щелочной среде при нагревании:
2[Cr(OH)6]3- + 3Н2O2 = 2СгO42- + 2OН— + 8Н2O
Методика. В пробирку вносят 2-3 капли раствора соли хрома (III), добавляют 4-5 капель 2 моль/л раствора NaOH, 2-3 капли 3%-го раствора Н2O2 и нагревают до изменения зеленой окраски раствора (цвет аквакомплексов [Сr(Н2O)6]3-) на желтую (цвет хромат-ионов).
б) Окисление перманганатом калия.
Перманганат калия КМnO4 в сернокислой среде при нагревании окисляет катион Cr3+ до дихромат-иона Сr2O72- : 10Cr 3+ + 6МnO4— + 11Н2O = 5Сr2O72- + 6Мn 2+ + 22Н+
Методика. В пробирку вносят 3-4 капли раствора соли хрома (III) (не хлорида!), прибавляют 3-4 капли раствора серной кислоты, нагревают и прибавляют к ней по каплям раствор КМnO4 до желто-оранжевой окраски раствора. При дальнейшем прибавлении реагента выпадает бурый осадок МnO2.
В таблице 4 приведены продукты некоторых аналитических реакций катионов четвертой аналитической группы по кислотно-основной классификации.
5. Аналитические реакции катионов пятой аналитической группы: Mg2+, Mn2+, Bi3+, Fe2+, Fe3+.
Аналитические реакции катиона магния Mg2+.
5.1. Реакции с щелочами и аммиаком.
Катионы Mg2+ при действии щелочей и аммиака образуют белый аморфный осадок гидроксида магния Mg(OH):
Mg2++2OH— → Mg(OH)2↓
Mg2+ + 2NH3 * Н2O ↔ Mg(OH)2 + 2NH4+
При реакции с аммиаком достигается неполное осаждение катионов Mg2+ в виде гидроксида, т.к. гидроксид магния частично растворяется в растворах солей аммония, особенно концентрированных.
Осадок Mg(OH) 2 не растворяется в щелочах, но растворяется в кислотах:
Mg(OH)2 + 2Н+ → Mg2+ + 2Н2O
Методика. В две пробирки вносят по 5-6 капель раствора соли магния и прибавляют по каплям: в одну — раствор NaOH, а в другую раствор аммиака до выпадения белого аморфного осадка.
5.2. Реакция с гидрофосфатом натрия (NaHPO4).
Катионы Mg2+ образуют с гидрофосфатом натрия в присутствии аммиачного буферного раствора белый мелкокристаллический осадок магний-аммоний фосфатаNH4MgPO4:
Mg2+ + HPO42- + NH3 =NH4MgPO4↓
Осадок магний-аммоний фосфата растворяется в минеральных кислотах и в уксусной кислоте:
NH4MgPO4↓ + 3НС1 →Н3РО4 + MgCl2 + NH4Cl
NH4MgPO4↓ + 2 CH3COOH → NH4H2PO4 + (CH3COO)2Mg
Реакция образования NH4MgPO4 достаточно чувствительна: предел обнаружения 0,01 мкг. Мешают катионы Li+, Ca2+, Sr2+, Ba2+ и другие, дающие малорастворимые фосфаты.
Методика. В пробирку вносят 2-3 капли раствора соли магния, прибавляют по 1-2 капли растворов NH4C1, аммиака и Na2HPO4. Раствор мутнеет и образуется белый осадок NH4MgPO4.
5.3. Реакция с магнезоном I (п -нитробензолазорезорцином).
В щелочной среде магнезон I, имеющий красную окраску, образует с катионами магния Mg2+ комплекс синего цвета, сорбирующийся на осадке гидроксида магния.
Реакция высокочувствительна: предел обнаружения 0,5 мкг. Мешают многие катионы (Cd2+, Sn2+, Cr2+, Fe2+, Co2+, Ni2+ и др.), также образующие окрашенные комплексы с магнезоном.
Методика. На предметное стекло наносят каплю раствора соли магния и прибавляют каплю щелочного раствора магнезона I. Образуется синий осадок. При малых концентрациях катионов магния осадок не выделяется, а раствор окрашивается в синий цвет.
Аналитические реакции висмута (III) Bi3+.
5.4. Реакция гидролиза.
Разбавление водой растворов солей висмута (III) приводит к их гидролизу с выделением белого осадка оксохлорида висмута BiOCl:
BiCl3 + Н2O ↔ BiOCl ↓+ 2НС1
[BiC16]3- + Н2O ↔ BiOCl ↓ + 2НС1 + 3С1—
При прибавлении раствора НСl и нагревании осадок растворяется (обратная реакция).
5.5. Реакция восстановления висмута (III) до металла
В щелочной среде (рН ~ 10) олово (II) восстанавливает висмут (III) до металлического висмута (0), выделяющегося в виде черного осадка. Олово (II) при этом окисляется до олова (IV):
2Bi(OH)3 + 3[Sn(OH)4] 2- → 2Bi↓ + 3[Sn(OH)6] 2-
При большом избытке щелочи и нагревании выпадает также черный осадок металлического олова вследствие протекания реакции диспропорционировапия:
2[Sn(OH)4] 2- → Sn + [Sn(OH)6]2-+ 2OH—
Методика. В пробирку вносят 2 капли солянокислого раствора хлорида олова (II), 8-9 капель 2 моль/л раствора NaOH до растворения первоначально выпавшего осадка Sn(OH)2 и добавляют 1-2 капли раствора соли висмута (III). Выпадает осадок черного цвета — металлический висмут. Особенности проведения этой реакции изложены выше (см. 4.8).
Аналитические реакции катиона марганца (II) Мп2+.
5.6. Реакция окисления катионов Мп2+ до пермангапат-ионов.
Катионы Мn2+ под действием различных окислителей окисляются до перманганат-ионов МnO4—, окрашивающих раствор в малино-фиолетовый цвет. В качестве окислителей применяют висмутат натрия NaBiO3, персульфат аммония (NH4)2S2O8, диоксид свинца РbO2 и др. Чаще всего используют висмутат натрия.
Реакции окисления проводят в отсутствие хлорид-ионов Сl—, т.к. они восстанавливаются перманганат-ионами до хлора Сl2:
2МnO4 + 10С1— + 16Н+ → 2Мn2+ + 5Сl2 + 8Н2O
а) Окисление висмутатом. натрия в кислой среде протекает по схеме:
2Mn2+ + 5NaBiO3+ 14Н+ → 2MnO4— + 3Bi3+ + 5Na+ + 7Н2O
Избыток висмутата натрия может маскировать окраску раствора. Методика. В пробирку вносят 5 капель концентрированной HNO3 и несколько крупинок висмутата натрия. Смесь перемешивают и добавляют к ней 1-2 капли раствора сульфата MnSO4 или нитрата Mn(NO3) 2 (но не хлорида МnCl2). Пробирку оставляют в штативе в вертикальном положении, через некоторое время раствор над реакционной смесью окрашивается в малиново-фиолетовый цвет.
б) Окисление персульфатом аммония.
Реакцию проводят в кислой среде в присутствии катализатора солей серебра (AgNO3) при нагревании:
2Мп2+ + 5S2O82- + 8Н2O → 2МnO4— + 10SO42+ + 16H+
Катализатором могут быть также соли кобальта и меди.
В горячем растворе возможно разложение перманганат-ионов, которое замедляется в присутствии ортофосфорной кислоты Н3РO4.
Методика. В пробирку внося несколько кристалликов (NH4)2S2O8 (или — 0,5 мл насыщенного раствора (NH4)2S2O8, прибавляют ~2 мл раствора HNO3 (или H2SO4), 2-3 капли раствора AgNO3, 1-2 капли концентрированного раствора Н3РО4. Нагревают смесь до кипения и прибавляют каплю раствора соли марганца (II). Раствор окрашивается в малиновый цвет.
Аналитические реакции катиона железа (II) Fe2+.
Аквакатионы железа (II) [Fe(H2O)6]2+ практически бесцветны, поэтому солей железа (II) обычно не окрашены.
5.7. Реакции с щелочами и аммиаком.
Катионы Fe2+ образуют со щелочами и аммиаком зеленоватый осадок гидроксида железа (II) (в отсутствие кислорода воздуха он белый):
Fe2+ + 2OН— →Fe(OH)2↓
Гидроксид Fe(OH)2 растворяется в кислотах, но не растворяется в щелочах. При стоянии на воздухе гидроксид железа (II) постепенно темнеет вследствие окисления железа (II) до железа (III) кислородом воздуха и образования красно-бурого гидроксида железа (III):
4Fe(OH)2 ↓ + O2 + 2Н2O → 4Fe(OH)3↓
В щелочной среде железо (II) легко окисляется пероксидом водорода, образуется красно-бурый осадок гидроксида железа(III):
2Fe2+ + Н2O2 + 4OH— →2Fe(OH)3↓
Методика. а) В пробирку вносят 5-6 капель раствора железа (II) и по каплям добавляют раствор NaOH до прекращения выпадения осадка Fe(OH)2. Нa воздухе осадок постепенно темнеет.
б) К свежеприготовленному, как описано выше, белому осадку Fe(OH)2 прибавить по 2-3 капли растворов NaOH и H2О2. Окраска осадка изменяется до красно-бурой.
5.8. Реакция с калия гексацианоферратом (III) (красной кровяной солью или феррицианидом калия)
Катионы Fe2+ реагируют с K3[Fe(CN)6] в кислой среде с образованием темно-синего осадка "турнбуленовой сини". Ранее полагали, что состав этого осадка соответствует формуле Fe3[Fe(CN)6]2*xH2О с переменным числом молекул воды. Позднее было доказано, что уже при образовании этого осадка осуществляется окислительно-восстановительный процесс с переносом электронов от «внешнего» железа (II) к «внутреннему» железу (III):
Fe2+ + [Fe+3 (CN)6] 3- → Fe3+ + [Fe+2(CN)6] 4-
Образующиеся катионы Fe3+ и анионы [Fe+2(CN)6] 4- дают темно-синий осадок конечного продукта Fe4+3[Fe+2(CN)6]3*xH2O, названного "турнбуленовой синью":
4Fe3+ + 3[Fe(CN)6]4— →Fe4[Fe(CN)6]3↓
Суммарное уравнение реакции:
4Fe2+ + 4[Fe+3 (CN)6] 3- → Fe4+3[Fe+2(CN)6]3↓ + [Fe+2(CN)6]4-
По составу, структуре и свойствам осадок ''турнбуленовой сини идентичен осадку ''берлинской лазури", получаемому при прибавлении K4[Fe(CN)6] к растворам солей железа (III).
Реакция очень чувствительна: предел обнаружения 0.05 мкг. Осадок "турнбуленовой сини'" не растворяется в кислотах, но разлагается в щелочной среде.
Методика. В пробирку вносят 2-3 капли раствора соли железа (II), прибавляют' 1-2 капли раствора HCl и 2-3 капли раствора ферроцнанида калия K3[Fe(CN)6]. Раствор окрашивается в синий цвет и выделяется синий осадок ''турнбуленовой сини".
Аналитические реакции катиона железа (III) Fe3+.
Аквакатионы железа (III) [Fe(H2O)6]3+ окрашены в желтый цвет, поэтому водные растворы солей железа (III) имеют желтую или красновато-бурую окраску.
5.9. Реакция с щелочами и аммиаком.
Катионы Fe3+ при взаимодействии со щелочами и аммиаком в водных растворах образуют красно-бурый осадок гидроксида железа (III):
Fe3+ + 3ОН— → Fe(OH) 3↓
Осадок растворим в разбавленных кислотах. Он не растворяется в насыщенном растворе хлорида аммония (в отличие от осадка Ре(ОН)2), а также в растворах щелочей.
Методика. В пробирку вносят 3-4 капли раствора соли железа (Ш) и прибавляют 3-4 капли раствора NaOH. Выпадает красно-бурый осадок гидроксида железа (III).
5.10. Реакция с калия гексацианоферратом (III)(желтой кровяной солью гит ферроцгшнидом калия)
Катионы Fe3+ в кислой среде (рН=2-3) реагируют с ферроцианидом калия с образованием темно-синего осадка "берлинской лазури". Состав осадка описывают формулой Fe4[Fe(CN)6]3*xH2O с переменным количеством молекул воды. Этот осадок неустойчив в щелочной среде, но стабилен в кислом растворе, поэтому реакцию проводят в кислой среде при рН ~ 2-3. Реакция образования чистой "'берлинской лазури" протекает по схеме:
4Fe3+ + 3[Fe(CN)6] 4-→ Fe4[Fe(CN)6]3↓
Реакция высокочувствительна. Открываемый минимум около 0,05 мкг. Мешают, как и при получении "турнбуленевой сини" окислители и восстановители.
Как и в случае с "турнбуленовой синью", осадок "берлинской лазури" не растворяется в кислотах и разлагается при прибавлении раствора щелочи:
Fe4[Fe(CN)6]3 ↓ + 12OH— → [Fe(CN)6]4- + 4Fe(OH)3 ↓
Методика. В пробирку вносят 2-3 капли раствора соли железа (III), прибавляют 1-2 капли раствора НСl и 2 капли раствора K4[Fe(CN)6]. Раствор окрашивается в синий цвет, выпадает осадок "берлинской лазури".
5.11. Реакция с тиоционат (роданид) ионами SCN—
Катионы Fe3+ реагируют с тиоцинат-ионами SCN— (лучше в кислой среде при рН ~ 3) с образованием тиоционатных комплексов железа (Ш) красного цвета:
[Fe (H2O)6.n] 3 + nSCN— → [Fe(SCN)n(H2O)6.n]3-n + nH2O, n = 1,2,3,…6.
В зависимости от соотношения концентраций реагентов могутдоминировать комплексы различного состава. Все они имеют красную окраску и находятся в равновесии.
Реакция высокочувствительна: предел обнаружения катионов железа (III) составляет 0,25 мкг. Мешают многие вещества: окислители, восстановители, ртуть (II), фториды, фосфаты, иодиды, цитраты, тартраты и другие соединения. Катионы железа (II) не мешают.
Методика. В пробирку вносят 3-4 капли раствора соли железа (III) и прибавляют 3-4 капли раствора тиоционата аммония или калия. Раствор окрашивается в красный цвет.
В таблице 5 охарактеризованы продукты некоторых реакций катионов пятой аналитической группы по кислотно-основной классификации.
6. Аналитические реакции катионов шестой аналитической группы: Cu2+, Cd2+, Hg2+, Co2+, Ni2+.
Аналитические реакции катиона меди (II) Сu2+.
Аквакатионы меди (II) [Cu(H2O)4]2+ окрашены в голубой цвет, поэтому водные растворы содей меди (II) имеют голубую окраску с разными оттенками.
6.1. Реакции с щелочами.
При прибавлении раствора щелочи к раствору соли меди (II) выпадает осадок гидроксида меди (II) Сu(ОН)2 имеющий окраску от сине-зеленой до голубой:
Cu2++2OH— → Cu(OH)2 ↓
При последующем кипячении реакционной смеси осадок гидроксида меди разлагается до черного оксида меди (II):
Cu(OH)2 ↓ → CuO ↓ + Н2O
Осадок Сu(ОН)2 растворяется в кислотах, в растворе аммиака (с образованием комплекса [Cu(NH3)4]2+ синего цвета), комплексообразующих органических кислотах (винная, лимонная):
Cu(OH)2 ↓ + 2Н+→ Сu2+ + 2Н2O
Cu(OH)2 ↓ + 4NH3*Н2O → [Cu(NH3)4]2++ 2OH— + 4Н2O
Cu(OH)2 ↓ + 2 Н2Tartr → [Cu(Tartr)2]2-+ 2H2O + 2Н+
Методика. В пробирку вносят 3-4 капли раствора соли меди (II) и прибавляют 1-2 капли раствора NaOH. Образуется осадок гидроксида меди голубого или сине-зеленого цвета. Смесь осторожно нагревают до кипения и кипятят до потемнения осадка вследствие образования черного оксида меди (II).
6.2. Реакция с аммиаком (NН3).
При постепенном прибавлении раствора аммиака к раствору соли меди (II), выпадает осадок основной соли меди (сине-зеленого цвета), который растворяется в избытке аммиака с образованием комплексного катиона ярко-синего цвета:
СuCl 2 + NH3*H2O(недостаток) → CuOHCl ↓+ NH4Cl
Сu(ОН)Cl↓+ 4 NH3*H2O(избыток )→ [Cu(NH3)4] 2+ + 4 Н2O + OH— + Сl—.
При единовременном добавлении избытка раствора аммиака голубой раствор сразу же переходит в ярко синий:
СuCl 2 + 4 NH3*H2O (избыток) → [Cu(NH3)4] 2++ 2С l— + 4 Н2O.
В кислой среде комплексный катион меди разрушается и окраска из ярко-синей переходит в голубую (цвет аквакомплекса меди (II)):
Cu(NH3)4]2+ + 4Н3O+ → [Cu(H2O)4]2++ 4NH4+
Мешают катионы Со2+, Ni2+ и Sn2+, образующие аммиачные окрашенные комплексы.
Методика. В пробирку вносят 3-5 капель раствора соли меди (II) и прибавляют по каплям разбавленный раствор аммиака при перемешивании смеси. Выпадающий вначале голубой (или голубовато-зеленый) осадок основной соли меди (II), затем осадок растворяется с образованием ярко-синего раствора. Прибавляют по каплям разбавленный раствор одной из кислот — HCl, HNO3 или H2SO4. Окраска раствора из ярко-синей переходит в голубую.
6.3. Реакция с тиосульфатом натрия (Na2S2O3).
При кипячении смеси подкисленного раствора соли меди (II) с избытком тиосульфата натрия Na2S2O3 происходит восстановление меди (II) до меди (I) Cu2S, кроме того образуется осадок серы. Выпадающий темно-бурый осадок — смесь сульфида меди (I) и серы. Реакция, по-видимому, протекает по схеме:
2Сu2+ + 2S2O3 2- + 2Н2O → Cu2S↓+ S↓ + 4Н+ + 2SO42-
Методика. В пробирку вносят 3-4 капли раствора соли меди (II), 2-3 капли разбавленного раствора H2SО4 и несколько кристалликов тиосульфата натрия. Выпадает темно-бурый осадок смеси сульфида меди (I) и свободной серы.
Аналитические реакции катиона кадмия Cd2+.
Аквакомплексы кадмия [Cd(H2O)n]2+ в водных растворах бесцветны.
6.4. Реакции с щелочами и аммиаком.
При прибавлении раствора щелочи или аммиака к раствору соли кадмия выпадает белый осадок гидроксида кадмия:
Cd2+ + 2OH— → Cd(OH)2 ↓
Осадок нерастворим в избытке щелочи, но растворяется в избытке аммиака с образованием бесцветного аммиачного комплекса [Cd(NH3)4]2+:
Cd(OH)2↓ + 4NH3*H2O → [Cd(NH3)4]2+ + 4H2O
Осадок гидроксида кадмия растворяется в кислотах:
Cd(OH)2 ↓ + 2H3O+ → [Cd(H2O) 3]2+
Методика. В две пробирки вносят по 3-4 капли раствора соли кадмия. В одну из них прибавляют 1 — 2 капли растворов NaOH или КОН. Выпадает белый осадок гидроксида кадмия Cd(OH)2, который не растворяется в избытке щелочи. В другую пробирку прибавляют по каплям раствор аммиака. Образующийся вначале белый осадок гидроксида кадмия растворяется в избытке аммиака.
Аналитические реакции катиона ртути (II) Hg2+.
6.5. Реакция с иодидом калия (KI).
Катионы Hg2+ дают с иодид-ионами Г в водном растворе красно-оранжевый осадок иодида ртути (И), который при избытке иодид-ионов растворяется с образованием бесцветного тетраиодомеркурат-
иона:
Hg2++2J— → HgJ2↓
HgJ2 ↓ + 2 J— → [HgI4]2-
Мешают катионы Pb2+, Cu2+, Ag +, Bi3+ и некоторые другие, а также окислители.
Методика. В пробирку вносят 2-3 капли раствора соли ртути (II) и прибавляют каплю разбавленного (5%) раствора иодида калия. Выпадает красный осадок иодида ртути (II) HgJ2. Осадок растворяется в избытке КJ.
Аналитические реакции катиона кобальта (II) Со2+.
Аквакатионы кобальта (II) [Со(Н2O)6]2+ окрашены в розовый цвет, поэтому водные растворы солей кобальта (II) имеют розовую окраску.
6.6. Реакции с щелочами.
Катионы Со2+ при реакции с щелочами образуют вначале синий осадок гидроксида кобальта (II) (например, CoOHCI). Окраска затем переходит в розовый осадок гидроксила кобальта (II) Со(ОН)2. Так, при взаимодействии хлорида кобальта (II) со щелочью реакция протекает по схеме:
СоСl2 + 2ОН— (недостаток) → СоОНСl ↓ (синий) + Сl—
СоОНСl ↓ (синий) + ОН— → Со(ОН)2 ↓ (розовый) + Сl—
Розовый гидроксид кобальта (II) Со(ОН)2 медленно буреет вследствие окисления кислородом воздуха до черно-бурого гидроксида кобальта (III):
4Со(ОН)2↓+ O2 + 4Н2O → 4Со(ОН)3↓
Методика. В пробирку вносят 3 капли раствора хлорида кобальта (II) и медленно, по каплям, при непрерывном перемешивании смеси, приливают водный раствор щелочи до образования синего осадка CoOHCl, переходящего при дальнейшем добавлении щелочи в розовый осадок Со(ОН)2, который через некоторое время чернеет за счет окисления до Со(ОН)3:
6.7. Реакции с аммиаком (NH3).
При реакции катионов Со2+ с аммиаком вначале также как в 6.6 образуется синий осадок основной соли. Дальнейшее прибавление раствора аммиака приводит к растворению осадка с образованием гексамминкобальт (II) катионов грязно-желтого цвета:
СоСl2 + NH3*H2O → СоОНСl ↓+ NH4Cl
СоОНСl ↓+ 5NH3*H2O + NH4Cl → [Co(NH3)6]Cl2 + 6Н2O
На воздухе раствор постепенно принимает вишнево-красный цвет вследствие окисления Со (II) до Со (III) с образованием хлоропентаммин-кобальт — анионов [Со(NН3) 6Сl]2+ вишнево-красного цвета:
4[Со+2(NН3)6]Сl2 + O2 + 6Н2O → 4[Co+3(NH3)5Cl](OH)2 + 4NH4Cl
В присутствии пероксида водорода и солей аммония реакция окисления [Со(NH3)6]2+ до [Со(NН3)6С1]2+ протекает мгновенно:
2[Co(NH3)6]Cl2 + H2O2 + 2NH4C1 + 2H2O → 2[Co(NH3)5Cl]Cl2 + 4NH3*H20
Методика. В пробирку вносят 3 капли раствора хлорида кобальта (II) и медленно, по каплям, прибавляют раствор аммиака до выпадения синего осадка CoOHCl, затем несколько кристаллов хлорида аммония и продолжают прибавление раствора аммиака при перемешивании смеси до полного растворения осадка и образования желтого раствора. При стоянии на воздухе раствор постепенно меняет окраску на вишнево-красную.
6.8. Реакция с тиоционат (роданид) ионами SCN—.
Катионы кобальта (II) в слабокислой среде реагируют с тиоционат-ионами SCN" с образованием синего комплекса тетратиоцианатоко-бальт (II)-иона [Co(NCS)4]2- :
Со2+ + 4SCN— ↔ [Co(SCN)4]2-
Комплекс в водных растворах неустойчив, и равновесие комплексообразования смещено в сторону образования розового аквакомплекса кобальта (II). Поэтому реакцию проводят при избытке тиоционат-ионов, чтобы сместить равновесие вправо.
В растворах органических растворителей (изоамиловый спирт, эфир, ацетон и др.) устойчивость комплекса повышается, поэтому при проведении данной реакции водный раствор, содержащий катионы Со2+, смешивают с небольшим количеством органического растворителя. При этом тетратиоционатный комплекс кобальта (II) переходит в органическую фазу, окрашивая ее в синий цвет.
Предел обнаружения ионов кобальта (II) этой реакции около 0,5 мкг.
Проведению реакции мешают катионы железа (III), меди (II), также образующих с ними окрашенные комплексы. Мешающее действие этих катионов можно устранить, восстановив их хлоридом олова (II) до железа (II) и меди(I).
Мешающее действие катионов Fe3+ устраняют также, связывая их в устойчивые бесцветные комплексы. Таким маскирующим агентом является фторид натрия NaF. Он связывает ионы железа (III) в
бесцветный комплекс:
Fe3+ + 6 F— → [Fe F6]3+
В качестве маскирующих агентов используют также оксалат-ионы С2O42- и ортофосфат-ионы РO43-, также образующие бесцветные комплексы железа (III).
Методика. В пробирку вносят 2-3 капли раствора соли кобальта (II), прибавляют 8-10 капель насыщенного раствора тиоциоиата калия KNCS или аммония NH4NCS (или несколько кристаллов одной из этих солей). 5-6 капель органического растворителя (изоамилового спирта) и встряхивают смесь. Верхний слой органической фазы окрашивается в синий цвет.
6.9. Реакция с реактивом Ильинского (1 -нитрозо-2-нафтол или α-нитрозо-β-нафтол).
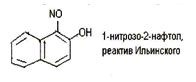
Кобальт (II) в этой реакции окисляется до кобальта (III), который с 1-нитрозо-2-нафтолом образует внутрикомплексное соединение, выделяющееся в виде пурпурно-красного осадка. Если 1-нитрозо-2-нафтол (реактив Ильинского) условно обозначить HL, реакцию можно описать схемой (после окисления кобальта):
Со3+ + 3HL→ [CoL3] +3H+
Реакцию проводят в нейтральной или слабокислой среде. Мешают катионы меди (II).
Методика. В пробирку вносят 2-3 капли раствора соли кобальта (II), 1-2 капли уксусной кислоты, 2-3 капли 1%-го раствора реактива Ильинского. При осторожном нагревании наблюдают выделение пурпурно-красного осадка внутрикомплексного соединения.
Аналитические реакции катиона никеля (II) Ni2+.
Аквакатионы никеля (II) [Ni(H2O)6]2+ окрашены в зеленый цвет, поэтому водные растворы солей никеля (II) имеют зеленую окраску.
6.10. Реакция со щелочами.
Катионы никеля (11) Ni2+ осаждаются щелочами из водных растворов в виде малорастворимого гидроксида никеля. (II) Ni(OH)2 зеленого цвета:
Ni2+ + 2OН— → Ni(OH)2↓
Осадок растворяется в растворах кислот и аммиака:
Ni(ОН)2 ↓ + 2Н+→Ni2+ + 2Н2O
Ni(ОН)2 ↓ + 6NH3*H2O → [Ni(NH3)6]2+ + 2OН— + 6Н2O
Методика. В пробирку вносят 2-3 капли раствора соли никеля (II) и прибавляют по каплям при перемешивании раствор щелочи. Выпадает светло-зеленый осадок.
6.11. Реакция с аммиаком (NH3).
Аммиак осаждает из растворов солей никеля (II) светло-зеленые осадки основных солей никеля (II), например:
Ni(NO3)2 + NH3*H2O → NiOHNO3↓+ NH4NO3
NiCl2 + NH3*H2O → NiOHCI↓ + NH4C1
2NiSO4 + NH3*H2O → (NiOH)2SO4↓+ (NH4)2SO4 и т.д.
В избытке аммиака осадок основной соли никеля (II) растворяется с образованием комплексных гексаминникель (II) — катионов синего цвета, например:
NiOHCI↓ + 6NH3*H2O → [Ni(NH3)6]2+ + OH— + Сl— + 6H2O
Методика. В пробирку вносят 2-3 капли раствора хлорида никеля (II) NiCl2 (нитрата Ni(NO3)2 или сульфата NiSO4) и прибавляют по каплям при перемешивании раствор аммиака до выпадения зеленого осадка NiOHCl. При перемешивании продолжают добавление концентрированного раствора аммиака до полного растворения осадка и образования синего цвета.
6.12. Реакция с реактивом Чугаева (диметилглиоксимом).
Катионы никеля Ni2+ при взаимодействии с диметилглиоксимом при рН = 6-9 образуют малорастворимое в воде внутрикомплексное соединение розово-красного цвета бисдиметилглиоксиматоникель (II):
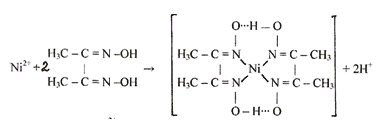
Схема реакции: Ni2+ + 2H2Dm → [Ni (HDm) 2]| + 2H+
Обычно реакцию проводят в среде аммиака.
Осадок растворяется в сильных кислотах и щелочах, нерастворим в растворах аммиака.
Катионы кобальта (II) в малых концентрациях не мешают определению никеля. Мешают катионы Cu2+, Pb2; Fe2+, Fe3+. Эта реакция, впервые предложенная Л. Ф. Чугаевым, является наиболее характерной на катионы никеля (II) и высокочувствительной: предел обнаружения равен 0,16 мкг.
Методика. В пробирку вносят 3-4 капли раствора соли никеля (II), прибавляют 3-4 капли концентрированного аммиака и 1 каплю спиртового раствора диметилглиоксима. Выпадает розово-красный осадок комплекса.
В таблице 6 охарактеризованы продукты некоторых аналитических реакций катионов шестой аналитической группы по кислотно-основной классификации.
Таблица 2. Продукты некоторых аналитических реакций катионов второй аналитической группы по кислотно-основной классификации
|
Реагент |
Продукты аналитических реакций |
||
|
Ag+ |
Hg2+ |
Pb2+ |
|
|
HCl, хлориды |
Белый осадок AgCl. Раств. в растворах NH3, Na2S2О3 |
Белый осадок Hg2Cl2 |
Белый осадок PbCl2. Раств-ся в горячей воде |
|
H2SO4 сульфаты |
Белый осадок Ag2SО4 (из конц. растворов)
|
Белый осадок Hg2SО4 (из конц. растворов) |
Белый осадок PbSО4 Растворим в р-рах щелочей, CH3COONH4, конц. HCl, H2SO4 |
|
NaOH, КОН |
Бурый осадок Ag2O. Ра-им в растворе аммиака |
Черный осадок Hg2O |
Белый осадок Рb (ОН)2. Растворим в щелочах |
|
H2S, Na2S, (NH4) 3S |
Черный осадок Ag2S. Растворяется в HNО3 |
Черный осадок Hg2S, разлагается на HgS + Hg |
Черный осадок PbS. Растворяется в HNО3 |
|
Na2CO3, K2CO3 |
Желтый осадок Ag2CO3. Растворим в растворе аммиака |
Желтый осадок Hg2CO3. Разлагается на HgO+Hg+CO2 |
Белый осадок Рb2(ОН) 2СО3. Растворим в щелочах |
|
KI |
Желтый осадок Agl. Растворим в растворе Na2S2O3 |
Желто-зеленый осадок Hg2J2, разлагается на Hg+Hgl2 |
Желтый осадок РbJ2. Растворим в горячей воде, изб. KI и уксусной кислоте. |
|
K2Cr2O7 + CH3COOH |
Кирпично-красный осадок Ag2Cr2O4 или Ag2Cr2О7. Растворим в аммиаке | Красный осадок Hg2CrO4. Растворим в HNО3 | Желтый осадок РbСrO4. Растворим в щелочах |
Таблица 3. Продукты некоторых аналитических реакций катионов третьей аналитической группы по кислотно-основной классификации
|
Реагент |
Продукты аналитических реакций |
||
|
Ca2+ |
Sr2+ |
Ва2+ |
|
|
H2SO4 |
Белый осадок CaSO4. Растворяется в (NH4)SO4 |
Белый осадок SrSO4. |
Белый осадок BaSO4. |
|
Нерастворим в минеральных кислотах |
|||
|
CaSO4*H2O (гипс, вода) |
Белый осадок SrSO4 |
Белый осадок BaSO4 Нерастворим в минеральных кислотах |
|
|
Na2CO3, К2СО3, (NH4)CO3 |
Белый осадок СаСО3 |
Белый осадок SrCO3 |
Белый осадок ВаСО3 |
| Осадки растворимы в минеральных кислотах и в уксусной кислоте | |||
|
Na2HPO4 рН~5-6 рН>7 |
Белые осадки гидрофосфатов (рН~5-6) и средних фосфатов (рН> 7) |
||
|
СаНРO4, Са3(РO4)2 |
SrHPO4, Sr3(PO4)2 |
ВаНРО3, Ва3(РO4)2 |
|
|
Осадки растворимы в минеральных кислотах и в уксусной кислоте |
|||
|
K2CrO4 |
СаНРO4 Са3РО4 |
Желтый осадок SrCrO4 (из конц. растворов), растворяется в минеральных кислотах и уксусной кислоте |
Желтый осадок ВаСrO4
Растворим в минеральных кислотах и нерастворим в уксусной. |
|
(NH4)2C2O4 |
Белый осадок СаС2O4 Нерастворим в уксусной кислоте |
Белый осадок SrC2O4.
Частично растворим в CH3COOH |
Белый осадок ВаС2O4
Растворим в CH3COOH при нагревании |
|
Осадки растворимы в минеральных кислотах |
|||
Таблица 4. Продукты некоторых аналитических реакций катионов четвертой аналитической по кислотно-основной классификации
|
Реагенты
|
Продукты аналитических реакций |
|||
|
Zn2+ |
Аl3+ |
Sn2+ |
Cr2+ |
|
|
NaOH, КОН
|
Белый осадок Zn(OH)2 |
Белый осадок Аl(ОН)3 |
Белый осадок Sn(OH) 2 |
Серо-зеленый, осадок Сг(ОН) 3 |
|
Осадки гидроксидов растворяются в избытке щелочей. |
||||
|
NaOH + Н2О2 |
[Zn(OH)4] 2- в растворе |
[А1(ОН) 4] — или [Al(OH) 6] 3+ в растворе |
[Sn(OH) 6] 2+ в растворе |
Желтый раствор СгO42- |
|
Раствор NH3 |
Белый осадок Zn(OH)2 |
Белый осадок А1(ОН)3 |
Белый осадок Sn(OH) 2 |
Серо-зеленый, осадок Сг(ОН)3 |
|
Na2CО3 К2СО3 |
Белый осадок (ZnOH)2CO3 |
Белый осадок Аl(ОН)3 |
Белый осадок Sn(OH)2 |
Серо-зелен, осадок Сг(ОН)3 |
|
Na2HPО4
|
Белый осадок Zn3 (PO4) 2 |
Белый осадок AlРО4. Нерастворим в СН3СООН |
Белый осадок SnHPO4, Sn3(PO4)2 |
Зеленый осадок CrPO4, нерастворим в СН3СООН |
|
Осадки растворяются в щелочах |
||||
|
(NH4) 2S |
Белый осадок ZnS |
Белый осадок Аl(ОН)3 |
Черно-бурый осадок SnS |
Серо-зеленый, (серо-фиолетовый) осадок Сг(ОН)3 |
Таблица 5. Продукты некоторых аналитических реакций катионов пятой аналитическойпо кислотно-основной классификации
|
Реагенты |
Продукты аналитических реакций |
||||
|
Mg2+ |
Bi3+ |
Mn2+ |
Fe2+ |
Fe3+ |
|
|
NaOH, КОН NH3, |
Белый осадок Mg(OH)2 |
Белый осадок Bi(OH)3 |
Белый осадок Мn (ОН)2 |
Белый осадок Fe(OH)3 |
Красно-бурый Fe(ОН) 3 |
|
NaOH + Н2О2 |
Белый осадок Mg(OH)2 |
Белый осадок Bi(OH)3 |
Темно- коричневый осадок МnО (ОН)2 или МnО2 |
Красно-бурый осадок Fe(OH)3 |
Красно-бурый Fe(OH)3 |
|
Na2CО3 |
Белый осадок (MgOH)2CO3 |
Белый осадок ВЮНСОз |
Белый осадок FeCО3 |
Белый осадок FeCО3 |
Красно-бурый FeOHCО3 |
|
Na2HPО4 |
Белый осадок MgHPO4, NH4MgPO4 |
Белый осадок BiP04 |
Белый осадок Мп3(РО)4 |
Зеленый осадок FeHPО4 |
Желтый осадок FePО4 |
|
(NH4)S |
Белый осадок Mg(OH)2 из конц.р-ра. |
Черный осадок Bi2S3 |
Осадок телесного, цвета MnS |
Черный осадок FeS |
Черный осадок FeS + S |
|
Разбавление водой хлоридных р-ров (гидролиз) |
Белый осадок ВiOСl |
||||
Таблица 6. Продукты некоторых аналитических реакций катионов шестой аналитической группы по кислотно-основной классификации
|
Реагенты |
Продукты аналитических реакций |
||||
|
Сu2+ |
Cd2+ |
Hg2+ |
Со2+ |
Ni2+ |
|
|
NaOH, КОН |
Голубой осад. CuOHCl (из хлоридных растворов) |
Белый осадок Cd(OH)2 |
Желтый осадок HgO |
Синий осадок Со(ОН)Сl (из хлоридных растворов) |
Зеленый осад. Ni(OH)Cl (из хлоридных растворов) |
|
Раствор NH3 в избытке |
Синий осадок [Сu(NНз)4] 2+ |
Бесцветный [Cd(NH3)4] 2+ |
Бесцветный [Hg(NH3)4] 2+ в растворе |
Желтый [Co(NH3)6]2+ в растворе |
Сине-фиолет. [Ni(NH3)6]2+ в растворе |
|
Na2CO3 |
Голубой осадок (СиОН)2СO3 |
Белый осадок (CdOH)2CO3 |
Красно-бурый осадок HgCO3 или (HgOH)2CO3 |
Розово-фиолетовый Осадок (СоОН)2СO3 |
Зеленый осадок (NiOH)2CO3 |
|
NaHPO4 |
Голубой осадок CuHPO4, Cu3(PO4)2 |
Белый осадок CdHPO4, Cd3(HO4)2 |
Белый осадок HgHPO4, Hg3(PO4)2 |
Фиолетовый осадок СоНРO4. Со3(РO4)2 |
Зеленый осадок NiHPO4, Ni3(PO4)3 |
|
(NH4)2S, H2S |
Черный осадок CuS |
Желтый осадок CdS |
Черный осадок HgS |
Черный осадок CoS |
Черный осадок NiS |
|
Дитизон H2DZ |
Коричневый CuDz |
Красный CdDz |
Оранжевый HgDz |
Фиолетовый CoDz |
Фиолетовый NiDz |
|
Комплексы экстрагируются из водной фазы органическими растворителями |
|||||
Если Вам захотелось создать свой сайт, вы можете заказать сайт в Москве. Web-студия специализирующаяся на создании сайтов с нуля, а также их техническом обслуживании и продвижении.
