Ферменты. Функции и обмен ферментов
1. Укажите особенности конкурентного ингибирования сукцинатдегидрогеназы малонатом:
— этот процесс необратим
— фермент денатурируется
— фермент ингибируется продуктами реакции
— изменяется первичная структура фермента
+ этот процесс обратим
+ угнетение активности зависит от концентрации ингибитора
— угнетение активности не зависит от концентрации ингибитора
2. Укажите особенности связывания цианидов с активным центром гемсодержащего фермента:
+ этот процесс необратим
— фермент денатурируется
— фермент ингибируется продуктами реакции
— изменяется первичная структура фермента
— этот процесс обратим
— угнетение активности зависит от концентрации ингибитора
+ угнетение активности не зависит от концентрации ингибитора
3. Чем объяснить, что амилаза слюны расщепляет крахмал в ротовой полости, но не действует в желудке?
— действие ферментов специфично
+ белковая часть молекулы фермента денатурируется
+ возможен распад первичной структуры фермента
— обратимо изменяется третичная структура
— молекулы субстрата становятся более реакционноспособны
4. Чем объяснить, что амилаза слюны повышает свою активность в присутствии NaCl и понижает в присутствии микроколичеств CuSO4?
— действие ферментов специфично
— белковая часть молекулы фермента денатурируется
— возможен распад первичной структуры фермента
+ обратимо изменяется третичная структура
— молекулы субстрата становятся более реакционноспособны
5. Чем объяснить, что амилаза слюны расщепляет крахмал, но не расщепляет сахарозу?
+ действие ферментов специфично
— белковая часть молекулы фермента денатурируется
— возможен распад первичной структуры фермента
— обратимо изменяется третичная структура
— молекулы субстрата становятся более реакционноспособны
6. Чем объяснить, что амилаза слюны теряет свою активность при температуре свыше 60 °С?
— действие ферментов специфично
+ белковая часть молекулы фермента денатурируется
— возможен распад первичной структуры фермента
— обратимо изменяется третичная структура
— молекулы субстрата становятся более реакционноспособны
7. Чем объяснить, что амилаза слюны быстрее расщепляет крахмал при повышении температуры до 45 °С?
— действие ферментов специфично
— белковая часть молекулы фермента денатурируется
— возможен распад первичной структуры фермента
— обратимо изменяется третичная структура
+ молекулы субстрата становятся более реакционноспособны
8. Чем объяснить, что крахмал не расщепляется в желудке пепсином, но расщепляется в кишечнике амилазой?
+ действие ферментов специфично
— белковая часть молекулы фермента денатурируется
— возможен распад первичной структуры фермента
— обратимо изменяется третичная структура
— молекулы субстрата становятся более реакционноспособны
9. Укажите свойства ферментов, общие со свойствами неорганических катализаторов:
+ ускоряют как прямую, так и обратную реакцию
— обладают термолабильностью
— активность зависит от pH среды
+ не изменяются в ходе реакции
— изменяют активность под действием активаторов и ингибиторов
— обладают специфичностью
— образуют коллодные растворы
10. Укажите свойства ферментов, обусловленные их белковой природой:
— ускоряют как прямую, так и обратную реакцию
+ обладают термолабильностью
+ активность зависит от pH среды
— не изменяются в ходе реакции
+ изменяют активность под действием активаторов и ингибиторов
+ обладают специфичностью
+ образуют коллодные растворы
11. Какие условия обязательно должны выполняться при определении активности ферментов?
+ постоянство температуры
+ Р = 1 атм
— pН = 7
— объем раствора = 1 мл
— концентрация субстрата = 1 ммоль/л
— время инкубации = 1 час
— масса фермента = 1 мг
— раствор — изотонический
12. Какие методы могут быть использованы для очистки фермента?
+ высаливание
— денатурация данного фермента
— очистку необходимо проводить при температуре 25 °С
— щелочной или кислотный гидролиз
+ электрофорез
+ хроматография
+ диализ
13. Схема определения активности щелочной фосфатазы следующая: в две пробирки наливают субстратный раствор, в опытную добавляют сыворотку крови, инкубируют 1 час при 37 °С, в обе пробирки добавляют трихлоруксусную кислоту, центрифугируют, добавляют молибдат и аскорбиновую кислоту для окрашивания и смотрят оптическую плотность на ФЭКе, с какой целью добавляли трихлоруксусную кислоту?
— для просветления контрольного раствора
— с целью высаливания белков
+ для денатурации белков
— для нейтрализации
— для осаждения непрореагировавшего субстрата
— для уменьшения оптической плотности раствора
14. Перечислите факторы, обуславливающие активность ферментов:
+ температура
+ pН среды
— изоэлектрическая точка данного фермента должна быть = pн среды
+ присутствие активатора или ингибитора
— размер фермента не менее 1 мкм
— симметричное расположение аллостерического и активного центров
— ионная сила раствора должна быть близка к нулю
— раствор должен быть обязательно прозрачным
15. Оксалоацетат и ионы меди ингибируют сукцинат-дегидрогеназу. Что общего и в чем различие в механизме действия этих ингибиторов? (выберите правильные ответы)
— оба присоединяются к аллостерическому центру
+ оба присоединяются к контактному участку
+ оксалоацетат — конкурентный ингибитор
— ионы меди — конкурентный ингибитор
— сдвигают равновесие хим. реакции влево
— увеличивают энергию активации субстрата
— образуется тройной комплекс оксалоацетат-фермент-сукцинат
— ингибирование обоих снимается увеличением концентрации субстрата
16. Перенос остатка фосфорной кислоты с молекулы АТФ на молекулу субстрата осуществляет:
— дегидрогеназа
— оксидаза
— оксигеназа
— мутаза
— синтаза
+ киназа
17. Включение кислорода в молекулу субстрата осуществляет:
— дегидрогеназа
— оксидаза
+ оксигеназа
— мутаза
18. Перенос остатка фосфорной кислоты в пределах молекулы субстрата осуществляет:
+ мутаза
— синтаза
— синтетаза
— фосфатаза
19. Реакцию, в которой акцептором атомов водорода является кислород, осуществляет:
— дегидрогеназа
+ оксидаза
— оксигеназа
— мутаза
20. Абсолютной групповой субстратной специфичностью обладают:
+ гексокиназа
— глюкокиназа
— трипсин
— щелочная фосфатаза
+ алкогольдегидрогеназа
21. Относительной групповой субстратной специфичностью обладают:
— гексокиназа
— глюкокиназа
+ трипсин
— глицилглициндипептидаза
+ щелочная фосфатаза
— алкогольдегидрогеназа
22. Абсолютной субстратной специфичностью обладают:
— гексокиназа
+ глюкокиназа
— трипсин
+ глицилглициндипептидаза
— щелочная фосфатаза
23. Активность каких ферментов в сыворотке крови значительно повышается при поражениях печени?
— амилаза
— асаt — аспартатаминотрансфераза
+ алаt — аланинаминотрансфераза
+ щелочная фосфатаза
— креатинфосфокиназа — КФК2 (мв)
— креатинфосфокиназа — КФК3 (мм)
24. Активность каких ферментов в сыворотке крови значительно повышается при поражениях миокарда?
— амилаза
+ асаt — аспартатаминотрансфераза
— алаt — аланинаминотрансфераза
— щелочная фосфатаза
+ креатинфосфокиназа — КФК2 (мв)
— креатинфосфокиназа — КФК3 (мм)
+ лактатдегидрогеназы — ЛДГ1, ЛДГ2
— лактатдегидрогеназы — ЛДГ4, ЛДГ5
25. Определение активности каких ферментов в сыворотке крови используется при поражениях костной ткани?
— амилаза
— алаt — аланинаминотрансфераза
+ щелочная фосфатаза
— креатинфосфокиназа — КФК2 (мв)
— лактатдегидрогеназы — ЛДГ1, ЛДГ2
26. Активность каких ферментов в сыворотке крови значительно повышается при поражениях скелетных мышц?
— креатинфосфокиназа — КФК2 (мв)
+ креатинфосфокиназа — КФК3 (мм)
— лактатдегидрогеназы — ЛДГ1, ЛДГ2
+ лактатдегидрогеназы — ЛДГ4, ЛДГ5
— лактатдегидроденаза — ЛДГ3
27. Определение активности каких ферментов в сыворотке крови используется при поражениях поджелудочной железы?
+ амилаза
— асаt — аспартатаминотрансфераза
— алаt — аланинаминотрансфераза
— щелочная фосфатаза
— креатинфосфокиназа — КФК2 (мв)
— креатинфосфокиназа — КФК3 (мм)
30. В каких случаях применяется ферментный препарат фибринолизин?
+ секреторная недостаточность желудка
— для очищения трофических язв от некротизированной ткани
— воспалительные заболевания поджелудочной железы
+ образование грубых рубцов, контрактур
+ острые тромбофлебиты, флеботромбозы
+ свежий инфаркт миокарда
31. В каких случаях применяется ферментный препарат трипсин, химотрипсин?
— секреторная недостаточность желудка
+ секреторная недостаточность кишечника
+ для очищения трофических язв от некротизированной ткани
— воспалительные заболевания поджелудочной железы
+ расжижения слизистого и гнойного секретов при гайморитах
— образование грубых рубцов, контрактур
32. В каких случаях применяются препараты контрикал, трасилол (ингибиторы протеаз)?
— секреторная недостаточность желудка
— секреторная недостаточность кишечника
— для очищения трофических язв от некротизированной ткани
+ воспалительные заболевания поджелудочной железы
33. В каких случаях применяется ферментный препарат пепсин?
+ секреторная недостаточность желудка
— образование грубых рубцов, контрактур
— острые тромбофлебиты, флеботромбозы
— свежий инфаркт миокарда
34. В каких случаях применяется ферментный препарат гиалуронидаза (лидаза)?
— расжижения слизистого и гнойного секретов при гайморитах
+ образование грубых рубцов, контрактур
— острые тромбофлебиты, флеботромбозы
— свежий инфаркт миокарда
35. Аспирин и индометацин широко применяются при лечении различных воспалительных процессов. Назовите фермент, ингибирование которого лежит в основе действия этих препаратов?
+ циклооксигеназа
36. Нитроглицерин и сустак применяются при лечении различных форм стенокардии. Назовите фермент, активация которого является одним из звеньев в реализации этими препаратами своего коронарорасширяющего действия?
+ гуанилатциклаза
37. Перечислите, пожалуйста, невитаминные коферменты.
+ нуклеотидные (удф-глюкоза, цдф-холин)
— липоевая кислота
— пиридоксиновые
— кобамидные
+ фосфаты моносахаридов
+ металлпорфириновые
+ глутатион
+ кофермент А
38. Перечислите, пожалуйста, коферменты, способные переносить аминогруппу.
— НАД, НАДФ
— липоевая кислота
— кофермент А
+ пиридоксиновые
— фосфаты моносахаридов
39. Перечислите, пожалуйста, коферменты, способные переносить ацильную группу.
— НАД, НАДФ
— липоевая кислота
+ карнитин
— биотин
+ кофермент А
40. Исходя из функции коферментов, определите, в состав каких ферментов входят коферменты пиридоксальфосфат и пиридоксаминфосфат?
— лактатдегидрогеназа
— дипептидаза
— а-амилаза
+ аланинаминотрансфераза
+ аспартатаминотрансфераза
41. Перечислите, пожалуйста, коферменты лигаз.
— НАД, НАДФ
— липоевая кислота
— карнитин
+ биотин
+ нуклеотидные (удф-глюкоза, цдф-холин)
42. Перечислите, пожалуйста, коферменты изомераз.
— НАД, НАДФ
— липоевая кислота
— карнитин
+ пиридоксиновые
+ фосфаты моносахаридов
43. Перечислите, пожалуйста, коферменты лиаз.
— липоевая кислота
— карнитин
— биотин
+ кофермент А
+ пиридоксиновые
44. Перечислите, пожалуйста, коферменты оксидоредуктаз.
+ НАД, НАДФ
+ ФМН, ФАД
— биотин
— нуклеотидные (удф-глюкоза, цдф-холин)
— кофермент А
45. Перечислите, пожалуйста, коферменты трансфераз.
— НАД, НАДФ
— биотин
+ нуклеотидные (удф-глюкоза, цдф-холин)
+ кофермент А
46. Исходя из функции кофермента, определите, в состав каких ферментов входит кофермент НАД+ ?
— а-амилаза
+ глутаматдегидрогеназа
— холинацетилтрансфераза
— дипептидаза
— пируватдекарбоксилаза
+ альдегиддегидрогеназа
47. Исходя из функции кофермента, определите, в состав каких ферментов входит кофермент А?
— дипептидаза
+ холинацетилтрансфераза
— пируватдекарбоксилаза
+ ацилпереносящий белок синтетазы жирных кислот
— цитохромоксидаза
48. Укажите наиболее активные коферментные формы витаминов:
— ТМФ
+ ТДФ
— ТТФ
— пиридоксамин
+ ПАЛФ
— пантотеновая к-та
+ кoа-sh
49. Перечислите, пожалуйста, нуклеотидные коферменты.
+ НАД, НАДФ
+ ФАД
— фосфаты моносахаридов
+ удф-глюкоза, цдф-холин
— пиридоксальфосфат
— ТГФК (тетрагидрофолиевая кислота)
50. Перечислите, пожалуйста, пептидные коферменты.
— удф-глюкоза, цдф-холин
— пиридоксальфосфат
— липоевая кислота
+ глутатион
+ биотин
— ТГФК (тетрагидрофолиевая кислота)
51. Один из методов лечения при отравлении метанолом состоит в том, что больному назначают этанол (этиловый спирт) либо внутрь, либо внутривенно. Объясните, почему такое лечение оказывается эффективным?
— этанол необратимо ингибирует фермент
— этанол обезвреживает формальдегид
— этанол изменяет равновесие реакции
+ этанол конкурирует за обладание активным центром
— фермент денатурируется
52. Могут ли данные соединения или группировки в радикалах аминокислот формировать активные центры ферментов?
+ кофермент НАД
+ ТДФ — активная форма витамина В1
— глюкоза
+ -cooh аспартата
+ -sh цистеина
53. Исходя из катализируемой реакции, определите к какому классу относится фермент а-амилаза ?
— оксидоредуктазы
— трансферазы
+ гидролазы
— лиазы
54. Исходя из катализируемой реакции, определите к какому классу относится фермент АТФаза ?
— оксидоредуктазы
— трансферазы
+ гидролазы
— лиазы
55. Исходя из катализируемой реакции, определите к какому классу относится фермент щелочная фосфатаза?
— трансферазы
+ гидролазы
— лиазы
— лигазы
56. Исходя из катализируемой реакции, определите к какому классу ферментов относится 5-гидрокситриптофандекарбоксилаза?
— гидролазы
+ лиазы
— изомеразы
— лигазы
57. Исходя из катализируемой реакции, определите к какому классу относится фермент дегидратаза?
— гидролазы
+ лиазы
— изомеразы
— лигазы
58. Исходя из катализируемой реакции, определите к какому классу относится фермент трипсин?
— оксидоредуктазы
— трансферазы
+ гидролазы
— лиазы
59. Витамин В2 является составной частью кофермента:
— пиридоксальфосфата
— никотинамидадениндинуклеотида
+ флавинадениндинуклеотида
— тиаминпирофосфата
60. Превращение перекиси водорода в воду и кислород осуществляется при участии:
— оксигеназы
+ каталазы
— пероксидазы
— оксидазы
61. Формилтрансферазные реакции протекают при участии кофермента:
— пиридоксальфосфата
— тиаминпирофосфата
+ тетрагидрофолиевой кислоты
— флавинадениндинуклеотида
62. Определите, какие выражения являются верными:
— недостаток ферментов в тканях у больного можно восполнить введением их парентерально.
+ металлоферменты могут катализировать реакции окисления-восстановления.
— при определении активности фермента концентрация субстрата должна быть физиологической.
63. Определите, какие выражения являются верными:
+ белки после денатурации легче расщепляются протеолитическими ферментами.
— при конкурентном ингибировании образуется тройной комплекс фермент-субстрат-ингибитор.
— изоферменты дают одинаковую скорость реакции.
64. Определите, какие выражения являются верными:
— в изоэлектрическом состоянии фермент наиболее устойчив в растворе.
+ коферменты могут изменяться в ходе ферментативной реакции.
+ единица активности фермента — количество фермента, способное превратить 1 мкмоль субстрата за 1 мин в стандартных условиях.
65. Определите, какие выражения являются верными:
— большинство метаболических процессов в организме близко к состоянию равновесия.
+ субстратное ингибирование снимается при снижении концентрации субстрата.
— при денатурации фермента увеличивается его растворимость.
66. Определите, какие выражения являются верными:
+ фермент уменьшает энергию активации субстрата.
— при аллостерическом ингибировании ингибитор начинает медленно присоединяться к активному центру и блокирует его.
— в полиферментных системах ферменты обязательно соединены друг с другом при помощи белок-белкового взаимодействия.
67. Определите, какие выражения являются верными:
+ ферменты гликолиза составляют полиферментную систему.
— в присутствие субстрата фермент становится менее устойчивым к действию различных факторов (температуры и т.д.).
— константа Михаэлиса — это константа равновесия химической реакции.
68. Определите, какие выражения являются верными:
+ в изоэлектрическом состоянии белки (ферменты) легче подвергаются тепловой денатурации.
— образование фермент-субстратного комплекса — необязательная стадия ферментативного катализа.
+ в физиологических условиях ферменты редко работают при насыщающих концентрациях субстрата.
69. Определите, какие выражения являются верными:
— чем выше костанта Михаэлиса, тем выше скорость реакции при прочих равных условиях.
— антикоферменты — неконкурентные ингибиторы.
+ иммобилизованные ферменты обычно менее активны, чем исходные.
70. Определите, какие выражения являются верными:
— после «высаливания» фермент необратимо утрачивает свои каталитические свойства.
— изоферменты катализируют разные реакции.
+ при определении активности фермента концентрация субстрата должна превышать константу михаэлиса более чем в 2 раза.
71. Определите, какие выражения являются верными:
— при нулевом порядке скорость реакции прямо пропорциональна концентрации одного из субстратов.
— изоферменты не отличаются друг от друга по физико-химическим свойствам.
+ для аллостерической регуляции характерна кооперативность.
72. Что можно отнести к изоферментам (имеют генетические различия в первичной структуре)?
+ малатдегидрогеназа митохондрий и цитоплазмы.
— все аллостерические модификации ферментов.
+ лактатдегидрогеназы.
— семейство химотрипсинов, образующихся из химотрипсиногена.
73. Для количественного определения ферментов в крови и моче могут быть использованы различные методы. Какой из данных методов неприемлем в условиях клиники?
— основанный на количественном определении продуктов реакции при действии фермента.
+ основанный на количественном определении фермента как белка.
— по уменьшению концентрации субстрата.
ФЕРМЕНТЫ
1. Какова химическая природа ферментов?
1 — сложные белки
2 — производные витаминов
3 — производные аминокислот
+ простые и сложные белки
2. Из приведенного перечня физико-химических свойств катализаторов различной химической природы выберите отличительные свойства присущие ферментам (5 ответов):
+ увеличивают скорость химических реакций
2– не изменяют скорость хи мических реакций
+ термолабильны
4 – термостабильны
5 – в процессе реакции не расходуются
6 — в процессе реакции расходу ются
+ чувствительны к небольшим изменениям рН
8 – не чувствительны к изменению рН
9 – увеличивают энергию активации
10 – не влияют на энергию активации
+ обладают высокой специфичностью
12 – не обладают высокой специфи чностью
+ отвечают на регуляторные воздействия
14 – не отвечают на регуляторные воздействия
+ обладают оптимумами по t°, pH, d
16– не обладают оптимумами по t°, pH, d
3. Какова физиологическая роль кофактора в катализе? (2 ответа)
1 – определяет субстратную и каталитическую специфичность
+ стабилизирует структуру фермента
+ принимает непосредственное участие в катализе
4 — принимает опосредованное участие в катализе
4. Дайте определение понятию апофермент:
1 -комплекс белка и кофермента
+ белковая часть сложного фермента
3 — не белковая часть сложного фермента
4 — простой фермент
5. Выберите название участка на ферменте, к которому присоединяется модулятор активности фермента:
1 — активный центр
+ аллостерический центр
3 — каталитический центр
4 — субстратный центр
5 — кофактор
6. Каким биохимическим методом можно обнаружить наличие фермента в биологическом материале:
1 — центрифугированием
2 – хроматографированием
3 — цветной реакцией на пептидную связь
+ цветной реакцией на продукт реакции
7. Как изменится скорость химической реакции при ферментативном катализе если Км с 10 ммоль/л уменьшится до 0,1 ммоль/л?
1 — уменьшится
+ увеличится
3 — не изменится
8. Выберите один из ниже приведённых признаков положенных в основу современной международной классификации ферментов:
1 — строение субстрата
+ тип химической связи
2 — строение продукта
9. К какому классу относятся ферменты, используемые для ингаляционной энзимотерапии?
1 — оксидоредуктазы
2 — трансферазы
+ гидролазы
4 — лиазы
5 — изомеразы
6 – все
10. Какому из приведенного набора субъединиц соответствует изофермент ЛДГ2 ?
1 — НННН
+ НННМ
3 — ННММ
4 — НМММ
5 — ММММ
11. Выберите, каким механизмом регуляции активности фермента обладает лекарственное вещество, если известно, что длительное применение препарата приводит к снижению эффективности лечения, длительная отмена — к ее восстановлению?
1 — аллостерическим
+ индукции — репрессии
3 — конкурентным
Укажите особенности конкурентного ингибирования сукцинатдегидрогеназы малонатом (СООН-СН2-СООН):
этот процесс необратим
фермент денатурируется
фермент ингибируется продуктами реакции
изменяется первичная структура фермента
+ этот процесс обратим
+ угнетение активности зависит от концентрации ингибитора
угнетение активности не зависит от концентрации ингибитора
Укажите особенности связывания цианидов с активным центром гемсодержащего фермента:
+ этот процесс необратим
фермент денатурируется
фермент ингибируется продуктами реакции
изменяется первичная структура фермента
этот процесс обратим
угнетение активности зависит от концентрации ингибитора
+ угнетение активности не зависит от концентрации ингибитора
Чем объяснить, что амилаза слюны расщепляет крахмал в ротовой полости, но не действует в желудке?
действие ферментов специфично
+ белковая часть молекулы фермента денатурируется
+ возможен распад первичной структуры фермента
обратимо изменяется третичная структура
молекулы субстрата становятся более реакционноспособны
Чем объяснить, что амилаза слюны повышает свою активность в присутствии NаCl и понижает в присутствии микроколичеств СuSO4?
действие ферментов специфично
белковая часть молекулы фермента денатурируется
возможен распад первичной структуры фермента
+ обратимо изменяется третичная структура
молекулы субстрата становятся более реакционноспособны
Чем объяснить, что амилаза слюны расщепляет крахмал, но не расщепляет сахарозу?
+ действие ферментов специфично
белковая часть молекулы фермента денатурируется
возможен распад первичной структуры фермента
обратимо изменяется третичная структура
молекулы субстрата становятся более реакционноспособны
Чем объяснить, что амилаза слюны теряет свою активность при температуре свыше 60 град С?
действие ферментов специфично
+ белковая часть молекулы фермента денатурируется
возможен распад первичной структуры фермента
обратимо изменяется третичная структура
молекулы субстрата становятся более реакционноспособны
Чем объяснить, что амилаза слюны быстрее расщепляет крахмал при повышении температуры до 45 град С?
действие ферментов специфично
белковая часть молекулы фермента денатурируется
возможен распад первичной структуры фермента
обратимо изменяется третичная структура
+ молекулы субстрата становятся более реакционноспособны
Чем объяснить, что крахмал не расщепляется в желудке пепсином, но расщепляется в кишечнике амилазой?
+ действие ферментов специфично
белковая часть молекулы фермента денатурируется
возможен распад первичной структуры фермента
обратимо изменяется третичная структура
молекулы субстрата становятся более реакционноспособны
Укажите свойства ферментов, общие со свойствами неорганических катализаторов:
+ ускоряют как прямую, так и обратную реакцию
обладают термолабильностью
активность зависит от рН среды
+ не изменяются в ходе реакции
изменяют активность под действием активаторов и ингибиторов
обладают специфичностью
образуют коллодные растворы
Укажите свойства ферментов, обусловленные их белковой природой:
ускоряют как прямую, так и обратную реакцию
+ обладают термолабильностью
+ активность зависит от ph среды
не изменяются в ходе реакции
+ изменяют активность под действием активаторов и ингибиторов
+ обладают специфичностью
+ образуют коллодные растворы
Какие условия обязательно должны выполняться при определении активности ферментов?
+ постоянство температуры
+ р = 1 атм
ph = 7
объем раствора = 1 мл
концентрация субстрата = 1 ммоль/л
время инкубации = 1 час
масса фермента = 1 мг
раствор — изотонический
Какие методы могут быть использованы для очистки фермента?
+ высаливание
денатурация данного фермента
очистку необходимо проводить при температуре 25 гpад с
щелочной или кислотный гидролиз
+ электрофорез
+ хроматография
+ диализ
Схема определения активности щелочной фосфатазы следующая:
— в две пробирки наливают субстратный раствор, в опытную добавляют сыворотку крови, инкубируют 1 час при 37 град С
— в обе пробирки добавляют трихлоруксусную кислоту, центрифугируют
— добавляют молибдат и аскорбиновую кислоту для окрашивания и смотрят оптическую плотность на ФЭК
С какой целью добавляли трихлоруксусную кислоту?
для просветления контрольного раствора
с целью высаливания белков
+ для денатурации белков
для нейтрализации
для осаждения непрореагировавшего субстрата
для уменьшения оптической плотности раствора
Перечислите факторы, обуславливающие активность ферментов:
+ температура
+ pН среды
изоэлектрическая точка данного фермента должна быть = pН среды
+ присутствие активатора или ингибитора
размер фермента не менее 1 мкм
симметричное расположение аллостерического и активного центров
ионная сила раствора должна быть близка к нулю
раствор должен быть обязательно прозрачным
Оксалоацетат и ионы меди ингибируют сукцинат-дегидрогеназу. что общего и в чем различие в механизме действия этих ингибиторов?
оба присоединяются к аллостерическому центру
+ оба присоединяются к контактному участку
+ оксалоацетат — конкурентный ингибитор
ионы меди — конкурентный ингибитор
сдвигают равновесие хим. реакции влево
увеличивают энергию активации субстрата
образуется тройной комплекс оксалоацетат-фермент-сукцинат
ингибирование обоих снимается увеличением концентрации субстрата
Перенос остатка фосфорной кислоты с молекулы АТФ на молекулу субстрата осуществляет:
дегидрогеназа
оксидаза
оксигеназа
мутаза
синтаза
синтетаза
+ киназа
фосфатаза
Включение кислорода в молекулу субстрата осуществляет:
дегидрогеназа
оксидаза
+ оксигеназа
мутаза
синтаза
синтетаза
киназа
фосфатаза
Перенос остатка фосфорной кислоты в пределах молекулы субстрата осуществляет:
дегидрогеназа
оксидаза
оксигеназа
+ мутаза
синтаза
синтетаза
киназа
фосфатаза
Реакцию, в которой акцептором атомов водорода является кислород, осуществляет:
дегидрогеназа
+ оксидаза
оксигеназа
мутаза
синтаза
синтетаза
киназа
фосфатаза
Абсолютной групповой субстратной специфичностью обладают:
+ гексокиназа
глюкокиназа
трипсин
глицилглициндипептидаза
щелочная фосфатаза
+ алкогольдегидрогеназа
Относительной групповой субстратной специфичностью обладают:
гексокиназа
глюкокиназа
+ трипсин
глицилглициндипептидаза
+ щелочная фосфатаза
алкогольдегидрогеназа
Абсолютной субстратной специфичностью обладают:
гексокиназа
+ глюкокиназа
трипсин
+ глицилглициндипептидаза
щелочная фосфатаза
алкогольдегидрогеназа
Активность каких ферментов в сыворотке крови значительно повышается при поражениях печени?
амилаза
асаt — аспартатаминотрансфераза
+ алаt — аланинаминотрансфераза
+ щелочная фосфатаза
креатинфосфокиназа — кфк2 (мв)
креатинфосфокиназа — кфк3 (мм)
Активность каких ферментов в сыворотке крови значительно повышается при поражениях миокарда?
амилаза
+ асаt — аспартатаминотрансфераза
алаt — аланинаминотрансфераза
щелочная фосфатаза
+ креатинфосфокиназа — кфк2 (мв)
креатинфосфокиназа — кфк3 (мм)
+ лактатдегидрогеназы — лдг1, лдг2
лактатдегидрогеназы — лдг4, лдг5
лактатдегидроденаза — лдг3
Определение активности каких ферментов в сыворотке крови используется при поражениях костной ткани?
амилаза
асаt — аспартатаминотрансфераза
алаt — аланинаминотрансфераза
+ щелочная фосфатаза
креатинфосфокиназа — кфк2 (мв)
креатинфосфокиназа — кфк3 (мм)
лактатдегидрогеназы — лдг1, лдг2
лактатдегидрогеназы — лдг4, лдг5
лактатдегидроденаза — лдг3
Активность каких ферментов в сыворотке крови значительно повышается при поражениях скелетных мышц?
амилаза
асаt — аспартатаминотрансфераза
алаt — аланинаминотрансфераза
щелочная фосфатаза
креатинфосфокиназа — кфк2 (мв)
+ креатинфосфокиназа — кфк3 (мм)
лактатдегидрогеназы — лдг1, лдг2
+ лактатдегидрогеназы — лдг4, лдг5
лактатдегидроденаза — лдг3
Определение активности каких ферментов в сыворотке крови используется при поражениях поджелудочной железы?
+ амилаза
асаt — аспартатаминотрансфераза
алаt — аланинаминотрансфераза
щелочная фосфатаза
креатинфосфокиназа — кфк2 (мв)
креатинфосфокиназа — кфк3 (мм)
лактатдегидрогеназы — лдг1, лдг2
лактатдегидрогеназы — лдг4, лдг5
В каких случаях применяется ферментный препарат фибринолизин?
секреторная недостаточность желудка
секреторная недостаточность кишечника
для очищения трофических язв от некротизированной ткани
воспалительные заболевания поджелудочной железы
расжижения слизистого и гнойного секретов при гайморитах
образование грубых рубцов, контрактур
+ острые тромбофлебиты, флеботромбозы
+ свежий инфаркт миокарда
В каких случаях применяется ферментный препарат трипсин, химотрипсин?
секреторная недостаточность желудка
+ секреторная недостаточность кишечника
+ для очищения трофических язв от некротизированной ткани
воспалительные заболевания поджелудочной железы
+ расжижения слизистого и гнойного секретов при гайморитах
образование грубых рубцов, контрактур
В каких случаях применяются препараты контрикал, трасилол (ингибиторы протеаз)?
секреторная недостаточность желудка
секреторная недостаточность кишечника
для очищения трофических язв от некротизированной ткани
+ воспалительные заболевания поджелудочной железы
расжижения слизистого и гнойного секретов при гайморитах
образование грубых рубцов, контрактур
острые тромбофлебиты, флеботромбозы
В каких случаях применяется ферментный препарат пепсин?
+ секреторная недостаточность желудка
секреторная недостаточность кишечника
для очищения трофических язв от некротизированной ткани
воспалительные заболевания поджелудочной железы
расжижения слизистого и гнойного секретов при гайморитах
образование грубых рубцов, контрактур
острые тромбофлебиты, флеботромбозы
свежий инфаркт миокарда
В каких случаях применяется ферментный препарат гиалуронидаза (лидаза)?
секреторная недостаточность желудка
секреторная недостаточность кишечника
для очищения трофических язв от некротизированной ткани
воспалительные заболевания поджелудочной железы
расжижения слизистого и гнойного секретов при гайморитах
+ образование грубых рубцов, контрактур
острые тромбофлебиты, флеботромбозы
свежий инфаркт миокарда
Аспирин и индометацин широко применяются при лечении различных воспалительных процессов. Назовите фермент ингибирование которого лежит в основе действия этих препаратов?
+ циклооксигеназа
Нитроглицерин и сустак применяются при лечении различных форм стенокардии. Назовите фермент, активация которого является одним из звеньев в реализации этими препаратами своего коронарорасширяющего действия?
+ гуанилатциклаза
Перечислите невитаминные коферменты.
+ нуклеотидные (УДФ-глюкоза, ЦДФ-холин)
липоевая кислота
пиридоксиновые
кобамидные
+ фосфаты моносахаридов
+ металлпорфириновые
+ глутатион
биотин
хиноновые
Перечислите коферменты, способные переносить аминогруппу.
НАД, НАДФ
липоевая кислота
карнитин
биотин
кофермент А
+ пиридоксиновые
фосфаты моносахаридов
Перечислите коферменты, способные переносить ацильную группу.
над, НАДФ
липоевая кислота
+ карнитин
биотин
+ кофермент А
пиридоксиновые
фосфаты моносахаридов
Перечислите невитаминные коферменты.
над, НАДФ
липоевая кислота
карнитин
биотин
кофермент А
пиридоксиновые
+ фосфаты моносахаридов
Перечислите коферменты лигаз.
над, НАДФ
липоевая кислота
карнитин
+ биотин
кофермент А
пиридоксиновые
фосфаты моносахаридов
Перечислите коферменты изомераз.
над, НАДФ
липоевая кислота
карнитин
биотин
кофермент А
+ пиридоксиновые
+ фосфаты моносахаридов
Перечислите коферменты лиаз.
над, НАДФ
липоевая кислота
карнитин
биотин
+ кофермент А
+ пиридоксиновые
фосфаты моносахаридов
Перечислите коферменты оксидоредуктаз.
+ над, НАДФ
+ ФМН, ФАД
биотин
нуклеотидные (УДФ-глюкоза, ЦДФ-холин)
кофермент А
Перечислите коферменты трансфераз.
над, НАДФ
фмн, фад
биотин
+ нуклеотидные (УДФ-глюкоза, ЦДФ-холин)
+ кофермент А
Перечислите коферменты лигаз.
НАД, НАДФ
ФМН, ФАД
+ биотин
+ нуклеотидные (УДФ-глюкоза, ЦДФ-холин)
кофермент А
Перечислите невитаминные коферменты.
НАД, НАДФ
ФМН, ФАД
биотин
+ нуклеотидные (УДФ-глюкоза, ЦДФ-холин)
кофермент А
Исходя из функции коферментов, определите, в состав каких ферментов входят коферменты пиридоксальфосфат и пиридоксаминфосфат?
лактатдегидрогеназа
дипептидаза
а-амилаза
+ аланинаминотрансфераза
+ аспартатаминотрансфераза
щелочная фосфатаза
цитохромоксидаза
Исходя из функции кофермента, определите, в состав каких ферментов входит кофермент НАД+?
моноаминооксидаза
а-амилаза
+ глутаматдегидрогеназа
холинацетилтрансфераза
пируватдекарбоксилаза
+ альдегиддегидрогеназа
Исходя из функции кофермента, определите, в состав каких ферментов входит кофермент А?
+ холинацетилтрансфераза
пируватдекарбоксилаза
+ ацилпереносящий белок синтетазы жирных кислот
цитохромоксидаза
Укажите наиболее активные коферментные формы витаминов:
ТМФ
+ ТДФ
+ ПАЛФ
пантотеновая к-та
+ КoА-SH
фолиевая к-та
Перечислите нуклеотидные коферменты.
+ НАД, НАДФ
+ ФАД
фосфаты моносахаридов
+ УДФ-глюкоза, ЦДФ-холин
пиридоксальфосфат
липоевая кислота
Перечислите пептидные коферменты.
липоевая кислота
+ глутатион
биотин
ТГФК (тетрагидрофолиевая кислота)
кобамидные
фосфаты моносахаридов
металлпорфириновые
биотин
хиноновые
Укажите правильную форму восстановленной формы НАД?

Правильная форма карбоксибиотина?
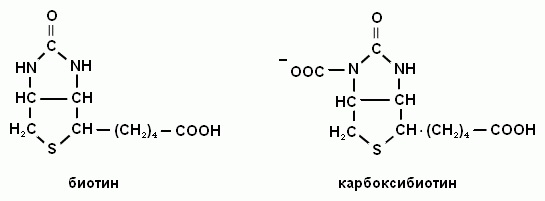
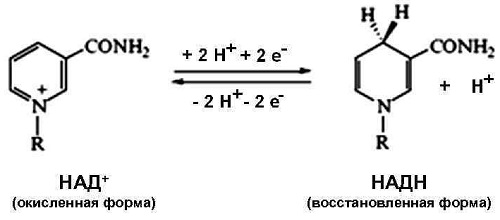
Укажите правильную форму восстановленной формы НАДН?
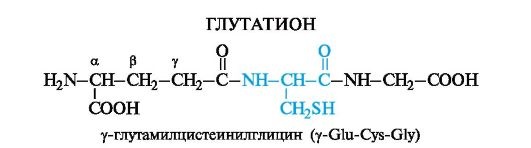
Какая химическая формула соответствует глутатиону?
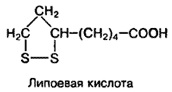
Какая химическая формула соответствует липоевой кислоте?
Один из методов лечения при отравлении метанолом состоит в том, что больному назначают этиловый спирт либо внутрь, либо внутривенно. Объясните, почему такое лечение оказывается эффективным?
этанол необратимо ингибирует фермент
этанол обезвреживает формальдегид
этанол изменяет равновесие реакции
+ этанол конкурирует за обладание активным центром
фермент денатурируется
Могут ли данные соединения или группировки в радикалах аминокислот формировать активные центры ферментов?
+ кофермент НАД
+ ТДФ — активная форма витамина В1
глюкоза
+ -COOH аспартата
+ -SH цистеина
Исходя из катализируемой реакции, определите к какому классу относится фермент а-амилаза?
оксидоредуктазы
трансферазы
+ гидролазы
лиазы
изомеразы
лигазы
Исходя из катализируемой реакции, определите к какому классу относится фермент атфаза?
оксидоредуктазы
трансферазы
+ гидролазы
лиазы
изомеразы
лигазы
Исходя из катализируемой реакции, определите к какому классу относится фермент щелочная фосфатаза?
оксидоредуктазы
трансферазы
+ гидролазы
лиазы
изомеразы
лигазы
Исходя из катализируемой реакции, определите к какому классу ферментов относится 5-гидрокситриптофандекарбоксилаза?
оксидоредуктазы
трансферазы
гидролазы
+ лиазы
изомеразы
лигазы
Исходя из катализируемой реакции, определите к какому классу относится фермент дегидратаза?
оксидоредуктазы
трансферазы
гидролазы
+ лиазы
изомеразы
лигазы
Исходя из катализируемой реакции, определите к какому классу относится фермент трипсин?
оксидоредуктазы
трансферазы
+ гидролазы
лиазы
изомеразы
лигазы
Витамин В2 является составной частью кофермента:
пиридоксальфосфата
биотина
никотинамидадениндинуклеотида
+ флавинадениндинуклеотида
тиаминпирофосфата
Превращение 2Н2О2 → 2 Н2О + О2 осуществляется при участии :
оксигеназы
+ каталазы
пероксидазы
оксидазы
НАД — зависимой дегидрогеназы
Формилтрансферазные реакции протекают при участии кофермента:
пиридоксальфосфата
тиаминпирофосфата
коэнзима А
+ тетрагидрофолиевой кислоты
флавинадениндинуклеотида
Определите, какие выражения являются верными:
недостаток ферментов в тканях у больного можно восполнить введением их парентерально.
+ металлоферменты могут катализировать реакции окисления-восстановления.
при определении активности фермента концентрация субстрата должна быть физиологической.
Определите, какие выражения являются верными:
+ белки после денатурации легче расщепляются протеолитическими ферментами.
при конкурентном ингибировании образуется тройной комплекс фермент-субстрат-ингибитор.
изоферменты дают одинаковую скорость реакции.
Определите, какие выражения являются верными:
в изоэлектрическом состоянии фермент наиболее устойчив в растворе.
+ коферменты могут изменяться в ходе ферментативной реакции.
+ единица активности фермента — количество фермента, способное превратить 1 мкмоль субстрата за 1 мин в стандартных условиях.
Определите, какие выражения являются верными:
большинство метаболических процессов в организме близко к состоянию равновесия.
+ субстратное ингибирование снимается при снижении концентрации субстрата.
при денатурации фермента увеличивается его растворимость.
Определите, какие выражения являются верными:
+ фермент уменьшает энергию активации субстрата.
при аллостерическом ингибировании ингибитор начинает медленно присоединяться к активному центру и блокирует его.
в полиферментных системах ферменты обязательно соединены друг с другом при помощи белок-белкового взаимодействия.
Определите, какие выражения являются верными:
+ ферменты гликолиза составляют полиферментную систему.
в присутствие субстрата фермент становится менее устойчивым к действию различных факторов (температуры и т.д.).
константа михаэлиса — это константа равновесия химической реакции.
Определите, какие выражения являются верными:
+ в изоэлектрическом состоянии белки (ферменты) легче подвергаются тепловой денатурации.
образование фермент-субстратного комплекса – необязательная стадия ферментативного катализа.
+ в физиологических условиях ферменты редко работают при насыщающих концентрациях субстрата.
Определите, какие выражения являются верными:
чем выше костанта михаэлиса, тем выше скорость реакции при прочих равных условиях.
антикоферменты — неконкурентные ингибиторы.
+ иммобилизованные ферменты обычно менее активны, чем исходные.
Определите, какие выражения являются верными:
после «высаливания» фермент необратимо утрачивает свои каталитические свойства.
изоферменты катализируют разные реакции.
+ при определении активности фермента концентрация субстрата должна превышать константу михаэлиса более чем в 2 раза.
Определите, какие выражения являются верными:
при нулевом порядке скорость реакции прямо пропорциональна концентрации одного из субстратов.
изоферменты не отличаются друг от друга по физико-химическим свойствам.
+ для аллостерической регуляции характерна кооперативность.
Что можно отнести к изоферментам (имеют генетические различия в первичной структуре)?
+ малатдегидрогеназа митохондрий и цитоплазмы.
все аллостерические модификации ферментов.
+ лактатдегидрогеназы.
семейство химотрипсинов, образующихся из химотрипсиногена.
Для количественного определения ферментов в крови и моче могут быть использованы различные методы. Какой из данных методов неприемлем в условиях клиники?
основанный на количественном определении продуктов реакции при действии фермента.
+ основанный на количественном определении фермента как белка.
по уменьшению концентрации субстрата.
Зависимость активности фермента от pН имеет вид, предположите вероятное местонахождение фермента в клетке:
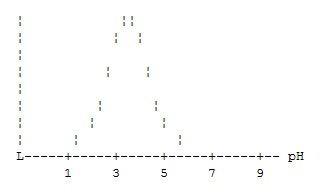
1 — цитоплазма
+ лизосомы
3 — микросомы
Зависимость активности фермента от pН имеет вид, предположите вероятные места нахождения фермента в клетке:
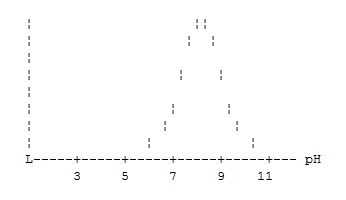
+ цитоплазма
лизосомы
+ митохондрии
Зависимость активности фермента от температуры имеет вид, укажите, к какому классу вероятнее всего принадлежит данный фермент?
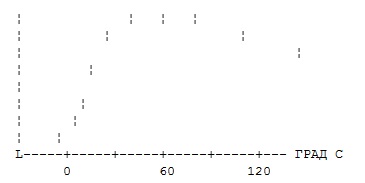
1 — липопротеид
2 — нуклеопротеид
+ гликопротеид
4 — фосфопротеид
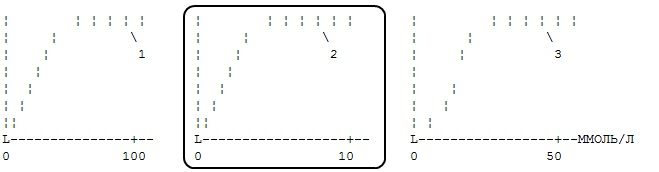
Зависимость активности трех ферментов от концентрации субстрата имеет вид. Определите, какой из ферментов имеет большее сродство к субстрату?
Зависимость растворимости трех ферментов от концентрации соли имеет вид. Предположите, какой из ферментов более гидрофобен (исходите из механизма высаливания)?
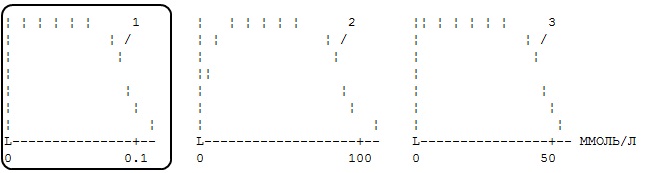
Зависимость растворимости трех ферментов от концентрации соли имеет вид. Предположите, какой из ферментов менее гидрофобен (исходите из механизма высаливания)?

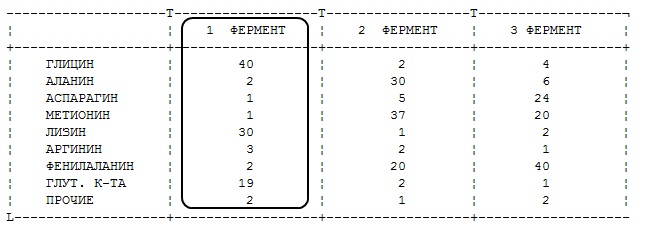
Гистограмма процентного содержания аминокислотных остатков у фермента. Сделайте вывод, какими свойствами обладает фермент?

+ кислыми
основными
нейтральными
Гистограмма процентного содержания аминокислотных остатков у фермента. Сделайте вывод, какими свойствами обладает фермент?

кислыми
+ основными
нейтральными
Характеристики трех исследованных ферментов следующие. Определите, какой из ферментов создает большее осмотическое давление?
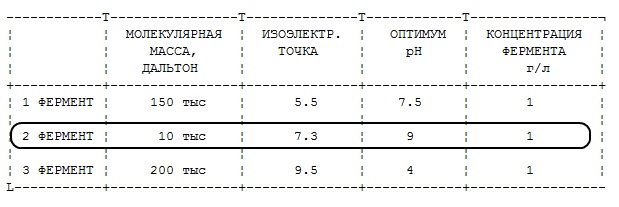
Характеристики трех исследованных ферментов следующие. Определите, какой из ферментов вероятнее всего находится в лизосомах?
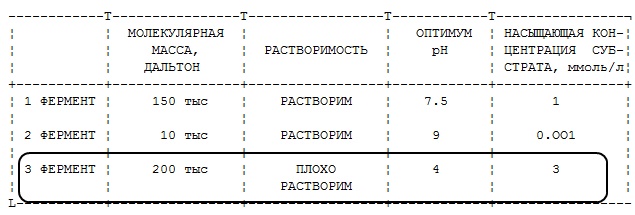
Процентное содержание аминокислотных остатков у трех ферментов следующее. Предположите, какой фермент менее растворим?
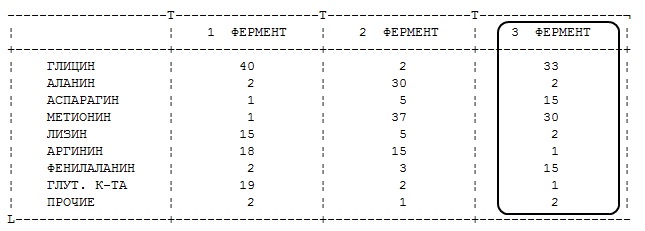
Процентное содержание аминокислотных остатков у трех ферментов следующее. Предположите, какой фермент более растворим?
Фермент какого класса ускоряет данную реакцию?

оксидоредуктазы
трансферазы
гидролазы
лиазы
изомеразы
+ лигазы
Фермент какого класса ускоряет данную реакцию?
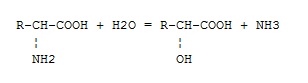
оксидоредуктазы
трансферазы
+ гидролазы
лиазы
изомеразы
лигазы
Фермент какого класса ускоряет данную реакцию?
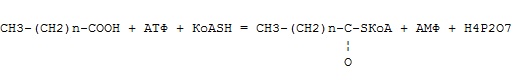
оксидоредуктазы
трансферазы
гидролазы
лиазы
изомеразы
+ лигазы
Фермент какого класса ускоряет данную реакцию?
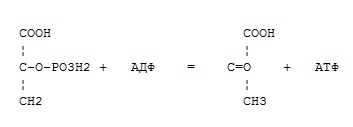
оксидоредуктазы
+ трансферазы
гидролазы
лиазы
изомеразы
лигазы
Фермент какого класса ускоряет данную реакцию?
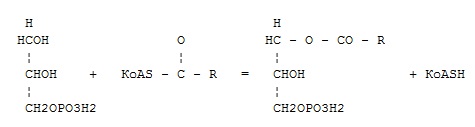
оксидоредуктазы
+ трансферазы
гидролазы
лиазы
изомеразы
лигазы
Фермент какого класса ускоряет данную реакцию?

оксидоредуктазы
+ трансферазы
гидролазы
лиазы
изомеразы
лигазы
Фермент какого класса ускоряет данную реакцию?

оксидоредуктазы
трансферазы
гидролазы
лиазы
+ изомеразы
лигазы
Фермент какого класса ускоряет данную реакцию?

оксидоредуктазы
+ трансферазы
гидролазы
лиазы
изомеразы
лигазы
Фермент какого класса ускоряет данную реакцию?
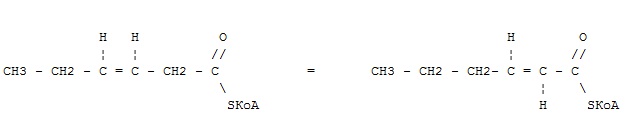
оксидоредуктазы
трансферазы
гидролазы
лиазы
+ изомеразы
лигазы
Фермент какого класса ускоряет данную реакцию?
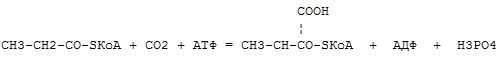
оксидоредуктазы
трансферазы
гидролазы
лиазы
изомеразы
+ лигазы
Фермент какого класса ускоряет данную реакцию?
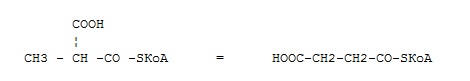
оксидоредуктазы
трансферазы
гидролазы
лиазы
+ изомеразы
лигазы
Фермент какого класса ускоряет данную реакцию?
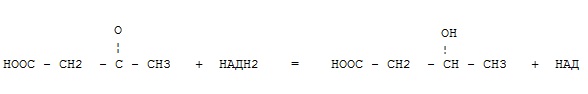
+ оксидоредуктазы
трансферазы
гидролазы
лиазы
изомеразы
лигазы
Фермент какого класса ускоряет данную реакцию?
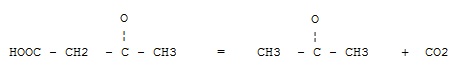
оксидоредуктазы
трансферазы
гидролазы
+ лиазы
изомеразы
лигазы
Фермент какого класса ускоряет данную реакцию?
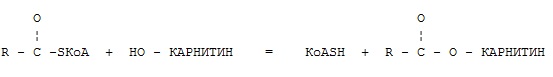
оксидоредуктазы
+ трансферазы
гидролазы
лиазы
изомеразы
лигазы
Фермент какого класса ускоряет данную реакцию?
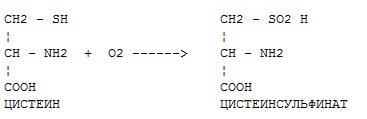
+ оксидоредуктазы
трансферазы
гидролазы
лиазы
изомеразы
лигазы
Фермент какого класса ускоряет данную реакцию?
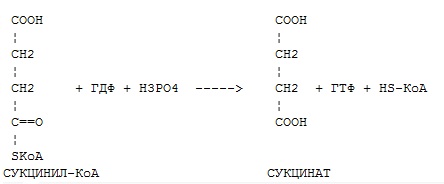
оксидоредуктазы
трансферазы
гидролазы
лиазы
изомеразы
+ лигазы
Фермент какого класса ускоряет данную реакцию?
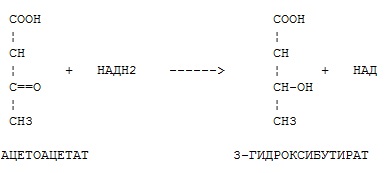
+ оксидоредуктазы
трансферазы
гидролазы
лиазы
изомеразы
лигазы
Фермент какого класса ускоряет данную реакцию?
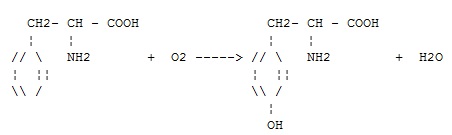
+ оксидоредуктазы
трансферазы
гидролазы
лиазы
изомеразы
лигазы
Фермент какого класса ускоряет данную реакцию?
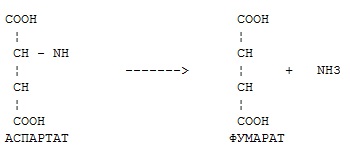
оксидоредуктазы
трансферазы
гидролазы
+ лиазы
изомеразы
лигазы
Фермент какого класса ускоряет данную реакцию?
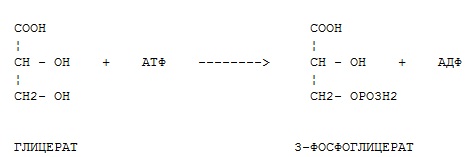
оксидоредуктазы
+ трансферазы
гидролазы
лиазы
изомеразы
лигазы
