Определение эффективности антимикробных консервантов (ОФС.1.2.4.0011.15)
Государственная фармакопея 13 издание (ГФ XIII)
Настоящая общая фармакопейная статья распространяется на метод определения эффективности антимикробных консервантов, входящих в состав лекарственных препаратов (ЛП).
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
ОФС.1.2.4.0011.15 Определение эффективности антимикробных консервантов
ГФ XII, ч.1, ОФС 42-0069-07
Настоящая общая фармакопейная статья распространяется на метод определения эффективности антимикробных консервантов, входящих в состав лекарственных препаратов (ЛП).
Антимикробные консерванты – это вещества органической или неорганической природы, обладающие антимикробным действием, которые добавляют в ЛП для предотвращения роста и развития микроорганизмов, которые могут попасть в них в процессе производства или при многократном применении. Эффективная концентрация консерванта в готовом ЛП должна быть ниже дозы, токсичной для человека.
Эффективность антимикробных консервантов – это способность вещества ингибировать рост микроорганизмов в ЛП на протяжении срока годности. Испытание эффективности консервантов – это процедура, состоящая из искусственной контаминации образца ЛП суспензиями определенных тест-микроорганизмов, инкубации контаминированных образцов при определенной температуре, отбора проб через указанные интервалы времени и подсчете жизнеспособных клеток микроорганизмов в 1г (мл) ЛП на протяжении периода испытания, расчетов и оценке полученных результатов.
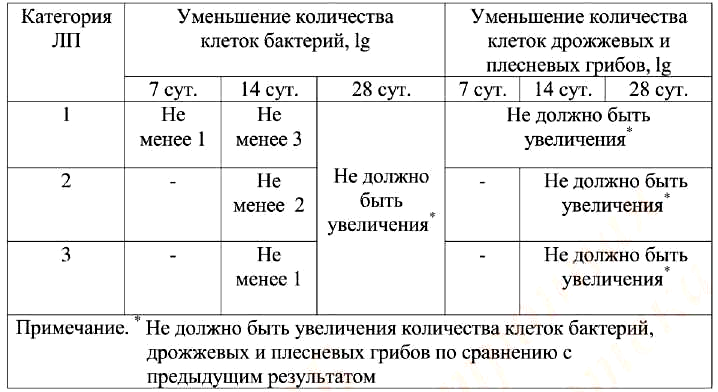
ЛП, в состав которых входят консерванты, разделены на три категории, представленные в табл. 1.
Таблица 1. Категории ЛП, содержащие консерванты

Недопустимо вносить консерванты в ЛП для внутриполостных, внутрисердечных, внутриглазных инъекций, имеющих доступ к спинномозговой жидкости, а также при разовой дозе, превышающей 15 мл.
1. Используемые тест-штаммы микроорганизмов и работа с ними
Эффективность консервантов определяют в отношении определенных видов бактерий и дрожжевых и плесневых грибов:
- Escherichia coli ГКМП 240533, АТСС 25922, АТСС 8739,
- Pseudomonas aeruginosa ГКМП 190155, АТСС 9027,
- Staphylococcus aureus ГКМП 201108, АТСС 6538,
- Candida albicans ГКМП 303903, ГКМП 303901, АТСС 10231, NCTC 885-653,
- Aspergillus brasiliensis BKM F-3882, АТСС 16404, BKM F-1119, АТСС 9642.
Примечания.
- Кроме перечисленных тест-штаммов можно использовать и другие микроорганизмы, которые должны быть типичными по культурально-морфологическим, тинкториальным и биохимическим свойствам.
- Набор тест-штаммов микроорганизмов может быть уменьшен или увеличен в зависимости от способа применения или состава испытуемого ЛП.
Все тест-штаммы микроорганизмов, полученные из Государственных коллекций с сертификатом производителя в ампулах, на дисках или в другом виде следует восстанавливать способами, описанными в прилагаемых к тест-штаммам инструкциях или в соответствии с ОФС «Микробиологическая чистота». Культуры бактерий и грибов пересевают, делая не более 5 пассажей. Условия культивирования тест-штаммов для приготовления инокулята представлены в табл. 2. Используемые питательные среды представлены в ОФС «Микробиологическая чистота».
Таблица 2. Условия культивирования тест-микроорганизмов для приготовления инокулята
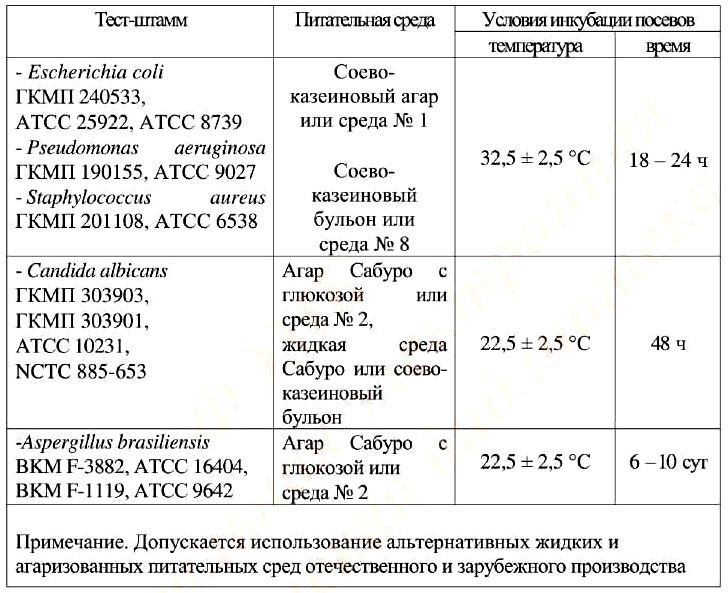
Примечание. Допускается использование альтернативных жидких и
агаризованных питательных сред отечественного и зарубежного производства
Контроль ростовых свойств используемых питательных сред проводят в соответствии с ОФС «Микробиологическая чистота».
При приготовлении инокулята суточные культуры тест-штаммов бактерий и C.albicans смывают с поверхности скошенного агара стерильным 0,9 % раствором натрия хлорида. Концентрацию клеток бактерий доводят до 109 КОЕ/мл, а C.albicans – до 107 КОЕ/мл, используя стандартный образец мутности или инструментальные методы, в том числе турбидиметрический.
В случае использования жидких питательных сред для культивирования тест-штаммов, клетки бактерий и C.albicans выделяют центрифугированием, промывают и ресуспендируют стерильным 0,9 % раствором натрия хлорида до концентрации 1·107 – 1·108 КОЕ/мл.
Для смыва конидий A.brasiliensis используют стерильный 0,9 % раствор натрия хлорида, содержащий 0,05 % раствор твина-80. Количество конидий A. brasiliensis в 1 мл смыва определяют с помощью камеры Горяева или чашечным агаровым методом. Полученную взвесь разводят до концентрации 107 конидий в 1мл.
Стандартизованные суспензии всех тест-штаммов микроорганизмов разводят до концентрации 107 – 108 КОЕ/мл.
2. Методика испытания
Для определения эффективности консервантов используют готовые ЛП в неповрежденной упаковке.
В каждый стерильный флакон с исследуемым препаратом вносят суспензию, содержащую один из тест-штаммов микроорганизмов, обеспечивая концентрацию клеток 105 – 106 КОЕ в 1 мл или 1 г ЛП, и перемешивают. Объем инокулята должен составлять 0,5 – 1 % от объема образца.
Образцы ЛП на твердой мазевой основе нагревают до температуры (42,5 ± 2,5) ⁰ С. Смешивают инокулят каждой стандартизованной микробной суспензии с образцом ЛП в течение не менее 1 мин до достижения гомогенной эмульсии. Для улучшения смешивания можно добавить определенное (валидированное) количество стерильного поверхностно-активного вещества, например, твина-80, если оно не влияет на жизнеспособность микроорганизмов или на эффективность консерванта.
Фактическую исходную концентрацию бактерий и грибов в контаминированных образцах определяют сразу после контаминации. Для этого чашечным агаровым методом делают посев на соответствующие питательные среды (табл. 2), используя подходящие разведения для получения на чашке от 30 до 300 колоний бактерий и от 10 до 100 колоний грибов. Для этой цели также можно применять метод мембранной фильтрации (при условии растворимости ЛП в водных растворителях или изопропилмиристате).
Контаминированные образцы ЛП выдерживают при температуре (22,5 ± 2,5) °С в защищенном от света месте в течение определенного времени. Через 7, 14, 28 сут после инокуляции образцов препаратов 1 категории и через 14, 28 сут препаратов 2 и 3 категорий определяют количество жизнеспособных микроорганизмов в 1 мл образца, делая высев на чашки Петри глубинным или модифицированным глубинным методами в соответствии с ОФС «Микробиологическая чистота».
Антимикробное действие ЛП устраняют одним из способов: разведением, мембранной фильтрацией или с помощью инактиватора, который вносят в чашки с питательной средой или в соответствующее разведение лекарственного средства перед посевом. Используемые инактиваторы, некоторые из которых указаны в ОФС «Микробиологическая чистота», не должны влиять на жизнеспособность микроорганизмов.
3. Результаты испытаний и их интерпретация
Чашечным агаровым методом определяют количество КОЕ/мл для каждого тест-штамма через указанные выше сроки инкубации контаминированного образца ЛП. Изменение количества микробных клеток по сравнению с исходной концентрацией в 1 мл выражают в десятичных логарифмах (lg). При оценке эффективности антимикробного действия консервантов увеличение КОЕ/мл не фиксируется, если последующее измерение превышает предыдущее менее, чем 0,5 lg КОЕ.
4. Требования к качеству
Консерванты считают эффективными, если наблюдают уменьшение количества клеток бактерий в соответствии с критериями, описанными в табл. 3. Количество клеток дрожжевых и плесневых грибов не должно увеличиваться на протяжении всего срока исследования.
Таблица 3. Критерии оценки эффективности антимикробных консервантов ЛП