Определение активности ферментных препаратов (ОФС.1.2.4.0013.15)
Государственная фармакопея 13 издание (ГФ XIII)
Настоящая общая фармакопейная статья распространяется на методы определения активности ферментов, которые основаны на определении скорости превращения субстратов для действия энзимов в соответствующие продукты ферментативной реакции, которые они катализируют.
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
ОФС.1.2.4.0013.15 Определение активности ферментных препаратов
Взамен ГФ XI, вып.2, стр. 25
Настоящая общая фармакопейная статья распространяется на методы определения активности ферментов, которые основаны на определении скорости превращения субстратов для действия энзимов в соответствующие продукты ферментативной реакции, которые они катализируют.
Классификация ферментов
Фермент (E) – белок, обладающий каталитическими свойствами в реакции преобразования субстрата (S) в продукт (P).
Согласно международной номенклатуре (табл.), все ферменты подразделяются на 6 классов в зависимости от типа катализируемых ими реакций.
Таблица. Классификация ферментов

Особенности измерения активности ферментов, описываемые в фармакопейных статьях, определяется их принадлежностью к тому или иному классу.
Принцип, положенный в основу всех методов определения активности фермента (Е), заключается в регистрации скорости убыли субстрата (S) (то есть вещества, на которое действует фермент) или скорости образования продукта реакции (P).
Простейшей схемой для описания кинетики ферментативных реакций является так называемая двухстадийная схема:

Е – фермент;
S – субстрат;
P – продукты реакции;
kкат – каталитическая константа.
Начальная скорость (υo) катализируемой ферментом реакции, при которой расходом субстрата можно пренебречь, описывается уравнением Михаэлиса–Ментен (2):

Для аллостерических ферментов начальная скорость ферментативной реакции не подчиняется уравнению Михаэлиса–Ментен.
Для определения скорости ферментативной реакции через определенные промежутки времени отбирают пробы из реакционной смеси и проводят количественное определение методами, основанными чаще всего на спектральных свойствах субстрата или продукта реакции.
Требования к условиям проведения ферментативной реакции
Ферментативная реакция должна проводиться в строго определенных условиях с учетом следующих факторов.
1.Начальная скорость реакции (хo).
Скорость ферментативной реакции количественно можно измерить по убыли субстрата или по образованию продукта реакции.
Типичные кинетические кривые ферментативной реакции приведены на рис. 1. Для каждой ферментативной реакции могут быть подобраны условия, при которых начальный участок кривой линеен, т. е. зависимость концентрации образовавшегося продукта или израсходованного субстрата от времени наблюдения имеет прямо пропорциональный характер.
Рисунок 1. Типичные кинетические кривые ферментативной реакции:
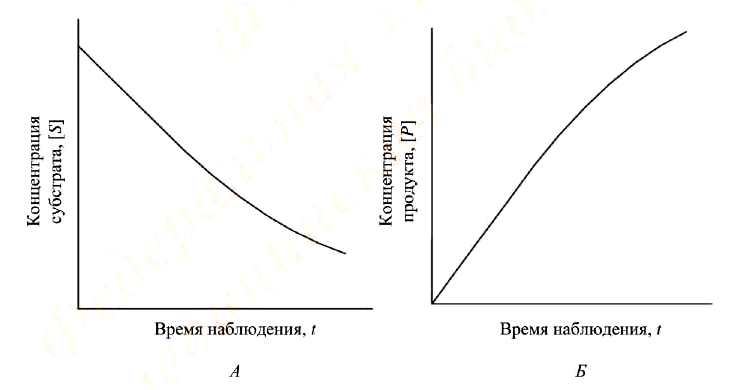
А – регистрация по скорости исчезновения субстрата реакции;
Б – регистрация по скорости образования продукта реакции
Начальная скорость реакции (υo) определяется как тангенс угла наклона линейного участка кривой.
Поскольку длительность прямолинейного участка кинетической кривой от опыта к опыту несколько изменяется, время инкубации (при использовании метода отбора проб) должно составлять не более 70 % и не менее 20% времени соответствующего прямолинейного участка.
2.Концентрация субстрата ([S]0).
В большинстве случаев зависимость начальной скорости ферментативной реакции (хo) от начальной концентрации субстрата ([S]0), согласно уравнению Михаэлиса–Ментен (2) описывается гиперболической функцией (рис. 2).
Начальная скорость реакции (υo) зависит от начальной концентрации субстрата ([S]0) вплоть до его насыщающей концентрации. Под насыщающей концентрацией ([S]нас) понимают такую концентрацию субстрата, при которой начальная скорость реакции практически перестает повышаться при дальнейшем увеличении концентрации субстрата, стремясь к своему предельному значению, называемому максимальной скоростью реакции Vмакс (рис. 2). Отрезок на оси абсцисс, соответствующий скорости, равной половине максимальной, будет представлять собой Км. При проведении ферментативной реакции реакционная смесь должна содержать такое количество субстрата, которое обеспечит насыщение фермента в течение всего хода определения (количество субстрата, взятого для проведения ферментативной реакции, должно быть примерно на 30% выше насыщающей концентрации).

Если форма кривой зависимости начальной скорости реакции (υo) от начальной концентрации субстрата ([S]0) отличается от гиперболической, определение параметров по уравнению Михаэлиса–Ментен невозможно. Такие отклонения наблюдаются в случае ингибирования или активации фермента субстратом, а также при работе с аллостерическими ферментами. В этом случае оптимальной является та концентрация субстрата, при которой начальная скорость реакции максимальна ([S]опт)– точка перегиба на экспериментальной кривой зависимости начальной скорости реакции от начальной концентрации субстрата (рис. 2).
После выбора насыщающей концентрации субстрата необходимо проверить, сохраняется ли при ней линейная зависимость [P] от t.
В качестве субстратов используются как природные вещества, такие как альбумин, казеин, крахмал, так и синтетические. Природные субстраты ферментов используют большей частью для подтверждения подлинности. Синтетические субстраты обеспечивают более высокую точность и лучшую воспроизводимость при количественном определении ферментативной активности.
3.Концентрация фермента ([Е]0).
В соответствии с уравнением Михаэлиса–Ментен начальная скорость ферментативной реакции (хo) в подавляющем большинстве случаев линейно зависит от концентрации фермента ([E]0). Выбор оптимальной для каждого метода концентрации фермента осуществляется экспериментально при помощи построения кривой зависимости начальной скорости реакции от концентрации фермента (рис. 3).
После выбора начальной концентрации фермента необходимо проверить, сохраняется ли при ней линейная зависимость [P] от t при выбранном значении насыщающей концентрации субстрата.

4. Температура.
Особенностью ферментативных реакций является наличие колоколообразной зависимости скорости реакции от температуры в достаточно широком интервале температур, которая характеризуется «температурным оптимумом» реакции. Эта особенность объясняется наложением 2 эффектов: возрастанием скорости реакции при увеличении температуры и ускорением тепловой денатурации белковой молекулы, приводящей к инактивации фермента при достаточно высоких температурах. Обычно ферментативную реакцию рекомендуется проводить в термостате при температуре (37 ± 0,1) ºС, если нет иных указаний в фармакопейной статье. Предварительно каждый из реагентов нагревают до температуры 37º С.
5. Значение рН.
Типичная кривая, описывающая для большинства ферментов рН-зависимость начальной скорости ферментативной реакции при наличии 2 ионогенных групп в активном центре фермента, приведена на рис. 4.
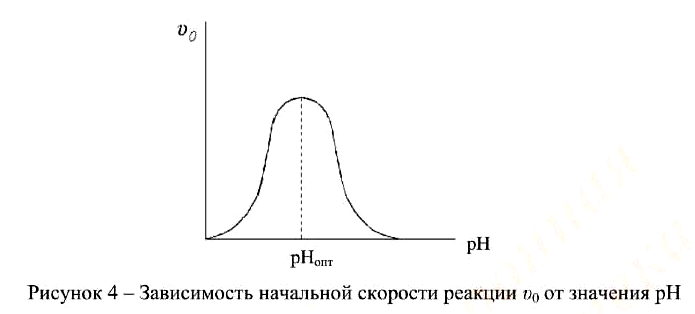
Определение активности следует проводить при оптимальном значении рН, определенном при выбранных значениях концентрации фермента и насыщающей концентрации субстрата; использовании буферного раствора того состава, который не ингибирует фермент и температуре (37 ± 0,1) ºС, если нет других указаний в фармакопейной статье.
После выбора оптимального значения рН необходимо проверить, сохраняется ли при этом рН линейная зависимость [P] от t при выбранных значениях концентрации фермента и насыщающей концентрации субстрата.Рисунок 4 – Зависимость начальной скорости реакции υ0 от значения рН
6.Кофакторы.
Существуют ферменты, для проявления каталитических свойств которых необходимо присутствие кофакторов – веществ, с помощью которых происходит активация ферментов. Кофакторами могут выступать один или несколько неорганических ионов, таких как Fe2+, Mn2+, Mg2+, Zn2+ или комплексная органическая или металлорганическая молекула, называемая коферментом.
Для определения оптимальной концентрации кофактора следует построить кривую зависимости начальной скорости реакции от начальной концентрации кофактора, аналогичную зависимости начальной скорости реакции от начальной концентрации субстрата, и по этой кривой выбрать насыщающую концентрацию кофактора.
После выбора насыщающей концентрации кофактора необходимо проверить, сохраняется ли при ней линейная зависимость [P] от t.
Конкретные параметры ферментативной реакции указываются в фармакопейных статьях.
Способы детекции
Для количественной регистрации скорости ферментативной реакции используют спектрофотометрические, флюресцентные, хеми- и биолюминесцентные методы детекции, основанные на спектральных свойствах субстрата или продукта реакции, а также детекцию с помощью микрокалориметрических датчиков и биодатчиков (биосенсоров) на основе хеми- и биолюминесценции; электрохимические методы, такие как потенциометрия, амперометрия и др. Для одних видов анализа детекция может проводиться непрерывно в ходе реакции, для других – после ее остановки.
Способ остановки ферментативной реакции должен быть указан в фармакопейной статье.
Единицы измерения ферментативной активности
Активность фермента измеряется количеством субстрата, преобразованного в продукт в единицу времени, и выражается в Международных единицах (МЕ) или единицах действия (ЕД).
МЕ – это такое количество фермента, которое при заданных условиях катализирует превращение одного микромоля субстрата за 1 мин (или одного микроэквивалента затронутых реакцией групп в тех случаях, когда атакуется более одной группы в каждой молекуле субстрата).
ЕД – это условная единица активности фермента, величина которой указывается в фармакопейной статье.
Нормируются:
- удельная активность препарата, которая выражается в единицах энзимной активности фермента (МЕ или ЕД) на 1 мг препарата или на 1 мг ферментного белка (в последнем случае удельная активность характеризует чистоту препарата). Определение содержания белка в препарате проводят одним из методов, приведенных в ОФС «Определение белка».
- доза, которая выражается в единицах ферментативной активности (МЕ или ЕД) на единицу лекарственной формы.
Перевод единиц активности ЕД в МЕ и обратно осуществляется опытным путем на основании статистически достаточного материала, обработанного в соответствии с ОФС «Статистическая обработка результатов определения специфической фармакологической активности лекарственных средств биологическими методами».
Определение активности ферментных препаратов в сравнении со стандартным образцом (СО)
С целью снижения погрешности методов определения ферментативной активности необходимо проводить определение ферментативной активности препарата в сравнении со стандартным образцом (СО) данного фермента.
Определение ферментативной активности испытуемого препарата и СО проводят в одинаковых условиях опыта.
Активность препарата (А) в соответствующих единицах (МЕ или ЕД) вычисляют по формуле:
А0 – ферментативная активность СО в единицах (МЕ или ЕД) на 1мг белка или препарата;
П – величина измеряемого параметра для СО;
П0 – величина измеряемого параметра для испытуемого препарата;
К – коэффициент, выравнивающий концентрации растворов испытуемого препарата и СО.

Определение активности иммобилизованных ферментов
Иммобилизованными называются ферменты, молекулы которых физически или химически связаны с каким-либо носителем. В качестве носителей могут быть использованы природные и синтетические полимеры, органические низкомолекулярные носители, неорганические материалы. В зависимости от природы носителя иммобилизованные ферменты могут существовать в форме гелей, пленок, гранул, макропористых порошков и в других формах.
Активность иммобилизованных ферментов может нормироваться на массу носителя или его площадь.
Кинетические характеристики иммобилизованных ферментов, численно определяемые константой Михаэлиса Км и каталитической константой kкат, могут существенно изменяться в зависимости от природы носителя и способа иммобилизации. Поэтому для корректного определения активности иммобилизованных ферментов необходим повторный подбор условий.
