Микробиологическая чистота (ОФС.1.2.4.0002.15)
Государственная фармакопея 13 издание (ГФ XIII)
- Рекомендуемые требования к качеству лекарственных средств
- Работа с тест-штаммами микроорганизмов
- Определение антимикробного действия
- Отбор образцов
- Методы количественного определения аэробных микроорганизмов
- Определение отдельных видов микроорганизмов
- Повторные испытания
- Биохимические тесты для индентификации микроорганизмов
- Питательные среды и растворы
- Оценка качества питательных сред
- Особенности проведения испытаний иммунобиологических лекарственных средств (ИЛС), содержащих живые микроорганизмы
- Определение микробиологической чистоты воды
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
ОФС.1.2.4.0002.15 Микробиологическая чистота
Взамен ГФ ХI, вып. 2. Изменения № 2, 3, ОФС 42 -0016-04, ГФ XII, ч. 1, ОФС 42-0067-07
Настоящая общая фармакопейная статья распространяется на методы определения микробиологической чистоты в нестерильных лекарственных средствах (НЛС), в том числе в лекарственных средствах (ЛС), содержащих живые микроорганизмы, а также вспомогательные вещества и полупродукты. Кроме того, указанные методы используются при определении эффективности антимикробных консервантов и мониторинге производственных помещений фармацевтических предприятий и отдельных лабораторий.
НЛС (субстанции, различные формы препаратов – таблетки, капсулы, гранулы, растворы, суспензии, сиропы, мази, суппозитории и др., а также вспомогательные вещества) могут быть контаминированы микроорганизмами. В НЛС допускается лимитированное количество микроорганизмов при отсутствии определенных видов, представляющих опасность для здоровья человека.
1. Рекомендуемые требования к качеству лекарственных средств
В табл. 1 и 2 приведены требования к качеству лекарственных средств (препаратов и субстанций), а также вспомогательных веществ, используемых в производстве лекарственных препаратов.
Таблица 1. Микробиологическая чистота лекарственных препаратов
| Категория | Препараты | Рекомендуемые требования |
| 1 | Препараты, в том числе биологические лекарственные средства, включая ИЛП, к которым предъявляется требование «Стерильность» | Препараты должны быть cтерильными |
| 2 | · Для применения местно, наружно, интравагинально
· Для введения в полости уха, носа · Респираторно · Трансдермальные пластыри За исключением тех лекарственных препаратов или ИЛП, которые должны быть стерильными |
· Общее число аэробных бактерий и дрожжевых и плесневых грибов (суммарно) – не более 102 КОЕ в 1 г (мл) препарата или на 1 пластыре (включая клейкую сторону и основу)
· Отсутствие Pseudomonas aeruginosa в 1 г (мл) препарата или на 1 пластыре (включая клейкую сторону и основу) · Отсутствие Staphylococcus aureus в 1 г (мл) препарата или на 1 пластыре (включая клейкую сторону и основу) · Отсутствие энтеробактерий, устойчивых к желчи, в 1 г (мл) препаратов, используемых респираторно · Отсутствие Candida albicans в 1 г (мл) интравагинальных препаратов |
| 3 | А. Для приема внутрь или введения ректально
За исключением тех лекарственных препаратов и ИЛП, которые должны быть стерильными |
· Общее число аэробных микроорганизмов – не более 103 КОЕ в 1 г (мл)
· Общее число дрожжевых и плесневых грибов – не более 102 КОЕ в 1 г (мл) · Отсутствие Escherichia coli в 1 г (мл) |
| Б. Для приема внутрь – из сырья природного происхождения (животного, растительного или минерального), уровень микробной загрязненности которого невозможно снизить в процессе предварительной обработки. Исключением являются лекарственные растительные средства и ИЛП, содержащие живые микроорганизмы, относящиеся к категориям 4 и 5 | · Общее число аэробных микроорганизмов – не более 104 КОЕ в 1 г (мл)
· Общее число дрожжевых и плесневых грибов – не более 102 КОЕ в 1 г (мл) · Энтеробактерий, устойчивых к желчи, – не более 102 КОЕ в 1 г (мл) · Отсутствие Escherichia coli в 1 г (мл) · Отсутствие Salmonella spp.в 10 г (мл) · Отсутствие Staphylococcus aureus в 1 г (мл) |
|
| 4 | Лекарственные растительные препараты и лекарственное растительное сырье
А. Применяемые в виде настоев и отваров, приготовленных с использованием кипящей воды |
· Общее число аэробных микроорганизмов – не более 107 КОЕ в 1 г
· Обще число дрожжевых и плесневых грибов – не более 105 КОЕ в 1 г · Escherichia coli – не более 102 КОЕ в 1 г |
| Б. Приготовленные без использования кипящей воды | · Общее число аэробных микроорганизмов – не более 105 КОЕ в 1 г
· Общее число дрожжевых и плесневых грибов – не более 104 КОЕ в 1 г · Энтеробактерий, устойчивых к желчи – не более 103 КОЕ в 1 г · Отсутствие Escherichia coli – в 1 г · Отсутствие бактерий рода Salmonella в 25 г |
|
| 5 | ИЛП, содержащие живые микроорганизмы | |
| 5.1. Вакцины | ||
| А. Для инъекций | Не допускается присутствие микроорганизмов-контаминантов (определение проводят в соответствии с ОФС «Стерильность») | |
| Б. Для внутрикожного введения и накожного скарификационного (нанесения) | · Общее число аэробных микроорганизмов, дрожжевых и плесневых грибов – не более 50 КОЕ в 1 мл
· Отсутствие энтеробактерий в 1 мл · Отсутствие Pseudomonas aeruginosa в 1 мл · Отсутствие Staphylococcus aureus в 1 мл (определение проводят в соответствии с ФС или нормативной документацией) |
|
| В. Для приема внутрь (таблетки) | · Общее число аэробных микроорганизмов – не более 103 КОЕ в единице препарата (г)
· Общее число дрожжевых и плесневых грибов менее 10 КОЕ в единице препарата (г) · Отсутствие бактерий семейства Enterobacteriaceae в единице препарата (г) · Отсутствие Pseudomonas aeruginosa в единице препарата (г) · Отсутствие Staphylococcus aureus в единице препарата (г) (определение проводят в соответствии с ФС или нормативной документацией) |
|
| 5.2. Бактериофаги | ||
| А. Растворы для приема внутрь и ректально | Не допускается присутствие микроорганизмов-контаминантов (определение проводят в соответствии с ОФС «Стерильность») | |
| Б. Для приема внутрь (таблетки), местно и наружно (мазь) | · Общее число аэробных бактерий — не более 102 КОЕ в 1 г
· Менее 10 дрожжевых и плесневых грибов в 1 г · Отсутствие бактерий семейства Enterobacteriaceae в 1 г · Отсутствие Pseudomonas aeruginosa в 1 г · Отсутствие Staphylococcus aureus в 1 г (определение проводят в соответствии с разделами 4, 5, 6 настоящей ОФС) |
|
| 5.3. Пробиотики | ||
| А. Для приема внутрь, интравагинально (лиофилизаты, суспензии, порошки) | · Отсутствие бактерий-контаминантов в единице препарата/г(мл)
· Отсутствие дрожжевых и плесневых грибов в единице препарата/г(мл) · Для колисодержащих препаратов – отсутствие в единице препарата/г(мл) БОЕ бактериофага |
|
| Б. Для приема внутрь, интравагинально, ректально (таблетки, капсулы, суппозитории) | · Общее число аэробных бактерий – не более 102 КОЕ в единице препарата (г)
· Общее число дрожжевых и плесневых грибов – менее 10 КОЕ в единице препарата (г) · Отсутствие энтеробактерий в единице препарата (г) · Отсутствие Pseudomonas aeruginosa в единице препарата (г) · Отсутствие Staphylococcus aureus в единице препарата (г) · Для колисодержащих препаратов – отсутствие в единице препарата (г) БОЕ бактериофага (для препаратов с содержанием E.coli не менее 1010 КОЕ допускается не более 10 БОЕ бактериофага) |
|
| 6 | ИЛП, содержащие инактивированные микроорганизмы, антигены и антитела, белки, пептиды, гликопротеины и др., в которых допускаются микроорганизмы-контаминанты | |
| 1. Для приема внутрь, интраназально | · Общее число аэробных микроорганизмов — не более 50 КОЕ в 1 г (мл)
· Отсутствие энтеробактерий в 1 г (мл) · Отсутствие E.coli в 1 г (мл) · Отсутствие бактерий рода Salmonella в 1 г (мл) · Отсутствие Pseudomonas aeruginosa в 1 г (мл) · Отсутствие Staphylococcus aureus в 1 г (мл) · Менее 10 дрожжевых и плесневых грибов в 1 г (мл) (определение проводят в соответствии с ФС или нормативной документацией) |
|
| 2. Для введения ректально | · Общее число аэробных микроорганизмов – не более 102 КОЕ в 1 г
· Отсутствие бактерий семейства Enterobacteriaceae в 1 г · Отсутствие Pseudomonas aeruginosa в 1 г · Отсутствие Staphylococcus aureus в 1 г ·Менее 10 дрожжевых и плесневых грибов в 1 г (определение проводят в соответствии с ФС или нормативной документацией) |
|
Таблица 2. Микробиологическая чистота субстанций и вспомогательных веществ для производства лекарственных препаратов
Категория |
Субстанции, вспомогательные материалы | Рекомендуемые нормы |
| 1.2 | Субстанции для производства | |
| А. Стерильных лекарственных препаратов, которые не подвергаются стерилизации | Субстанции должны быть стерильными | |
| Б. Стерильных лекарственных препаратов, которые подвергаются стерилизации;
Нестерильных лекарственных препаратов, относящихся к категории 2 |
· Общее число аэробных бактерий, дрожжевых и плесневых грибов (суммарно) не более 102 КОЕ в 1 г (мл)
· Отсутствие энтеробактерий, устойчивых к желчи, в 1 г (мл) · Отсутствие Pseudomonas aeruginosa в 1 г (мл) · Отсутствие Staphylococcus aureus в 1 г (мл) |
|
| 2.2 | Субстанции синтетического происхождения для производства нестерильных лекарственных препаратов | · Общее число аэробных микроорганизмов – не более 103 КОЕ в 1г (мл)
· Общее число дрожжевых и плесневых грибов – не более 102 КОЕ в 1 г (мл) · Отсутствие Escherichia coli в 1 г (мл) |
| 3.2 | Субстанции природного происхождения (растительного, животного или минерального) для производства нестерильных лекарственных препаратов | · Общее число аэробных микроорганизмов – не более 104 КОЕ в 1 г (мл)
· Общее число дрожжевых и плесневых грибов – не более 102 КОЕ в 1 г (мл) · Отсутствие Escherichia coli в 1 г (мл) · Отсутствие бактерий рода Salmonella в 25 г (мл) · Отсутствие Pseudomonas aeruginosa в 1 г (мл) · Отсутствие Staphylococcus aureus в 1 г (мл) · Энтеробактерий, устойчивых к желчи, не более 102 КОЕ в 1 г (мл) |
| 4.2 | Вспомогательные вещества (мука пшеничная, крахмал, тальк и т.д.) | · Общее число аэробных микроорганизмов – не более 103 КОЕ в 1 г (мл)
· Общее число дрожжевых и плесневых грибов – не более 102 КОЕ в 1 г (мл) · Отсутствие Escherichia coli – в 1 г (мл) · Отсутствие бактерий рода Salmonella в 25 г (мл) · Отсутствие Pseudomonas aeruginosa в 1 г (мл) · Отсутствие Staphylococcus aureus в 1 г (мл) · Энтеробактерий, устойчивых к желчи, – не более 102 КОЕ в 1 г (мл) |
| 5.2 | Субстанции для производства биологических лекарственных препаратов, включая ИЛП: | |
| А. Для производства стерильных лекарственных препаратов, которые не подвергаются стерилизации | Субстанции должны быть стерильными | |
| Б. Для производства стерильных лекарственных препаратов, которые подвергаются стерилизации | · Общее число аэробных микроорганизмов – не более 102 КОЕ в 1 г (мл)
· Отсутствие энтеробактерий в 1 г (мл) · Отсутствие Pseudomonas aeruginosa в 1 г (мл) · Отсутствие Staphylococcus aureus в 1 г (мл) · Менее 10 дрожжевых и плесневых грибов в 1 г (мл) |
|
| В. Для производства ИЛП, содержащих живые микроорганизмы:
— в которых не допускаются микроорганизмы-контаминанты (живые вакцины (инъекционные препараты), бактериофаги, растворы для приема внутрь и ректально); — в которых лимитируются микроорганизмы-контаминанты (живые вакцины для приема внутрь (таблетки); бактериофаги (таблетки)) |
Не допускается присутствие микроорганизмов-контаминантов (определение проводят в соответствии с ОФС «Стерильность») | |
| Г. Для производства ИЛП-пробиотиков, содержащих живые микроорганизмы, в которых допускаются микроорганизмы-контаминанты (таблетки, капсулы, суппозитории) | · Отсутствие посторонних аэробных бактерий в 200 мг
· Менее 10 дрожжевых и плесневых грибов в 200 мг |
|
| Д. Для производства ИЛП, содержащих инактивированные микроорганизмы, антигены и антитела, белки, пептиды, гликопротеины и др. | Субстанции должны быть стерильными |
Примечания к табл. 1 и 2
- В нормативных документах могут быть указаны в виде исключения и другие нормы в зависимости от состава ЛС и особенностей технологического процесса их производства.
- В нормативных документах на препараты для детей могут быть введены более строгие нормы, а именно:
- в 1 г (мл) препаратов для детей (от 0 до 1 года) – не более 50 аэробных бактерий и дрожжевых и плесневых грибов (суммарно) при отсутствии энтеробактерий, устойчивых к желчи, Pseudomonas aeruginosa, Staphylococcus aureus;
- в 1 г (мл) препаратов для детей (старше 1 года) – не более 500 аэробных микроорганизмов и 50 дрожжевых и плесневых грибов (суммарно) при отсутствии энтеробактерий, устойчивых к желчи, Pseudomonas aeruginosa, Staphylococcus aureus.
- В нормативных документах на ИЛП — пробиотики для детей введены более строгие нормы, а именно:
- для детей (от 3 мес до 1 года) для приема внутрь (таблетки, капсулы и др.), ректально (суппозитории) – не более 10 аэробных бактерий в 1 единице препарата/г; при отсутствии в 1 единице препарата энтеробактерий, Pseudomonas aeruginosa, Staphylococcus aureus и дрожжевых и плесневых грибов;
- для детей (от 1 года) для приема внутрь (таблетки, капсулы), ректально (суппозитории) – не более 50 аэробных бактерий в 1 г препарата; при отсутствии в 1 единице препарата: энтеробактерий, Pseudomonas aeruginosa, Staphylococcus aureus, дрожжевых и плесневых грибов.
- При обнаружении во время проведения испытания других патогенных бактерий, кроме указанных выше, считают, что качество лекарственных средств, субстанций и вспомогательных веществ не соответствует требованиям по показателю «Микробиологическая чистота».
Испытание лекарственных средств на микробиологическую чистоту проводят в асептических условиях с помощью приведенных ниже методов и питательных сред.
Испытание включает способы подготовки различных лекарственных форм, отбор образцов для анализа, методы количественного определения жизнеспособных микроорганизмов, выявление и идентификацию отдельных видов бактерий, наличие которых недопустимо или ограничено в лекарственных средствах, а также питательные среды, растворы и реактивы, необходимые для проведения испытаний.
Для инкубации посевов на питательных средах для бактерий стандартной температурой является (32,5 ± 2,5) оС, для грибов – (22,5 ± 2,5) оС.
2. Работа с тест-штаммами микроорганизмов
Для проведения испытания (определение антимикробного действия ЛС, качества питательных сред, биохимического тестирования выделенных микроорганизмов) необходимо использовать тест-штаммы микроорганизмов, депонированные в официальных отечественных и зарубежных коллекциях, например:
- Государственной коллекции патогенных микроорганизмов (ГКПМ), Россия;
- Российской коллекции патогенных грибов (РКПГ);
- Всероссийской коллекции микроорганизмов (ВКМ) РАН, Россия;
- Американской коллекции типовых культур (АТСС), США;
- Национальной коллекции типовых культур (NCTC), Великобритания;
- Коллекции культур института Пастера (CIP), Франция.
Тест-штаммы микроорганизмов, используемые в испытаниях, приведены в табл. 3.
Таблица 3. Тест-штаммы микроорганизмов, используемых в испытаниях
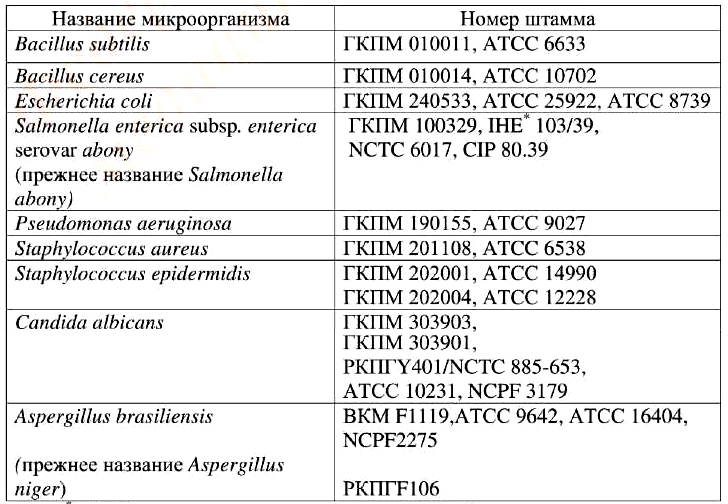
*IHE – Институт гигиены и эпидемиологии, Прага, Чехия
Кроме перечисленных в табл. 3 тест-штаммов микроорганизмов, возможно использование и других культур, типичных по морфологическим, тинкториальным и биохимическим свойствам.
Набор тест-микроорганизмов может быть уменьшен или увеличен в случае необходимости.
Тест-микроорганизмы в лиофилизированном виде в ампулах, в пробирках на полужидком агаре хранят при температуре от 2 до 8 оС. Культуры микроорганизмов на дисках хранят при температуре не выше минус 20 оС.
Допускается не более 5 пассажей от исходной культуры.
2.1. Активация лиофилизированных тест-штаммов микроорганизмов
Тест-штаммы микроорганизмов лиофилизированные, в ампулах, получают из официальных коллекций с сертификатом соответствия (паспортом штамма).
Ампулы вскрывают в асептических условиях в соответствии с инструкцией производителя.
Для восстановления жизнеспособности культуры необходимо не менее 2 пересевов на питательной среде, соответствующей биологическим свойствам штамма, при инкубации в оптимальных для данного штамма температурных условиях. Для получения изолированных колоний тест-штамма проводят пересев на соответствующую плотную питательную среду.
После окончания инкубации культуры изучают морфологию выросших колоний, микроскопируют мазки, окрашенные по Граму, изучают биохимические свойства с использованием тест-систем, разрешенных к использованию. Тест-штамм микроорганизма должен обладать типичными морфологическими, тинкториальными, биохимическими свойствами в соответствии с представленными сертификатами коллекции.
После подтверждения свойств тест-штамма культуру пересевают на соответствующую питательную среду (первый пассаж) и инкубируют в стандартных условиях.
Для получения конидий A. brasiliensis культуру выращивают на агаре Сабуро с глюкозой (или среде № 2) в течение 5 – 7 сут в стандартных условиях.
2.2. Активация тест-штаммов микроорганизмов, хранящихся на дисках
Диск помещают в жидкую питательную среду, соответствующую потребностям данного микроорганизма. После инкубации в соответствующих условиях совершают те же операции и в той же последовательности, как при активации лиофилизированной культуры.
2.3. Хранение тест-штаммов при глубокой заморозке
Хранение тест-штаммов микроорганизмов в условиях глубокой заморозки осуществляется при температуре минус (70 ± 5) °С (криосистема). Криосистема состоит из набора плотно закрытых пробирок, содержащих керамические бусы, погруженных в специфическую криожидкость, и свинцового криоблока с ячейками. Работу с тест-штаммами проводят в полном соответствии с рекомендациями производителя криосистемы.
3. Определение антимикробного действия
Во избежание неправильной оценки полученных результатов перед испытанием на микробиологическую чистоту необходимо определить возможность проявления лекарственным средством антимикробного действия в отношении определенных видов микроорганизмов.
В основе метода определения антимикробного действия лежит сравнение интенсивности роста тест-штаммов микроорганизмов в присутствии и без испытуемого препарата.
3.1. Приготовление инокулята
24-часовые бульонные культуры бактерий, выращенные на соево-казеиновом бульоне или среде № 8, и 24–48-часовую культуру C. albicans, выращенную на жидкой среде Сабуро (соево-казеиновом бульоне или среде № 8), разводят стерильным 0,9 % раствором натрия хлорида 1:1000 (B. cereus, C. albicans) и 1:100000 (E. coli, S. abony, P. aeruginosa, S. aureus) до концентрации около 104 КОЕ/мл.
Взвесь спор B.subtilis также разводят до концентрации 104 КОЕ в 1 мл.
Культуру A. brasiliensis со скошенного агара Сабуро с глюкозой или со среды № 2 смывают 0,9 % раствором натрия хлорида с 0,05 % раствором твина-80. Определяют количество конидий в 1 мл смыва, используя камеру Горяева или чашечный агаровый метод, и разводят до концентрации 104 конидий в 1 мл.
3.2. Подготовка образца для определения антимикробного действия
К образцу ЛС добавляют подходящий разбавитель для получения разведения 1:10. В качестве разбавителя используют, как правило, фосфатный буферный раствор с натрия хлоридом и пептоном (рН 7,0), нейтрализующую жидкость или буферный раствор, содержащий не более 5 % твина-80.
Для разведения препаратов с известным антимикробным действием используют нейтрализующую жидкость. Из разведения 1:10 готовят последовательные разведения 1:50, 1:100, 1:500, 1:1000 и т.д.
3.3. Методы определения антимикробного действия
Испытание на наличие антимикробного действия проводят одним из описанных ниже методов.
3.3.1. Определение антимикробного действия в условиях испытания на микробиологическую чистоту
Каждое разведение испытуемого препарата в количестве 1 мл вносят в 6 чашек Петри диаметром 90 мм, в 2 из которых прибавляют по 0,2 мл взвеси B. cereus (или спор B .subtilis), в 2 другие – по 0,2 мл рабочей взвеси культуры C. albicans, в 2 последние – 0,2 мл взвеси конидий A. brasiliensis. Чашки с бактериями заливают 10 – 15 мл расплавленного и охлажденного до (42,5 ± 2,5) оС соево-казеинового агара или среды № 1, чашки с культурами грибов – тем же количеством агара Сабуро или среды № 2.
По 1,0 мл каждого разведения препарата вносят в пробирки с 10 мл жидких сред – бульона Мосселя и соево-казеинового бульона (или аналогичных – среда № 3 и среда № 8). Затем по 1 мл взвеси тест-штаммов E. coli, S. аbony, P. aeruginosa, S. aureus (каждый штамм отдельно) вносят в пробирку со средой, соответствующей потребностям микроорганизма.
В контрольные чашки и пробирки вместо разведений препарата вносят такое же количество растворителя.
Посевы инкубируют в стандартных условиях в течение 48 ч для бактерий и 5 сут – для грибов.
3.3.2. Метод репликаций
Метод репликаций рекомендуется использовать для определения антимикробного действия водонерастворимых (суспензии, эмульсии и др.) или окрашенных лекарственных средств.
В стерильные чашки Петри вносят по 1 мл каждого разведения исследуемого препарата. В контрольные чашки вносят по 1 мл разбавителя, используемого для получения разведений. В чашки Петри, как в эксперименте, так и в контроле, добавляют по 10 – 15 мл расплавленного и охлажденного до температуры (42,5 ± 2,5) оС соево-казеинового агара или среды № 1, в другие – такое же количество агара Сабуро или среды № 2 и тщательно перемешивают. После застывания агара чашки подсушивают в термостате или ламинарном шкафу для удаления конденсата с поверхности среды, на которую затем бактериологической петлей, пипеткой или репликатором наносят рабочую взвесь каждого тест-штамма бактерий и грибов в виде бляшек. Посевы на средах инкубируют в стандартных условиях в течение 48 ч для бактерий и 5 сут – для грибов.
3.4. Учет и интерпретация результатов
После окончания времени инкубации просматривают посевы и отмечают появление типичного роста тест-микроорганизмов в контрольных чашках и пробирках (без препарата) и испытуемых (с различными разведениями препарата). В случаях, затрудняющих учет результатов (помутнение или изменение окраски жидкой среды в результате взаимодействия ЛС с питательной средой), делают пересевы на агаризованные среды.
При наличии роста E. coli, S. abony, P. aeruginosa, S. аureus на питательных средах делают вывод об отсутствии антимикробного действия исследуемого препарата.
Наличие в испытуемых чашках и пробирках роста тест-микроорганизмов, аналогичного контрольным, обозначают знаком «+», отсутствие роста – знаком «–». Если на средах с препаратом наблюдают уменьшение количества колоний на чашках или отсутствие роста тест-микроорганизмов, делают заключение о наличии у него антимикробного действия. Первое из последовательных разведений препарата, в котором отсутствует антимикробное действие, используют для посева на соответствующую питательную среду.
3.5. Способы устранения антимикробного действия ЛС
Для устранения антимикробного действия ЛС рекомендованы следующие методы:
- увеличение разведения препарата за счет большего объема разбавителя или питательной среды в пределах норм допустимой микробной загрязненности (в качестве разбавителя вместо стандартного фосфатного буферного раствора используют нейтрализующую жидкость (п. 9) лабораторного или промышленного изготовления);
- применение специфических инактиваторов (например, использование β-лактамазы для некоторых β-лактамных антибиотиков и пара-аминобензойной кислоты (ПАБК) — для сульфаниламидных препаратов), нейтрализующих антимикробное действие препарата, но не угнетающих рост микроорганизмов, контаминирующих ЛС;
- использование неспецифических инактиваторов для препаратов с консервантами. После проведения валидации в буферный раствор и (или) в питательные среды могут быть добавлены твин-80, соевый или яичный лецитин и др.;
- для препаратов, растворимых в воде или в изопропилмиристате (ИПМ), применяется метод мембранной фильтрации с последующим промыванием фильтров.
3.5.1. Инактивация некоторых антибиотиков
Для инактивации пенициллинов и цефалоспоринов, независимо от их лекарственной формы, в буферный раствор, используемый для растворения, суспендирования или эмульгирования образца, а также в питательные среды перед их использованием асептически вносят стерильный раствор β-лактамазы в количестве, указанном в нормативных документах.
3.5.2.Инактивация сульфаниламидных препаратов
Для инактивации сульфаниламидных препаратов, независимо от их лекарственной формы, в буферный раствор, используемый для растворения, суспендирования или эмульгирования образца, а также в питательные среды, если необходимо, до стерилизации вносят ПАБК из расчета 0,05 г/л среды в случае, если антимикробное действие не удается устранить путем разведения.
3.5.3. Инактивация консервантов, входящих в состав ЛС
Для инактивации консервантов, входящих в состав ряда лекарственных препаратов, в буферный раствор, в котором эмульгируют образец, а также в питательные среды до стерилизации вносят следующие неспецифические инактиваторы: 3 % твина-80 или 0,3 % лецитина (яичного или соевого) от объема среды. В случае, если в препарате имеется более 2 консервантов различной химической структуры, в среду вносят 3 % твина-80, 0,3 % лецитина, 0,1 % L-гистидина и 0,5 % натрия серноватистокислого одновременно. Инактиваторы антимикробного действия лекарственных средств указаны в табл. 4.
Таблица 4. Инактиваторы антимикробного действия ЛС
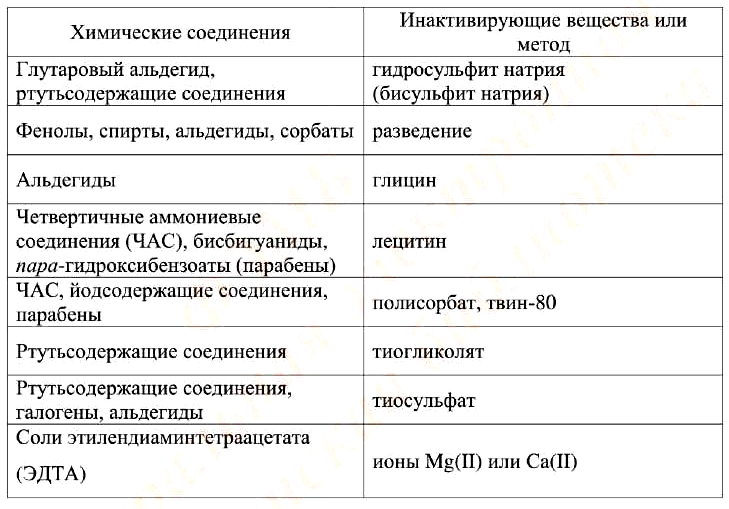
В случае, если при анализе качества ЛС нельзя использовать метод мембранной фильтрации, а все вышеперечисленные способы устранения его антимикробного действия в отношении конкретного тест-штамма микроорганизма неэффективны, этот вид испытания не проводят.
4. Отбор образцов
От каждой исследуемой серии ЛС для проведения испытания отбирают необходимое количество образцов в соответствии с категорией препарата из достаточного числа разных упаковок (не менее 3 – 10).
Для аэрозолей на основе жидких или твердых веществ отбирают 10 контейнеров, для трансдермальных пластырей – 10 пластырей.
В некоторых случаях (при высокой стоимости препарата и/или малом объеме серии) образец может быть уменьшен в отдельных случаях до 2 – 3 г (мл). Уменьшение количества образца с указанием метода испытания должно быть обосновано и утверждено в нормативной документации в установленном порядке.
4.1. Твердые лекарственные формы:
- 10,0 г образца — для определения общего числа бактерий и грибов в 1 г препарата, для испытания на отсутствие P. aeruginosa, S. aureus и E. coli;
- 25,0 г образца – для определения бактерий рода Salmonella;
- 10,0 г образца – для количественного определения энтеробактерий, устойчивых к желчи.
4.1.1. Таблетки, драже, гранулы, порошки и др.
10,0 г образца измельчают (в случае необходимости) и переносят в 100 мл буферного раствора. Далее проводят количественное и качественное определение микроорганизмов.
4.1.2. Капсулы
10,0 г образца переносят в 100 мл буферного раствора, содержащего не более 5 % твина-80 и нагретого до температуры не выше 40 оС. После суспендирования капсул в буферном растворе проводят количественное и качественное определение микроорганизмов.
4.2. Мягкие лекарственные формы:
- 10,0 г препарата — для определения общего числа бактерий и грибов, для теста на отсутствие P. aeruginosa, S. aureus , E. coli в 1 г препарата;
- 10,0 г образца – для теста на отсутствие или количественного определения в 1 г препарата энтеробактерий, устойчивых к желчи.
4.2.1. Мази, линименты, кремы, суппозитории, легко смешиваемые с водой
10,0 г образца помещают в стерильную колбу, содержащую 100 мл буферного раствора и стерильные стеклянные бусы диаметром 5 – 6 мм. Смесь нагревают на водяной бане до температуры не выше 40 оС и энергично встряхивают до получения гомогенной эмульсии, которую используют для количественного и качественного определения микроорганизмов.
4.2.2. Мази, линименты, кремы, суппозитории, трудно смешиваемые с водой
10,0 г образца смешивают со стерильным твином-80, количество которого не должно быть более 1/2 объема образца (в данном случае 5 г). Смесь нагревают на водяной бане или в термостате до температуры не выше 40 оС (в исключительных случаях — до температуры 45 оС) и осторожно перемешивают. При этом время нагрева не должно превышать 30 мин. Добавляют необходимое количество предварительно нагретого до соответствующей температуры стерильного фосфатного буферного раствора со стеклянными бусами. Смесь осторожно перемешивают для получения гомогенной эмульсии в разведении 1:10, которую используют для количественного и качественного определения микроорганизмов. Возможно использование других технических средств, методик гомогенизации с соблюдением правил асептики и режимов термостатирования.
4.3. Жидкие лекарственные формы:
- 10,0 мл образца исследуют для определения общего числа микроорганизмов и грибов в 1 мл препарата, для теста на отсутствие E. coli, P. aeruginosa, S. aureus;
- 25,0 мл образца – для испытания на отсутствие бактерий рода Salmonella;
- 10,0 мл образца – для количественного определения энтеробактерий, устойчивых к желчи.
4.3.1. Растворы, суспензии, сиропы, микстуры
Переносят 10,0 мл образца в 90 мл буферного раствора, перемешивают и проводят количественное и качественное определение микроорганизмов.
4.3.2. Растворы в маслах, эмульсии
Помещают 10,0 мл образца в стерильную колбу, содержащую 90 мл буферного раствора с твином-80 в количестве не более 5 % и стеклянные бусы. Смесь нагревают на водяной бане до температуры не выше 40 оС и энергично встряхивают до получения гомогенной эмульсии, которую используют для количественного и качественного определения микроорганизмов.
4.4. Аэрозоли
4.4.1. Аэрозоли на основе спиртов и твердых веществ
Переносят 3,0 г образца (после испарения пропеллента) в 30 мл буферного раствора, перемешивают и проводят количественное и качественное определение микроорганизмов. Не менее 1,0 г образца, применяемого респираторно, используют для испытания на отсутствие энтеробактерий, устойчивых к желчи.
4.4.2. Аэрозоли на основе масел
Переносят 3,0 г образца (после испарения пропеллента) в стерильную емкость с 30 мл буферного раствора с твином-80 в количестве не более 5 % и стерильные стеклянные бусы. Смесь нагревают на водяной бане до температуры не выше 40 оС и энергично встряхивают до получения гомогенной эмульсии, которую используют для количественного и качественного определения микроорганизмов.
Не менее 1,0 г образца, применяемого респираторно, используют для испытания на отсутствие энтеробактерий, устойчивых к желчи.
4.5. Трансдермальные пластыри
При отборе трансдермальных пластырей используют образец, состоящий из 10 единиц. С каждого из 10 пластырей снимают защитную пленку, пользуясь стерильными инструментами. При необходимости пластырь разрезают стерильными ножницами на более мелкие фрагменты, которые переносят в колбу вместимостью 1000 мл, содержащую 500 мл стерильного буферного раствора и стеклянные бусы (условное разведение 1:50). Колбу нагревают на водяной бане до температуры не выше 40 оС, энергично встряхивают в течение 30 мин.
Используют по 50 мл полученного смыва для количественного определения микроорганизмов методом мембранной фильтрации и испытания на отсутствие P. aeruginosa и S. aureus.
Если известно, что пластырь обладает антимикробным действием, в разбавитель добавляют подходящий инактиватор (твин-80 и/или лецитин).
В случае, если смыв с трансдермальных пластырей нельзя использовать для определения методом мембранной фильтрации, применяют метод прямого посева на питательные среды, используя разведение 1:50.
4.6. Лекарственные растительные препараты
К лекарственным растительным препаратам (ЛРП) относятся препараты, произведенные или изготовленные из одного вида лекарственного растительного сырья или нескольких видов такого сырья и реализуемые в расфасованном виде во вторичной (потребительской) упаковке (пачки, пакеты, брикеты и пр.).
От каждой контролируемой серии лекарственного растительного препарата отбирают объединенную пробу, из которой выделяют образец для определения микробиологической чистоты — минимум 5 невскрытых потребительских упаковок общей массой не менее 50 г.
Перед испытанием потребительские упаковки вскрывают с помощью стерильных инструментов, отбирают из них пробу в равных количествах, перемешивают и переносят в стерильную емкость.
Для количественного определения аэробных микроорганизмов и грибов образец массой 10,0 г (плоды, кора, корни и корневища, почки и др.) или 2,0 г (трава, листья, цветки и другие с большим коэффициентом водопоглощения) переносят в стерильную колбу. При массе образца 10,0 г в колбу помещают 100 мл стерильного 0,9 % раствора натрия хлорида. Колбу с исследуемым образцом встряхивают на качалке или аппарате для встряхивания в течение не менее 15 мин. Полученный смыв считают разведением 1:10. При массе образца 2,0 г в колбу добавляют 200 мл стерильного 0,9 % раствора натрия хлорида. Полученный смыв считают разведением 1:100.
Если образец плохо смачивается, в колбу прибавляют поверхностно-активное вещество – стерильный твин-80 в количестве 0,1 % от объема раствора.
Из полученных смывов ЛРП, соответствующих разведениям 1:10 или 1:100, готовят последовательные десятикратные разведения в том же разбавителе. Количественное определение аэробных бактерий и грибов проводят чашечным агаровым методом, как указано в разделе 5.
Испытание на отсутствие E. сoli, Salmonella и энтеробактерий, устойчивых к желчи, выполняют в соответствии с методами, приведенными в разделе 6.
5. Методы количественного определения аэробных микроорганизмов
В зависимости от природы ЛС и его физико-химических свойств используют один из вариантов чашечного агарового метода (глубинный, двухслойный, поверхностный, модифицированный глубинный), метод мембранной фильтрации или пробирочный метод наиболее вероятных чисел.
5.1.Чашечные агаровые методы
Для культивирования микроорганизмов используют агаризованные питательные среды: соево-казеиновый агар или среду № 1 сухую для контроля микробной загрязненности – для выращивания бактерий, агар Сабуро с глюкозой или среду № 2 сухую для контроля микробной загрязненности – для выращивания дрожжевых и плесневых грибов.
Для каждого разведения образца используют не менее 2 чашек Петри с определенной средой.
5.1.1. Глубинный метод
В стерильную чашку Петри диаметром 90 мм вносят 1 мл испытуемого образца, приготовленного для анализа. Добавляют 15 – 20 мл расплавленной и охлажденной до температуры (42,5 ± 2,5) оС стерильной агаризованной питательной среды и быстро перемешивают вращательными движениями. При большем диаметре чашек Петри количество среды соответственно увеличивают до 20 – 25 мл. После застывания агара чашки переворачивают и инкубируют посевы.
5.1.2. Двухслойный метод
Расплавленную агаризованную стерильную питательную среду вносят в количестве 15 – 20 мл в стерильную чашку Петри диаметром 90 мм и оставляют до застывания. При большем диаметре чашки Петри количество среды соответственно увеличивают. Поверхность агара в чашке подсушивают.
В пробирку с 4 мл соответствующей расплавленной и охлажденной до температуры (42,5 ± 2,5) оС питательной среды вносят 1 мл образца, приготовленного для анализа, быстро перемешивают содержимое пробирки. Затем содержимое пробирки выливают на поверхность застывшего и подсушенного агара в чашке Петри, равномерно распределяя верхний слой среды вращательными движениями. После застывания чашку переворачивают и помещают в термостат для инкубации.
5.1.3. Поверхностный метод
Расплавленные и охлажденные до температуры (42,5 ± 2,5) оС стерильные питательные среды вносят в количестве 15 – 20 мл в каждую стерильную чашку Петри диаметром 90 мм и оставляют до застывания. При большем диаметре чашек Петри количество среды соответственно увеличивают. Поверхность агара в чашках подсушивают в термостате или ламинарном шкафу.
Образец, приготовленный для анализа, наносят стерильной пипеткой на агар в количестве 0,1 мл и равномерно распределяют шпателем по поверхности среды.
Чашки переворачивают и помещают в термостат для инкубации.
5.1.4. Модифицированный глубинный метод
Образец, приготовленный для анализа, в количестве 1,0 мл вносят в стерильную чашку Петри диаметром 90 мм. Добавляют 7 – 10 мл расплавленной и охлажденной до температуры (42,5 ± 2,5) оС питательной среды и быстро перемешивают вращательными движениями. После застывания агара чашки переворачивают и инкубируют.
5.1.5. Учет и интерпретация результатов, полученных чашечными агаровыми методами
Посевы просматривают ежедневно. Подсчет колоний производят через 48 – 72 ч (предварительный результат) и через 5 сут (окончательный результат).
Для получения достоверных результатов отбирают чашки, в которых число колоний бактерий не превышает 250, а колоний грибов – 50. Если при учете результатов 2 последующих разведений число колоний на чашках находится в указанных выше пределах, рассчитывают результаты из меньшего разведения.
Если в среднем на чашках выросло более 250 колоний бактерий или более 50 колоний грибов, делают ряд дальнейших последовательных разведений образца, выбирая приемлемое для посева значение.
Если на соево-казеиновом агаре (или на среде № 1) дополнительно обнаружены колонии грибов, то их суммируют с числом бактерий и определяют общее число аэробных микроорганизмов, которое установлено для каждой категории ЛС.
Если на питательной среде отсутствует рост микроорганизмов, результаты отмечают в протоколе испытания следующим образом: при посеве ЛС в разведении 1:10 – «В 1 г (или в 1 мл) лекарственного средства содержится менее 10 бактерий (или грибов)»; при посеве ЛС в разведении 1:100 – «В 1 г (или в 1 мл) лекарственного средства содержится менее 100 бактерий (или грибов)» и т.д.
Количество микроорганизмов (N) в 1 г или в 1 мл рассчитывают по формуле:

где:
с – количество колоний на всех чашках Петри;
n – число чашек Петри;
d – коэффициент разведения образца;
10 – коэффициент пересчета при проведении высева на чашку в объеме 0,1 мл.
Пример. При посеве 1,0 мл образца из разведения 10-2 на 2 чашках выросло 168 и 215 колоний:

Полученный результат округляют до 2 значащих цифр – 19000 и записывают как 1,9 104 колониеобразующих единиц (КОЕ).
При необходимости подсчета общего количества микроорганизмов (бактерий и грибов суммарно) в 1 г или в 1 мл лекарственного средства следует сложить число аэробных бактерий с числом грибов.
Примечания.
В связи с тем, что ЛРП, представляющие собой лекарственные растения или их части (листья, цветки, трава, плоды, семена, кора, корни, корневища и др.), являются неоднородными в отношении количества аэробных бактерий и грибов, нормы допустимой микробной загрязненности лекарственного растительного сырья интерпретируют следующим образом:
- если количество микроорганизмов в 1 г не более 105 КОЕ – максимально допускается 5 * 105 КОЕ/г;
- если количество микроорганизмов в 1 г не более 107КОЕ – максимально допускается 5 * 107 КОЕ/г и т.д.
Для остальных категорий лекарственных препаратов (за исключением ЛРП) нормы допустимой микробной загрязненности интерпретируют следующим образом:
- если количество микроорганизмов в 1 г или в 1 мл не более 102 КОЕ – максимально допускается 2 * 102КОЕ/г или мл;
- если количество микроорганизмов в 1 г или в 1 мл не более 103 КОЕ – максимально допускается 2 * 103 КОЕ и т.д.
Варианты чашечного агарового метода (глубинный, двухслойный и глубинный модифицированный) можно использовать при испытании различных лекарственных форм, независимо от уровня микробной загрязненности. Поверхностный агаровый метод предпочтительнее использовать при испытании ЛС с высоким уровнем микробной контаминации. Для сокращения сроков получения результатов количественного определения бактерий и грибов, колонии которых склонны к сливному росту, используют модифицированный агаровый метод посева.
5.2. Метод мембранной фильтрации
Метод мембранной фильтрации используют для количественного и качественного определения микроорганизмов в ЛС, обладающих или не обладающих антимикробным действием, в частности для растворов и водорастворимых ЛС, а также для жиросодержащих препаратов, растворимых в изопропилмиристате (ИПМ).
5.2.1. Условия проведения испытания
Установка для мембранной фильтрации должна иметь конструкцию, из которой легко извлекается фильтр, с последующим его переносом на питательные среды. Используют мембранные фильтры с диаметром пор не более 0,45 мкм, способные эффективно задерживать микроорганизмы, что необходимо подтвердить валидацией. Материал мембраны следует выбирать таким образом, чтобы компоненты исследуемого препарата не влияли на эффективность его работы. Фильтры из нитрата целлюлозы используют для водных, масляных и разбавленных спиртовых растворов (менее 30 %), из ацетата целлюлозы – для спиртовых растворов (более 30 %), кислот, щелочей. Мембранную фильтрацию проводят в асептических условиях с помощью вакуума.
5.2.2. Выполнение испытания
Образец, как правило, растворяют в буферном растворе в соотношении 1:10. В воронку фильтровальной установки вносят сначала промывную жидкость (примерно 5 мл) для смачивания фильтра. Добавляют количество раствора препарата, соответствующее 1 г испытуемого образца, и немедленно фильтруют. В случае наличия антимикробного действия ЛС для отмывания мембраны используют 0,9 % раствор натрия хлорида или описанные ниже жидкости (№ 1, № 2, № 3), для чего через фильтр пропускают не менее 3 порций по 100 мл подходящей стерильной промывной жидкости. При необходимости к промывной жидкости могут быть добавлены поверхностно-активные вещества (например, твин-80) или инактиваторы антимикробного действия. Через 1 мембрану можно пропускать не более 500 мл промывной жидкости.
Допускается использование для отмывания мембран менее 3 порций промывной жидкости при условии валидации метода.
Для того чтобы определить, полностью ли отмыты мембраны от фильтруемого препарата, обладающего антимикробным действием, после фильтрации раствора в последнюю порцию промывной жидкости вносят по 1 мл взвеси тест-штаммов микроорганизмов культур, соответствующих категории испытуемого образца. Количество вносимого каждого в отдельности микроорганизма не должно превышать 100 КОЕ в 1 мл.
Рост тест-штаммов на фильтрах подтверждает отсутствие антимикробного действия лекарственного средства. В случае, если антимикробное действие сохраняется, используют специфические или неспецифические инактиваторы или увеличивают объем промывной жидкости.
Смыв с трансдермальных пластырей пропускают через мембранные фильтры по 50 мл (соответствует 1 пластырю) через каждую мембрану.
По окончании процесса фильтрации мембраны переносят на соответствующие питательные среды, разлитые в чашки Петри или флаконы с жидкими питательными средами. Чашки с фильтрами переворачивают. Посевы на чашках и во флаконах инкубируют в стандартных условиях.
5.2.3. Учет и интерпретация результатов
Подсчет колоний производят через 48 – 72 ч (предварительные результаты) и через 5 сут (окончательные результаты). Отбирают чашки, в которых число колоний бактерий на фильтрах не превышает 100, а грибов – 50, и рассчитывают число микроорганизмов на 1,0 г (1,0 мл) образца или на 1 пластырь. Если на фильтре большее количество микроорганизмов, то делают ряд последовательных разведений образца и выбирают подходящее.
Учет результатов на жидких питательных средах проводят в соответствии с разделом 6.
5.2.4. Жидкости для промывания фильтров
Для промывания фильтров можно использовать любую стерильную жидкость, не подавляющую рост микроорганизмов:
- 0,9 % раствор натрия хлорида рН (7,0 ± 0,2) (после стерилизации);
- жидкость № 1: растворяют 1 г ферментативного пептона в 1000 мл воды очищенной, фильтруют или центрифугируют для осветления, разливают в сосуды и стерилизуют; рН (7,0 ± 0,2);
- жидкость № 2: добавляют 1 мл твина-80 к 1000 мл жидкости № 1, разливают во флаконы и стерилизуют. Величина рН после стерилизации (6,9 ± 0,2). Жидкость № 2 применяют, если в составе препарата имеется масло;
- жидкость № 3: растворяют 5 г мясного пептона, 3 г мясного экстракта и 10 г твина-80 в 1000 мл воды очищенной. Разливают во флаконы и стерилизуют; рН после стерилизации (6,9 ± 0,2).
5.3 Метод наиболее вероятных чисел (НВЧ)
Метод НВЧ используют при испытании ЛС с низким уровнем микробной контаминации, а также в тех случаях, когда нельзя применить другие методы. Метод НВЧ менее чувствителен и точен по сравнению с чашечным агаровым методом или методом мембранной фильтрации, и его используют только для определения общего числа бактерий, так как результаты, полученные при определении общего числа грибов, особенно плесневых, считают недостоверными.
5.3.1. Выполнение испытания
Исследуемый образец готовят в виде раствора, суспензии или эмульсии в разведениях 1:10, 1:100, 1:1000, используя подходящий растворитель. Жидкую питательную среду разливают в 12 стерильных пробирок по 9 мл в каждой. Пробирки ставят в штатив в 4 ряда по 3 пробирки в ряду.
В первый ряд пробирок вносят по 1 мл испытуемого образца в разведении 1:10, во второй ряд – по 1 мл в разведении 1:100, в третий ряд – по 1 мл в разведении 1:1000. В пробирки четвертого ряда вносят по 1 мл разбавителя, который используют для растворения, суспендирования или эмульгирования образца. Посевы инкубируют в стандартных условиях в течение не более 3 сут.
5.3.2. Учет и интерпретация результатов
Отмечают число пробирок в первом, втором и третьем рядах, в которых визуально наблюдают рост микроорганизмов. Среда в пробирках четвертого ряда (контроль разбавителя) должна оставаться стерильной. Полученное трехзначное число соответствует наиболее вероятному количеству жизнеспособных микроорганизмов в 1,0 г или в 1,0 мл лекарственного средства (табл. 5).
Таблица 5. Наиболее вероятное число микроорганизмов
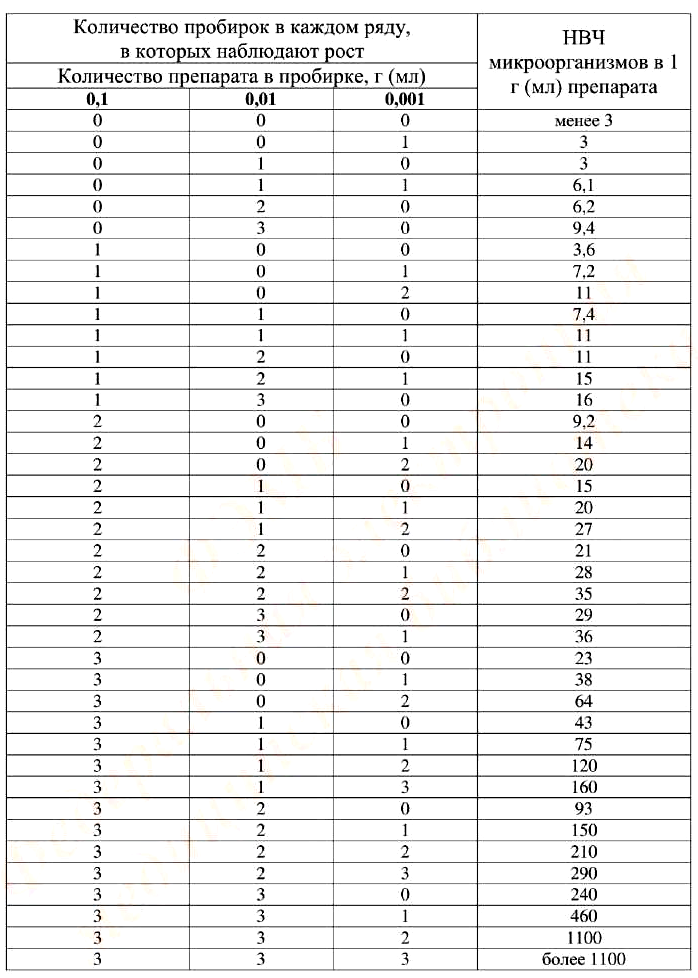
Пример. В первом ряду рост микроорганизмов наблюдается в 3 пробирках, во втором ряду — в 2 пробирках, в третьем ряду — в 1 пробирке. Полученное число «321» по табл. 5 соответствует цифре «150».
Следовательно, наиболее вероятное число бактерий в 1 г или 1 мл исследуемого образца — 150. Если учет результатов не может быть определен точно в связи с природой исследуемого препарата (помутнение среды, изменение ее цвета и т.п.), делают пересев на соответствующую жидкую или агаризованную среду, чтобы убедиться в наличии роста микроорганизмов.
6. Определение отдельных видов микроорганизмов
Испытание включает использование селективных и диагностических питательных сред.
6.1. Энтеробактерии, устойчивые к желчи
6.1.1 Испытание на отсутствие энтеробактерий, устойчивых к желчи (качественный метод)
Для восстановления жизнеспособности микроорганизмов используют предварительную инкубацию образца в жидкой питательной среде. С этой целью 10,0 г или 10,0 мл исследуемого образца переносят в 100 мл соево-казеинового бульона (или среды № 8), перемешивают и инкубируют при температуре (22,5 ± 2,5) оС в течение 2 ч, но не более 5 ч. После инкубации снова перемешивают содержимое флакона, в котором проводилось восстановление жизнеспособности микроорганизмов (гомогенат А), и переносят 10 мл (количество, соответствующее 1 г или 1 мл образца) в 100 мл среды обогащения (бульон Мосселя). Посевы инкубируют в течение 24 – 48 ч в стандартных условиях. При появлении роста делают пересев бактериологической петлей на агар Мосселя или среду № 4, которую инкубируют в течение 18 – 24 ч.
Если на агаре Мосселя выявлены типичные колонии энтеробактерий (табл.7), по морфологическим и тинкториальным свойствам представляющие собой грамотрицательные неспорообразующие палочки, не обладающие цитохромоксидазой (п.8.1), считают, что исследуемый образец контаминирован энтеробактериями, устойчивыми к желчи.
6.1.2. Количественное определение энтеробактерий, устойчивых к желчи
Для посева используют 3 пробирки с 9 мл бульона Мосселя в каждой. Гомогенат А в количестве 1 мл (соответствует 0,1 г или 0,1 мл образца) вносят в первую пробирку, тщательно перемешивают и переносят 1 мл (соответствует 0,01 г или 0,01 мл образца) во вторую пробирку, снова перемешивают и переносят 1 мл (соответствует 0,001 г или 0,001 мл образца) в третью пробирку, меняя пипетку после каждого шага. Посевы инкубируют в течение 24 – 48 ч.
Для подтверждения отсутствия энтеробактерий, устойчивых к желчи, делают пересев бактериологической петлей из каждой пробирки с видимым ростом на агар Мосселя (среда № 4) и инкубируют чашки Петри в течение 18 – 24 ч. Проводят микроскопическое исследование обнаруженных на плотной среде колоний. Выявление грамотрицательных палочковидных неспорообразующих бактерий свидетельствует о присутствии в ЛС энтеробактерий, устойчивых к желчи. Наиболее вероятное количество устойчивых к желчи энтеробактерий в 1 г или 1 мл образца определяют по табл. 6.
Таблица 6. Интерпретация результатов

6.2. Бактерии Escherichia coli
6.2.1. Испытание на отсутствие бактерий E. coli (качественный метод)
10 г исследуемого образца, растворенного или разбавленного стерильным фосфатно-буферным раствором 1:10, переносят в количестве 10 мл (соответствует 1 г или 1 мл испытуемого ЛС) в 100 мл соево-казеинового бульона (или среды № 8). Перемешивают и инкубируют в течение 18 – 24 ч. При наличии роста 1 мл содержимого флакона переносят в 100 мл бульона Мак-Конки (или среды № 3) и инкубируют 24 – 48 ч при температуре (43 ± 1) оС.
При обнаружении роста в бульоне бактериологической петлей делают пересев на агар Мак-Конки или среду № 4. Посевы инкубируют в течение 18 – 48 ч (агар Мак-Конки) или 18 – 24 ч (среда № 4). Если после инкубации на плотных питательных средах выявлены колонии, типичные для E. coli (табл. 7), их микроскопируют. При обнаружении в мазках мелких грамотрицательных палочек отдельные типичные колонии пересевают в пробирки на скошенный соево-казеиновый агар или среду № 1 и инкубируют в течение 18 – 24 ч для накопления чистой культуры микроорганизма.
Для идентификации выделенных бактерий используют биохимические тесты на цитохромоксидазу (п.8.1), индол (п.8.2) и способность утилизировать натрия цитрат. Для этого из пробирок с чистой культурой делают пересевы на агар Симмонса (или среду № 14) и соево-казеиновый бульон (или среду № 15). Через 18 – 24 ч инкубации отмечают рост бактерий или его отсутствие на агаре Симмонса (или среде № 14). Утилизацию цитрата устанавливают по смещению рН среды в щелочную сторону (изменению цвета среды с зеленого на синий). Наличие индола определяют по появлению красного кольца на поверхности соево-казеинового бульона (или среды № 15) при добавлении реактива Ковача.
Если в ходе исследования обнаруживают типичные грамотрицательные палочки, не содержащие фермент цитохромоксидазу, не утилизирующие натрия цитрат и образующие индол, считают, что ЛС контаминировано бактериями E. coli.
6.2.2. Количественное определение бактерий E. coli
Количественное определение E.coli проводят так же, как и количественное определение энтеробактерий, устойчивых к желчи (п. 6.1.2), делая пересев из гомогената А в пробирки с бульоном Мак-Конки (или средой № 3). При обнаружении роста в пробирках (табл. 7) из каждой пробирки делают пересев бактериологической петлей на агар Мак-Конки или среду № 4. Посевы инкубируют в стандартных условиях в течение 18 – 48 ч (агар Мак-Конки) или 18 – 24 ч (среда № 4).
При обнаружении на указанных средах типичных колоний бактерий (табл. 7), по морфологическим и тинкториальным свойствам представляющих собой грамотрицательные палочки, которые не содержат фермент цитохромоксидазу, не утилизируют натрия цитрат и образуют индол, делают вывод, что ЛС контаминировано бактериями E. coli. Наиболее вероятное количество клеток E. coli в 1 г или в 1 мл испытуемого образца определяют по табл. 6.
6.3. Испытание на отсутствие бактерий рода Salmonella
Переносят 10 (25) г или 10 (25) мл исследуемого образца в 100 (225) мл соево-казеинового бульона (или среды № 8), перемешивают и инкубируют в течение 18 – 24 ч. После перемешивания 0,1 мл переносят в 10 мл накопительного бульона для бактерий рода Salmonella – среду Раппопорта – Вассилиадиса и инкубируют в стандартных условиях в течение 18 – 24ч. По окончании инкубации делают пересев бактериологической петлей на одну из 2 плотных диагностических сред: ксилоза-лизин-дезоксихолат агар или висмут-сульфитный агар (среда № 5), которые затем инкубируют в течение 48 ч.
При выявлении на указанных средах колоний, типичных для бактерий рода Salmonella (табл. 7), проводят микроскопическое исследование. При обнаружении в мазках грамотрицательных палочек характерные колонии пересевают на скошенный трехсахарный агар с солями железа (или среду № 13), нанося большое количество культуры бактериологической петлей сначала на скошенную часть агара, а потом уколом в столбик, не касаясь дна пробирки. Через 24 ч инкубации в стандартных условиях отмечают изменение цвета среды из красного в желтый в основании столбика питательной среды (ферментация глюкозы). В скошенной части агара цвет среды не изменяется (отсутствие ферментации сахарозы и лактозы). Почернение среды свидетельствует об образовании сероводорода — типичном признаке большинства бактерий рода Salmonella. Параллельно проводят определение наличия фермента цитохромоксидазы (п.8.1), а также другие биохимические и серологические тесты в случае необходимости дополнительного подтверждения.
Если в образце обнаружены бактерии, типичные по своим культуральным, морфологическим и тинкториальным свойствам (табл. 7), не содержащие фермент цитохромоксидазу, не ферментирующие сахарозу и лактозу и выделяющие сероводород, считают, что лекарственное средство контаминировано бактериями рода Salmonella.
6.4. Испытание на отсутствие бактерий Pseudomonas aeruginosa
Исследуемый образец, растворенный или разбавленный стерильным буферным раствором 1:10, переносят в количестве 10 мл (соответствует 1 г или 1 мл) в 100 мл жидкой питательной среды (соево-казеинового бульона или среды № 8). Перемешивают и инкубируют в стандартных условиях в течение 24 – 48 ч. После окончания инкубации при наличии роста производят пересев бактериологической петлей на селективную питательную среду для выделения синегнойной палочки (цетримидный агар или цетилпиридиний хлорид (ЦПХ) агар – среда № 16). Посевы инкубируют в стандартных условиях в течение 24 – 48 ч. Выделенные колонии микроорганизмов, которые по своим тинкториальным и морфологическим свойствам являются грамотрицательными палочками, пересевают на агар для выявления сине-зеленого пигмента пиоцианина (или среду № 9). Посевы инкубируют в течение 24 – 48 ч.
Для подтверждения видовой принадлежности выделенных бактерий к P. aeruginosa определяют наличие фермента цитохромоксидазы (п.8.1) и способность выделенных микроорганизмов расти на соево-казеиновом бульоне (или среде № 8) при температуре (42 ± 1) оС в течение 18 – 24 ч.
При испытании качества трансдермальных пластырей 10 пластырей помещают в 500 мл фосфатного буферного раствора и осторожно встряхивают в течение не менее 15 мин.
Полученную жидкость в количестве 50 мл пропускают через стерильный мембранный фильтр из нитрат-целлюлозы с диаметром пор 0,45 мкм, который затем переносят в 100 мл соево-казеинового бульона (или среды № 8). Посевы инкубируют в течение 24 – 48 ч. После инкубации при наличии роста производят пересев бактериологической петлей на селективные среды – цетримидный агар или ЦПХ-агар. Дальнейшую идентификацию проводят, как указано выше.
Если в образце обнаружены бактерии, типичные для псевдомонад по своим морфологическим и тинкториальным свойствам (табл. 7), образующие сине-зеленый пигмент пиоцианин, содержащие фермент цитохромоксидазу и растущие при температуре (42 ± 1) оС, считают, что ЛС контаминировано бактериями P. aeruginosa.
6.5. Испытание на отсутствие бактерий Staphylococcus aureus
Исследуемый образец, растворенный или разбавленный стерильным буферным раствором 1:10, переносят в количестве 10 мл (что соответствует 1 г или 1 мл образца) в 100 мл соево-казеинового бульона или среды № 8. Перемешивают и инкубируют в течение 24 – 48 ч. При наличии роста пересевают петлей на маннитно-солевой агар (или среду № 10) и инкубируют в стандартных условиях в течение 24 – 48 ч.
Появление после окончания инкубации типичных золотисто-желтых колоний (табл. 7), окруженных желтыми зонами на среде с маннитом, свидетельствует о росте S. aureus, ферментирующем маннит. Проводят микроскопическое исследование типичных колоний. При обнаружении в мазках грамположительных кокков, расположенных в виде виноградных гроздей, производят пересев на соево-казеиновый агар (или среду № 1). Инкубируют в стандартных условиях в течение 18 – 24 ч. Для идентификации проводят тест на наличие коагулазы (п.8.3).
При испытании микробиологической чистоты трансдермальных пластырей 10 пластырей помещают в 500 мл фосфатного буферного раствора и осторожно встряхивают в течение не менее 15 мин.
Полученную жидкость в объеме 50 мл пропускают через стерильный мембранный фильтр из нитрата целлюлозы с диаметром пор 0,45 мкм, который затем переносят в 100 мл соево-казеинового бульона (или среды № 8) и инкубируют в течение 24 – 48 ч. После инкубации при наличии роста пересевают петлей на маннитно-солевой агар (или среду № 10) для выделения S. аureus . Посевы инкубируют в течение 48 ч.
Если в образце обнаружены типичные по культуральным, морфологическим и тинкториальным свойствам бактерии (табл. 7), содержащие коагулазу, утилизирующие маннит, считают, что ЛС контаминировано S.aureus.
6.6. Испытание на отсутствие грибов Candida albicans
Исследуемый образец, растворенный или разбавленный стерильным буферным раствором 1:10, переносят в количестве 10 мл (что соответствует 1 г или 1 мл образца) в 100 мл бульона Сабуро, перемешивают и инкубируют в течение 3 – 5 сут при температуре (32,5 ± 2,5) оС. При наличии роста пересевают бактериологической петлей на агар Сабуро с глюкозой (или среду № 2) и инкубируют в течение 24 – 48 ч при той же температуре.
Рост белых круглых, выпуклых, гладких и блестящих колоний может указывать на наличие Candida albicans, что подтверждают в ходе дальнейшей идентификации, одним из этапов которой является микроскопическое исследование (окраска по Граму), выявляющее грамположительные дрожжеподобные почкующиеся овальные или округлые клетки размером 4 – 8 мкм. Для идентификации возможно использовать хромогенную среду, предназначенную для дифференциации C. albicans и других видов грибов рода Candida.
Если в образце обнаружены типичные по морфологическим и тинкториальным свойствам дрожжеподобные грибы (табл. 7), идентифицированные как C. albicans, считают, что ЛС контаминировано указанным видом грибов.
6.7. Культуральные, морфологические и тинкториальные свойства микроорганизмов
Характерные культуральные, морфологические и тинкториальные свойства некоторых микроорганизмов — возможных контаминантов ЛС представлены в табл. 7.
Таблица 7. Культуральные, морфологические и тинкториальные свойства микроорганизмов-контаминантов
| Питательные среды | Морфология колоний | Окраска по Граму |
| Escherichia coli | ||
| Бульон Мак-Конки | Обесцвечивание среды, помутнение, газообразование | грамотрицательные
палочки, не имеющие спор |
| Среда № 3 | Изменение окраски среды, газообразование | |
| Агар Мак-Конки | Кирпично-красные колонии, могут быть окружены зонами выпавшей в осадок желчи | |
| Среда № 4 | Малиновые или розовые колонии с металлическим блеском, окруженные зонами малинового цвета | |
| Агар Мосселя | Красные колонии, окруженные красными зонами преципитации | |
| Salmonella spp. | ||
| Бульон Раппопорта – Вассилиадиса | Помутнение среды при сохранении цвета или отсутствие видимого роста | грамотрицательные
палочки, не имеющие спор |
| Ксилоза-лизин-дезоксихолат агар | Красные колонии с черным центром или без него | |
| Висмут-сульфит агар (или среда № 5) | Черные колонии с антрацитовым блеском, среда под колониями окрашена в черный цвет | |
| Агар Мосселя | Красные колонии, окруженные красными зонами преципитации | |
| Pseudomonas aeruginosa | ||
| Соево-казеиновый бульон (среда № 8) | Помутнение, поверхностный рост в виде пленки | грамотрицательные палочки, не имеющие спор |
| Цетримидный агар | Зеленоватые колонии, зеленые в УФ свете | |
| Среда № 16
(ЦПХ-агар) |
Зеленоватые колонии, зеленые в УФ свете | |
| Агар для выявления пиоцианина, среда № 9 | Сине-зеленые колонии, сине-зеленые в УФ свете | |
Staphylococcus aureus |
||
| Соево-казеиновый бульон (среда №8) | Равномерное помутнение | грамположительные кокки в виде гроздей |
| Маннитно-солевой агар
(или среда № 10) |
Золотисто-желтые колонии, окруженные желтыми зонами | |
| Staphylococcus epidermidis | ||
| Маннитно-солевой агар
(или среда № 10) |
Белые колонии, отсутствие желтых зон вокруг колоний | грамположительные кокки в виде гроздей |
| Candida albicans | ||
| Бульон Сабуро | Придонный рост | грамположительные дрожжеподобные почкующиеся овальные или круглые клетки размером 4–8 мкм |
| Сабуро агар
(среда № 2) |
Белые, круглые, выпуклые, гладкие и блестящие колонии | |
7. Повторные испытания
В случае необходимости при выявлении контаминации ЛС повторяют тот раздел испытания, результаты которого не соответствуют требованиям нормативной документации. Анализ проводят на удвоенном количестве образцов препарата.
8. Биохимические тесты для индентификации микроорганизмов
8.1. Тест на наличие фермента цитохромоксидаза (оксидазный тест)
Реактив – 1 % раствор N,N-диметил-пара-фенилендиамина дигидрохлорида. Раствор хранят при температуре 2 – 8 оС во флаконах из нейтрального светозащитного стекла в течение установленного валидированного срока годности. Раствор должен быть бесцветным.
Полоску фильтровальной бумаги смачивают реактивом. Платиновой петлей или стеклянной палочкой наносят 24-часовую чистую культуру исследуемых бактерий, выросших на соево-казеиновом агаре (или среде № 1). Темно-красное окрашивание, появляющееся в течение 1 мин, свидетельствует о положительной оксидазной реакции. Положительным контролем служит тест-микроорганизм P. aeruginosa, отрицательным – тест-микроорганизм E. coli (окраска отсутствует).
8.2. Тест на наличие индола
Реактив Ковача:
- Спирта амилового или изоамилового — 75 мл
- пара-дДиметиламинобензальдегида — 5 г
- Хлористоводородной кислоты, концентрированной — 20 мл
Соответствующее количество пара-диметиламинобензальдегида растворяют в изоамиловом или амиловом спирте при нагревании на водяной бане при температуре (52,5 ± 2,5) оС, остужают и по каплям прибавляют хлористоводородную кислоту. Раствор хранят в защищенном от света месте при температуре 2 – 8 оС. Реактив должен быть желтого цвета. При неправильном хранении цвет реактива становится коричневым, и реактив становится непригодным для использования.
В пробирку с соево-казеиновым бульоном (или со средой № 15), в которой выросла исследуемая суточная культура, вносят 0,5 мл реактива Ковача и слегка встряхивают. Через 3 – 5 мин при наличии индола наблюдают появление красного кольца на поверхности среды в пробирке. Положительным контролем является тест-микроорганизм E. coli, отрицательным – тест-штамм S. abony (окраска отсутствует).
8.3. Тест на наличие фермента коагулазы (реакция плазмокоагуляции)
Сухую цитратную кроличью плазму разводят согласно приложенной инструкции 0,9 % стерильным раствором натрия хлорида и разливают по 0,5 мл в стерильные пробирки. Вносят в пробирку с восстановленной кроличьей плазмой 1 петлю суточной чистой культуры выделенных бактерий, выращенных на соево-казеиновом агаре (или на среде № 1). Вторую пробирку не инокулируют (отрицательный контроль). Положительным контролем служит тест-штамм S. aureus, отрицательным – тест-штамм S. epidermidis. Все пробирки инкубируют в стандартных условиях. Реакцию плазмокоагуляции отмечают через каждый час в течение 4 – 6 ч, слегка наклоняя пробирку, не встряхивая ее.
При отсутствии положительной реакции плазмокоагуляции удлиняют время инкубации до 24 ч для получения окончательных результатов. Тест на наличие коагулазы считается положительным при обнаружении сгустка плазмы.
9. Питательные среды и растворы
Для испытания качества ЛС на микробиологическую чистоту используют питательные среды отечественного или зарубежного производства.
При приготовлении питательных сред в лаборатории необходимо строго придерживаться приведенной рецептуры, а при использовании коммерческих сухих питательных сред — инструкции предприятия-изготовителя. Входящие в состав питательных сред индикаторы и красители добавляют в виде растворов определенной концентрации. Необходимое значение рН питательной среды устанавливают при температуре (22,5 ± 2,5) оС.
Если нет других указаний в нормативной документации, среды стерилизуют в автоклаве при температуре 121 оС в течение 15 мин, при условии валидации процесса стерилизации.
Фосфатный буферный раствор с натрия хлоридом и пептоном (рН 7,0):
| Калия фосфат однозамещенный | 3,6 г |
| · Натрия фосфат двузамещенный | 7,2 г |
| · Натрия хлорид | 4,3 г |
| · Пептон (мясной или казеиновый) | 1,0 г |
| · Вода очищенная | 1000,0 мл |
Нейтрализующая жидкость
| · Твин-80 | 30,0 г |
| · Лецитин (яичный или соевый) | 3,0 г |
| · Гистидина гидрохлорид | 1,0 г |
| · Пептон (мясной или казеиновый) | 1,0 г |
| · Натрия хлорид | 4,3 г |
| · Калия фосфат однозамещенный | 3,6 г |
| · Натрия фосфат двузамещенный | 7,2 г |
| · Вода очищенная | 1000,0 мл |
| рН после стерилизации | 7,6 ± 0,2 |
Полужидкий агар для хранения тест-микроорганизмов
| · Панкреатический гидролизат казеина | 8,0 г | |
| · Натрия хлорид | 5,0 г | |
| · Агар микробиологический | 5,0 г | |
| · Вода очищенная | 1000,0 мл | |
| рН после стерилизации | 7,0 ± 0,2 | |
Соево—казеиновый агар (Casein Soya Bean Digest agar)
| · Панкреатический гидролизат казеина | 15,0 г |
| · Папаиновый гидролизат бобов сои | 5,0 г |
| · Натрия хлорид | 5,0 г |
| · Агар микробиологический | 15,0 г |
| · Вода очищенная | 1000,0 мл |
| рН после стерилизации | 7,3 ± 0,2 |
Альтернативная среда отечественного производства для выращивания аэробных бактерий – среда № 1 для контроля микробной загрязненности, сухая; мясопептонный агар (МПА); агаризованные питательные среды на основе гидролизата рыбной муки (ГРМ).
Бульон Сабуро (Sabouraud Broth)
| · Пептон (мясной) | 5,0 г |
| · Пептон (казеиновый) | 5,0 г |
| · Глюкозы моногидрат | 20,0 г |
| · Вода очищенная | 1000,0 мл |
| рН после стерилизации | 5,6 ± 0,2 |
Агар Сабуро с глюкозой (Sabouraud 4% Glucose Agar )
| · Пептон (мясной или казеиновый) | 10,0 г |
| · Глюкозы моногидрат | 40,0 г |
| · Агар бактериологический | 15,0 г |
| · Вода очищенная | 1000,0 мл |
| рН после стерилизации | 5,6 ± 0,2 |
Альтернативная отечественная среда для выращивания дрожжевых и плесневых грибов – среда № 2 (агар Сабуро с глюкозой) для контроля микробной загрязненности, сухая, различных производителей.
Для повышения селективности среды с целью предотвращения роста бактерий перед стерилизацией добавляют 50 мг хлорамфеникола (левомицетина) на 1 л среды или перед розливом в чашки Петри в расплавленную среду вносят 0,1 г натриевой соли бензилпенициллина и 0,1 г тетрациклина на 1 л среды в виде стерильных растворов.
Бульон Мосселя для обогащения энтеробактерий (Enterobacteria Enrichment Broth – Mossel)
| · Панкреатический гидролизат желатина | 10,0 г | ||
| · Глюкозы моногидрат | 5,0 г | ||
| · Бычья желчь сухая | 20,0 г | ||
| · Калия фосфат однозамещенный | 2,0 г | ||
| · Натрия фосфат двузамещенный | 8,0 г | ||
| · Бриллиантовый зеленый | 0,015 г | ||
| · Вода очищенная | 1000,0 мл | ||
| рН | 7,2 ± 0,2 | ||
Среду нагревают при температуре 100 °С в течение 30 мин с последующим быстрым охлаждением.
Альтернативная отечественная среда для выращивания аэробных бактерий – среда № 3 для контроля микробной загрязненности, сухая; различных производителей.
Агар Мосселя (Crystal violet, Neutral Red, Bile Agar with Glucose)
| · Дрожжевой экстракт | 3,0 г |
| · Панкреатический гидролизат казеина | 7,0 г |
| · Соли желчи | 1,5 г |
| · Лактозы моногидрат | 10,0 г |
| · Натрия хлорида | 5,0 г |
| · Глюкозы моногидрат | 10,0 г |
| · Агар микробиологический | 15,0 г |
| · Нейтральный красный | 0,03 г |
| · Кристаллический фиолетовый | 0,002 г |
| · Вода очищенная | 1000,0 мл |
| рН | 7,4 ± 0,2 |
Нагревают до кипения. Среду не автоклавируют.
Альтернативная отечественная среда для выделения энтеробактерий – среда № 4 (Эндо) для контроля микробной загрязненности, сухая; различных производителей.
Бульон Мак-Конки (MacConkey Broth)
| · Панкреатический гидролизат желатина | 20,0 г | ||
| · Лактозы моногидрат | 10,0 г | ||
| · Бычья желчь сухая | 5,0 г | ||
| · Бромкрезоловый пурпурный | 0,01 г | ||
| · Вода очищенная | 1000,0 мл | ||
| рН после стерилизации | 7,3 ±0,2 | ||
Альтернативная отечественная среда обогащения для энтеробактерий – среда № 3 для контроля микробной загрязненности, сухая, различных производителей.
Агар Мак-Конки (MacConkey Agar)
| · Панкреатический гидролизат желатина | 17,0 г | ||
| · Пептон (мясный или казеиновый) | 3,0 г | ||
| · Лактозы моногидрат | 10,0 г | ||
| · Натрия хлорид | 5,0 г | ||
| · Соли желчи | 1,5 г | ||
| · Агар микробиологический | 13,5 г | ||
| · Нейтральный красный | 0,03 г | ||
| · Кристаллический фиолетовый | 0,001 г | ||
| · Вода очищенная | 1000,0 мл | ||
| рН после стерилизации | 7,1 ± 0,2 | ||
Перед стерилизацией кипятят 1 мин, постоянно встряхивая.
Альтернативная отечественная среда для выделения энтеробактерий – среда № 4 (Эндо) для контроля микробной загрязненности, сухая, различных производителей.
Накопительная среда для бактерий рода Salmonella (бульон Раппопорта – Вассилиадиса)
| · Соевый пептон | 4,5 г |
| · Магния хлорид шестиводный | 29,0 г |
| · Натрия хлорид | 7,2 г |
| · Калий фосфорнокислый двузамещенный | 0,18 г |
| · Калий фосфорнокислый однозамещенный | 1,26 г |
| · Малахитовый зеленый | 0,036 г |
| · Вода очищенная | 1000,0 мл |
| рН после стерилизации | 5,2 ± 0,2 |
Среду автоклавируют в течение 15 мин при температуре 115 оС.
Ксилоза, лизин, дезоксихолат агар (Xylose, Lisine, Deoxycholate Agar)
| · Ксилоза | 3,5 г |
| · L–лизин | 5,0 г |
| · Лактозы моногидрат | 7,5 г |
| · Сахароза | 7,5 г |
| · Натрия хлорид | 5,0 г |
| · Дрожжевой экстракт | 3,0 г |
| · Феноловый красный | 0,08 г |
| · Агар микробиологический | 13,5 г |
| · Натрия дезоксихолат | 2,5 г |
| · Натрия тиосульфат | 6,8 г |
| · Железа аммоний цитрат | 0,8 г |
| · Вода очищенная | 1000,0 мл |
| рН | 7,4 ± 0,2 |
Доводят до кипения, охлаждают до температуры 50 °С и разливают в чашки Петри. Среду не автоклавируют.
Висмут-сульфитный агар (Bismuth Sulfite agar)
| · Мясной экстракт | 5,0 г |
| · Мясной пептон | 10,0 г |
| · Глюкозы моногидрат | 5,0 г |
| · Натрия фосфат двузамещенный | 4,0 г |
| · Железа сульфат | 0,3 г |
| · Бриллиантовый зеленый | 0,025 г |
| · Висмута сульфит | 8,0 г |
| · Агар микробиологический | 15,0 г |
| · Вода очищенная | 1000,0 мл |
| рН | 7,6 ± 0,2 |
Среду не автоклавируют. Приготовленная среда непрозрачна, зеленого цвета.
Альтернативная отечественная среда для выделения сальмонелл – среда № 5 для контроля микробной загрязненности, сухая, различных производителей.
Соево—казеиновый бульон (Casein Soya Bean Digest Broth)
| · Панкреатический гидролизат казеина | 17,0 г | ||
| · Папаиновый гидролизат бобов сои | 3,0 г | ||
| · Натрия хлорид | 5,0 г | ||
| · Калия фосфат двузамещенный | 2,5 г | ||
| · Глюкозы моногидрат | 2,5 г | ||
| · Вода очищенная | 1000,0 мл | ||
| рН после стерилизации | 7,3 ± 0,2 | ||
Альтернативная отечественная среда для выращивания бактерий – среда № 8 для контроля микробной загрязненности, сухая, различных производителей.
Цетримидный агар (Cetrimide Agar)
| · Панкреатический гидролизат желатина | 20,0 г | ||
| · Магния хлорид | 1,4 г | ||
| · Калия сульфат двузамещенный | 10,0 г | ||
| · Цетримид (цетилпиридиния бромид) | 0,3 г | ||
| · Агар микробиологический | 13,6 г | ||
| · Глицерин | 10,0 мл | ||
| · Вода очищенная | 1000,0 мл | ||
| рН после стерилизации | 7,2 ± 0,2 | ||
Альтернативная отечественная среда для выделения синегнойной палочки – ЦПХ (среда № 16) – агар для выделения синегнойной палочки, сухая.
ЦПХ агар (среда № 16)
| · Пептон сухой ферментативный | 20,0 г | ||
| · Калий сернокислый | 7,6 г | ||
| · Магний сернокислый семиводный | 2,4 г | ||
| · Сода кальцинированная | 1,0 г | ||
| · Фенозан-кислота | 0,2 г | ||
| · ЦПХ (N-цетилпиридиний хлористый 1-водный) | 0,3 г | ||
| · Агар микробиологический | 8,0 г | ||
| · Вода очищенная | 1000,0 мл | ||
| рН | 7,2 ± 0,2 | ||
Среду не автоклавируют.
Агар для выявления пиоцианина Pseudomonas (Pseudomonas Agar Medium for Detection of Pyocyanin)
| · Панкреатический гидролизат желатина | 20,0 г | ||
| · Магния хлорид безводный | 1,4 г | ||
| · Калия сульфат безводный | 10,0 г | ||
| · Агар микробиологический | 15,0 г | ||
| · Глицерин | 10,0 мл | ||
| · Вода очищенная | 1000,0 мл | ||
| рН после стерилизации | 7,2 ± 0,2 | ||
Все компоненты, кроме глицерина, растворяют в воде. Нагревают при перемешивании и кипятят 1 мин. Добавляют глицерин и стерилизуют.
Альтернативная отечественная среда для идентификации синегнойной палочки – среда № 9 для контроля микробной загрязненности, сухая, различных производителей.
Маннитно-солевой агар
| · Пептон ферментативный сухой | 10,0 г |
| · D-Маннит | 10,0 г |
| · Натрия хлорид | 75,0 г |
| · Агар микробиологический | 15,0 г |
| · Феноловый красный | 0,025 г |
| · Вода очищенная | 1000,0 мл |
| рН после стерилизации | 7,4 ± 0,2 |
Альтернативная отечественная среда для выделения и идентификации золотистого стафилококка – среда № 10 для контроля микробной загрязненности, сухая, различных производителей.
Трехсахарный агар с солями железа (Triple Sugar–Iron–Agar)
| · Мясной экстракт | 3,0 г |
| · Дрожжевой экстракт | 3,0 г |
| · Пептон (казеиновый или мясной) | 20,0 г |
| · Натрия хлорид | 5,0 г |
| · Лактозы моногидрат | 10,0 г |
| · Сахароза | 10,0 г |
| · Глюкозы моногидрат | 1,0 г |
| · Железо–аммоний цитрат | 0,3 г |
| · Натрия тиосульфат | 0,3 г |
| · Феноловый красный | 0,025 г |
| · Агар микробиологический | 12,0 г |
| · Вода очищенная | 1000,0 мл |
| рН после стерилизации | 7,4 ± 0,2 |
Среду разливают в пробирки, заполняя их на 1/3 объема. После стерилизации среду оставляют для застывания таким образом, чтобы образовались столбик и скошенная часть над ним.
Альтернативная отечественная среда для идентификации сальмонелл – среда № 13 для контроля микробной загрязненности, сухая, различных производителей.
Цитратный агар Симмонса
| · Натрия хлорид | 5,0 г |
| · Магния сульфат
· Аммония дигидрофосфат · Калия гидрофосфат · Натрия цитрат · Бромтимоловый синий · Агар микробиологический · Вода очищенная |
0,2 г
1,0 г 1,0 г 3,0 г 0,08 г 20,0 г 1000,0 мл |
| рН после стерилизации | 7,2 ± 0,2 |
Альтернативная отечественная среда для идентификации E. coli – среда № 14 для контроля микробной загрязненности, сухая, различных производителей.
Питательный агар с глюкозой
| · Триптический гидролизат казеина с содержанием аминного азота 150 мг %
· Экстракт кормовых дрожжей · Агар микробиологический · Глюкоза · Натрия хлорид · Вода очищенная |
150 мл
5,0 г 20,0 г 5,0 г 5,0 г до 1000,0 мл |
| рН после стерилизации | 7,2 ± 0,2 |
Стерилизация: при температуре 121 °С, 15 мин
Мясопептонный агар (МПА) с 0,5 % глюкозы
| · Мясная вода
· Натрия хлорид · Пептон ферментативный сухой · Агар микробиологический · Глюкоза |
1000,0 мл
5,0 г 10,0 г 20,0 г 5,0 г |
| рН после стерилизации | 7,4 ± 0,1 |
Стерилизация: при температуре 121 °С, 15 мин.
Питательный агар с 9 % натрия хлорида (солевой агар)
| · Мясная вода
· Натрия хлорид · Пептон ферментативный сухой · Агар микробиологический · Глюкоза |
1000,0 мл
5,0 г 10,0 г 20,0 г 5,0 г |
| рН после стерилизации | 7,4 ± 0,1 |
Питательный агар с 9 % натрия хлорида может быть приготовлен на основе МПА с добавлением 9 % натрия хлорида.
Мясотрипсиновый гидролизат с содержанием аминного азота (0,60 + 0,05) %
| · Мясо (говядина)
· Вода питьевая · Железа поджелудочная крупного рогатого скота · Хлороформ · Натрий углекислый кислый |
1000,0 г
2000,0 мл 130,0 г 1000,0 мл 13,0 г |
| рН после стерилизации | 7,4 ± 0,1 |
Стерилизация: при температуре 121 °С 15 мин.
Кровяной агар с добавлением дефибринированной крови
| · 2 % мясопептонный агар
· Дефибринированная кровь |
950,0 мл
50,0 мл |
| рН после стерилизации | 7,4 ± 0,1 |
В расплавленный и охлажденный до температуры 45 °С МПА добавляют дефибринированную кровь (человека, барана, кролика), перемешивают до однородного состояния и разливают по чашкам Петри.
- Приготовление дефибринированной крови. Кровь асептически собирают в стерильный сосуд, на дне которого находятся стеклянные бусы, закрывают пробкой и встряхивают 20 – 25 мин до выпадения фибрина; жидкую, не свернувшуюся часть крови, добавляют в нужном количестве к охлажденному до температуры (45 + 2) оС МПА.
Среда с мочевиной
| (содержание аминного азота (6,6 ± 0,6 г/ла) )
· Натрия хлорид · Агар микробиологический · Мочевина · Лактоза · Глюкоза · Индикатор комбинированный (Андреде с добавлением 0,35 % бромтимолового синего)б) · Вода очищенная |
80,0 мл
5,0 г 10,0 г 10,0 г 10,0 г 1,0 г 40,0 мл до 1000,0 мл |
| рН после стерилизации | 7,1 ± 0,1 |
Стерилизация: при температуре 110 оС 15 мин.
а) Приготовление сброженного казеинового гидролизата. Микробную суспензию готовят суспендированием в 0,9 % растворе натрия хлорида 24-часовой культуры E. coli М-17, выращенной на МПА. Полученную микробную суспензию доводят до 10 МЕ мутности по СО. На 1 л казеинового гидролизата добавляют 3 – 5 мл микробной суспензии, инкубируют в течение 24 ч при температуре (37 + 1) оС и стерилизуют.
б) Приготовление комбинированного индикатора Андреде. К 400 мл воды дистиллированной прибавляют 1 г фуксина кислого и 64 мл 1 М раствора натрия гидроксида, выдерживают 1 сут при температуре (37 + 1) оС и 2 сут при комнатной температуре. Хранят в бутыли темного стекла с притертой пробкой при комнатной температуре в защищенном от света месте.
При приготовлении комбинированного индикатора Андреде к 100 мл индикатора Андреде добавляют 350 мг бромтимолового синего.
Среда с мочевиной по Преусу
| · Мясотрипсиновый гидролизат с содержанием
аминного азота (0,60 ± 0,05) % а) · Агар микробиологический · Глюкоза · Мочевина (раствор 50 %-ный водный) · Бромтимоловый синий |
1000,0 мл
15,0 г 5,0 г 20,0 мл 12,0 мл |
| рН после стерилизации | 7,0 ± 0,1 |
Среда Гаузе № 2 агаризованная
| · Бульон Хоттингера с содержанием
амминного азота 700 мг% · Пептон сухой · Натрия хлорид · Глюкоза · Агар микробиологический · Вода очищенная |
30,0 мл
5,0 г 5,0 г 10,0 г 30,0 г до 1000,0 мл |
| рН после стерилизации | 7,2 ± 0,2 |
Бульон Хоттингера
| · Гидролизат Хоттингера
· Натрия хлорид · Вода очищенная |
24,0 г
5,0 г до 1000,0 мл |
| рН после стерилизации | 7,2 ± 0,2 |
Желточно-солевой агар
| · Мясопептонный агар
· Натрия хлорид · Желточная взвесь (1 желток на 200 мл 0,9 % раствора натрия хлорида) · Вода очищенная |
850,0 мл
90,0 г 150,0 мл до 1000,0 мл |
| рН после стерилизации | 7,2 ± 0,2 |
Возможно внесение изменений в составы питательных сред и замена материалов животного происхождения компонентами промышленного производства при условии подтверждения качества и валидации их применения для проведения испытаний по показателю «Микробиологическая чистота».
10. Оценка качества питательных сред
Для каждой серии коммерческой среды (сухой и готовой к использованию), а также для каждой партии среды, изготовленной в лаборатории, проводят определение ростовых, селективных и диагностических свойств.
Основными биологическими критериями качества питательных сред являются их ростовые и селективные свойства, определяемые с помощью микроорганизмов и аттестованных питательных сред. В качестве аттестованных используют готовые к употреблению среды с сертификатом производителя, а также ранее аттестованные в лаборатории среды высокого качества.
Ростовые свойства питательной среды — это способность питательной среды обеспечивать эффективный и типичный рост соответствующих тест-штаммов микроорганизмов.
Селективные свойства — это способность питательной среды подавлять рост сопутствующих микроорганизмов из микробной ассоциации.
Тест-микроорганизмы, штаммы-ассоцианты и условия инкубации для определения ростовых и селективных свойств питательных сред представлены в табл. 8.
10.1. Ростовые свойства питательных сред
10.1.1. Приготовление рабочей взвеси тест-микроорганизмов
Культуры бактерий и грибов C. albicans смывают с поверхности скошенного агара стерильным 0,9 % раствором натрия хлорида. Готовят стандартные взвеси каждого тест-штамма, соответствующие 10 МЕ по стандартному образцу мутности. Для культур B. subtilis, B. cereus и C. albicans — это концентрация 107 КОЕ/мл, для E. coli, S. abony, P. aeruginosa, S. aureus — 109 КОЕ/мл. Стандартизованные взвеси методом последующих десятикратных разведений доводят стерильным 0,9 % раствором натрия хлорида до концентрации 103 КОЕ/мл. Для определения фактической концентрации рабочих взвесей бактерий и C. albicans культуры высевают поверхностным методом из концентрации 103 КОЕ/мл по 0,1 мл на чашку Петри с соответствующей аттестованной агаризованной средой.
Для смыва конидий A. brasiliensis с агара Сабуро с глюкозой используют стерильный 0,9 % раствор натрия хлорида, содержащий 0,05 % твина-80. Количество конидий в 1 мл взвеси определяют с помощью камеры Горяева или посевом подходящего разведения на аттестованный агар Сабуро с глюкозой или среду № 2.
Для посева готовят рабочую взвесь A. brasiliensis с концентрацией конидий около 0,5 103 в 1 мл, которую высевают поверхностным методом по 0,1 мл на чашки с агаром Сабуро с глюкозой (или средой № 2).
Приготовленные рабочие взвеси тест-микроорганизмов используют для определения ростовых свойств питательных сред. Количество клеток тест-штаммов для внесения в жидкую или агаризованную питательные среды не должно превышать 102 КОЕ.
10.1.2. Испытание агаризованных сред
Испытуемую и аттестованную агаризованные среды разливают в чашки Петри диаметром 90 мм по 15 – 20 мл, подсушивая агар после застывания. По 0,1 мл рабочей взвеси тест-микроорганизма с концентрацией 103 КОЕ/мл засевают поверхностным методом на чашки Петри с испытуемой и аттестованной средами в двойной повторности.

где
N – средняя арифметическая числа колоний на чашке Петри с испытуемой средой;
Nо – средняя арифметическая числа колоний на чашке Петри с аттестованной средой.
10.1.3. Испытание жидких сред
Жидкие испытуемые и аттестованные питательные среды разливают в стерильные пробирки размером 15 × 150 мм по 10 мл. По 0,1 мл рабочей взвеси тест-штамма микроорганизма с концентрацией 103 КОЕ/мл засевают в пробирки с испытуемой и стандартной средой (по 3 пробирки для каждого вида среды). Инкубируют при соответствующей температуре в течение минимального для этого теста времени. Рост микроорганизмов определяют визуально.
10.1.4. Требование к ростовым свойствам питательных сред
Испытуемая агаризованная среда считается годной к использованию, если коэффициент прорастания не менее 0,7 по сравнению с аттестованной питательной средой.
Испытуемая жидкая среда считается годной к использованию, если на испытуемой и аттестованных средах наблюдают визуально одинаковый рост тест-штамма.
10.2. Определение селективных свойств питательных сред
10.2.1. Проведение испытания
Для определения селективных свойств питательных сред испытуемую и аттестованную среды контаминируют штаммами-ассоциантами, каждым в отдельности, с посевной дозой на 2 порядка выше, чем доза тест-штамма.
Посев на агаризованные среды проводят поверхностным методом. В 2 чашки с каждой средой (испытуемой и стандартной) вносят по 0,1 мл рабочей взвеси штамма-ассоцианта с концентрацией 105 КОЕ/мл.
Для посева на жидкие питательные среды в 2 пробирки с каждой средой вносят по 0,1 мл рабочей взвеси с концентрацией 105 КОЕ/мл штамма-ассоцианта. На всех засеянных питательных средах (в чашках Петри и пробирках) после наиболее длительного срока инкубации для этого теста при соответствующей температуре отмечают отсутствие роста штамма-ассоцианта.
10.2.2.Требование к селективным свойствам питательных сред
Испытуемая селективная среда считается годной к использованию, если при посеве штаммов-ассоциантов наблюдается полное отсутствие их роста.
10.3. Определение диагностических свойств питательных сред
10.3.1. Выполнение испытания
Испытание диагностических свойств проводят для таких питательных сред, как агар Мосселя (или среда № 4), агар Мак-Конки, ксилозо-лизин-дезоксихолат-агар (или среда № 5), цетримидный агар (или ЦПХ-агар), агар для выявления пиоцианина (или среда № 9), маннитно-солевой агар (или среда № 10), трехсахарный агар с солями железа (или среда № 13), цитратный агар Симмонса (или среда № 14).
Для подтверждения диагностических свойств питательной среды бактериологической петлей делают посев бульонной культуры тест-микроорганизмов (каждого в отдельности) на 2 чашки Петри или в 2 пробирки с испытуемой средой. После инкубации в стандартных условиях определяют характерные признаки тест-штаммов определенного вида микроорганизмов: внешний вид колоний, цвет, наличие пигмента, ореол вокруг колоний, изменение цвета среды и др. (табл. 7).
Для подтверждения селективных свойств диагностических питательных сред делают посев бульонной культуры штаммов-ассоциантов (каждого в отдельности) на испытуемую среду. После инкубации в стандартных условиях рост штаммов-ассоциантов должен отсутствовать.
10.3.2. Требование к диагностическим свойствам питательных сред
Испытуемая среда считается годной к использованию, если морфологические и диагностические признаки тест-микроорганизмов соответствуют описанию, приведенному в табл. 8, при этом рост штаммов-ассоциантов полностью отсутствует.
10.4. Стерильность питательных сред
Не менее 5 % емкостей (флаконов, пробирок) от каждой партии приготовленной питательной среды контролируют на стерильность, выдерживая их при соответствующей температуре в течение 48 – 72 ч. При обнаружении микробного роста хотя бы в одной из емкостей испытуемая партия питательной среды подлежит уничтожению.
10.5. Хранение питательных сред
Сухие питательные среды необходимо хранить герметично упакованными, в темном сухом месте при температуре 2 – 30 оС. После вскрытия упаковки на флаконе необходимо написать дату и далее хранить при комнатной температуре до окончания срока годности. Приготовленные из сухих смесей и разлитые во флаконы питательные среды хранят 1 мес при комнатной температуре или 3 мес при температуре 2 – 8 оС. Срок годности сред, разлитых в чашки Петри, составляет 7 сут при температуре 2 – 8 оС. Исключение составляет среда № 4, разлитая в чашки Петри, срок годности которой не более 3 сут при хранении без доступа света.
Таблица 8. Тест-микроорганизмы и условия инкубации для определения ростовых и селективных свойств питательных сред
Питательные среды |
Применение |
Тест–штаммы микроорганизмов |
Условия инкубации |
| 1 |
2 |
3 |
4 |
| · Соево-казеиновый агар
· Среда № 1 для выращивания бактерий |
Выделение аэробных микроорганизмов | Bacillus subtilis ATCC 6633 или Bacillus cereus ATCC 10702; Escherichia coli ATCC 8739 или АТСС 25922; Staphylococcus аureus ATCC 6538 | 72 ч
(32,5 ± 2,5) оС |
| · Бульон Сабуро | Выделение дрожжевых грибов | Candida albicahs РКПГY/NCTC 885-653 или АТСС 10231 | 5 сут
(22,5 ± 2,5) оС |
| · Агар Сабуро с глюкозой
· Среда № 2 для выращивания грибов |
Выделение дрожжевых и плесневых грибов | Candida albicahs РКПГY/NCTC 885-653 или АТСС 10231;
Aspergillus brasiliensis АТСС 9642, АТСС 16404 ВКМF1119 или A. niger РКПГF106 |
5 сут
(22,5 ± 2,5) оС |
| · Бульон Мосселя
· Бульон Мак-Конки · Среда № 3 |
Обогащение энтеробактерий | Escherichia coli ATCC 8739 или АТСС 25922;
Salmonella enterica subsp. enterica serovar abony IHE 103/39 или NCTC 6017 Штаммы-ассоцианты: Staphylococcus аureus ATCC 6538 |
24– 48 ч
(32,5 ± 2,5) оС |
| · Агар Мак-Конки
· Агар Мосселя · Среда № 4 для выделения энтеробактерий |
Выделение энтеробактерий | Escherichia coli ATCC 8739 или АТСС 25922; Salmonella enterica subsp.enterica serovar abony IHE 103/39 или NCTC 6017
Штаммы-ассоцианты для определения селективных свойств: Staphylococcus аureus ATCC 6538 |
24 – 48 ч
(32,5 ± 2,5) оС |
| · Ксилоза-лизин-дезоксихолат агар
· Висмут-сульфитный агар · Среда № 5 для идентификации бактерий рода Salmonella |
Выделение бактерий
рода Salmonella |
Salmonella enterica ssp. enterica serovar abony IHE 103/39 или NCTC 6017
Штаммы-ассоцианты для определения селективных свойств: Escherichia coli ATCC 8739 или АТСС 25922; Staphylococcus аureus ATCC 6538 или Bacillus cereus ATCC 10702 |
24 – 48 ч
(32,5 ± 2,5) оС |
| · Cоево-казеиновый бульон
· Среда № 8 для выращивания бактерий |
Накопление аэробных бактерий | Bacillus cereus ATCC 10702 или Bacillus subtilis ATCC 6633; Escherichia coli ATCC 8739 или АТСС 25922; Staphylococcus аureus ATCC 6538; Pseudomonas aeruginosa ATCC 9027 | 24 ч
(32,5 ± 2,5) оС |
| · Агар для выявления пиоцианина P. aeruginosa
· Среда № 9 для идентификации P. aeruginosa |
Выделение P. aeruginosa | Pseudomonas aeruginosa ATCC 9027 | 24 – 48 ч
(32,5 ± 2,5) оС |
| · Цетримидный агар
· ЦПХ-агар для выделения P. aeruginosa |
Идентификация P. aeruginosa | Pseudomonas aeruginosa ATCC 9027
Штаммы-ассоцианты для определения селективных свойств: Escherichia coli ATCC 8739 или АТСС 25922; Staphylococcus аureus ATCC 6538 |
24 – 48 ч
(32,5 ± 2,5) оС |
| · Маннитно-солевой агар
· Среда № 10 для идентификации S. aureus |
Идентификация
S. aureus |
Staphylococcus аureus ATCC 6538; Staphylococcus еpidermidis АТСС 14990 или АТСС 1228
Штамм-ассоциант для определения селективных свойств: Pseudomonas aeruginosa ATCC 9027 |
48 ч
(32,5 ± 2,5) оС |
| · Бульон Раппопорта – Вассилиадиса | Обогащение бактерий рода Salmonella | Salmonella enterica subsp. enterica serovar abony IHE 103/39 или NCTC 6017 | 24 ч
(42,5 ± 2,5) оС |
| · Трехсахарный агар с солями железа
· Среда № 13 для идентификации бактерий рода Salmonella |
Идентификация бактерий рода Salmonella | Salmonella enterica subsp. enterica serovar abony IHE 103/39 или NCTC 6017; Escherichia coli ATCC 8739 или АТСС 25922 | 24 ч
(32,5 ± 2,5) оС |
| · Цитратный агар Симмонса
· Среда № 14 для идентификации E. coli |
Идентификация E. coli | Escherichia coli ATCC 8739 или АТСС 25922;
Salmonella enterica subsp. enterica serovar abony IHE 103/39 или NCTC 6017 |
24 ч
(32,5 ± 2,5) оС |
11. Особенности проведения испытаний иммунобиологических лекарственных средств (ИЛС), содержащих живые микроорганизмы
Пробиотики медицинского применения
11.1. Отбор проб
Испытания проводятся в асептических условиях.
От каждой серии ЛС отбирают по 10 единиц (флаконов, капсул, таблеток, суппозиториев)/г препарата не менее чем из 5 различных упаковок, при увеличении серии – дополнительно по 1 флакону (капсуле, таблетки, суппозиторию т.д.) от каждой тысячи.
Две единицы испытуемого препарата (флаконы, капсулы, таблетки, суппозитории и т.д.) объединяют в 1 образец, если нет других указаний в нормативной документации.
Суспензии – содержимое 2 флаконов объединяют в 1 образец, перемешивают пипеткой 8 – 10 раз и получают исходное разведение.
Лиофилизаты для приготовления растворов или суспензий для приема внутрь и местного применения – содержимое каждого флакона разводят стерильным 0,9 % раствором натрия хлорида из расчета 1 мл на 1 дозу. Объединяют полученную суспензию из 2 флаконов, перемешивают 8 – 10 раз и получают исходное разведение.
Таблетки – каждый образец (2 таблетки) предварительно асептически растирают в ступке до гомогенного состояния (или в пробирке до состояния порошка) и дробно добавляют 20 мл стерильного 0,9 % раствора натрия хлорида, перемешивают и получают разведение 1:10.
Порошки – каждый образец (содержимое 2 саше) помещают в колбу, добавляют 20 мл стерильного 0,9 % раствора натрия хлорида, перемешивают и получают разведение 1:10.
Капсулы – каждый образец (2 капсулы) вносят в пробирки, добавляют 20 мл предварительно нагретого до температуры (39 ± 1) оС стерильного 0,9 % раствора натрия хлорида и перемешивают.
Суппозитории – каждый образец (2 суппозитория) помещают в пробирки, добавляют предварительно нагретый до температуры (39 ± 1) оС стерильный 0,9 % раствор натрия хлорида до общего объема 20 мл и перемешивают.
Пробирки с капсулами или суппозиториями помещают на водяную баню при температуре (39 ± 1) оС. Через 10 – 30 мин содержимое пробирок перемешивают до гомогенного состояния, получая разведение 1:10.
Условия проведения испытания на микробиологическую чистоту препаратов пробиотиков представлены в табл. 9-10.
11.2. Методы проведения анализа
11.2.1. Метод прямого посева
Из полученной суспензии испытуемого образца соответствующего разведения по 1 мл высевают на чашки Петри или в широкие (d = 20 мм, h = 200 мм) пробирки (флаконы) со скошенными столбиками питательной среды.
На чашках Петри суспензию распределяют по всей поверхности питательной среды без применения шпателя (осторожными вращательными движениями). Чашки выдерживают 30 – 40 мин на плоскости стола, не переворачивая, до полного впитывания суспензии в агар, после чего переворачивают вверх дном и инкубируют в термостате.
На средах, скошенных в пробирках (флаконах), посев распределяют путем обкатки и инкубируют в термостате сначала в горизонтальном положении – 2 сут, а в оставшийся период – в вертикальном.
Посев суспензии в пробирки со скошенным агаром с мочевиной делают пастеровской пипеткой уколом до дна пробирки, а остатки посевного материала при выведении пипетки растирают по поверхности скошенной части столбика среды и инкубируют в термостате.
Посев образцов препаратов, в которых не допускается присутствие посторонних микроорганизмов и грибов или допускается не более 50 КОЕ/единицу препарата, производят из исходного разведения испытуемого образца. Посев образцов препаратов, в которых допускается общее количество аэробных микроорганизмов 102 КОЕ/единицу препарата, осуществляют из разведения 1:10 (10-1) испытуемого образца.
Препараты, в состав которых входят живые колибактерии: на чашки Петри с агаром Эндо высевают по 0,5 мл суспензии исходного разведения испытуемого образца. Материал распределяют по поверхности среды шпателем Дригальского, затем тем же шпателем производят посев на новую чашку Петри с агаром Эндо для получения изолированных колоний.
При испытании препаратов, в которых не допускается контаминация, перед посевом на среды из каждого образца делают мазки, которые затем, в зависимости от присутствующих в них пробиотических бактерий, окрашивают по Граму или по Цилю-Нильсену, и микроскопируют. Мазок исследуют в 10 полях зрения. В микропрепарате должны присутствовать только характерные для исследуемого образца пробиотика бактерии.
11.2.2. Метод определения степени контаминации аэробными микроорганизмами
Для определения степени контаминации аэробными бактериями готовят дополнительное разведение, для чего 1 мл микробной суспензии из исходного разведения или из разведения 1 : 10 (в зависимости от лекарственной формы и предельно допустимых значений норм микробной контаминации) переносят в пробирки с 9 мл 0,9 % раствора натрия хлорида и перемешивают 8 – 10 раз, получая следующее разведение, т.е. 10-1 или 10-2 соответственно. Затем производят посев на чашки Петри по 1 мл из разведения 10-1 и 10-2 (или из исходного разведения и 10-1) на 2 чашки для каждого разведения.
Посев образцов препаратов, в которых допускается общее количество аэробных микроорганизмов 102 КОЕ в единице препарата, проводят из разведения 10-1 и 10-2. Посев образцов препаратов, в которых допускается общее количество аэробных микроорганизмов не более 50 КОЕ/единицу препарата, проводят из исходного разведения и 10-1.
11.2.3. Метод посева штрихом
Чашку Петри с агаризованной питательной средой делят на 4 – 5 секторов. Посев из исходного разведения испытуемого образца начинают в первом секторе, тщательно втирая взвесь петлей в агар. Затем этой же петлей продолжают посевы во втором и последующих секторах. В последних секторах должны расти изолированные колонии.
11.2.4. Метод определения наличия фага в колисодержащих препаратах
По 1,0 мл исходного разведения испытуемого образца высевают на чашки Петри с МПА. Посевной материал распределяют по всей поверхности среды, покачивая чашку Петри, чтобы получить сплошной газон. Остатки суспензии удаляют стерильной пастеровской пипеткой. Закрытые чашки с посевами выдерживают на столе, не переворачивая, 30 – 40 мин (до полного впитывания суспензии в агар), после чего их переворачивают вверх дном и инкубируют в термостате при температуре (20 ± 2) оС в течение (19 ± 1) ч.
По окончании инкубации чашки просматривают на наличие зон фаголизиса. Если на фоне роста E. coli на поверхности чашки Петри обнаруживаются зоны фаголизиса любого размера и формы, производят повторный посев на удвоенном количестве образцов.
11.3. Подготовка питательных сред, используемых при определении микробной контаминации препаратов-пробиотиков
Готовые питательные среды расплавляют на водяной бане, охлаждают до температуры (45 ± 1) оС, разливают по 25 мл в чашки Петри диаметром 90 мм, установленные на ровной поверхности. Кровяной агар разливают слоем 1,5 – 2 мм.
После застывания питательной среды закрытые чашки Петри вверх дном помещают в термостат при температуре (37 ± 1) оС на 48 ч для подсушивания и контроля стерильности питательной среды.
Чашки со средой Эндо подсушивают в ламинарном боксе (под ламинарным потоком воздуха) с открытыми крышками в течение 45 – 50 мин.
Питательные среды в широких пробирках (d = 20 мм, h = 200 мм) или флаконах расплавляют и столбик питательной среды скашивают.
11.4. Учет полученных результатов
Через 72 ч после начала инкубирования посевов и окончательно через 5 – 8 сут подсчитывают число колоний бактерий (допустимой аэробной микрофлоры) на 2 чашках (каждого разведения), находят среднее значение (для колоний, выросших на 2 чашках одного разведения) и, умножая его на показатель разведения, вычисляют число бактерий в 1 таблетке (капсуле, суппозитории и др.) или в 1 г.
Если при посеве образца из разведений 10-1 и 10-2 нет роста, результат отмечают следующим образом: «В 1 капсуле (таблетке, суппозитории и.д.) менее 10 КОЕ бактерий».
При обнаружении в посевах роста условно-патогенных бактерий (энтеробактерий, протеев, гемолизирующих бактерий и др.) и грибов, считают, что качество препарата не соответствует требованиям по показателю «Микробиологическая чистота».
Если количество аэробных микроорганизмов превышает допустимый предел количества КОЕ в 1 таблетке (капсуле, суппозитории и т.д.), то контроль повторяют на удвоенном количестве образцов.
Таблица 9. Условия проведения испытания на микробиологическую чистоту препаратов пробиотиков, в которых не допускаются микроорганизмы-контаминанты (суспензии и лиофилизаты для приготовления растворов или суспензий для приема внутрь и местного применения)
| Группировочное название | Питательные среды | Чашки,
пробирки |
Условия
инкубирования |
Учитываемые
микроорганизмы |
Учет результатов |
| Бифидосодержащие препараты | МПА или
ГРМ-агар |
Пробирки
(или чашки Петри) |
(37 ± 1) оС
8 сут |
Аэробные
микроорганизмы |
Не должно быть роста |
| Питательный агар с глюкозой или МПА с 0,5 % глюкозы | Пробирки
(или чашки Петри) |
(37 ± 1) оС
8 сут |
Аэробные
микроорганизмы |
||
| Агар Сабуро | Пробирки
(или чашки Петри) |
(22 ± 2) оС
8 сут |
Дрожжевые и плесневые грибы | ||
| Лактосодержащие препараты
(лактобактерии — микроаэрофилы) |
МПА | Чашки Петри (или пробирки) | (37 ± 1) оС
8 сут |
Аэробные
микроорганизмы |
Не должно быть роста |
| Агар Сабуро | Пробирки
(или чашки Петри) |
(22 ± 2) оС
8 сут |
Дрожжевые и плесневые грибы | ||
| Лактосодержащие препараты
(лактобактерии — факультативные анаэробы) |
Питательный агар с 9 % натрия хлорида | Пробирки
(или чашки Петри) |
(37 ± 1) оС
8 сут |
Аэробные
микроорганизмы |
Не должно быть роста |
| Агар Сабуро с антибиотиками | Пробирки
(или чашки Петри) |
(22 ± 2) оС
8 сут |
Дрожжевые и плесневые грибы | ||
| Агар Эндо | Чашки Петри | (37 ± 1) оС
24 – 48 ч |
Представители
семейства Enterobacteriaceae |
||
| МПА | Пробирки (или чашки Петри) | (37 ± 1) оС
8 сут |
Аэробные
микроорганизмы |
Не должно быть роста бактерий-контаминантов
(допускается рост лактобактерий в виде мелких сероватых полупрозрачных колоний, образующих сплошной газон) |
|
| Колисодержащие препараты | Питательный агар с 9 % натрия хлорида | Пробирки
(или чашки Петри) |
(37 ± 1) оС
8 сут |
Аэробные
микроорганизмов |
Не должно быть роста |
| Агар Сабуро с антибиотиками | Пробирки
(или чашки Петри) |
(22 ± 2) оС
8 сут |
Дрожжевые и плесневые грибы | ||
| Агар Эндо | Чашки Петри | (37 ± 1) оС
(19 ± 1) ч |
Лактозонегативные представители семейства Enterobacteriaceae | Не должно быть роста лактозонегативных колоний | |
| МПА (контроль на отсутствие фаголизиса) | Чашки Петри | (20 ± 2) оС
(19 ± 1) ч |
Для контроля контаминации фагом | Не должно быть зон фаголизиса (для препаратов с содержанием E. coli не менее 1010 допускается не более 10 БОЕ бактериофага) | |
| Препараты, содержащие бактерии рода Bacillus
(споровые пробиотики) |
Агар Сабуро | Чашки Петри | (22 ± 2) оС
8 сут |
Дрожжевые и плесневые грибы | Не должно быть роста бактерий-контаминантов (возможен рост бактерий рода Bacillus – гладкие белые или с желтовато-розовым оттенком колонии) |
| Агар Эндо | Чашки Петри | (37 ± 1) оС
24 — 48 ч |
Представители
семейства Enterobacteriaceae |
Не должно быть роста бактерий-контаминантов (возможен рост бактерий рода Bacillus — мелкие бесцветные или с оттенком от слабо-розового до красноватого колонии) | |
| Среда Гаузе № 2 | Чашки Петри | (37 ± 1) оС
8 сут |
Аэробные микроорганизмы | Не должно быть роста бактерий-контаминантов (возможен рост бактерий рода Bacillus — шероховатые с фестончатыми краями розовато-бежевые и гладкие белые колонии) | |
| Кровяной агар | Чашки Петри | (37 ± 1) оС
24 – 48 ч |
Аэробные
микроорганизмы |
Не должно быть роста бактерий-контаминантов (возможен рост бактерий рода Bacillus — шероховатые с фестончатыми краями серовато-розовые и гладкие бежево-коричневые колонии, без гемолиза) | |
| Среда с мочевиной и индикатором Андреде или по Преусу | Пробирки | (37 ± 1) оС
72 ч |
Бактерии рода Proteus | Не допускается изменение цвета среды (возможен рост бактерий рода Bacillus – мелкие бесцветные колонии, возможно покраснение среды) | |
| Желточно-солевой агар (или среда № 10) | Чашки Петри | (37 ± 1) оС
72 ч |
Стафилококки | Не должно быть роста бактерий-контаминантов (возможен рост бактерий рода Bacillus – круглые белые, хорошо снимающиеся колонии) | |
Примечание. При появлении сомнительных колоний производят микроскопическое исследование.
Таблица 10. Условия проведения испытания на микробиологическую чистоту препаратов пробиотиков, в которых допускается содержание посторонних микроорганизмов и грибов (суппозитории, таблетки, капсулы)
| Группировочное название/ лекарственная форма | Питательные среды | Чашки,
пробирки |
Условия
инкубирования |
Учитываемые
микроорганизмы |
Учет результатов |
| Бифидосодержащие
препараты |
МПА | Чашки Петри | (37 ± 1) оС
8 сут |
Аэробные
бактерии |
Подсчитывают число бактериальных колоний допустимых бактерий-контаминантов |
| Среда Эндо | Чашки Петри | (37 ± 1) оС
24 – 48 ч |
Бактерии семейства Enterobacteriaceae | Не должно быть роста | |
| Кровяной агар | Чашки Петри | (37 ± 1) оС
24 – 48 ч |
Гемолизирующие
микроорганизмы |
Не должно быть колоний, окруженных
зоной гемолиза |
|
| Среда с мочевиной и индикатором Андреде или по Преусу | Пробирки | (37 ± 1) оС
24 – 48 ч |
Бактерии рода
Proteus |
Не допускается изменение цвета среды | |
| Агар Сабуро | Чашки Петри | (22 ± 2) оС
8 сут |
Дрожжевые и плесневые грибы | Не должно быть
роста |
|
| Среда № 9 | Чашки Петри | (37 ± 1) оС
24 – 48 ч |
Pseudomonas aeruginosa | ||
| Среда № 10 | чашки Петри | (37 ± 1) оС
24 – 48 ч |
Staphylococcus aureus | ||
| Лактосодержащие препараты
(лактобактерии — микроаэрофилы) |
МПА или
среда № 1 |
Чашки Петри | (37 ± 1) оС
8 сут |
Аэробные
микроорганизмы |
Подсчитывают число бактериальных колоний допустимых бактерий-контаминантов |
| Среда Эндо | Чашки Петри | (37 ± 1) оС
24 – 48 ч |
Бактерии семейства Enterobacteriaceae | Не должно быть роста | |
| Кровяной агар | Чашки Петри | (37 ± 1) оС
24 – 48 ч |
Гемолизирующие
микроорганизмы |
Не должно быть колоний, окруженных зоной гемолиза | |
| Среда с мочевиной и индикатором Андреде или по Преусу | Пробирки | (37 ± 1) оС
24 – 48 ч |
Бактерии рода
Proteus |
Не допускается изменение цвета среды | |
| Агар Сабуро
или среда № 2 |
Чашки Петри | (22 ± 2) оС
8 сут |
Дрожжевые и
плесневые грибы |
Не должно быть
роста |
|
| Среда № 9 | Чашки Петри | (37 ± 1) оС
24 – 48 ч |
Pseudomonas aeruginosa | ||
| Среда № 10 | Чашки Петри | (37 ± 1) оС
24 – 48 ч |
Staphylococcus aureus | ||
| Лактосодержащие препараты
(лактобактерии – факультативные анаэробы) |
Питательный агар с 9 % натрия хлорида | Чашки Петри | (37 ± 1) оС
8 сут |
Аэробные
микроорганизмы |
Подсчитывают число бактериальных колоний допустимых бактерий-контаминантов |
| Среда Эндо | Чашки Петри | (37 ± 1) оС
24 – 48 ч |
Бактерии семейства
Enterobacteriaceae |
Не должно быть роста | |
| Кровяной агар | Чашки Петри | (37 ± 1) оС
24 – 48 ч |
Гемолизирующие микроорганизмы | Не должно быть колоний, окруженных зоной гемолиза | |
| Среда с мочевиной и индикатором Андреде или по Преусу | Пробирки | (37 ± 1) оС
24 – 48 ч |
Бактерии рода Proteus | Не допускается изменение цвета среды | |
| Агар Сабуро с антибиотиками | Чашки Петри | (37 ± 1) оС
8 сут |
Дрожжевые и плесневые грибы | Не должно быть роста |
12. Определение микробиологической чистоты воды
12.1. Вода для инъекций (ангро)
Общее число аэробных микроорганизмов (бактерий и грибов) не более 10 КОЕ в 100 мл. Не допускается наличие Еscherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa в 100 мл.
Для анализа микробиологической чистоты воды для инъекций отбирают образец в объеме не менее 1000,0 мл.
Исследование проводят методом мембранной фильтрации в асептических условиях. Для посева используют мембранные фильтры из нитроцеллюлозы с диаметром пор не более 0,45 мкм и внешним диаметром 47 мм. Для смачивания фильтра применяют стерильный 0,9 % раствор натрия хлорида (не менее 5 мл).
Для определения общего числа аэробных микроорганизмов фильтруют 100 мл воды для инъекций в двойной повторности. После окончания фильтрации каждый фильтр переносят в чашки Петри на поверхность агаризованной среды R2A следующего состава:
| Гидролизат казеина | 0,5 г |
| · Дрожжевой экстракт | 0,5 г |
| · Протеозный пептон | 0,5 г |
| · Глюкоза | 0,5 г |
| · Крахмал растворимый | 0,5 г |
| · Калия гидрофосфат | 0,3 г |
| · Магния сульфат | 0,024 г |
| · Натрия пируват | 0,3 г |
| · Агар микробиологический | 15,0 г |
| · Вода очищенная | 1000,0 мл |
| рН после стерилизации | 7,2 ± 0,2 |
Посевы инкубируют в термостате при температуре (32,5 ± 2,5) оС в течение 5 сут. Производят подсчет колоний через 48 – 72 ч (предварительные результаты), через 5 сут (окончательные результаты) и определяют среднее арифметическое число аэробных микроорганизмов (бактерий и грибов суммарно) в 100 мл воды.
Для определения общего числа аэробных микроорганизмов допустимо использовать соево-казеиновый агар или среду № 1 для выделения бактерий, агар Сабуро или среду № 2 – для выращивания грибов.
Для определения Еscherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa фильтруют 100 мл воды в двойной повторности. В соответствии с получаемыми результатами для определения каждого микроорганизма допустима фильтрация 200 мл воды очищенной через один фильтр.
После окончания фильтрации 2 фильтра переносят в чашки Петри на поверхность агаризованной среды Эндо (среда № 4). Посевы инкубируют при температуре (32,5 ± 2,5) оС в течение 24 ч. Микроскопируют — малиново-красные колонии с металлическим блеском или без него, окруженные малиновыми зонами преципитации, неслизистые. При обнаружении в мазках грамотрицательных палочек отдельные колонии отсевают на скошенный в пробирках соево-казеиновый агар (среду № 1) и инкубируют в течение 18 – 24 ч. После инкубации проводят идентификацию в соответствии с п.8*. Если в образце обнаружены грамотрицательные неспорообразующие бактерии в виде палочек, не содержащие фермент цитохромоксидазу, не утилизирующие натрия цитрат и образующие индол, считают, что вода контаминирована E. сoli.
Следующие 2 мембранных фильтра переносят в чашки Петри на поверхность агаризованной среды № 9. Посевы инкубируют при температуре (32,5 ± 2,5) оС в течение 24 – 48 ч. При наличии на фильтрах, помещенных на среду № 9, колоний бактерий, выделяющих в агар сине-зеленый пигмент пиоцианин, проводят микроскопирование и идентификацию в соответствии с п.8*. Если в образце обнаружены грамотрицательные неспорообразующие бактерии в виде палочек, выделяющие сине-зеленый пигмент пиоцианин, обладающие ферментом цитохромоксидазой и растущие при температуре (42 ± 1) оС, считают, что вода контаминирована P. aeruginosa.
Для определения S. аureus 2 мембранных фильтра переносят в чашки Петри на поверхность питательной среды – маннитно-солевой агар или среда № 10 – и инкубируют в течение 24 – 48 ч. Золотисто-желтые колонии, окруженные желтыми зонами, отсевают на соево-казеиновый агар или среду № 1. Проводят микроскопирование и идентификацию в соответствии с п.8*. Если в образце обнаружены грамположительные кокки, расположенные в виде гроздьев, ферментирующие маннит (маннитно-солевой агар, среда № 10), содержащие фермент коагулазу, считают, что образец воды контаминирован S. аureus.
Примечание. * — Для идентификации могут быть использованы другие методы (тест-системы, автоматические анализаторы и др.).
12.2. Вода очищенная
Общее число аэробных микроорганизмов (бактерий и грибов) не более 100 КОЕ в 1 мл. Не допускается наличие Еscherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa в 100 мл.
Для анализа микробиологической чистоты воды очищенной отбирают образец в объеме не менее 1000 мл.
Для определения общего числа аэробных микроорганизмов фильтруют следующие объемы воды очищенной: 1 мл , 10 мл и 100 мл (в двойной повторности). Допускается для проведения испытания использовать один объем воды, выбранный в соответствии с получаемыми результатами. Далее анализ выполняют в соответствии с п.12.1.
