Ионометрия (ОФС.1.2.1.0004.15)
Государственная фармакопея 13 издание (ГФ XIII)
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Взамен ГФ XII, ч.1, ОФС42-0048-07
Метод ионометрии основан на измерении активности (концентрации) определяемых ионов с помощью ионоселективных (индикаторных) электродов. Ионоселективный электрод обладает избирательной чувствительностью к определенному виду ионов, от содержания которых зависит его потенциал. В основу ионометрии положен принцип потенциометрического анализа, заключающийся в измерении разности потенциалов (электродвижущей силы) индикаторного ионоселективного электрода и электрода сравнения, потенциал которого постоянен.
Зависимость электродвижущей силы электродной системы от активности потенциалопределяющего иона описывается уравнением Нернста:

где:
- Е – разность потенциалов между измерительным электродом и электродом сравнения (электродвижущей силы), мВ;
- Е0 – стандартное значение электродвижущей силы при а=1, мВ;
- R – универсальная газовая постоянная, Дж/(моль∙K);
- T – абсолютная температура, К;
- F – число Фарадея, Кл/моль;
- z – заряд определяемого иона;
- а – активность или эффективная концентрация свободных ионов в растворе, связанная с концентрацией соотношением:
а = f ∙ C (2),
где:
С – молярная концентрация, моль/л;
f – коэффициент активности.
Для очень разбавленных растворов коэффициент активности близок к единице и активность ионов равна концентрации.
Если коэффициент активности поддерживается постоянным, уравнение Нернста принимает вид:
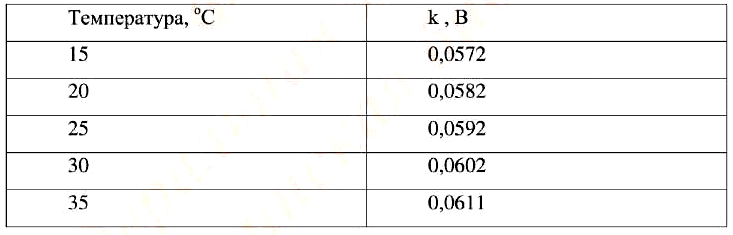
Коэффициент k и приведен в табл. 1.

Таблица 1. Значения k при различных температурах
Коэффициент активности (f) считается постоянным, если при измерениях во всех анализируемых и калибровочных растворах поддерживается одинаковая ионная сила. Для создания постоянной ионной силы к раствору добавляют раствор индифферентного электролита (фоновый раствор) с концентрацией в 10-100 раз больше, чем суммарная концентрация других ионов в растворе, с тем, чтобы различные количества анализируемого иона не влияли на ионную силу раствора и коэффициент активности определяемого иона оставался постоянным.

Таким образом, при постоянной ионной силе раствора и постоянной температуре наблюдается линейная зависимость электродвижущей силы электродной системы от концентрации определяемого иона.
Измерение активности и концентрации ионов
Ионометрические измерения осуществляют с использованием ионометра (высокоомного вольтметра с входным сопротивлением по крайней мере в 100 раз большим, чем сопротивление используемых электродов), который включает в себя электродную систему и измерительный преобразователь.
В качестве ионоселективных электродов могут использоваться электроды с жидкой (пластифицированные электроды) или с твердой мембраной (монокристаллические, поликристаллические или стеклянные электроды), электроды с заряженными (положительно или отрицательно) или нейтральными подвижными носителями, сенсибилизированные электроды (электроды с ферментативной подложкой, газ-индикаторные электроды). Электродом сравнения служит, главным образом, хлорсеребряный электрод или каломельный электрод с соответствующими индифферентными соединительными жидкостями.
Показания прибора снимают в милливольтах или в единицах рХ. Подготовка ионометра к работе и проведение измерений производятся согласно инструкциям, прилагаемым к прибору. Измерения выполняют при постоянной температуре ± 0,5 ºC и постоянной ионной силе раствора. Помещают электроды в испытуемый раствор и снимают установившееся показание при медленном и постоянном перемешивании.
При частых измерениях периодически проверяют стабильность отклика и линейность градуировочного графика в диапазоне концентраций испытуемого раствора. В противном случае проверку проводят перед каждым измерением.
1. Метод градуировочного графика
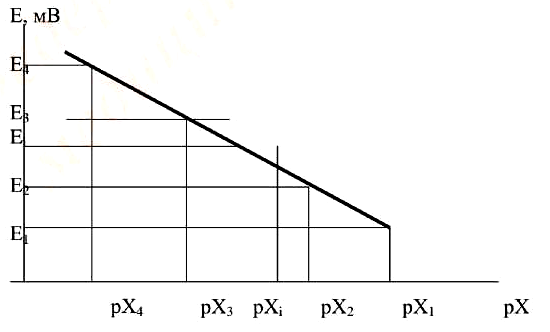
Метод градуировочного графика заключается в построении графика зависимости электродвижущей силы электродной системы от логарифма концентрации стандартных растворов и последующем нахождении концентрации испытуемого раствора по измеренному в нем значению электродвижущей силы электродной системы. Градуировочный (калибровочный) график строится микропроцессором измерительного преобразователя автоматически на основе введенных в него значений электродвижущей силы электродной системы и соответствующих им значений рХ при калибровке иономера в стандартных растворах (двух и более). Подбор концентраций стандартных растворов должен соответствовать диапазону концентраций испытуемых растворов: крайние значения концентраций испытуемых растворов должны находиться внутри линейной области калибровочного графика. Значение рХ в испытуемом растворе находится автоматически с использованием градуировочного графика по измеренному значению электродвижущей силы электродной системы (Е) – рис.1.
Рисунок 1. Градуировочный график зависимости электродвижущей силы электродной системы от концентрации потенциалопределяющего иона.
Поскольку в разбавленных растворах рХ = — lgC, значение молярной концентрации (моль/л) вычисляют по уравнению:
С = 10 –рХ (6),
Значение массовой концентрации иона (г/л) рассчитывают, исходя из уравнения:
С = М ∙ 10-рХ (7),
где:
М – молярная масса иона, г/моль.
При наличии влияния других компонентов испытуемого раствора на потенциал ионоселективного электрода используют метод стандартных добавок.
2. Метод стандартных добавок
Метод применим в линейных областях калибровочной кривой.
2.1. Метод многократных добавок
В испытуемый раствор объемом V, приготовленный, как указано в фармакопейной статье, вводят несколько (не менее трех) порций объемом V0 ( V0 ≤ 0,01*V) раствора с известной концентрацией определяемого иона, соблюдая условие неизменной ионной силы в растворе. Измеряют потенциал до и после каждой добавки и вычисляют разность ΔЕ между потенциалом, измеренным после добавки раствора с известной концентрацией, и исходным потенциалом испытуемого раствора. Полученная величина связана с концентрацией определяемого иона уравнением:

где:
V — объем испытуемого раствора, л;
C – молярная концентрация определяемого иона в испытуемом растворе, моль/л;
V0. — добавленный объем стандартного раствора, л;
C0. — концентрация определяемого иона в стандартном растворе, моль/л;
S — крутизна электродной функции, определяемая экспериментально при постоянной температуре измерением разности потенциалов двух стандартных растворов, концентрации которых отличаются в 10 раз и соответствуют линейной области калибровочной кривой, мВ.
Строят график зависимости 10ΔЕ/S от объема добавки V0. и экстраполируют полученную прямую до пересечения с осью абсцисс. В точке пересечения концентрация испытуемого раствора определяемого иона выражается уравнением:

2.2 Метод однократной добавки
К объему V испытуемого раствора, приготовленного как описано в фармакопейной статье, прибавляют объем V0. стандартного раствора с концентрацией C0.. Готовят контрольный раствор в тех же условиях. Измеряют потенциалы испытуемого и контрольного раствора до и после добавления стандартного раствора. Вычисляют концентрацию C анализируемого иона, используя следующее уравнение и делая необходимые поправки на контрольный раствор:

V — объем испытуемого или контрольного раствора, л;
C — концентрация определяемого иона в испытуемом растворе, моль/л;
V0 — добавленный объем стандартного раствора, л;
C0 — концентрация определяемого иона в стандартном растворе, моль/л;
ΔЕ — разность потенциалов, измеренных до и после добавки, мВ;
S — крутизна электродной функции, определяемая экспериментально при постоянной температуре измерением разности потенциалов двух стандартных растворов, концентрации которых отличаются в 10 раз и соответствуют линейной области калибровочной кривой, мВ.
3. Потенциометрическое определение рН
Водородным показателем рН, характеризующим концентрацию ионов водорода в водных растворах, называется отрицательный десятичный логарифм активности ионов водорода
рН = — lg aH+ (12)
Потенциометрическое определение рН заключается в измерении электродвижущей силы электродной системы, где в качестве ионоселективного электрода используют чувствительный к ионам водорода электрод (обычно стеклянный), в качестве электрода сравнения – стандартный электрод с известной величиной потенциала (насыщенный каломельный или хлорсеребряный электроды). На практике для измерения рН применяют метод градуировочного графика. рН испытуемого раствора связан с рН стандартного раствора следующим уравнением:

где:
Е – потенциал электрода в испытуемом растворе, мВ;
ЕS – потенциал того же электрода в растворе с известным значением рН (стандартном растворе), мВ;
k — коэффициент, который означает изменение электродвижущей силы на единицу изменения рН, мВ;
pHs – pH стандартного раствора.
Прибор. В качестве прибора для потенциометрического определения рН используют иономеры или рН-метры с чувствительностью не менее 0,05 единиц рН или 3 мВ. Калибровка приборов производится по стандартным буферным растворам, приведенным в общей фармакопейной статье «Буферные растворы».
Методика. Все измерения проводят при одной и той же температуре в интервале от 20 до 25 ºС, если нет других указаний в фармакопейной статье. В табл. 2 приведена зависимость значений рН от температуры для различных стандартных буферных растворов, используемых для калибровки прибора. Для приготовления указанных растворов могут быть использованы стандарт-титры для приготовления буферных растворов — рабочих эталонов рН (фиксаналы) промышленного производства.
Таблица 2. рН стандартных буферных растворов при различных температурах

Если необходимо, учитывают температурные поправки в соответствии с инструкцией предприятия-производителя. Прибор калибруют при помощи буферного раствора калия гидрофталата (первичный стандарт) и одного из буферных растворов с другим значением рН (предпочтительно одного из приведенных в табл. 2). Показания прибора для третьего буферного раствора с промежуточным значением рН не должны отличаться больше, чем на 0,05 единиц рН от табличного значения рН этого раствора. Электроды прибора погружают в испытуемый раствор и измеряют рН в тех же условиях, что и для буферных растворов.
Все испытуемые растворы и стандартные буферные растворы должны быть приготовлены на воде очищенной, не содержащей углерода диоксид, для чего перед употреблением ее необходимо прокипятить. Вода, не содержащая углерода диоксид, должна иметь рН 5,8 — 7,0.
Приготовление стандартных буферных растворов
0,05 М раствор калия тетраоксалата. 12,61 г KC4H3O8∙ 2H2O растворяют в воде и доводят объем раствора тем же растворителем до
1000,0 мл.
Насыщенный при 25 °С раствор калия гидротартрата. Избыток КС4Н5О6 энергично встряхивают с водой при температуре 25 °С в течении 30 мин. Фильтруют или декантируют. Раствор используют свежеприготовленным.
0,05 М раствор калия дигидроцитрата. 11,41 г KС6Н7О7 растворяют в воде и доводят объем раствора тем же растворителем до 1000,0 мл. Раствор используют свежеприготовленным.
0,05 М раствор калия гидрофталата. 10,13 г KC8Н5О4, предварительно высушенного при температуре от 110 до 135 °С до постоянной массы, растворяют в воде и доводят объем раствора тем же растворителем до
1000,0 мл.
0,025 М раствор калия фосфата однозамещенного и 0,025 М раствор динатрия гидрофосфата безводного. 3,39 г KН2РО4 и 3,53 г Na2HPO4, предварительно высушенных в течение двух часов при температуре от 110 до 130 °С до постоянной массы, растворяют в воде и доводят объем раствора тем же растворителем до 1000,0 мл.
0,0087 М раствор калия фосфата однозамещенного и 0,0303 М раствор динатрия гидрофосфата безводного. 1,18 г KH2PO4 и 4,30 г Na2HPO4, предварительно высушенных при температуре от 110 до 130 °С, растворяют в воде и доводят объем раствора тем же растворителем до 1000,0 мл.
0,01 М раствор натрия тетрабората. 3,80 г Na2B4O7 · 10H2O растворяют в воде и доводят объем раствора тем же растворителем до 1000,0 мл. Хранят, защищая от углерода диоксида.
0,025 М раствор натрия карбоната и 0,025 М раствор натрия гидрокарбоната. 2,64 г Na2CO3 и 2,09 г NaHCO3 растворяют в воде и доводят объем раствора тем же растворителем до 1000,0 мл.
При измерении рН в неводных и смешанных растворителях, а также в некоторых коллоидных системах, следует иметь в виду, что полученные значения рН являются условными.
Примечание. Буферные растворы хранят в хорошо закрытых склянках нейтрального стекла в течение 3-х мес. При образовании осадков и видимых изменений буферные растворы не подлежат использованию.
