Иммуногенность коклюшной суспензии и цельноклеточного коклюшного компонента комбинированных вакцин (ОФС.1.7.2.0005.15)
Государственная фармакопея 13 издание (ГФ XIII)
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
ОФС.1.7.2.0005.15 Иммуногенность коклюшной суспензии и цельноклеточного коклюшного компонента комбинированных вакцин
ОФС вводится впервые
Настоящая общая фармакопейная статья предназначена для определения иммуногенности коклюшной суспензии и цельноклеточного коклюшного компонента комбинированных вакцин путем сравнения с иммуногенностью референс-препарата коклюшной вакцины, откалиброванного в международных единицах (МЕ) по соответствующему международному стандартному образцу. Определение проводят на модели экспериментального менингоэнцефалита при внутримозговом введении иммунизированным мышам заражающей дозы тест-штамма Bordetella рertussis 18323 по методу Kendrick.
Материалы
Животные. Здоровые мыши с массой тела (11±1) г чувствительной линии или аутбредные мыши, способные давать адекватный иммунный ответ. Используют мышей одного пола или самцов и самок, равномерно распределенных по группам. В 1 опыте различия массы тела отдельных животных не должны превышать 2 г. Перед проведением испытания за животными проводят наблюдение в течение 3 сут. При гибели более 10 % мышей данную партию не используют.
Референс-препараты:
- стандартный образец иммуногенности коклюшной вакцины, калиброванный в МЕ по соответствующему международному стандартному образцу;
- стандартный образец мутности 10 МЕ, калиброванный в международных оптических единицах (МЕ).
Тест-штамм. B. pertussis 18323, хранят в лиофилизированном состоянии. Продолжительность хранения высушенного штамма не должна превышать 10 лет; биологические свойства лиофилизированного тест-штамма проверяют ежегодно.
Среды. Используют среды Борде-Жангу, казеиново-угольный агар (КУА), их модификации или другие среды, адаптированные к коклюшному микробу.
Среда Борде-Жангу
В 1500 мл воды очищенной последовательно растворяют ингредиенты:
- калий фосфорнокислый двузамещенный – 2,25 г,
- калий фосфорнокислый однозамещенный – 0,75 г,
- калий хлористый – 1,5 г,
- магний сернокислый – 0,075 г,
- натрий хлористый – 7,5 г.
Полученный солевой раствор до внесения следующих ингредиентов должен иметь рН 7,4–7,5.
Затем в солевой раствор вносят:
- фильтрат картофельного отвара – 500 мл,
- агар зарубежных фирм «Дифко» (США) или «Мерк» (Германия) – 60 г.
Среду кипятят до полного растворения агара, устанавливают рН 7,1–7,2, разливают по (200 ± 5) мл в стерильные флаконы вместимостью 500 мл и стерилизуют при температуре 110 ºС в течение 30 мин. Среду Борде-Жангу хранят при температуре от 2 до 8 ºС не более 3 мес.
Фильтрат картофельного отвара
В 1 л воды очищенной вносят 0,5 кг очищенного мелко нарезанного картофеля и нагревают до кипения. В момент закипания добавляют 40 мл глицерина и кипятят в закрытой посуде до полного разваривания картофеля втечение 1,0–1,5 ч. Доводят объем водой очищенной до первоначального уровня и процеживают через двухслойную марлевую салфетку. Картофельный отвар используют свежеприготовленным.
Для получения среды Борде-Жангу с 30 % крови содержимое флакона нагревают до температуры 5055 ºС, вносят 60 мл дефибринированной крови человека, перемешивают и разливают в чашки Петри. Срок хранения среды с кровью 10 сут при температуре от 2 до 8 ºС.
Примечание.
Дефибринированную кровь получают на участках заготовки крови, где ее контролируют на отсутствие возбудителей инфекций, которые передаются при гемотрансфузиях, в соответствии с утвержденными уполномоченными органами РФ «Инструкцией по заготовке и консервированию донорской крови» и «Инструкцией по проведению донорского прерывистого плазмафереза». Срок хранения крови не более 2 сут.
Среда КУА (казеиново-угольный агар)
На 1 л среды добавляют:
- гидролизат казеина (170 ± 5) мл (берется из расчета, чтобы в готовой среде содержание аминного азота составляло от 150 до160 мг%),
- дрожжевой диализат (90 ± 10) мл,
- калий фосфорнокислый однозамещенный – 0,5 г,
- магний хлористый 6-водный 0,4 г,
- крахмал растворимый 1,5 г,
- кальций хлористый 0,01 г или 1 % раствор – 1 мл,
- железо сернокислое 7-водное 0,01 г или 0,5 % раствор – 2 мл,
- медь сернокислая 5-водная – 0,005 г или 0,2 % раствор – 2 мл,
- цистеин 0,03 г или 1,5 % раствор – 2 мл,
- агар микробиологический 30,0 г,
- уголь активированный 2 г.
Содержание хлоридов в среде должно составлять (0,75 ± 0,15) %, аминного азота (155 ± 10 мг %); рН среды доводят до 7,07,1 с помощью 20 % раствора натрия гидроксида.
Среду разливают в матрацы по (250 ± 10) мл, пробирки по (11 ± 1) мл и флаконы вместимостью 500 мл по (200 ± 5) мл, стерилизуют 30 мин при температуре 110 ºС и хранят при температуре от 2 до 8 ºС не более 1 мес. Для получения среды с 10 % крови содержимое флакона растапливают, охлаждают до температуры 50–55 ºС, вносят 20 мл дефибринированной крови человека и перемешивают. Срок хранения среды с кровью 10 сут при температуре от 2 до 8 ºС.
Гидролизат казеина:
- казеин (сухой) – 2000 г,
- хлористоводородная кислота концентрированная – 1000 мл,
- вода очищенная – 500 мл.
Степень расщепления белка – не менее 93 %. Аминный азот 8501000 мг %, общий азот 9101080 мг %, натрия хлорид 46 %. Среду стерилизуют 30 мин при температуре 110 ºС. Среду используют свежеприготовленной (при добавлении 0,5 % хлороформа срок хранения 1 год при температуре от 2 до 8 ºС).
Дрожжевой диализат:
- дрожжи хлебопекарные – 1000 г,
- вода очищенная – 1000 мл,
- хлороформ – 4 мл.
Аминный азот – не менее 0,54 мг/мл. Срок хранения 3 мес при температуре от 2 до 8 ºС.
1 % раствор гидролизата казеина
Гидролизат казеина – 10 мл (аминный азот 8,5–10,0 мг/мл), натрий хлористый – 6,0 г (до концентрации хлоридов 0,6 %), вода очищенная – до 1000 мл. С помощью 20 % раствора натрия гидроксида рН доводят до (7,1±0,2). Среду стерилизуют 15 мин при температуре 121 ºС. Срок хранения 6 мес. Каждую серию гидролизата казеина проверяют на безвредность путем внутримозгового введения 5 мышам по 0,03 мл. Животные должны оставаться живыми и здоровыми в течение 3 сут.
Метод исследования иммуногенной активности коклюшной вакцины
Мышей распределяют в группы по 1820 животных в каждой: по 2 группы для испытуемого и референс-препаратов. Одновременно для контроля вирулентности заражающего штамма B. pertussis 18323 (определение LD50 культуры) из этой же партии животных формируют 4 группы по 10 мышей в каждой.
Необходимо соблюдать принцип случайного распределения животных по группам, случайными должны быть и расположение клеток на полках, и порядок введения разрешающей дозы.
Иммунизация мышей
Готовят по 3 пятикратных разведения испытуемого и референс-препаратов. В качестве растворителя используют 0,9 % раствор натрия хлорида, рН (7,1 ± 0,2). В интервале используемых разведений каждого образца должна содержаться средняя эффективная доза ЕD50.
В ампулу с референс-препаратом вносят стерильный растворитель из такого расчета, чтобы в 1 мл содержалась 1 МЕ (разведение I). Из разведения I делают 2 последующих пятикратных разведения по схеме (табл. 1).
Таблица 1. Пример разведения референс-препарата
| Разведение | Объем вносимого разведения I референс-препарата, мл | Объем вносимого растворителя, мл | Разведения референс-препарата (в 0,5 мл) | Иммунизирующая доза– 0,5мл | |
| Количество исходного референс-препарата, мл | Количество МЕ | ||||
| I | 15 | 0 | 1:60 | 0,0167 | 0,5 |
| II | 2,5 | 10,0 | 1:300 | 0,0033 | 0,1 |
| III | 0,5 | 12,0 | 1:1500 | 0,00066 | 0,02 |
Образец испытуемой вакцины разводят в 14 раз (разведение I). Из разведения I делают 2 последующих пятикратных разведения по схеме (табл. 2). Если полученное в опыте значение ЕD50 испытуемой вакцины будет больше значений использованных доз, необходимо изменить разведение I (например, 1:10). Последующие 2 разведения делают по вышеприведенной схеме.
Приготовленные разведения вакцины и референс-препарата хранят при температуре от 2 до 8 ºС и используют в течение не более 4 ч.
Таблица 2. Пример разведения испытуемой вакцины
| Разведение | Объем вно-симого I разведения вакцины, мл | Объем вносимого растворителя, мл | Кратность разведений исходной вакцины
(в 0,5 мл) |
Иммунизирующая доза в объеме 0,5 мл | |
| Количество исходной вакцины, мл | Количество МЕ (предполагаемое содержание) | ||||
| I | 14 | 0 | 1:28 | 0,0357 | 0,5 |
| II | 2,5 | 10,0 | 1:140 | 0,0071 | 0,1 |
| III | 0,5 | 12,0 | 1:700 | 0,00142 | 0,02 |
Каждой мыши в каждой группе внутрибрюшинно вводят по 0,5 мл одного из разведений испытуемой вакцины или референс-препарата. К моменту введения заражающей дозы не менее 94 % иммунизированных мышей должно остаться в живых и без признаков заболевания. Если гибель животных превышает указанную величину, то опыт не подлежит учету.
Приготовление заражающей суспензии тест-штамма B. рertussis 18323
Бактериальную суспензию B. pertussis 18323, используемую для заражения, готовят из 2024-часовой культуры второго–третьего пассажа, выращенной на среде Борде-Жангу, с кровью человека или КУА с кровью человека или на других, адаптированных к коклюшному микробу средах.
Выросшую культуру контролируют путем микроскопии мазков, окрашенных по Граму. Микробные клетки B. рertussis 18323 должны быть морфологически однородны. Посторонняя микрофлора должна отсутствовать.
Готовят бактериальную суспензию микробных клеток с концентрацией, соответствующей 10 МЕ по стандартному образцу мутности (разведение 1А). Все дальнейшие разведения микробной суспензии делают в 1% растворе гидролизата казеина, содержащего 0,6% раствор натрия хлорида, рН (7,1±0,2).
Полученную суспензию разводят последовательно так, чтобы получить заражающую дозу, содержащую 100000 микробных клеток (рабочая суспензия) в объеме 0,03 мл (100–1000 LD50) . Из рабочей суспензии готовят разведения 1/10, 1/50, 1/250 и 1/1250 для определения LD50 тест-штамма и проверки жизнеспособности микробов в суспензии (табл. 3).
Таблица 3. Пример разведения тест-штамма B. рertussis 18323
| Номер пробирки | Кратность разведения | Объем перено-
симой суспен-зии из предыдущей пробирки в последующую, мл |
Объем внесенного растворителя,мл | Полученная суспензия
содержит в 0,03 мл (эквивалентно) |
Назначение |
| 1 | 1А : 3 | 1 | 2 | 100 млн | |
| 2 | 1I : 10 | 0,5 | 4,5 | 10 млн | |
| 3 | 12 : 10 | 0,5 | 4,5 | 1 млн | |
| 4 | 13 : 10 | 2 | 18 | 100000 | Разливают в 3 пробирки для заражения –
рабочая суспензия |
| 5 | 14 : 10 | 0,5 | 4,5 | 10000 | Для определения LD50 штамма |
| 6 | 15 : 5 | 1,0 | 4,0 | 2000 | |
| 7 | 16 : 5 | 1,0 | 4,0 | 400 | |
| 8 | 17 : 5 | 1,0 | 4,0 | 80 |
Из пробирки 8 сразу после приготовления разведения делают посев по 0,1 мл на 3 чашки Петри со средой Борде-Жангу или КУА с кровью с целью подсчета количества содержащихся в ней живых клеток, выраженного в колониеобразующих единицах (КОЕ). Культуру помещают в термостат с температурой (36 ± 0,5) оС на 34 сут. Для определения количества КОЕ в 30 мкл проводят подсчёт выросших колоний на 3 чашках и полученное значение делят на 10. В 0,03 мл разведения из пробирки 8 должно быть не более 50 КОЕ.
При разведении и в процессе заражения суспензию хранят в холодной водяной бане (вода со льдом). Продолжительность работы с микробной суспензией не должна превышать 2,5 ч с момента приготовления смыва культуры.
Если в испытании используют высокочувствительную к коклюшным антигенам линию мышей, то заражающую дозу тест-штамма 18323 следует уменьшить до содержания 100–1000 LD50 в объеме 0,03 мл.
Заражение иммунизированных животных
Мышам, иммунизированным испытуемой вакциной и референс-препаратом, через 1417 сут интрацеребрально вводят по 0,03 мл рабочей суспензии живой культуры тест-штамма B. рertussis 18323 (пробирка 4) путем прокола лобной кости в точке, расположенной в 2 мм от средней линии и на 2 мм выше глаза. Для заражения используют туберкулиновые шприцы с ценой деления 0,01 мл, используя иглу № 27, имеющую короткий срез и муфту; длина свободного конца иглы от края муфты до среза должна составлять от 3 до 4 мм. Для определения величины LD50 разведения заражающей дозы (пробирки 5, 6, 7, 8) вводят контрольным мышам соответствующих групп интрацеребрально по 0,03 мл.
Мышей, погибших в течение 3 сут после заражения, исключают из опыта (неспецифическая гибель); в каждой клетке оставляют по 16 мышей.
За зараженными животными наблюдают 14 сут с ежедневной регистрацией их гибели. В день учета результатов (14-е сут) в число погибших включают также всех парализованных мышей.
Вычисление величины LD50 (табл. 4) культуры тест-штамма производят по формуле Кербера:
lgLD50 = lg DN–δ(∑Li–0,5),
где DN максимальная из испытуемых доз;
δ логарифм кратности разведения (отношение большей дозы к следующей за ней меньшей дозе);
Li отношение числа животных, погибших при введении данной дозы культуры, к общему числу животных, которым эта доза была введена;
∑Li сумма значений Li, найденных для всех испытанных доз.
Таблица 4. Пример расчета величины LD50 культуры тест-штамма B. рertussis 18323
| Доза культуры (число микробных клеток)
0,03 мл |
Число зараженных животных | Число погибших (парализованных) из общего числа зараженных животных | Значения Li | LD50 | Кол-во колоний в заражаю-щей дозе 80 клеток |
| 104 | 10 | 9/10 | 0,9 | 648 | 23 |
| 2103
|
10 | 7/10 | 0,7 | ||
| 4102
|
10 | 4/10 | 0,4 | ||
| 80 | 10 | 2/10 | 0,2 |
∑Li=2,2
lg LD50 = lg 104–lg 5(2,2–0,5)=4,0–0,6991,7=2,8117
LD50=648 микробных клеток.
В заражающей дозе (105 микробных клеток) содержится 648=154 LD50
Оценка иммуногенной активности испытуемой вакцины
Расчет иммуногенной активности испытуемого препарата проводят по методу Вильсона и Вустера с использованием таблиц Национального института здоровья США (для n=16) или статистическим методом с помощью программы Probit-analysis. Для проведения расчета в таблице Вильсона-Вустера (табл. 5) по вертикальной оси отмечают величину, равную сумме выживших мышей от всех 3 доз препарата (А), по горизонтальной оси – разницу между числом мышей, выживших от наибольшей и наименьшей доз, взятых в опыт (В). В месте пересечения прямых, проведённых от соответствующих величин А и В, находят ЕD50 (верхняя цифра) и её стандартные отклонения, выраженные в процентах (нижние цифры). Найденное значение соответствует ЕD50 для средней иммунизирующей дозы, равной 100 мл. Для определения величины ЕD50 в опыте, найденную в таблице величину ЕD50 делят на 100 и умножают на значение средней иммунизирующей дозы в данном опыте. Результаты опыта считают достоверными, если стандартное отклонение средней иммунизирующей дозы не ниже 64 % и не выше 157 % от найденного значения ЕD50.
Примеры расчета количества МЕ в 1 мл по методу Вильсона и Вустера приведены в табл. 6.
Таблица 5. Таблица Вильсона-Вустера
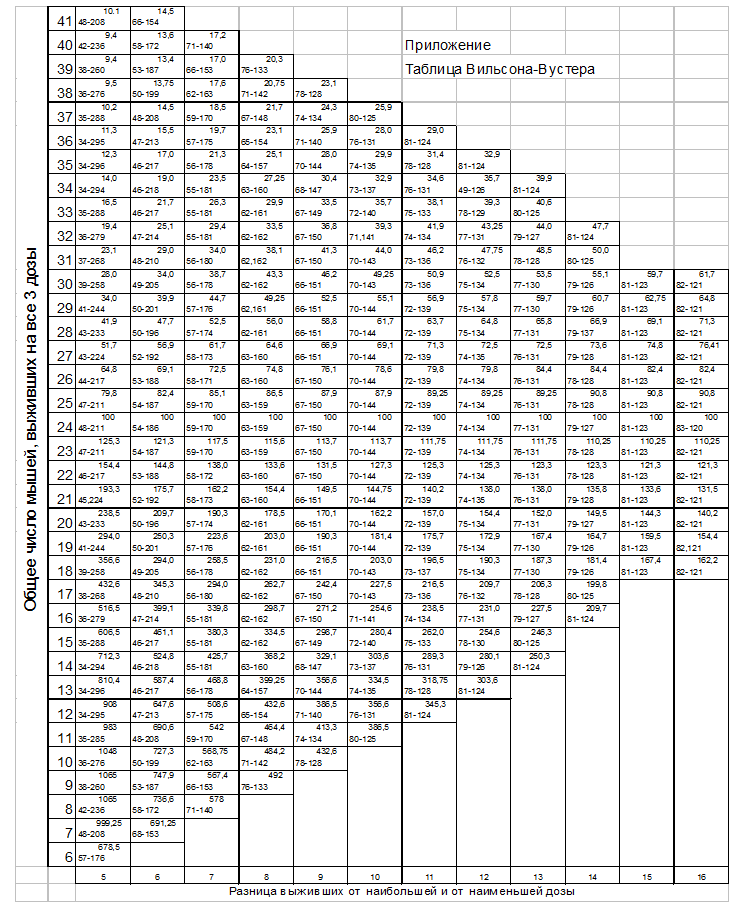
Таблица 6. Пример расчета иммуногенной активности вакцины
| Препарат | Доза препарата в 0,5 мл | Количество выживших мышей/общее число зараженных в группе | Величины А/В и ЕD50 по таблице | ЕD50 (стандарт-ные от-клонения в опыте) | ||
| Разведение | Количество исходного препарата,мл | Количе-ство МЕ в имму-низирующей дозе | ||||
| Референс-препарат | 1:60 | 0,0167 | 0,5 | 14/16 | 27/11
71,3 72–139 |
0,0023
(0,00327– 0,00169) |
| 1:300 | 0,0033 | 0,1 | 10/16 | |||
| 1:1500 | 0,00066 | 0,02 | 3/16 | |||
| Вакцина | 1:28 | 0,0357 | 13/16 | 23/11
111,75 72–139 |
0,0079
(0,011– -0,0057) |
|
| 1:140 | 0,0071 | 8/16 | ||||
| 1:700 | 0,00142 | 2/16 | ||||
Средняя иммунизирующая доза референс-препарата, выраженная в мл (0,0033 мл), содержит 0,1 МЕ (табл. 6). При определении ЕD50 референс-препарата используют значение средней иммунизирующей дозы, выраженное в МЕ.

Количество МЕ в 1 мл вакцины определяют по формуле:


Доверительный интервал значения иммуногенности (МЕ/мл) препарата рассчитывают по формулам:

где
R – количество МЕ в 1 мл препарата;
Rмин – нижний предел доверительного интервала;
Rмакс – верхний предел доверительного интервала;
К – доверительный коэффициент.

где S1 = (lg ЕD50 )макс.lg ЕD 50 для более иммуногенного препарата при избранном уровне существенности различия 95 или 99%;
S2 = lg ЕD50(lg ЕD50)мин. для менее иммуногенного препарата.
Для примера:

Отсюда:

Таким образом, в 1 мл вакцины содержится 9,0 МЕ с доверительным интервалом от 5,6 до 14,4 МЕ.
Если в первом опыте активность препарата не соответствует установленным требованиям, опыт повторяют. В этом случае при вычислении количества МЕ в 1,0 мл препарата учитывают результаты всех достоверных опытов (не более 3). Используют расчет средней геометрической (Xгеом.) величины значения по формуле:
![]()
где
Пx произведение усредняемых величин;
n число определений.
Критерии достоверности теста:
- ЕD50 референс-препарата и испытуемой вакцины лежит в интервале между наибольшей и наименьшей иммунизирующими дозами;
- LD50 не превышает 1000 микробных клеток;
- заражающая доза микробных клеток содержит не менее 100 и не более 1000 LD50;
- в 0,03 мл разведения из пробирки 8 содержится не более 50 КОЕ.




