Фолдинг белка и его нарушения. Болезни, связанные с ним
1. Введение
1.1. Структура белка
2. Цели и задачи работы
3. Фолдинг белка.
3.1. Кодирование формирования третичной структуры.
3.2. Особенности фолдинга белка в клетке
3.3. Одностадийное кооперативное сворачивание небольших белков.
3.4. Сворачивание белков через образование промежуточных состояний.
3.5. Модель энергетической воронки
3.6. Переходное состояние и ядро сворачивания.
3.7. Развёрнутое состояние белка.
3.8. Нативное состояние белка
3.9. Роль промежуточных состояний в образовании агрегированых форм белков.
4. Болезни связанные с нарушением фолдинга белка
4.1. Болезнь Альцгеймера
4.2. Болезнь Крейтцфельдта — Якоба
5. Заключение
Фолдинг белка. Введение
Белки — важнейший структурный компонент живых организмов, так как именно каталитическая активность ферментов определяет возможность лёгкого протекания огромного множества химических реакций идущих в каждом организме на планете и обеспечивающих его жизнедеятельность.
Белки — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидными связями альфа-аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс у зелёных растений.
Фолдинг белка. Структура белка
Размер белка может измеряться в числе аминокислот или в дальтонах (молекулярная масса), чаще из-за относительно большой величины молекулы в производных единицах — килодальтонах (кДа). Белки дрожжей, в среднем, состоят из 466 аминокислот и имеют молекулярную массу 53 кДа. Самый большой из известных в настоящее время белков — титин — является компонентом саркомеров мускулов; молекулярная масса его различных изоформ варьирует в интервале от 3000 до 3700 кДа, он состоит из 38 138 аминокислот (в человеческой мышце solius).

Сравнительный размер белков. Слева направо: антитело(IgG), гемоглобин, инсулин(гормон), аденилаткиназа (фермент) и глютаминсинтетаза (фермент) [23; 2000]
Молекулы белков представляют собой линейные полимеры, состоящие из α-L-аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда,модификации происходят уже после синтеза белка на рибосоме). Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10130 вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации—белками, хотя это деление весьма условно.
При образовании белка в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-COOH) другой аминокислоты образуются пептидные связи. Концы белка называют C- и N-концом (в зависимости от того, какая из групп концевой аминокислоты свободна: -COOH или -NH2, соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца.

Фолдинг белка. Схематичное представление пептидной связи
Последовательность аминокислот в белке соответствует информации, содержащейся в гене данного белка. Эта информация представлена в виде последовательности нуклеотидов, причём одной аминокислоте соответствует в ДНК последовательность из трёх нуклеотидов— так называемый триплет или кодон. То, какая аминокислота соответствует данному кодону в мРНК, определяется генетическим кодом, который может несколько отличаться у разных организмов. Синтез белков на рибосомах происходит, как правило, из 20 аминокислот, называемых стандартными. Триплетов, которыми закодированы аминокислоты в ДНК, у разных организмов от 61 до 63 (то есть от числа возможных триплетов (4³ = 64), вычтено число стоп-кодонов (1—3)). Поэтому появляется возможность, что большинство аминокислот может быть закодировано разными триплетами. То есть, генетический код может является избыточным или, иначе, вырожденным. Это было окончательно доказано в эксперименте при анализе мутаций. Генетический код, кодирующий различные аминокислоты имеет разную степень вырожденности (кодируются от 1 до 6 кодонами), это зависит от частоты встречаемости данной аминокислоты в белках, за исключением аргинина. Часто основание в третьем положении оказывается несущественным для специфичности, то есть одна аминокислота может быть представлена четырьмя кодонами, различающимися только третьим основанием. Иногда различие состоит в предпочтении пурина пиримидину. Это называют вырожденностью третьего основания.
Такой трёхкодонный код сложился эволюционно рано. Но существование различий в некоторых организмах, появившихся на разных эволюционных стадиях, указывает на то, что он был не всегда таким.
Согласно некоторым моделям, сначала код существовал в примитивном виде, когда малое число кодонов обозначало сравнительно небольшое число аминокислот. Более точное значение кодонов и большее число аминокислот могли быть введены позже. Сначала только первые два из трех оснований могли быть использованы для узнавания [что зависит от структуры тРНК].
—Б. Льюин. Гены, М.: 1987, с. 62.
Гомологичные белки (предположительно имеющие общее эволюционное происхождение и нередко выполняющие одну и ту же функцию), например, гемоглобины разных организмов, имеют во многих местах цепи идентичные, консервативные остатки аминокислот. В других местах находятся различные аминокислотные остатки, называемые вариабельными. По степени гомологии (сходства аминокислотной последовательности) возможна оценка эволюционного расстояния между таксонами, к которым принадлежат сравниваемые организмы.
Уровни организации:
Кроме последовательности аминокислот полипептида (первичной структуры), крайне важна трёхмерная структура белка, которая формируется в процессе фолдинга (от англ. folding, «сворачивание»). Трёхмерная структура формируется в результате взаимодействия структур более низких уровней. Выделяют четыре уровня структуры белка:
- Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы — сочетания аминокислот, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка.
- Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями
- Третичная или трёхмерная структура — пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль.
- Четверичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.[2; 1984]
2. Цели и задачи работы
Цель этой работы — используя доступную литературу получить представление о таком важном процессе живого организма (любого живого организма на планете), как фолдинг белка. Также я ставлю своей целью описать роль нарушений процесса фолдинга в этиологии таких тяжёлых заболеваний как болезнь Альцгеймера и болезнь Крейцфельда-Якоби (коровье бешенство).
Фолдинг белка
Процесс образования белков в клетке состоит из двух этапов — биосинтеза полипептидной цепи и ее сворачивания в нативную трехмерную структуру. Первый процесс — передача информации о последовательности и числе аминокислот, хранящейся в ДНК, и сборка необходимых аминокислот в полипептидную цепь с образованием первичной структуры белка, хотя и является очень сложным, к настоящему времени хорошо изучен. На этом этапе на основании информации, закодированной в одномерной ДНК, строится одномерная полипептидная цепь белка. На втором этапе происходит фолдинг — сворачивание цепочки аминокислот, из которых образован данный белок и которые определяют его первичную структуру, в уникальную трехмерную структуру. Только после сворачивания в уникальное компактное, высокоорганизованное нативное состояние белок становится функционально активным. [2; 2003]
Схематичное изображение биосинтеза белка в клетке и его перехода в функционально активное состояние.

Фолдинг белка. Кодирование формирования третичной структуры.
Несмотря на то что в клетке имеется много факторов, вовлеченных в процесс фолдинга полипептидной цепи, можно считать установленным то обстоятельство что код, согласно которому полипептидная цепь сворачивается в уникальную третичную структуру, заключен в аминокислотной последовательности самой полипептидной цепи [5; 2002]. Впервые это было продемонстрировано в работах Анфинсена [6;1973], показавшего экспериментально, что рибонуклеаза A, денатурированная мочевиной, в присутствии агента, разрушающего S—S-связи, восстанавливает полностью нативную структуру и ферментативную активность после удаления денатуранта и агента, разрушающего S—S-связи. За эту работу Анфинсен был удостоен Нобелевской премии.
В последующем способность к ренатурации была показана для ряда других однодоменных белков относительно небольшого размера [6;2004]. Тем самым было доказано, что пространственная структура нативного состояния макромолекулы белка запрограммирована в его первичной структуре. При этом важно подчеркнуть, что принципы кодировки нативной пространственной структуры белка принципиально отличаются от принципа кодировки его аминокислотной последовательности . При синтезе белка последовательно, шаг за шагом считывается информация, закодированная в нуклеотидах, и одна за другой собираются в полипептидную цепь сооветствующие аминокислоты, т. е. одномерная информация, заключенная в нуклеотидной последовательности ДНК, трансформируется в одномерную же информацию о последовательности аминокислот первичной структуры белка. При фолдинге белка пошаговый механизм передачи информации явно не работает. В определении контактов, возникающих в третичной пространственной структуре макромолекулы белка, участвуют удаленные друг от друга по цепи аминокислотные остатки. При этом определяющую роль в фолдинге белка играют лишь некоторые (далеко не все) аминокислотные остатки. По этой причине гомологичные белки (иногда с достаточно низкой гомологией) имеют сходную структуру С другой стороны, одна-единственная аминокислотная замена может существеннейшим образом сказаться на скорости сворачивания или даже полностью нарушить правильное сворачивание белка [5; 2002].
Мерой стабильности структуры белка является свободная энергия F = H – TS, которая определяется его энтальпией H, т. е. энергией взаимодействия атомов белка,и его энтропией S = R ln N (R — молярная газовая постоянная, T — абсолютная температура), являющейся мерой числа конформаций N, которыми данное состояние белка может быть реализовано. Способность белка самопроизвольно сворачиваться в нативное состояние означает, что этому состоянию белка отвечает минимум свободной энергии. Более строго нужно говорить о минимуме свободной энергии системы белок—растворитель. Дело в том, что одним из основных факторов, определяющих стабильность структуры белка, являются гидрофобные взаимодействия, т. е. стремление неполярных групп белка уйти из водного окружения, поскольку при этом происходит освобождение молекул воды, образующих вокруг неполярных групп белка льдоподобные упорядоченные структуры. Образование гидрофобного ядра макромолекулы белка приводит к существенному уменьшению свободной энергии системы белок—растворитель за счет возрастания энтропии растворителя.
Сворачивание белка заключается в поиске уникальной нативной структуры, отвечающей минимуму свободной энергии, среди большого числа конформаций, которые может принимать полипептидная цепь за счет поворотной изомеризации относительно связей N—Cα(угол φ), Сα—С (угол Ψ) и С—N (угол ώ) . Однако жесткость пептидной связи не допускает вращения вокруг связи C—N. Атомы, входящие в пептидную связь, лежат в одной плоскости в трансконформации .
Исключение составляет пептидная связь, предшествующая остатку пролина. В нативном белке часть пептидных связей в этом случае имеет цисконформацию. Энергетические барьеры между шестью конформациями полипептидной цепи, отвечающими минимуму свободной энергии по углам φ и Ψ, составляют около 1 ккал/моль, т. е. близки к энергии тепловых колебаний (0.6 ккал/моль). Поэтому поворотная изомеризация относительно связей N—Cα и Сα—С обеспечивает возможность существования огромного числа конформаций основной цепи белка в развернутом состоянии. Возможно практически свободное вращение относительно этих
связей.
Простой расчет показывает, что даже для небольшого белка из ста аминокислотных остатков потребуется биллион лет, для того чтобы найти нативную структуру, если сворачивание будет осуществляться за счет произвольного перебора всех возможных конформаций. Тот факт, что сворачивание белка в состояние, отвечающее минимуму свободной энергии, происходит за очень короткий промежуток времени (который
обычно составляет доли секунды), известен как «парадокс Левинталя». Это сделало очевидным, что в аминокислотной последовательности запрограммирована не только структура нативного состояния макромолекулы белка, но и путь его достижения.

Иллюстрация планарности пептидной связи. [4; 2005]
Фолдинг белка. Особенности фолдинга белка в клетке
Фолдинг белка в живой клетке осложнен по крайней мере двумя факторами. Во-первых, фолдинг белка всегда сопряжен с его синтезом. Сходящая с рибосомы полипептидная цепь сразу начнет сворачиваться. Если это небольшой б-спиральный белок, то сворачивание полипептидной цепи происходит по мере ее роста (котрансляционное сворачивание). Однако это не всегда так, и существует опасность возникновения неправильных внутримолекулярных контактов. Кроме того, сходя с рибосомы, полипептидная цепь сразу попадает в «густонаселенную» физиологическую среду клетки. При этом очень велика опасность образования нежелательных контактов с «соседями» [6;2004]. Поэтому для правильного сворачивания белков в этих условиях им необходимы помощники. Такими помощниками являются шапероны и ферменты, ответственные за цис-трансизомеризацию пролина и образование «правильных» дисульфидных мостиков. Шапероны представляют собой обширный класс белков, различающихся по молекулярной массе, структуре и функции. Они способствуют котрансляционному сворачиванию полипептидных цепей, что особенно важно при синтезе больших мультидоменных белков, препятствуют агрегации денатурированных белков, ускоряют процесс перехода белка из промежуточного в нативное состояние, участвуют в транспорте белков к местам их назначения, в частности обеспечивают перенос белков через мембраны [6;2004]. Необходимо подчеркнуть, что наличие помощников при фолдинге белка в клетке отнюдь не противоречит фундаментальному заключению, сделанному на основании экспериментов, выполненных in vitro, о том, что структура нативного состояния белка и путь ее достижения закодированы в его первичной структуре.
Фолдинг белка. Одностадийное кооперативное сворачивание небольших белков.
Вопрос о том, как же белки сворачиваются в уникальное компактное, высокоорганизованное, функционально активное состояние, является в настоящее время одним из центральных вопросов структурной и клеточной биологии. Решение проблемы фолдинга лежит на стыке биологии, физики и химии, и нет другой области исследований, где бы эти науки так перекрывались [5; 2002]. Основным подходом к решению этой проблемы является изучение процессов сворачивания—разворачивания белков in vitro с использованием различных физических методов, дающих информацию о структуре белка.
Методы малоуглового рассеяния рентгеновских лучей, седиментации, вискозиметрии и проникающей гель-хроматографии дают информацию о размерах и форме макромолекулы, методы кругового дихроизма в дальней УФ-области и ИФ-спектроскопии — о вторичной структуре белка, круговой дихроизм в ближней УФ-области спектра и собственная флуоресценция — о третичной структуре белка. Флуоресценция гидрофобного красителя АНС (1-анилинонафталин-8-сульфоната) используется для тестирования гидрофобных кластеров на поверхности белка и возникновения аморфных агрегатов. Другой флуоресцентный краситель — тиофлавин T — используется для тестирования амилоидных фибрилл, богатых в-складчатыми структурами. Свободный краситель в водном растворе имеет очень низкий квантовый выход флуоресценции. При встраивании в амилоидные фибриллы квантовый выход флуоресценции тиофлавина T возрастает на три порядка.
Проведение исследований процессов сворачивания—разворачивания белков с использованием этих методов показало, что по крайней мере для сравнительно небольших однодоменных белков переход между развернутым (U) и нативным (N) состояниями является обратимым и осуществляется по принципу «все или ничего». Регистрация равновесной зависимости любой экстенсивной физической характеристики белка от температуры или концентрации химического денатуранта позволяет определить константу равновесия в каждой точке денатурационной зависимости:
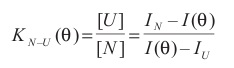
и, тем самым, разность свободной энергии макромолекулы белка в этих состояниях ΔFN-U
Здесь ΔHN-U и ΔSN-U изменение соответственно энтальпии и энтропии в результате реакции U → N, R — газовая постоянная, T — абсолютная температура, I(Θ) — экспериментально измеряемая величина, Θ — температура или концентрация денатуранта, IN(Θ) и IU(Θ) — значения I(Θ) для белка в нативном и денатурированном состояниях. Обычно принимается, что IN(Θ) = aN + bN*Θ и IU(Θ) = aU + bU*Θ, где aN, bN, aU, bU — постоянные. Экспериментальные данные свидетельствуют о том, что свободная энергия макромолекулы белка в состояниях N и U различается не очень сильно, так что путем изменения температуры или концентрации химического денатуранта (гуанидингидрохлорида, мочевины, ионов H+ или OH– и т. п.) можно подобрать условия, при которых свободные энергии нативного и полностью развернутого состояний становятся равными. При этом нативная структура стабильна благодаря сильным взаимодействиям в макромолекуле белка (в том числе гидрофобным взаимодействиям, возникновение которых существенно увеличивает энтропию системы белок—растворитель), развернутая — за счет высокого уровня конформационной энтропии основной цепи.
Разность свободных энергий белка в нативном и развернутом состояниях ДFN – U является мерой стабильности белка. Стабильность белка изменяется линейно с изменением концентрации денатуранта :
ΔF([D]) = ΔF([0]) — m * [D],
Где [D] — концентрация денатуранта, ΔF([0]) — разность свободных энергий макромолекулы белка в состояниях N и U в отсутствии денатуранта, m=d(ΔFN-U([D]))/d([D]). Зависимость стабильности белка от температуры подчиняется соотношению Гиббса-Гельмгольца [4; 2005]:
![]()
где Tm — температура середины перехода, ΔHm, ΔCp —изменение величин энтальпии и теплоемкости при переходе из состояния U в N при температуре Tm.
Сопоставление результатов определения основных термодинамических характеристик процесса разворачивания белка, полученных путем измерения равновесных зависимостей тех или иных физических характеристик (метод Ван-Гоффа) и методом дифференциальной сканирующей калориметрии, позволяет делать вывод о кооперативности процесса разворачивания белка [5; 2002].
Белки — это природные гетерополимеры, однако по свойствам они существенно отличаются от синтетических гетерополимеров. Большое разнообразие мономерных звеньев (20 различных аминокислот) само по себе уже существенно отличает белки от синтетических гетерополимеров. В отличие от синтетических полимеров число мономерных звеньев (аминокислот), образующих белок, и их последовательность в белковой цепи строго детерминированы. И наконец (и это очень существенно!), в отличие от синтетических полимеров белки могут образовывать кристаллы, т. е. все молекулы белка в нативном состоянии идентичны, если, конечно, не считать флуктуаций структуры, обусловленных тепловым броуновским движением входящих в их состав атомов. А это возможно только в том случае, если между нативным и всеми другими состояниями белка (полностью развернутым состоянием или промежуточным частично свернутым состоянием) существует свободноэнергетический барьер. Таким образом, в отличие от синтетических полимеров первичная структура белка такова, что она обеспечивает существование энергетического барьера между нативным и развернутым (илипромежуточным) состояниями.
В результате этот переход является фазовым переходом первого рода и осуществляется попринципу «всё или ничего». Это обстоятельство чрезвычайно существенно для правильного функционирования белков, так как только существование свободноэнергетического барьера между нативным и денатурированными состояниями белка приводит к тому, что все молекулы белка в нативном состоянии идентичны. Уникальная первичная структура, обеспечивающая существование энергетического барьера между нативным и денатурированными состояниями, является результатом эволюционного отбора.
Величину свободноэнергетического барьера ΔF# – U, разделяющего состояния N и U , можно определить, измерив константу скорости процесса сворачивания белка kU – N:
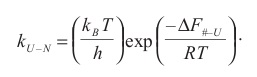
Здесь # — переходное состояние, kB — постоянная Больцмана, h — постоянная Планка; остальные величины были определены выше. Экспериментальные данные свидетельствуют о том, что если процесс сворачивания белка не осложнен процессами изомеризации пролиновых остатков, реорганизацией S—S-связей и т. п., то при физиологических условиях процесс сворачивания белка осуществляется быстро, за доли секунды. Это свидетельствует о том, что свободноэнергетический барьер на пути сворачивания белка невысок. Сворачивание белка, т. е. переход из развернутого состояния, которое может быть реализовано огромным числом конформаций боковой цепи, в нативное состояние, в котором конформация основной цепи строго детерминирована, связано с огромным увеличением свободной энергии за счет уменьшения конформационной энтропии основной цепи. Это означает, что процесс U → N может осуществляться быстро только в том случае, если потеря конформационной энтропии основной цепи компенсируется уменьшением свободной энергии за счет возникновения внутримолекулярных контактов.
Как уже было сказано выше, макромолекуле белка, в каком бы структурном состоянии она ни находилась (в том числе и нативном), присущ определенный уровень структурной (равновесной) динамики, обусловленный тепловым броуновским движением входящих в состав белка атомов [4; 2005]. Существует представление о том, что внутримолекулярная подвижность играет важную роль при выполнении белком его функции. Предполагается, что за счет теплового броуновского движения часть макромолекул принимает конформацию, при которой выполнение биологической функции (например, взаимодействие фермента с субстратом, взаимодействие антиген—антитело и т. д.) термодинамически более выгодно по сравнению с конформацией основного состояния макромолекулы.
Для объяснения одностадийного сворачивания белков было предложено несколько разных моделей, различающихся в деталях, но близких по своей сути. Предполагается, что в результате флуктуации основной цепи белковая цепь достигает такого состояния, в котором присутствует определенный набор нативных контактов между остатками — как соседними, так и достаточно удаленными друг от друга по цепи. После формирования ядра сворачивания процесс фолдинга быстро приходит к завершению. Ядром сворачивания может стать, например, участок α-спирали, образующийся на начальном этапе сворачивания белка, или образование нативных контактов между неполярными группами боковых цепей, приводящее в конечном итоге к образованию гидрофобного ядра молекулы. Как уже было сказано выше, образование контактов между неполярными группами белка сопровождается возрастанием энтропии растворителя, которая компенсирует уменьшение энтропии, связанное с уменьшением числа возможных конформаций основной цепи белка при его сворачивании в глобулу. Гидрофобные взаимодействия являются определяющими в формировании нативной глобулярной структуры макромолекулы белков.
Фолдинг белка. Сворачивание белков через образование промежуточных состояний.
Не все белки сворачиваются в нативное состояние по одностадийному механизму. В начале 1980-х годов было установлено, что переход из нативного состояния в полностью развернутое для ряда белков осуществляется не по принципу «все или ничего», а через образование термодинамически стабильных промежуточных состояний [4; 2005]. Было так же показано, что ренатурация многих глобулярных белков из полностью развернутого состояния происходит через стадию накопления кинетического интермедиата [5; 2002], свойства которого совпадают со свойствами термодинамически стабильного состояния белковой молекулы, промежуточного между нативным и полностью развернутым состояниями. В этом состоянии макромолекула белка сохраняет компактность и выраженную вторичную структуру, присущую нативному состоянию, однако отличается от нативной молекулы отсутствием жесткой упаковки боковых цепей. О. Б. Птицыным была выдвинута идея [5; 2002] о том, что это состояние белка, названное по совокупности перечисленных выше признаков «расплавленной глобулой», может играть универсальную роль в процессе самоорганизации белковой молекулы.
Идея о существовании универсального термодинамически стабильного интермедиата типа расплавленной глобулы оказалась исключительно плодотворной и на длительное время определила направление научных исследований многих ведущих лабораторий мира. Интерес исследователей к изучению белков в состоянии расплавленной глобулы еще более возрос в связи с появлением данных о том, что это состояние, возможно, является одной из основных форм существования макромолекул белков в клетке и обеспечивает ряд существенных внутриклеточных процессов, таких как узнавание белков шаперонами, проникновение белков через мембраны, диссоциация лигандов и т. д. [5; 2002]. В последующем выяснилось, что наряду с состоянием типа расплавленной глобулы возможны и другие денатурированные частично свернутые состояния белка, например предшественник расплавленной глобулы [6;1973] или высоко структурированная расплавленная глобула . Во многих случаях было обнаружено, что переход в промежуточное состояние сопровождается агрегацией ил и специфической ассоциацией [4; 2005], что совершенно исключалось в модели «расплавленной глобулы».
Фолдинг белка. Модель энергетической воронки
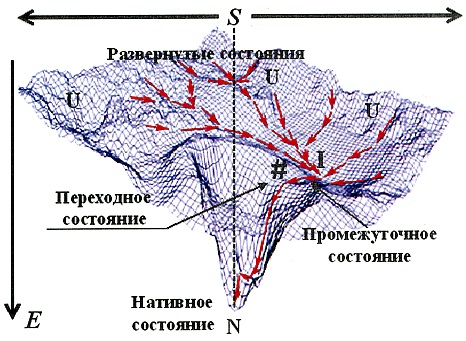
Энергетическая поверхность, определяющая пути сворачивания белка в нативное состояние.[4; 2005]
Согласно современным представлениям, переход от полностью развернутого состояния в уникальное нативное состояние может осуществляться различными путями, которые определяются энергетической поверхностью, т. е. зависимостью свободной энергии макромолекулы белка от всех координат, определяющих состояние системы (модель «энергетических поверхностей»). В рамках этой модели развернутому состоянию полипептидной цепи отвечает широкое «холмистое плато» свободной энергии, отражающее реализацию этого состояния огромным числом конформаций основной цепи. Возвышенности на плато отражают существование запрещенных конформаций . Переход от полностью развернутого состояния в уникальное нативное состояние может осуществляться различными путями. Число возможных конформационных состояний полипептидной цепи уменьшается по мере приближения к нативному состоянию, поэтому такую энергетическую поверхность часто называют также «энергетической воронкой». Совпадение денатурационных кривых, полученных путем измерения различных физических характеристик белка, является экспериментальным свидетельством того, что переход между этими состояниями осуществляется по принципу «все или ничего». Это означает, что плато отделено от входа в воронку свободноэнергетическим барьером, отвечающим переходному состоянию #.
Фолдинг белка. Переходное состояние и ядро сворачивания.
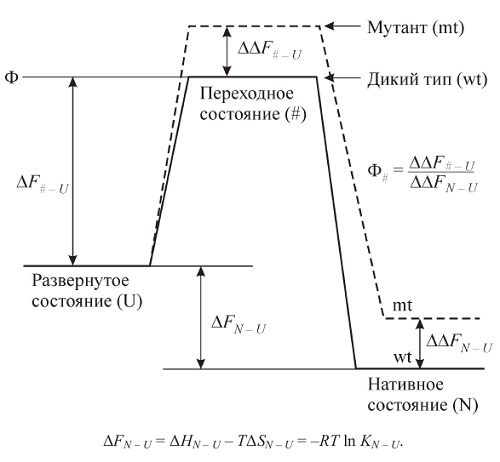
Изучение переходного состояния — ключевой момент в изучении процесса фолдинга. Величина барьера между нативным и денатурированным состояниями может быть определена из экспериментов по изучению кинетики сворачивания.
Для того чтобы определить структуру переходного состояния, т. е. выявить те аминокислотные остатки, взаимодействие между которыми происходит на ранних стадиях сворачивания белка, А. Фершт предложил использовать изучение кинетики сворачивания различных мутантных форм белка. Точечная мутация в белке может приводить к изменению стабильности нативного белка и скорости сворачивания. Различие стабильности нативного состояния белка дикого типа и мутанта ΔΔFN – U может быть определено на основании измерения денатурационных кривых этих двух белков. Путем измерения констант скоростей образования нативного состояния белка дикого типа и мутанта может быть определена разность свободных энергий этих белков в переходномсостоянии ΔΔF# – U (см. график). Величина отношения Ф# = ΔΔF# – U/ΔΔFN – U является мерой участия этого остатка в формировании структуры переходного состояния. Величина Ф# равна единице в том случае, если контакты этой аминокислоты, определяющие изменение стабильности белка в нативном состоянии, возникли уже в переходном состоянии. Это говорит о том, что данная аминокислота входит в ядро сворачивания. Другой крайний случай — величина Ф# равна нулю. Это свидетельствует о том, что контакты данной аминокислоты, влияющие на стабильность нативного белка, возникают на последнем этапе сворачивания после преодоления молекулой свободно энергетического барьера, отвечающего переходному состоянию.
Фолдинг белка. Развёрнутое состояние белка.
Структура белков в развернутом состоянии вряд ли даже отдаленно напоминает структуру статистического клубка, характерного для линейных полимеров в «хорошем» растворителе. Белок приобретает структуру, близкую к структуре статистического клубка, лишь в растворах с высоким содержанием денатурантов, таких как мочевина или гуанидингидрохлорид. Имеются, однако, данные о том, что даже при высоких концентрациях мочевины (8 М) макромолекулы некоторых белков сохраняют элементы структуры, присущие нативному состоянию [10;2005]. Таким образом, состояние U достаточно компактно, и число конформаций основной цепи, с помощью которых оно может быть реализовано, значительно меньше числа всех возможных конформаций основной цепи.
Фолдинг белка. Нативное состояние белка
Схема, иллюстрирующая переход прионного белка, имеющего преимущественно α-спиральную структуру, в состояние амилоидных фибрилл.[4; 2005]
В том случае, если на склонах воронки нет глубоких минимумов, молекула после преодоления свободноэнергетического барьера быстро достигает нативного состояния. Скорее всего, минимум свободной энергии, отвечающей нативному состоянию, в которое белок сворачивается наиболее быстро, является одновременно и абсолютным минимумом свободной энергии. Модель энергетической воронки позволяет, однако, предположить, что нативное состояние не обязательно отвечает абсолютному минимуму свободной энергии, а является состоянием, отвечающим минимуму свободной энергии, который достигается скорейшим образом. Возможно, существует еще один более глубокий или близкий по величине свободной энергии минимум, отделенный от нативного состояния свободноэнергетическим барьером. В этом случае молекула быстро сворачивается в нативное состояние, а потом медленно переходит в неправильно свернутое состояние, отвечающее этому более глубокому, или глобальному, минимуму. Скорость перехода в это неправильно свернутое состояние зависит от свободноэнергетического барьера, отделяющего его от нативного состояния. Примерами белков, для которых такая ситуация реализуется, являются ингибиторы сериновых протеаз — серпины. Энергетические поверхности сворачивания прионов, по-видимому, также имеют два близких по величине минимума свободной энергии. В нативном состоянии прионы являются белками с выраженной β-спиральной вторичной структурой. Второму минимуму свободной энергии отвечает состояние с α-складчатой вторичной структурой. Белок в этом состоянии склонен к агрегации с образованием амилоидных фибрилл. В обычных условиях такие неправильно свернутые молекулы белка ликвидируются защитными системами клетки. Привнесение этого белка извне инициирует процесс превращения α-формы белка в β-форму, что становится причиной развития инфекционной губчатой энцефалопатии — болезни «коровьего бешенства» [5; 2002]. Существует ряд других тяжких заболеваний (которые иногда называют конформационными болезнями), таких как болезни Альцгеймера, Паркинсона и т. д., также связанных с нарушением правильного фолдинга белков и возникновением амилоидных фибрилл [4; 2005]. Болезни эти наиболее часто встречаются у людей преклонного возраста, когда защитные системы клеток и организма в целом не справляются с функцией ликвидации неправильно свернутых белков.
Фолдинг белка. Роль промежуточных состояний в образовании агрегированых форм белков.
При наличии на склонах воронки глубоких локальных минимумов могут образовываться промежуточные состояния. Соотношение доли молекул, находящихся в нативном и промежуточном состояниях в условиях равновесия, определяется разностью их свободных энергий, скорость достижения равновесия — величиной свободноэнергетического барьера, отделяющего эти состояния. В противоположность представлению о том, что промежуточное состояние, являясь вехой на пути сворачивания, может содержать только нативоподобные структуры, модель энергетической поверхности позволяет предположить, что могут существовать промежуточные состояния, имеющие элементы структуры, не присутствующие в нативном белке.
Возникновение таких промежуточных состояний может инициировать ассоциацию или агрегацию макромолекул. В некоторых случаях эти агрегаты могут иметь аморфный характер, в других — возникают обогащенные β-структурой амилоидные фибриллы. Исследования структуры и путей образования денатурированных частично свернутых агрегированных (ассоциированных) форм белков важны не только для решения фундаментальной проблемы фолдинга белка, но имеют также существенное практическое значение для медицины (выяснение причин заболеваний, связанных с нарушением фолдинга белков: [9;2000] и биотехнологии (анализ причин возникновения неправильно свернутых агрегированных форм рекомбинантных белков и их аккумуляции в телах включения. В связи с практической значимостью для медицины выяснение факторов, способствующих образованию амилоидных фибрилл, а также изучение структуры белков в этом состоянии являются в настоящее время предметом интенсивных исследований.
Установлено, что амилоидные фибриллы разного происхождения имеют сходную морфологию. Они представляют собой длинные неразветвленные структуры диаметром несколько нанометров, образованные перевитыми между собой протофибриллами, в которых β-слои ориентированы перпендикулярно оси фибриллы. Для все большего числа белков удается подобрать условия, при которых такие структуры возникают. Обычно амилоидные фибриллы образуются при инкубации белков, находящихся в промежуточных состояниях, при повышенной температуре и интенсивном перемешивании. Это обусловлено, по-видимому, тем, что для этих белков наряду с минимумом свободной энергии, отвечающим промежуточному состоянию, имеется еще один, достаточно глубокий минимум свободной энергии, отвечающий β—форме белка. В этом состоянии белки склонны к агрегации с образованием амилоидных фибрилл. Переход из промежуточного состояния в β -форму при низкой температуре происходит очень медленно, поскольку он требует преодоления значительного активационного барьера, разделяющего эти состояния белка. Скорость этого процесса существенно возрастает при инкубации белка при повышенной температуре. Ввиду того что процесс агрегации β—формы белка сопровождается значительным снижением свободной энергии и является необратимым, этот процесс может осуществляться даже в том случае, если мономер белка в β-форме имеет более высокий уровень свободной энергии, чем тот же белок в промежуточном состоянии, из которого эта форма возникает.
Таким образом, экспериментальные результаты, полученные in vitro, свидетельствуют о том, что первичная структура несет информацию о пространственной структуре макромолекулы и путях ее достижения. Кроме того, она обеспечивает существование свободноэнергетического барьера между развернутым и нативным состояниями белка, в результате чего переход U—N осуществляется как фазовый переход первого рода. Несмотря на огромное число экспериментальных и теоретических работ по изучению процессов сворачивания—разворачивания белков, вопрос о том, каким образом в последовательности аминокислотных остатков закодирована информация о пространственной структуре белка, остается нерешенным. В настоящее время ключевым вопросом является выяснение структуры ядра сворачивания, что требует выполнения чрезвычайно трудоемких экспериментов с привлечением методов генной инженерии для получения мутантных форм белка и физико-химического исследования кинетики процессов их сворачивания—разворачивания. Большинство работ выполнено на небольших однодоменных белках. Значительно менее исследованы процессы фолдинга мультидоменных глобулярных и водонерастворимых мембранных белков.
Фолдинг белка. Болезни, связанные с нарушением фолдинга белка
Существует ряд заболеваний этиология и патогенез которых связан с нарушениями фолдинга белка. Их можно (с теми или иными допущениями) разделить на те, где нарушения процесса свёртывания происходит самопроизвольно и те, где нарушение свёртывание индуцируется инородным белком — прионом.
К первой группе можно отнести такие заболевания как болезнь Альцгеймера, болезнь Паркинсона, по некоторым гипотезам — диабет типа II и рассеяный склероз.
Вторая группа — прионные болезни — болезнь Крейцфельда-Якоби (коровье бешенство), Фатальная семейная бессонница, болезнь Куру и другие.
Фолдинг белка. Болезнь Альцгеймера
Общая характеристика болезни Альцгеймера
Болезнь Альцгеймера (также сенильная деменция альцгеймеровского типа) — наиболее распространённая форма деменции, неизлечимое дегенеративное заболевание, впервые описанное в 1906 году немецким психиатром Алоисом Альцгеймером. Как правило, она обнаруживается у людей старше 65 лет, но существует и ранняя болезнь Альцгеймера — редкая форма заболевания. Общемировая заболеваемость на 2006 год оценивалась в 26.6 млн человек, а к 2050 году число больных может вырасти вчетверо.
Заболеваемость у лиц старше 65 лет
|
Возраст |
Заболеваемость (новые случаи) |
|---|---|
|
65-69 |
3 |
|
70-74 |
6 |
|
75-79 |
9 |
|
80-84 |
23 |
|
85-89 |
40 |
|
90- |
69 |
У каждого человека болезнь протекает по-своему, но при этом наблюдается ряд общих симптомов. Первые заметные проявления обычно по ошибке связывают с преклонным возрастом или объясняют влиянием стресса. Наиболее часто на ранних стадиях распознаётся расстройство памяти, этот симптом может проявляться, например, неспособностью вспомнить недавно заученную информацию. При обращении к врачу и подозрении на болезнь Альцгеймера, для уточнения диагноза обычно анализируют поведение, проводят серию когнитивных тестов, если возможно, проводится магнитно-резонансная томография (МРТ).С развитием болезни проявляются такие симптомы как спутанность, раздражительность и агрессивность, колебания настроения, нарушается способность говорить и понимать сказанное (афазия), происходит потеря долговременной памяти и общее самоустранение больного от дел по мере затухания сознания. Постепенная потеря функций организма ведёт к смерти. Индивидуальный прогноз затруднён из-за вариаций в длительности течения болезни, которая может развиваться подспудно на протяжении длительного времени прежде, чем станут заметны симптомы и будет поставлен диагноз. Средняя продолжительность жизни после установления диагноза составляет около семи лет,менее трех процентов больных живут более четырнадцати лет. [16; 2008]
В настоящее время не достигнуто полного понимания причин и хода болезни Альцгеймера. Исследования говорят об ассоциации болезни с накоплением бляшек и нейрофибриллярных клубков в тканях мозга. Современные методы терапии лишь несколько смягчают симптомы, но пока не позволяют ни замедлить, ни остановить развитие заболевания. Множество перспективных методов терапии достигли этапа клинических испытаний, число которых на 2008 год составляло более пятисот, однако неясно, будет ли доказана их эффективность. Предлагается множество способов предупредить болезнь Альцгеймера, но не отмечено их воздействия на ход заболевания и его тяжесть. Как для предупреждения, так и для борьбы с болезнью часто рекомендуют заниматься физическими упражнениями, стимулировать мышление и придерживаться сбалансированной диеты.
Болезнь Альцгеймера принадлежит к заболеваниям, накладывающим самый тяжелый финансовый груз на общество в развитых странах.
Течение болезни Альцгеймера
Ход болезни подразделяют на четыре стадии, с прогрессирующей картиной когнитивных и функциональных нарушений. [12;2003]
Предеменция
Первые симптомы часто путают с проявлениями старения или реакцией на стресс. Наиболее ранние когнитивные затруднения выявляются у некоторых людей при детальном нейрокогнитивном тестировании за восемь лет до постановки диагноза. Эти изначальные симптомы могут отражаться на выполнении самых сложных повседневных задач. Наиболее заметно расстройство памяти, проявляющееся в затруднении при попытке вспомнить недавно заученные факты и в неспособности усвоить новую информацию. Малозаметные проблемы исполнительных функций: сосредоточенности, планирования, когнитивной гибкости и абстрактного мышления, либо нарушение семантической памяти (память о значении слов, о взаимоотношении концепций), также могут быть симптомом ранних стадий болезни Альцгеймера. На этой стадии может отмечаться апатия, которая остаётся самым устойчивым нейропсихиатрическим симптомом на всём протяжении заболевания.Также преклиническую стадию называют «мягким когнитивным нарушением»,но ведутся споры о том, использовать ли последнее название для обозначения первой ступени болезни Альцгеймера либо выделить в отдельную диагностическую единицу.
Ранняя деменция
Прогрессирующее снижение памяти и агнозия при болезни Альцгеймера рано или поздно ведут к подтверждению диагноза. У небольшого числа пациентов при этом на первый план выступают не расстройства памяти, а нарушения речи, исполнительных функций, восприятия либо двигательные нарушения (апраксия). Болезнь по-разному отражается на различных аспектах памяти. Старые воспоминания о собственной жизни (эпизодическая память), давно заученные факты (семантическая память), имплицитная память (неосознанная «память тела» о последовательности действий, например, о том, как использовать столовые приборы) в меньшей степени подвержены расстройству по сравнению с новыми фактами или воспоминаниями. Афазия в основном характеризуется оскудением словарного запаса и сниженной беглостью речи, что в целом ослабляет способность к словесному и письменному выражению мыслей. На этой стадии болезни человек обычно способен адекватно оперировать простыми понятиями при речевом общении. При рисовании, письме, надевании одежды и других задачах с использованием тонкой моторики, человек может казаться неловким из-за определённых проблем с координацией и планированием движений. По мере развития болезни человек зачастую вполне способен выполнять многие задачи независимо, однако ему могут потребоваться помощь или присмотр при попытке провести манипуляции, требующие особенных когнитивных усилий.
Умеренная деменция
Способность к независимым действиям снижается из-за прогрессирующего ухудшения состояния. Расстройства речи становятся очевидными, так как с потерей доступа к словарному запасу человек все чаще подбирает неверные слова на замену забытым (парафразия). Также идет потеря навыков чтения и письма.Со временем всё более нарушается координация при выполнении сложных последовательностей движений, что снижает способность человека справляться с большинством повседневных задач. На этом этапе усиливаются проблемы с памятью, и больной может не узнавать близких родственников. Прежде нетронутая долговременная память также нарушается и отклонения в поведении становятся более заметными. Обычными являются такие нейропсихиатрические проявления как бродяжничество, вечернее обострение (англ. sundowning), раздражительность и эмоциональная лабильность, проявляющаяся в плаче, спонтанной агрессии, или в сопротивлении уходу. Синдром ложной идентификации и другие симптомы бреда развиваются примерно у 30 % пациентов. Может развиться недержание мочи. У родственников больного и ухаживающих за ним лиц эти симптомы вызывают стресс, который может быть смягчён перемещением пациента из-под домашнего присмотра в стационарное заведение.[15; 2009]
Тяжелая деменция
На последней стадии болезни Альцгеймера пациент полностью зависит от посторонней помощи. Владение языком сокращается до использования единичных фраз и даже отдельных слов, и в итоге речь полностью теряется. Несмотря на утрату вербальных навыков, пациенты часто способны понимать и отвечать взаимностью на эмоциональные обращения к ним. Хотя на этом этапе все еще могут быть проявления агрессии, гораздо чаще состояние больного характеризуется апатией и истощением,и с какого-то момента он не в состоянии осуществить даже самое простое действие без чужой помощи. Больной теряет мышечную массу, передвигается с трудом и на определенном этапе оказывается не в силах покинуть кровать, а затем и самостоятельно питаться. Смерть наступает обычно вследствие стороннего фактора, такого как пролежневая язва или пневмония, а не по вине собственно болезни Альцгеймера. [14; 2006]
Фолдинг белка. Биохимия и патофизиология болезни Альцгеймера.
Причины развития болезни Альцгеймера
Объяснение возможных причин заболевания предложено в трёх основных конкурирующих гипотезах. Согласно старейшей «холинергической гипотезе», на которой основано большинство существующих методов терапии, болезнь Альцгеймера вызывается сниженным синтезом нейромедиатора ацетилхолина. Поддержка этой гипотезы ослабла, поскольку медикаменты, призванные скорректировать дефицит ацетилхолина, имеют невысокую эффективность. Предполагаются иные холинергические эффекты, например, инициация крупномасштабной агрегации амилоида,ведущая к генерализованному нейровоспалительному процессу.
В 1991 году была предложена «амилоидная гипотеза», согласно которой базовой причиной заболевания являются отложения бета-амилоида (Aβ). Ген, кодирующий белок (APP), из которого образуется бета-амилоид, расположен на 21 хромосоме. Интересным фактом в поддержку амилоидной гипотезы является то, что практически у всех доживших до 40 лет людей, страдающих синдромом Дауна (дополнительная копия 21 хромосомы либо ее участка), обнаруживается Альцгеймер-подобная патология. К тому же APOE4, основной генетический фактор риска болезни Альцгеймера, приводит к избыточному накоплению амилоида в тканях мозга ещё до наступления симптомов. Более того, у трансгенных мышей, в организме которых вырабатывается мутантная форма человеческого гена APP, в мозге происходит отложение фибриллярных амилоидных бляшек и отмечаются другие патологические признаки, свойственные болезни Альцгеймера. Экспериментальная вакцина продемонстрировала способность очищать мозг от амилоидных бляшек в ранних испытаниях на людях, однако не оказала значительного воздействия на деменцию.
Не обнаружено уверенной корреляции накопления бляшек с потерей нейронов. Это говорит в поддержку тау-гипотезы, согласно которой каскад нарушений запускается отклонениями в структуре тау-белка. Предположительно, нити гиперфосфорилированного тау-белка начинают объединяться между собой, образуя в итоге нейрофибриллярные клубки внутри нервных клеток. Это вызывает дезинтеграцию микротрубочек и коллапс транспортной системы внутри нейрона,приводя сначала к нарушению биохимической передачи сигналов между клетками, а затем и к гибели самих клеток.
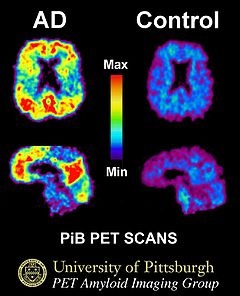
ПЭТ-сканирование: При болезни Альцгеймера, введённый в организм Питтсбургский состав B скапливается в мозге, закрепляясь за отложения бета-амилоида (слева). Справа — мозг пожилого человека без признаков болезни Альцгеймера. [21; 2009]
Фолдинг белка. Нейропатология при болезни Альцгеймера
Болезнь характеризуется потерей нейронов и синаптических связей в коре головного мозга и определённых субкортикальных областях. Гибель клеток приводит к выраженной атрофии поражённых участков, в том числе к дегенерации височных и теменной долей, участков фронтальной коры и поясной извилины.
Как амилоидные бляшки, так и нейрофибриллярные клубки хорошо заметны под микроскопом при посмертном анализе образцов мозга больных. Бляшки представляют собой плотные, в большинстве случаев нерастворимые отложения бета-амилоида и клеточного материала внутри и снаружи нейронов. Внутри нервных клеток они растут, образуя нерастворимые закрученные сплетения волокон, часто называемые клубками. У многих пожилых людей в мозге образуется некоторое количество бляшек и клубков, однако при болезни Альцгеймера их больше в определённых участках мозга, таких как височные доли.
Фолдинг белка. Биохимия развития болезни Альцгеймера
При болезни Альцгеймера изменения в структуре тау-белка (Тау-белок(англ. Microtubule-associated protein tau, MAPT) принадлежит к группе белков, ассоциированных с микротрубочками (MAP).Альтернативный сплайсинг порождает в организме человека шесть известных изоформ белка, в основном обнаруживаемых в нейронах.) приводят к дезинтеграции микротрубочек в клетках мозга.

Ферменты разрезают предшественник бета-амилоида на участки, один из которых играет ключевую роль в формировании сенильных бляшек при болезни Альцгеймера. [20; 2009]
Более специфически, болезнь Альцгеймера относят также к таупатиям — болезням, связанным с ненормальной агрегацией тау-белка. Каждый нейрон содержит цитоскелет, отчасти составленный из микротрубочек, которые действуют подобно рельсам, направляя питательные вещества и другие молекулы из центра на периферию клетки, к окончанию аксона, и обратно. Тау-белок, наряду с несколькими другими белками, ассоциирован с микротрубочками, в частности, после фосфорилирования он их стабилизирует. При болезни Альцгеймера тау-белок подвергается избыточному фосфорилированию, из-за чего нити белка начинают связываться друг с другом, слипаться в нейрофибриллярные клубки и разрушать транспортную систему нейрона.
Фолдинг белка. Патологический механизм болезни Альцгеймера
Неизвестно, как именно нарушение синтеза и последующее скопление бета-амилоидных пептидов вызывает патологические отклонения при болезни Альцгеймера. Амилоидная гипотеза традиционно указывала на скопление бета-амилоида как на основное событие, запускающее процесс нейрональной дегенерации. Считается, что отложения нарушают гомеостаз ионов кальция в клетке и провоцируют апоптоз. Известно, что местом скопления Aβ в нейронах пациентов являются митохондрии, также этот пептид ингибирует работу некоторых ферментов и влияет на использование глюкозы.
Воспалительные процессы и цитокины могут играть роль в патофизиологии. Поскольку воспаление является признаком повреждения тканей при любом заболевании, при болезни Альцгеймера оно может играть вторичную роль по отношению к основной патологии либо представлять собой маркер иммунной реакции.
Фолдинг белка. Влияние генетической предрасположенности на развитие болезни Альцгеймера
Известны три гена, мутации которых в основном позволяют объяснить происхождение редкой ранней формы, однако распространенная форма болезни Альцгеймера пока не укладывается в рамки исключительно генетической модели. Наиболее выраженным генетическим фактором риска на данный момент считается APOE, но вариации этого гена ассоциированы лишь с некоторыми случаями болезни.
Менее 10 % случаев болезни в возрасте до 60 лет связаны с аутосомно-доминантными (семейными) мутациями, которые в общем массиве составляют менее 0.01 %. Мутации обнаружены в генах APP, пресенилина 1 и пресенилина 2, большинство из них усиливают синтез малого белка Abeta42, основного компонента сенильных бляшек.
В роду большинства больных не отмечается предрасположенности к заболеванию, однако гены могут отчасти обуславливать риск. Самый известный генетический фактор риска — наследуемая аллель E4 гена APOE, с которой может быть связано до половины случаев поздней спорадической болезни Альцгеймера.Генетики сходятся в мнении о том, что многие другие гены могут в какой-то степени способствовать либо препятствовать развитию поздней болезни Альцгеймера. Всего на ассоциацию с этим распространенным типом болезни проверено более 400 генов. Один из недавних примеров — вариация гена RELN, связанная с повышенной заболеваемостью у женщин.
Фолдинг белка. Диагностика
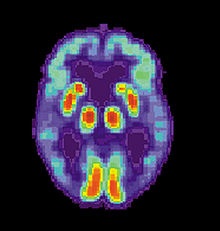
PET-сканирование мозга при болезни Альцгеймера демонстрирует угасание активности в височных долях.
Клинический диагноз болезни Альцгеймера обычно основан на истории пациента (анамнезе жизни), истории его родственников и клинических наблюдений (наследственном анамнезе), при этом учитываются характерные неврологические и нейропсихологические признаки и исключаются альтернативные диагнозы. Для того, чтобы отличить болезнь от других патологий и разновидностей деменции, могут быть использованы сложные методы медицинской визуализации — компьютерная томография, Магнитно-резонансная томография, фотонно эмиссионная компьютерная томография или Позитронно-эмиссионная томография. Для более точной оценки состояния проводится тестирование интеллектуальных функций, в том числе памяти. Медицинские организации вырабатывают диагностические критерии с целью облегчить диагностику практикующему врачу и стандартизировать процесс постановки диагноза. Иногда диагноз подтверждается либо устанавливается посмертно при гистологическом анализе тканей мозга.
Фолдинг белка. Диагностические критерии
Национальный Институт Неврологических и Коммуникативных Расстройств и Инсульта (NINDS) и Ассоциация болезни Альцгеймера составили наиболее часто используемый набор критериев для диагностики болезни Альцгеймера. Согласно критериям, для постановки клинического диагноза возможной болезни Альцгеймера требуется подтвердить наличие когнитивных нарушений и предположительного синдрома деменции в ходе нейропсихологического тестирования. Для окончательного подтверждения диагноза необходим гистопатологический анализ тканей мозга, и в ходе сверки прижизненных диагнозов по критериям с посмертным анализом были отмечены хорошая статистическая надёжность и проверяемость. Чаще всего нарушения при болезни Альцгеймера затрагивают восемь доменов: память, языковые навыки, способность воспринимать окружающее, конструктивные способности, ориентирование в пространстве, времени и собственной личности, навыки решения проблем, функционирования, самообеспечения. Эти домены эквивалентны критериям NINCDS-ADRDA, перечисленным в DSM-IV-TR.
Фолдинг белка. Диагностические инструменты
В диагностике болезни Альцгеймера может помочь нейропсихологическое скрининг-тестирование, при котором пациенты копируют фигуры, запоминают слова, читают, выполняют арифметические действия.
Нейропсихологические тесты, например, MMSE, широко применяются для оценки когнитивных нарушений, которые должны присутствовать при заболевании. Для получения надёжных результатов требуются более развёрнутые наборы тестов, особенно на ранних стадиях болезни.[96][97] В начале болезни неврологический осмотр обычно не показывает ничего необычного, за исключением явных когнитивных отклонений, которые могут напоминать обычную деменцию. Ввиду этого, для дифференциальной диагностики болезни Альцгеймера и других заболеваний важно расширенное неврологическое исследование. Беседа с членами семьи также используется при оценке хода болезни, поскольку родственники могут предоставить важную информацию об уровне повседневной активности человека и о постепенном снижении его мыслительных способностей. Так как сам пациент обычно не замечает нарушений, точка зрения ухаживащих за ним людей особенно важна. В то же время во многих случаях ранние симптомы деменции остаются незамеченными в семье и врач получает от родственников неточную информацию.Дополнительные тесты обогащают картину информацией о некоторых аспектах болезни либо позволяют исключить другие диагнозы. Анализ крови может выявить альтернативные причины деменции,которые изредка даже поддаются терапии, обращающей симптомы вспять.Также применяются психологические тесты для выявления депрессии, которая может как сопутствовать болезни Альцгеймера, так и являться причиной когнитивного снижения.
Аппаратура SPECT- и PET-визуализации при её доступности может быть использована для подтверждения диагноза совместно с другими методами оценки, включающими анализ ментального статуса. У людей, уже страдающих от деменции, SPECT, по некоторым данным, позволяет более эффективно дифференцировать болезнь Альцгеймера от других причин, по сравнению со стандартным тестированием и рассмотрением анамнеза. Возможность наблюдать отложения бета-амилоида в мозге живых людей появилась благодаря созданию в Питтсбургском университете Питтсбургского состава B (PiB), связывающегося с амилоидными отложениями при введении в организм. Короткоживущий радиоактивный изотоп углерод-11 в соединении позволяет определять распределение этого вещества в организме и получать картину амилоидных отложений в мозге больного с помощью ПЭТ-сканера. Показано также, что объективным маркером болезни может быть содержание бета-амилоида либо тау-белка в спинномозговой жидкости. Эти два новых метода вызвали предложения о разработке новых диагностических критериев.
Анализ заболеваемости болезнью Альцгеймера в мире
За основу был взят анализ ВОЗ, проведённый на основе официальных данных министерств здравоохранения различных стран:
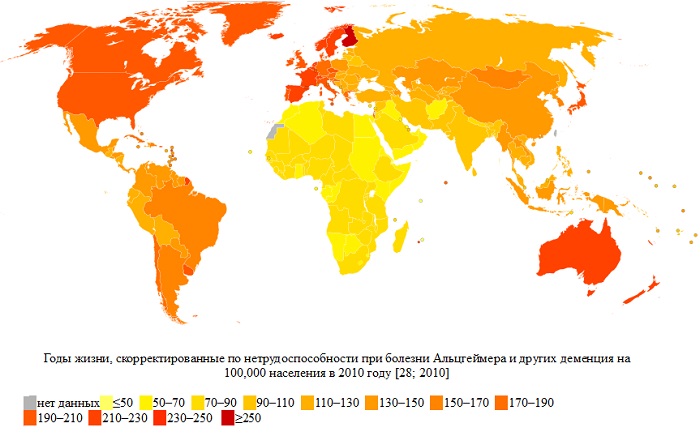
Годы жизни, скорректированные по нетрудоспособности (DALY, сокр. от «Disability-adjusted life year») — показатель, оценивающий суммарное «бремя болезни». DALY был впервые разработан Всемирной организацией здравоохранения, и в настоящее время все чаще используется в сферах общественного здравоохранения. Показатель представляет собой линейную сумму потенциальных лет жизни, потраченных из-за преждевременной смерти и нетрудоспособности. Таким образом, смертность и заболеваемость удаётся оценить в одних единицах измерения и представить в виде одного показателя. Осмысление DALY впервые было выполнено Мюррэем (Murray) и Лопезом (Lopez) в изданной в 1996 году при содействии Всемирной Организации Здравоохранения и Всемирного Банка работе.
При взгляде на эту карту отчётливо видно, что по заболеваемости и смертности болезнью Альцгеймера первые позиции занимают США, Англия, Франция, Германия, Дания и Австралия. Жители России и стран СНГ менее подвержены этому заболеванию, стран Африки — в наименьшей степени.
Несмотря на другие статистические данные, говорящие о том, что люди негроидной расы менее подвержены болезни Альцгеймера (на 1000 европоидов приходится порядка 800 негроидов имеющих диагноз Болезнь Альцгеймера) достаточно ясно, что статистика ВОЗ не отражает реального состояния дел.
Для доказательства этого было решено взять процентные расходов на медицину в бюджетах разных стран и наложить их на карту мира.
Все цифры я не стал здесь приводить за избыточностью и ненужностью, но для примера:
|
Страна |
Расходная часть бюджета |
Расходы на медицину и здравоохранение |
% на медицину и здравоохранение |
|
Российская Федерация [29; 2010] |
9 166 433 752,5 тыс. рублей |
300 397 082,1 тыс. рублей |
3,28 |
|
Украина [30; 2010] |
321 948 850,3 тыс. гривн |
31 168 612,2 тыс. гривн |
9,68 |
|
США [31; 2010] |
3,94 трлн. долларов |
0,615 трлн.долларов |
15,62 |
|
Япония [32; 2010] |
92,41 трлн. йен |
6,65 трлн. йен |
7,2 |
В итоге была получена следующая карта:
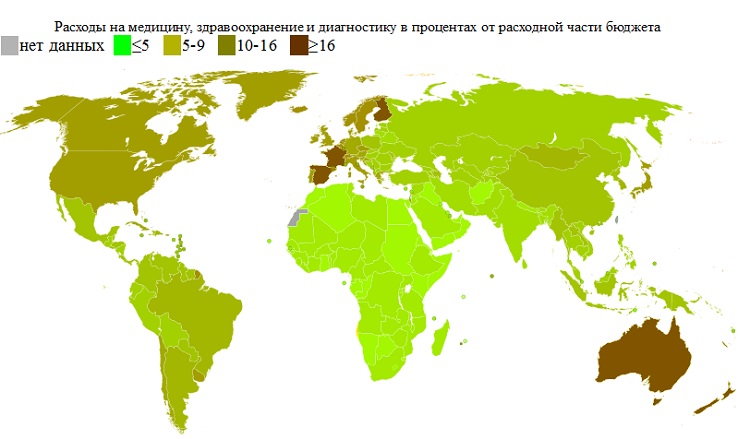
Взглянув на эти две карты можно отчётливо увидеть, что количество зарегистрированных случаев болезни Альцгеймера зависит не столько от уровня жизни, экологических условий и тому подобного, сколько от расходов на своевременную диагностику и обнаружение болезни.
В странах с низким уровнем расходов на диагностику — и как следствие в большинстве случаев — с низким её качеством, в большей части смертей от болезни Альцгеймера истинная причина даже не фиксируется.
Фолдинг белка. Фармакотерапия болезни Альцгеймера
Регулирующими агентствами, такими как FDA и EMEA, в настоящее время одобрены четыре препарата для терапии когнитивных нарушений при болезни Альцгеймера — три ингибитора холинэстеразы и мемантин, NMDA-антагонист. При этом нет таких лекарств, среди действий которых было бы указано замедление либо остановка развития болезни Альцгеймера.
Известным признаком болезни Альцгеймера является снижение активности холинергических нейронов. Ингибиторы холинэстеразы снижают скорость разрушения ацетилхолина (ACh), повышая его концентрацию в мозге и компенсируя потерю ACh, вызванную потерей холинергических нейронов. По состоянию на 2008 год, врачами использовались такие ACh-ингибиторы как донепезил, галантамин, и ривастигмин (в форме таблеток и пластыря ) [14; 2006]. Есть свидетельства эффективности этих препаратов на начальной и умеренной стадиях, а также некоторые основания к их применению на поздней стадии. Только донепезил одобрен к применению при наступлении тяжелой деменции. Использование этих препаратов при мягком когнитивном нарушении не замедлило наступления болезни Альцгеймера. Среди побочных действий препаратов самыми распространёнными являются чувство тошноты и рвота, связанные с избытком холинергической активности, они возникают у 10-10 % пациентов и могут быть слабо- либо умеренно выраженными. Реже встречаются спазмы мышц, брадикардия, снижение аппетита, потеря веса, увеличение кислотности желудочного сока.
Возбудительный нейротрансмиттер глутамат играет важную роль в работе нервной системы, но его избыток ведет к чрезмерной активации глутаматных рецепторов и может вызывать гибель клеток. Этот процесс, называемый эксайтотоксичностью, отмечается не только при болезни Альцгеймера, но и при других состояниях, например, при болезни Паркинсона и рассеянном склерозе. Препарат под названием Мемантин, изначально применявшийся при лечении гриппа, ингибирует активацию глутаматных NMDA-рецепторов. [13; 2003] Показана умеренная эффективность мемантина при болезни Альцгеймера умеренной и сильной тяжести, но неизвестно, как он действует на ранней стадии. Редко отмечаются слабовыраженные побочные эффекты, среди них — галлюцинации, замешательство, головокружение, головная боль и утомление. В комбинации с донепезилом мемантин демонстрирует «статистически значимую, но клинически едва заметную эффективность» в действии на когнитивные показатели.
У пациентов, чьё поведение представляет проблему, антипсихотики могут в умеренной степени снизить агрессию и воздействовать на психоз. В то же время эти препараты вызывают серьёзные побочные эффекты, в частности, цереброваскулярные осложнения, двигательные нарушения и снижение когнитивных способностей, что исключает их повседневное использование. При длительном назначении антипсихотиков при болезни Альцгеймера отмечается повышенная смертность. [16; 2006]
Фолдинг белка. Направление исследований
Фолдинг белка. Фармация, биохимия и молекулярная биология.
В 2008 году более 400 фармацевтических препаратов находились на стадии тестирования в различных странах мира. Примерно четверть из них проходили III фазу клинических испытаний, при успешном завершении которой вопрос о применении средства рассматривается регулирующими органами.
Существует направление клинических исследований, нацеленное на коррекцию базовых патологических изменений. Одной из типичных мишеней для препаратов, проходящих тестирование, являются скопления бета-амилоида, которые необходимо сократить. Испытываются такие методы, как иммунотерапия или вакцинация против амилоидного белка. В отличие от обычной вакцинации, осуществляемой заранее, в случае болезни Альцгеймера вакцина будет вводиться пациентам, уже получившим диагноз. Согласно концепции исследователей, иммунная система больного должна научиться распознавать и атаковать отложения амилоида, уменьшая их размеры и облегчая течение болезни. В качестве конкретного примера вакцины можно привести молекулу ACC-001, клинические испытания которой были заморожены в 2008 году. Другое подобное средство — бапинейзумаб, искусственное антитело, идентичное натуральному анти-амилоидному антителу. Также в разработке находятся нейропротекторные средства, например, AL-108,и ингибиторы металло-белковых взаимодействий, такие как PBT2.Гибридный белок этанерцепт, действующий как TNF-ингибитор, демонстрирует обнадёживающие результаты.
В ходе клинических испытаний, проведённых в 2008 году, у пациентов на начальной и умеренной стадиях были отмечены позитивные сдвиги в течении болезни под воздействием тетраметилтионина хлорида, ингибирующего агрегацию тау-белка,и антигистамина димебона. [18; 2009]
Чтобы обеспечить учёным разных стран возможность обмениваться идеями и предлагать гипотезы, а также предоставить всем интересующимся сведения о новейших научных исследованиях, был создан онлайн-проект Alzheimer Research Forum.
Фолдинг белка. Системы распределённых вычислений.
Folding@home — проект распределённых вычислений для проведения компьютерной симуляции свёртывания молекул белка. Проект запущен 1 октября 2000 года учёными из Стэнфордского университета. По состоянию на июль 2008 года — это крупнейший проект распределённых вычислений, как по мощности, так и по числу участников. [1; 2010]
Цель проекта — с помощью моделирования процессов свёртывания/развёртывания молекул белка получить лучшее понимание причин возникновения болезней, вызываемых дефектными белками, таких как Альцгеймера, Паркинсона, диабет типа II, болезнь Крейтцфельдта — Якоба (коровье бешенство) и склероз. К настоящему времени проект Folding@home успешно смоделировал процесс свёртывания белковых молекул на протяжении 5—10 мкс — что в тысячи раз больше предыдущих попыток моделирования.[6; 2010]. По результатам эксперимента вышло несколько научных работ.
Фолдинг белка. Болезнь Крейтцфельдта — Якоба
Болезнь Кройцфельдта — Якоба, (более распространена транскрипция Крейтцфельдта — Якоба, названо по именам немецких врачей Hans Gerhard Creutzfeldt, Alfons Maria Jakob; синонимы: псевдосклероз спастический, синдром кортико-стриоспинальной дегенерации, трансмиссивная спонгиоформная энцефалопатия, коровье бешенство) — прогрессирующее дистрофическое заболевание коры большого мозга, базальных ганглиев и спинного мозга. Считается основным проявлением губчатой энцефалопатии (прионная болезнь).
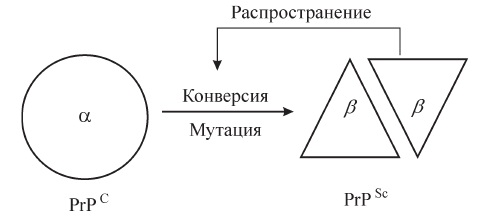
Прионы (от англ. proteinaceous infectious particles — белковые заразные частицы) — особый класс инфекционных агентов, чисто белковых, не содержащих нуклеиновых кислот, вызывающих тяжёлые заболевания центральной нервной системы у человека и ряда высших животных (т. н. «медленные инфекции»). Прионный белок, обладающий аномальной трёхмерной структурой, способен прямо катализировать структурное превращение гомологичного ему нормального клеточного белка в себе подобный (прионный), присоединяясь к белку-мишени и изменяя его конформацию. Как правило, прионное состояние белка характеризуется переходом α-спиралей белка в β-слои.
Фолдинг белка. Молекулярные основы патогенеза болезни
В ходе исследований мозговых тканей умерших от прионных инфекций животных было показано, что прионы не содержат нуклеиновых кислот, а представляют собой белки. Одним из первых охарактеризованных прионных белков стал PrP (от англ. prion-related protein или protease-resistant protein) массой около 35 кДа. Известно, что PrP может существовать в двух конформациях — «здоровой» — PrPC, которую он имеет в нормальных клетках (C — от англ. cellular — «клеточный»), в которой преобладают альфа-спирали, и «патологической» — PrPSc, собственно прионной (Sc- от scrapie), для которой характерно наличие большого количества бета-тяжей. При попадании в здоровую клетку, PrPSc катализирует переход клеточного PrPC в прионную конформацию. Накопление прионного белка сопровождается его агрегацией, образованием высокоупорядоченных фибрил (амилоидов), что в конце концов приводит к гибели клетки. Высвободившийся прион, по-видимому, оказывается способен проникать в соседние клетки, также вызывая их гибель.
Функции белка PrPC в здоровой клетке — поддержание качества миелиновой оболочки, которая в отсутствии этого белка постепенно истончается. В норме белок PrPC ассоциирован с клеточной мембраной, гликозилирован остатком сиаловой кислоты. Он может совершать циклические переходы внутрь клетки и обратно на поверхность в ходе эндо- и экзоцитоза. Один такой цикл длится около часа. В эндоцитозном пузырьке или на поверхности клетки молекула PrPC может разрезаться протеазами на две примерно равные части.
До конца механизм спонтанного возникновения прионных инфекций не ясен. Считается (но ещё не полностью доказано), что прионы образуются в результате ошибок в биосинтезе белков. Мутации генов, кодирующих прионный белок (PrP), ошибки трансляции, процессы протеолиза — считаются главными кандидатами на механизм возникновения прионов. Согласно недавно проведённым исследованиям прионы способны к дарвиновской эволюции за счёт действия естественного отбора. [25; 2006]
Фолдинг белка. Этиология болезни Кройцфельдта — Якоба
Человек может заразиться прионами, содержащимися в пище, так как они не разрушаются ферментами пищеварительного тракта. Беспрепятственно проникая через стенку тонкого кишечника, они в конечном итоге попадают в центральную нервную систему. Так переносится новый вариант болезни Крейтцфельдта-Якоба (nvCJD), которой люди заражаются после употребления в пищу говядины, содержащей нервную ткань из голов скота, больных бычьей губчатой энцефалопатией (BSE, коровье бешенство).
Прионы могут проникать в тело и парентеральным путем. Были описаны случаи заражения при внутримышечном введении препаратов, изготовленных из человеческих гипофизов (главным образом гормоны роста для лечения карликовости), а также заражение мозга инструментами при нейрохирургических операциях, поскольку прионы устойчивы к применяемым в настоящее время термическим и химическим методам стерилизации. Эта форма болезни Крейтцфельдта-Якоба обозначается как ятрогенная (1CJD).
При определённых, неизвестных условиях, в организме человека может произойти спонтанная трансформация прионного белка в прион. Так возникает так называемая спорадическая болезнь Крейтцфельдта-Якоба (sCJD), впервые описанная в 1920 г. независимо друг от друга Гансом Герхардом Крейтцфельдтом и Альфонсом Марией Якобом. Предполагается, что спонтанное возникновение этой болезни связано с фактом, что в норме в человеческом теле постоянно возникает небольшое количество прионов, которые эффективно ликвидируются клеточным Аппаратом Гольджи. Нарушение этой способности «самоочищения» клеток может привести к повышению уровня прионов выше допустимой границы нормы и к их дальнейшему неконтролируемому распространению. Причиной возникновения спорадической болезни Крейтцфельдта-Якоба согласно этой теории является нарушение функции Аппарата Гольджи в клетках.
Особую группу прионовых заболеваний представляют собой наследственные (врожденные) болезни, вызванные мутацией гена прионового белка, который делает возникший прионовый белок более подверженным спонтанному изменению пространственной конфигурации и превращения их в прионы. К этой группе наследственных заболеваний относится и наследственная форма болезни Крейтцфельдта-Якоба (fCJD), которая наблюдается в ряде стран мира.
При прионовой патологии наивысшая концентрация прионов обнаружена в нервной ткани заражённых людей. Значительное количество прионов встречается в лимфатической ткани. Наличие прионов в биологических жидкостях, включая слюну, пока не было однозначно подтверждено. Если представление о постоянном возникновении небольшого количества прионов верно, то можно предположить, что новые, более чувствительные методы диагностики откроют это количество прионов, разбросанное по различным тканям. В данном случае, однако, речь пойдёт о «физиологическом» уровне прионов, которые не представляют собой никакой угрозы для человека. [26; 1999]
Фолдинг белка. Формы болезни болезни Кройцфельдта — Якоба
Спонтанная — классическая
Согласно современным представлениям (прионной теории), прионы при этой форме заболевания возникают в мозге спонтанно, без какой-либо видимой внешней причины. Болезнь обычно поражает людей в возрасте более 50 лет и проявляется с вероятностью 1-2 случая на миллион жителей. Вначале проявляется в форме кратких потерь памяти, изменениями настроения, потерей интереса к происходящему вокруг. Больной постепенно перестает осиливать и текущие действия, связанные с каждодневной жизнью. В конечной фазе наступает расстройство зрения, галлюцинации и расстройство речи (особенная медленная речь).
Около 40 % больных со спорадической формой имеют подострое течение с прогрессирующими когнитивными нарушениями, в 40 % случаев встречаются мозжечковые нарушения, в 20 % — их комбинация.
- Клиническая картина включает расстройства поведения, нарушения высших корковых функций, корковые нарушения зрения (вплоть до корковой слепоты), мозжечковую дисфункцию, сочетание пирамидной и экстрапирамидной симптоматики, эпилептические припадки
- Практически у всех больных развиваются фокальные, в том числе миоклонус века, миоклонус губы и/или вторично-генерализованные миоклонические припадки, которые могут провоцироваться фоно- и фотостимуляцией, тактильным раздражением (прикосновением). У большинства больных во время ЭЭГ-исследования выявляются характерные периодические или псевдопериодические пароксизмы острых волн и/или спайков на общем замедленном низкоамплитудном фоне биоэлектрической активности головного мозга.
- В терминальной стадии — глобальные выраженные когнитивные нарушения, летальный исход через 8 месяцев от дебюта заболевания.
Наследственная
Болезнь возникает в семьях, где наследуется повреждение гена для прионового белка. Дефектный прионовый белок является намного более подверженным спонтанному превращению в прион. Признаки и ход болезни подобны классической форме.
Ятрогенная
Болезнь возникает непреднамеренным внесением прионов в тело пациента при медицинском вмешательстве. Источником прионов ранее были некоторые лекарства, инструменты или мозговые оболочки, которые забирались у мертвых людей и использовались для закрытия раны при операциях на мозге. Сегодня этот источник заражения полностью устранен. Признаки и ход болезни подобен классической форме.
Новый вариант
Болезнь появилась впервые в 1995 году в Великобритании и от того момента от нее умерло не более 100 человек. Вероятнее всего, что они заразились мясными продуктами, содержащими бычьи прионы из мозга «бешеных коров». В отличие от «классической» формы болезнь поражает и молодых людей в возрасте около 20 лет. В первую очередь она проявляется в изменении личности. Люди теряют интерес к своему хобби, сторонятся и своих самых близких, поддаются депрессиям. Далее следует похудание, нарушение координации движений. Пациент неспособен сам о себе позаботиться, не соблюдает основные правила гигиены, не может без чужой помощи поесть. Повреждение мозга все больше и больше нарушает основные жизненные функции, и, наконец, пациент умирает. В отличие от классической формы при новом варианте болезни Кройцфельдта — Якоба отдалено наступление слабоумия, и пациент очень долго осознает свое ухудшающееся состояние. [27; 2008]
Основные характеристики:
- психические расстройства и сенсорные нарушения,
- характерны глобальные когнитивные нарушения и атаксия.
- описано несколько случаев заболевания, дебютировавшего с корковой слепоты (вариант Heidenhain).
Фолдинг белка. Общие клинические проявления Болезни Крейцфельтда-Якоба
- быстро прогрессирующая — в течение 2 лет — («опустошающая») деменция с дезинтеграцией всех высших корковых функций; пирамидные нарушения (спастические парезы);
- экстрапирамидные нарушения (хореоатетоз);
- миоклонус;
- атаксия, акинетический мутизм;
- дизартрия;
- эпилептические припадки;
- зрительные нарушения (диплопия)
Стадии заболевания:
- Продромальный период — симптомы неспецифичны и возникают примерно у 30 % больных. Они появляются за недели и месяцы до возникновения первых признаков деменции и включают астению, нарушения сна и аппетита, внимания, памяти и мышления, снижение массы тела, потерю либидо, изменение поведения.
- Инициальный период — для первых признаков заболевания обычно характерны зрительные нарушения, головные боли, головокружение, неустойчивость и парестезии. У основной части больных постепенно развивается, реже — острый или подострый дебют. В некоторых случаях, как при так называемых амиотрофических формах, неврологические знаки могут предшествовать началу деменции.
- Развернутый период — обычно отмечается прогрессирующий спастический паралич конечностей с сопутствующими экстрапирамидными знаками, тремором, ригидностью и характерными движениями. В других случаях может отмечаться атаксия, падение зрения или мышечная фибрилляция и атрофия верхнего двигательного нейрона.
Фолдинг белка. Диагностика
БКЯ должна предполагаться во всех случаях деменций, которые прогрессируют быстро в течение месяцев или 1-2 лет и сопровождаются множественными неврологическими симптомами.
Определенная БКЯ:
Характерная неврологическая и морфологическая в том числе патолого-анатомическая и нейрорадиологическая симптоматика.
Протеазорезистентный PrР (по данным Western-блоттинга).
Выявление скрепи-ассоциированных фибрилл.
Вероятная БКЯ:
Прогрессирущая деменция.
Характерный ЭЭГ-паттерн (для спорадической БКЯ).
По крайней мере, 2 признака из нижеперечисленных:
миоклонус;
ухудшение зрения;
мозжечковая симптоматика;
пирамидные или экстрапирамидные симптомы;
акинетический мутизм.
Возможная БКЯ:
Прогрессирующая деменция.
Нетипичные изменения на ЭЭГ (или ЭЭГ провести невозможно).
По крайней мере, 2 признака из нижеперечисленных:
миоклонус;
ухудшение зрения;
мозжечковая симптоматика;
пирамидные или экстрапирамидные симптомы;
акинетический мутизм.
Продолжительность заболевания — менее 2 лет.
Из параклинических методов диагностики БКЯ наиболее информативными являются:
характерные данные магнитно-резонансной томографии (МРТ) головного мозга (особенно на поздних стадиях развития заболевания) в виде билатеральных гиперинтенсивных сигналов на Т2-взвешенных изображениях (симптом «медовых сот»), преимущественно в области хвостатых ядер (в области головки), подушки главным образом таламуса; показано, что симптом «медовых сот» наиболее характерен для нвБКЯ; могут выявляться признаки атрофии коры больших полушарий и мозжечка;
позитронно-эмиссионая томография (Позитронно-эмиссионная томография) менее информативна, выявляются множественные зоны гипометаболизма глюкозы на уровне подкорковых ядер и коры больших полушарий и полушарий мозжечка;
для спорадической БКЯ характерно выявление на ЭЭГ трехфазной активности, ранняя пароксизмальная активность обычно диагностируется через 12 нед и более от дебюта спорадической БКЯ (у 80-88 % больных); фокальная, билатеральная и генерализованная миоклоническая пароксизмальная активность диагностируется в 15, 53 и 100 % случаев при продромальной, начальной и терминальной стадиях БКЯ соответственно; могут регистрироваться различные виды периодической пароксизмальной активности: двухфазные или трехфазные периодические комплексы, возникающие каждые 1-2 с; периодические комплексы с мультифазной конфигурацией; периодические полиспайковые разряды. ЭЭГ-паттерн «вспышка-подавление» характерен для терминальной стадии заболевания с явлениями декортикации;
для новой формы выше описанные изменения ЭЭГ не характерны, ЭЭГ-паттерн может значимо не меняться по сравнению с возрастной нормой;
результаты тестирования когнитивных функций (например, менее 24 баллов по краткой шкале MMSE;
анализ ликвора (люмбальная пункция должна проводиться во всех случаях заболевания), учитываются давление ликвора, уровень сахара, цитоз, наличие бактериальных и вирусных культур, криптококковогоантигена и др.; может быть небольшое повышение уровня белка (но не более 100 мг/дл); важным диагностическим критерием является уровень маркера в ликворе — чувствительность и специфичность этого теста превышает 90 %;
если диагноз неясен, то возможно проведение прижизненной биопсии мозга (при наличии информированного согласия со стороны родственников или опекунов в случае недееспособности пациента);
морфологическое и гистологическое исследование тканей головного мозга (коры, подкорковых ядер) при аутопсии (посмертная диагностика). [27; 2008]
Лечение
Этиотропной терапии нет. Проводится симптоматическое лечение. При выявлении БКЯ необходимо отменить все лекарственные препараты, которые могут негативно влиять на мнестические функции и поведение пациента. Множество потенциальных терапевтических вмешательств при БКЯ остаются в настоящее время на уровне дискуссии. Традиционные противовирусные средства, такие как амантадин, интерфероны, пассивная иммунизация и вакцинация человека и животных, оказались неэффективными. Среди лекарств положительно влияющих на процесс: Брефелдин А, разрушая аппарат Гольджи, препятствует синтезу PrPSc в инфицированной культуре клеток. Блокаторы кальциевых каналов, в частности NMDA-рецепторов, способствуют более длительному выживанию инфицированных нейрональных культур.
Фолдинг белка. Заключение
Используя доступные мне источники информации (научную литературу, тематические сайты научных и образовательных организаций) я получил представление о природе фолдинга белков, биофизических и биохимических основах этого процесса и заболеваниях являющихся следствием его нарушений. Так же я проанализировал связь зарегистрированных случаев болезни Альцгеймера (данные ВОЗ) с затратами на здравоохранение в различных странах.
Можно сделать вывод, что исследования фолдинга белков — это одна из важнейших проблем современной биохимии и молекулярной биологии, но и кроме того — изучение процесса фолдинга может дать нам возможность лучше понимать и лечить такие тяжёлые для общества и отдельных людей заболевания как болезнь Альцгеймера, Паркинсона,диабет типа II,болезнь Крейтцфельдта — Якоба (коровье бешенство) и склероз.
Список литературы:
1. Сайт Стэнфордского университета, раздел проекта
Folding@home. URL: http://folding.stanford.edu/ (дата обращения: 28.11.2010).
2. Hashimoto M, Rockenstein E, Crews L, Masliah E (2003). «Role of protein aggregation in mitochondrial dysfunction and neurodegeneration in Alzheimer’s and Parkinson’s diseases». — Neuromolecular Med. 4 (1–2): 21–36.
3. Страйер Л. «Биохимия в 3 томах». — Т. 1: М.: Мир, 1984. 138 с.
4. И. М. Кузнецова, В. Форже, К. К. Туроверов. «Структурная динамика, стабильность и фолдинг белков» .— Цитология, том 47,№ 11 2005
5. Финкельштейн, Птицын, «Физика белка» .— Москва, 2002. 216 с.
6. Сайт Стэнфордского университета, раздел проекта Folding@home. Русскоязычное сообщество. URL: http://folding.stanford.edu/Russian/Science (дата обращения: 28.11.2010).
7. Anfinsen C. (1973). «Principles that Govern the Folding of Protein Chains». Science 181: 223—229.
8. Альбертс Б., Брей Д., Льюис Дж. и др. «Молекулярная биология клетки. В 3 томах ». —Т.1: М.: Мир, 2004. 215 с.
9. Я. Кольман, К.-Г. Рем. «Наглядная биохимия» .— М.: Мир, 2000, с. 308—309.
10. «Спектральные свойства тиофлавина T и его комплексов с амилоидными фибриллами» .— Журн. прикл. Спектроскопии. 70 (6) : 767—773. 2005
11. Билл Грант «Старческое слабоумие. Болезнь Альцгеймера и другие формы» .— Alzheimer’s Disease. A Carer’s Guide Серия: Советы врача Норинт, 2003 г.,
12. «Memantine. » US National Library of Medicine (Medline) (2004-01-04)
13. «Guidelines for managing Alzheimer’s disease: Part II. Treatment» .— American Family Physician 65 2006
14. Сайт Компании Открытых Систем. Статья «Болезнь Альцгеймера
(проблемы ухода за больным) », URL: http://sir35.ru/Karla/DA_124.htm (дата обращения: 1.12.2010).
15. Сайт Американского Института Здравоохранения. Статья «Study Evaluating Safety, Tolerability, And Immunogenicity Of ACC-001 In Subjects With Mild To Moderate Alzheimer’s Disease», URL: http://clinicaltrials.gov/ct2/show/NCT00479557 (дата обращения: 6.12.2010).
16. Kawas CH (2006). «Medications and diet: protective factors for AD?» .— Alzheimer Dis Assoc Disord 20 (3 Suppl 2): S89–96.
17. «Effect of dimebon on cognition, activities of daily living, behaviour, and global function in patients with mild-to-moderate Alzheimer’s disease: a randomised, double-blind, placebo-controlled study» .— Lancet 372 (9634): 207–15 2009
18. «Forecasting the global burden of Alzheimer’s disease» .— Alzheimer’s and Dementia 3 (3): 186–91 2008
19. Ю. Г. Каминский, Е. А. Косенко «Популярно и не очень о болезни Альцгеймера» .— Либроком, 2009 г., 136 стр.
20. Автор — Garrondo, изображение является собственной работой автора и распространяется по лицензии CC BY-SA. 2008
21. Автор — Klunkwe, изображение является собственной работой автора и распространяется по лицензии CC AS-A. 2010
22. Anthony Nicholls, Kim Sharp and Barry Honig, «PROTEINS, Structure, Function and Genetics», Vol. 11, No. 4, 2000, pg. 281Ff .— Распространяется по лицензии СС AS-A
23. Alexei Kouprianov. Own work, based on the diagram en:Image:Prion propagation.png 2008
24. И.С.Шкундина, М.Д.Тер-Аванесян. «Прионы .— Успехи биологической химии», т. 46, 2006
25. «Prion biology and diseases, edited by S.B.Prusiner ». — Cold Spring Harbor, NY, 1999. с. 311
26. Сайт интернет-издания «Здоровая Украина». «СтатьяТрансмиссивная спонгиоформная энцефалопатия: болезнь Крейцфельда-Якоба». , URL: http://www.health-ua.com/articles/1736.html (дата обращения: 28.11.2010).
27. Сайт Всемирной Организации Здравоохранения , URL: http://www.who.int (дата обращения: 4.12.2010).
28. Сайт Министерства Финансов РФ, URL: http://www1.minfin.ru/ru/budget/federal_budget/ (дата обращения: 4.12.2010).
29. Сайт РИА «Новый Регион» статья «Рада приняла бюджет Украины на 2010 год» URL: http://www.nr2.ru/kiev/281030.html (дата обращения: 4.12.2010).
30. Сайт Информационного агенства «Росбалт Бизнес». «Статья Бюджет США в 2010 году» URL: http://www.rosbalt.ru/2010/02/01/708846.html (дата обращения: 4.12.2010).
31. Сайт РЦБ. Статья «Бюджет Японии на 2010 год» URL: http://focus.ua/economy/89850 (дата обращения: 4.12.2010).
