Березы почки (ФС.2.5.0006.15)
Государственная фармакопея 13 издание (ГФ XIII)
ФАРМАКОПЕЙНАЯ СТАТЬЯ
ФС.2.5.0006.15 Березы почки — Betulaе gemmae
Взамен ГФ XI, вып. 2, ст. 41
Собранные до распускания в зимне-весенний период (январе – апреле) и высушенные листовые почки дикорастущих деревьев березы повислой (березы бородавчатой) – Betula pendula Roth. (Betula verrucosa Ehrh.) и березы пушистой – Betula pubescens Ehrh., сем. березовых – Betulaceae.
ПОДЛИННОСТЬ
Внешние признаки. Цельное сырье. Почки удлиненно-конические, заостренные или притупленные, часто клейкие. Почечные чешуи расположены черепицеобразно, плотно прижаты по краям, слегка реснитчатые (нижние короче верхних и иногда с несколько отстающими кончиками); длина почек 3–7 мм, в поперечнике – 1,5–3 мм. Цвет почек коричневый, у основания иногда зеленоватый. Запах бальзамический, приятный. Вкус водного извлечения слегка вяжущий, смолистый.
Микроскопические признаки. Цельное сырье. При рассмотрении поперечных срезов почки должно быть видно полуобъемлющее по типу почкосложение. В центре видны крупные зачатки 2 – 3 листьев. Характер листосложения – складчатый. Между фрагментами крупных складчатых чешуй локализованы поперечные сечения мелких, не складчатых, ровной формы, сложенных пополам фрагментов зачатков листьев. На срезах в базальной части, рядом с основанием почки, складчатые фрагменты зачатков листьев отсутствуют. В центре поперечного среза базальной части почки заметны фрагменты 2 черешков. Поперечные сечения черешков округлые с углублением в верхней части. Проводящие элементы черешка представлены одним закрытым коллатеральным пучком С-образной формы.
Поверхность зачатков листьев, их черешков и кроющих чешуй опушена щитковидными железками. Головки железок многоклеточные округлые 8-, 9-клеточные. Клетки головки тонкостенные, прозрачные, с каплями эфирного масла. Ножка железки крупная, многоклеточная, состоит из овальных или слегка вытянутых клеток, заполненных коричневым содержимым.
Помимо щитковидных железок на поверхности зачатков листьев имеются простые одноклеточные бичевидные волоски с сильно утолщенной, иногда лигнифицированной клеточной стенкой. Протопласт бичевидных волосков аморфный, коричневого или темно-желтого цвета.
Кроющие чешуи почек опушены слабее. На поперечных срезах кроющих чешуй должны быть видны простые бичевидные волоски, локализованные по краю. Железки конусовидной формы на кроющих чешуях локализованы у их основания. Клетки, составляющие головку конусовидных железок, образуют головку от самого основания трихомы. Ножка железки на продольном срезе – треугольной формы и состоит из мелких, слегка вытянутых клеток, заполненных коричневым содержимым.
Мезофилл зачатков листьев на поперечном срезе однороден и представлен тонкостенными клетками округлой, иногда продолговатой формы, с зернистым протопластом желто–зеленого цвета. Эпидермис зачатков листьев тонкостенный, слабо кутинизированный. Непосредственно под эпидермой в мезофилле локализованы многочисленные друзы и кристаллы оксалата кальция. В мезофилле зачатков листьев, ближе к базальной части почки, имеются многочисленные проводящие пучки коллатерального типа. Проводящие элементы ксилемы на поперечном срезе имеют многоугольную форму, их стенки лигнифицированы.
Эпидермис чешуй с внешней стороны сильно кутинизирован. Полости клеток пигментированы. Под эпидермисом локализован блок пластинчатой колленхимы. На внешней и внутренней поверхностях почечных чешуй, в эпидермисе, изредка встречаются сформированные чечевички. Этот признак характерен особенно для краевых чешуй. Мезофилл кроющих чешуй состоит из более крупных, чем у зачатков листьев, округлых клеток. Протопласт клеток мезофилла пигментирован. Характер пигментации зависит от локализации чешуй. В мезофилле краевых чешуй пигментация сильнее. Мезофилл внутренних чешуй практически не пигментирован.
Проводящие пучки кроющих чешуй мелкие, с малым количеством проводящих элементов.
При рассмотрении чешуи почки с поверхности должно быть видно, что клетки эпидермиса наружной стороны чешуи более толстостенные, чем внутренней, стенки клеток эпидермиса наружной стороны чешуи утолщаются по направлению от основания к верхушке и краям чешуи.
На верхушке и по краю чешуй эпидермис опушен простыми одноклеточными волосками; по краю они более толстостенные и значительной длины. Устьица располагаются с наружной стороны чешуй. Сквозь эпидермис внутренней стороны просвечивают узкие проводящие пучки со спиральными элементами ксилемы и многочисленные мелкие друзы. У внутренних чешуй стенки клеток эпидермиса утолщены только в нижней части чешуи.
На зубцах края зачатков листьев локализованы крупные конусообразные железки, аналогичные описанным ранее для кроющих чешуй. Поверхность зачатков листьев густо опушена многочисленными крупными железками коричневого цвета в различных стадиях развития.
С нижней стороны эпидермиса листового зачатка наблюдаются устьица. По жилкам зачатка листьев и его краям, особенно у основания листочков, расположены простые одноклеточные бичевидные волоски, аналогичные волоскам чешуй. Сквозь эпидермис просвечивают друзы оксалата кальция.

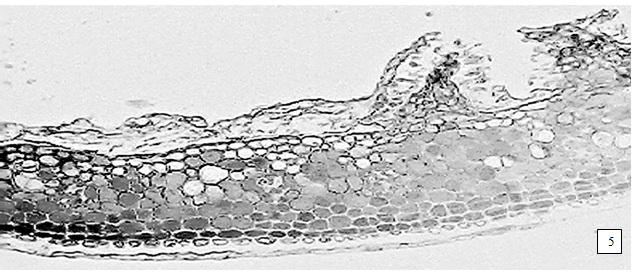
Рисунок. Березы почки. 1 – фрагмент эпидермиса кроющей чешуи с устьицами (400×); 2 – фрагмент эпидермиса с железками (400×); 3 – простой бичевидный волосок; 4 – друзы оксалата кальция; 5 – фрагмент поперечного среза кроющей чешуи с конусовидной железкой (400×)
Определение основных групп биологически активных веществ
- Тонкослойная хроматография
Приготовление растворов.
Раствор стандартного образца (СО) судана красного G. Около 0,0025 г СО судана красного G растворяют в 10 мл спирта 96 %. Срок годности раствора 6 мес при хранении в прохладном, защищенном от света месте.
Анисового альдегида раствор. Смешивают последовательно: 0,5 мл анисового альдегида, 10 мл уксусной кислоты ледяной, 85 мл спирта 96 % и 5 мл серной кислоты концентрированной. Срок годности раствора 30 суток при хранении в прохладном, защищенном от света месте.
Около 0,5 г сырья измельченного до однородной массы помещают в колбу со шлифом вместимостью 100 мл, прибавляют 10 мл спирта 70 % и нагревают с обратным холодильником на кипящей водяной бане в течение 15 мин. Колбу с содержимым охлаждают до комнатной температуры, после чего ее выдерживают в морозильной камере при температуре минус 18 ºС в течение не менее 1 ч. Содержимое колбы быстро фильтруют через бумажный фильтр (испытуемый раствор).
На линию старта аналитической хроматографической пластинки на полимерной подложке размером 10 × 10 см наносят 10 мкл испытуемого раствора и 3 мкл раствора СО судана красного G.
Пластинку с нанесенными пробами сушат на воздухе, помещают в камеру, предварительно насыщенную в течение не менее 30 мин смесью растворителей толуол – этилацетат – муравьиная кислота безводная (95:5:2), и хроматографируют восходящим способом. После того как фронт растворителей пройдет 80 – 90 % длины пластинки от линии старта, ее вынимают из камеры, сушат до удаления следов растворителей.
Пластинку обрабатывают анисового альдегида раствором и выдерживают в сушильном шкафу при температуре 100 – 105 ºС в течение 2 – 3 мин и просматривают при дневном свете.
На хроматограмме раствора СО судана красного G должна обнаруживаться зона судана розового, розово-фиолетового или фиолетового цвета.
На хроматограмме испытуемого раствора должны обнаруживаться 4 зоны адсорбции фиолетового, сине-фиолетового или серо-фиолетового цвета ниже зоны на хроматограмме СО судана красного G, зона адсорбции розового, розово-фиолетового или фиолетового цвета на уровне зоны судана красного G, одна зона адсорбции фиолетового, сине-фиолетового или серо-фиолетового цвета чуть выше зоны судана красного G; допускается обнаружение других зон адсорбции (липофильные соединения).
ИСПЫТАНИЯ
Влажность. Цельное сырье – не более 10 %.
Зола общая. Цельное сырье – не более 4 %.
Зола, нерастворимая в хлористоводородной кислоте. Цельное сырье – не более 0,7 %.
Посторонние примеси
Другие части березы (веточки, в том числе отделенные от почек при анализе, сережки и пр.). Цельное сырье – не более 8 %.
Почки, тронувшиеся в рост и распустившиеся. Цельное сырье – не более 2 %.
Органическая примесь. Цельное сырье – не более 1 %.
Минеральная примесь. Цельное сырье – не более 0,5 %.
Тяжелые металлы. В соответствии с требованиями ОФС «Определение содержания тяжелых металлов и мышьяка в лекарственном растительном сырье и лекарственных растительных препаратах».
Радионуклиды. В соответствии с требованиями ОФС «Определение содержания радионуклидов в лекарственном растительном сырье и лекарственных растительных препаратах».
Остаточные количества пестицидов. В соответствии с требованиями ОФС «Определение содержания остаточных пестицидов в лекарственном растительном сырье и лекарственных растительных препаратах».
Микробиологическая чистота. В соответствии с требованиями ОФС «Микробиологическая чистота».
Количественное определение. Цельное сырье: сумма флавоноидов в пересчете на лютеолин – не менее 2,5 %; эфирного масла – не менее 0,2 %.
Сумма флавоноидов
Приготовление растворов.
Раствор СО лютеолина. Около 0,02 г (точная навеска) СО лютеолина помещают в мерную колбу вместимостью 50 мл, прибавляют 35 мл спирта 96 % и растворяют при нагревании (70–80 °С). Содержимое колбы охлаждают до комнатной температуры, доводят объем раствора спиртом 96 % до метки и тщательно перемешивают (раствор А СО лютеолина). Срок годности раствора 30 сут.
1,0 мл раствора А СО лютеолина помещают в мерную колбу вместимостью 50 мл, прибавляют 2 мл алюминия хлорида спиртового раствора 2 % и 1 каплю уксусной кислоты разбавленной 30 %, доводят объем спиртом 96 % до метки и перемешивают (раствор Б СО лютеолина). Срок годности раствора 30 сут.
Аналитическую пробу сырья измельчают до величины частиц, проходящих сквозь сито с отверстиями размером 3 мм. Около 1,0 г (точная навеска) измельченного сырья помещают в колбу с притертой пробкой вместимостью 100 мл и прибавляют 40 мл спирта 70 %. Колбу закрывают пробкой, взвешивают с погрешностью + 0,01 г, присоединяют к обратному холодильнику и нагревают на кипящей водяной бане в течение 1 ч. Содержимое колбы охлаждают до комнатной температуры, взвешивают и доводят спиртом 70 % до первоначальной массы. Извлечение фильтруют через бумажный фильтр с красной полосой, отбрасывая первые 10 мл.
5,0 мл фильтрата помещают в мерную колбу вместимостью 25 мл, доводят объем раствора спиртом 96 % до метки и перемешивают (раствора А испытуемого раствора). 1,0 мл раствора А испытуемого раствора помещают в мерную колбу вместимостью 50 мл, прибавляют 2 мл алюминия хлорида спиртового раствора 2 % и 1 каплю уксусной кислоты разбавленной 30 %, доводят объем спиртом 96 % до метки и перемешивают (раствор Б испытуемого раствора).
Оптическую плотность раствора Б испытуемого раствора измеряют через 30 мин на спектрофотометре при длине волны 400 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения используют раствор состоящий из 1,0 мл раствора А испытуемого раствора и 1 капли уксусной кислоты разбавленной 30 %, доведенный спиртом 96 % до метки в мерной колбе вместимостью 50 мл.
Параллельно измеряют оптическую плотность раствора Б СО лютеолина в тех же условиях. В качестве раствора сравнения используют раствор состоящий 1,0 мл раствора А СО лютеолина, 1 капли уксусной кислоты разбавленной 30 %, доведенный спиртом 96 % до метки в мерной колбе вместимостью 50 мл.
Содержание суммы флавоноидов в пересчете на лютеолин в абсолютно сухом сырье в процентах (X) вычисляют по формуле:

где А – оптическая плотность раствора Б испытуемого раствора;
Аo –оптическая плотность раствора Б СО лютеолина;
a – навеска сырья, г;
ao – навеска СО лютеолина, г;
Р – содержание основного вещества в СО лютеолина, %;
W – влажность сырья, %.
Допускается содержание суммы флавоноидов в пересчете на лютеолин вычислять с использованием удельного показателя поглощения комплекса лютеолина с алюминия хлоридом по формуле:
Эфирное масло

В соответствии с требованиями ОФС «Определение содержания эфирного масла в лекарственном растительном сырье и лекарственных растительных препаратах» (метод 1; навеска 10,0 или 20,0 г измельченного сырья до величины частиц, проходящих сквозь сито с отверстиями размером 3 мм, время перегонки 2 ч).
Упаковка, маркировка и транспортирование. В соответствии с требованиями ОФС «Упаковка, маркировка и транспортирование лекарственного растительного сырья и лекарственных растительных препаратов».
Хранение. В соответствии с требованиями ОФС «Хранение лекарственного растительного сырья и лекарственных растительных препаратов».
