ХИМИЧЕСКАЯ СВЯЗЬ
Химическая связь – это совокупность взаимодействий между электронами и ядрами, приводящая к соединению атомов в молекулу
Электроны в атоме ведут себя как волны, их дви-жение описывается с помощью волновой функции ψ : ψ = f(x,y,z)где x. y. z – пространственные координаты
Электронная плотность – это вероятность нахождения электрона в данной точке пространства, она определяется величиной квадрата волновой функции [ψ]2.
Атомная орбиталь (АО) – это область пространства, где вероятность нахождения электрона максимальна (95%).
Состояние электрона в атоме характеризуется с помощью квантовых чисел. Энергия и геометрическое строение атомных орбиталей описывается с помощью квантовых чисел с учетом принципа Паули, правила Гунда и принципа минимума энергии.
Формы атомных орбиталей:
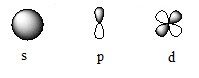
При сближении атомов происходит перекрывание АО и образование молекулярных орбиталей (МО).
Ковалентная связь – это связь, образованная обобществлением электронов связывающихся атомов (по 1 электрону от каждого).
σ-связь – образуется осевым перекрыванием s-s-, s-p- или p-p-орбиталей
π-связь – образуется боковым перекрыванием p-орбиталей
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА УГЛЕРОДА
Атом углерода во внешней электронной оболочке имеет 4 атомных орбитали:
При образовании связей происходит гибридизация атомных орбиталей: несколько близких по энергии орбиталей как бы усредняются, образуя такое же количество орбиталей равных по энергии и отличающихся геометрической направленностью.
Гибридные орбитали обеспечивают более полное перекрывание при образовании связей, и это делает гибридизацию энергетически выгодной.
У атома углерода различаются три типа гибридизации:
-sp3 гибридизация, в ней участвует s-орбиталь и три р-орбитали;
-sp2 гибридизация: s-орбиталь и две р-орбитали;
-sp гибридизация: s-орбиталь и одна р-орбиталь.
ПРОСТЫЕ И КРАТНЫЕ УГЛЕРОД-УГЛЕРОДНЫЕ СВЯЗИ
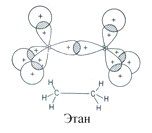
Простая (ординарная) σ-связь образуется путем осевого перекрывания гибридных орбиталей. Молекула этана имеет трехмерную (тетрагональную) геометрическую структуру:
Двойная связь образуется между двумя sp2-гибридизованными атомами и состоит из σ-связи, образованной осевым перекрыванием гибридных орбиталей, и π-связи, образованной боковым перекрыванием негибридизованных р-орбиталей. Молекула этилена имеет тригональную (планарную) геометрическую структуру — все σ-связи расположены в одной плоскости
Тройная связь образуется между двумя sp-гибридизованными атомами и состоит из σ-связи и двух π-связей, причем плоскости π-связей перпендикулярны друг другу. Молекула ацетилена имеет дигональную (линейную) геометрическую структуру (все σ-связи находятся на одной прямой)
МЕТОДЫ ОПИСАНИЯ ЭЛЕКТРОННОЙ СТРУКТУРЫ
Метод МО ЛКАО (Хюккель)
ψ = С1ψ1 + С2 ψ2 + С3ψ3 + … + Сnψn
ψ – молекулярная орбиталь
ψn – атомные орбитали
Этот метод применяется для расчетов энергетических параметров молекул и δ-зарядов на атомах.
Метод валентных схем
Применяется для описания структур, которые не могут быть однозначно описаны одной структурой. В основе метода лежит концепция мезомерии (К.Ингольд, 1922 г.) и теория резонанса валентных структур (Л.Полинг,1928 г.).
Примеры:

Донорно-акцепторная (координационная) связь – это ковалентная связь, образованная за счет пары электронов одного атома:
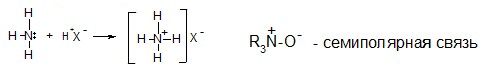
В комплексных соединениях комплексообразователь и лиганд также связаны координационными связями (лиганд – донор электронов, комплексо-образователь – акцептор электронов).
Донорами электронов могут быть соединения с развитой системой π-электронов
ХАРАКТЕРИСТИКИ КОВАЛЕНТНОЙ СВЯЗИ
Энергия связи (кДж/моль) – это энергия, которую нужно затратить для разрыва связи, она равна энергии, выделяющейся при образовании связи:
— является мерой прочности связи.
— может быть косвенно определена по энергии сгорания вещества.
Энергия связи уменьшается с увеличением её длины.
Кратные связи короче и прочнее ординарных, но не пропорционально, т.е. σ-связь прочнее π-связи.
Длина связи – расстояние (в нм) между центрами связанных атомов, она определяется методом рентгено-структурного анализа (РСА).
Валентные углы – это углы между осями орбиталей, они также определяются методом РСА.
Ковалентный радиус атома – равен ½ длины ковалентной связи между одинаковыми атомами.
Ван-дер-ваальсов радиус – равен ½ расстояния между максимально сближенными атомами. Всегда больше ковалентного радиуса.
Полярность связи – смещение пары электронов, образующих связь, в сторону более электроотрицательного атома.
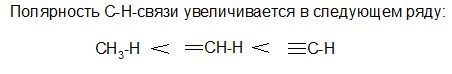
Мерой полярности связи является дипольный момент (μ): μ = q·l
q – парциальные заряды на атомах
l – длина связи
Для многоатомных молекул μ определяется как векторная сумма дипольных моментов всех связей.
Поляризуемость связи – это способность к динамическому смещению электронов под действием электромагнитного поля (воздействие приближаю-щейся активной частицы или молекул растворителя).
Поляризуемость в значительной степени определяет реакционную способность связи.
Поляризуемость увеличивается с увеличением длины связи, например:
С-O (1) C—S (2)
у (1) стационарный диполь больше, чем у (2), но в динамических условиях реакции легко поляризуемая (2) более реакционноспособна. Поляризуемость π-связи значительно больше, чем σ-связи.
СЛАБЫЕ ВЗАИМОДЕЙСТВИЯ
ВОДОРОДНЫЕ СВЯЗИ
Связи Х-Н (X = O,N,S) сильно полярны, поэтому протон слабо экранирован и взаимодействует с электронами другого атома:
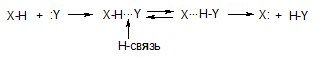
Такие переходы из-за малого энергетического барьера осуществляются легко (подвижность протона). Энергия Н-связей составляет 10-20 кДж/моль, поэтому при нагревании они разрываются.
Водородные связи играют большую роль в формировании физических и химических свойств соединений, содержащих группы –OH, -NH, -SH:
— они обусловливают гидратацию ионов и полярных соединений в водных растворах;
— они играют главную роль в формировании вторичной структуры биополимеров: полисахаридов, белков, нуклеиновых кислот.
ДИПОЛЬ-ДИПОЛЬНОЕ ВЗАИМОДЕЙСТВИЕ
Полярные молекулы могут ассоциироваться следующим образом:
Сила такого взаимодействия пропорциональна 3-й степени расстояния.
Диполь-дипольное взаимодействие повышает температуры плавления и кипения вещества.
ДИСПЕРСИОННОЕ ВЗАИМОДЕЙСТВИЕ
Неполярные молекулы при тесном сближении взаимодействуют, индуцируя асциллирующие диполи, которые притягиваются друг к другу.
Сила такого взаимодействия пропорциональна 6-й степени расстояния и максимальна на расстоянии ван-дер-ваальсовых радиусов, а также увеличивается при увеличении размера молекулы (длины цепи).
Такое взаимодействие играет большую роль в образовании комплекса лекарственного вещества с рецептором.
МЕХАНИЗМ РЕАКЦИИ И АКТИВНЫЕ ЧАСТИЦЫ
Химическая реакция – это, как правило, многостадийный процесс. Она начинается с разрыва связей в исходных соединениях, после чего образуются новые связи и новые соединения. В ходе реакции образуются неустойчивые промежуточные частицы. Последовательность всех этих стадий называется механизмом реакции.
Активные частицы – это частицы, обладающие высокой внутренней энергией и высокой химической активностью, они инициируют реакцию.
ТИПЫ АКТИВНЫХ ЧАСТИЦ
1. Электрофилы
2. Нуклеофилы
3. Радикалы
1.Электрофилы
Общим в электронной структуре электрофилов является то, что они имеют негибридизованную р-орбиталь, на которой нет электронов (вакантная орбиталь):
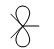
Электрофил – это электронодефицитная частица, она атакует в места с повышенной электронной плотностью.
2. Нуклеофилы
Общее в электронной структуре нуклеофилов — это р-орбиталь, несущая пару электронов с противо-положными спинами (неподеленная пара электронов):
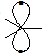
Нуклеофил– это электроноизбыточная частица, она атакует в места с пониженной электронной плотностью.
3. Радикалы
Радикалы на негибридизованной р-орбитали имеют один электрон с некомпенсированным спином (неспаренный электрон):
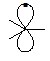
Наличие неспаренного электрона повышает внутреннюю энергию радикалов и придает им высокую химическую активность.
Радикалы атакуют и разрывают преимущественно малополярные связи
Активные частицы образуются в результате разрыва хим
ической связи.
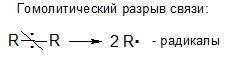
Малополярные связи разрываются гомолитически, и образуются два радикала.
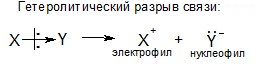
Полярные связи разрываются гетеролитически, и образуются нуклеофил и электрофил.
