Вирусоподобные инфекционные агенты
Основы молекулярной биологии вирусов и антивирусной терапии. Зинченко А.И., Паруль Д.А. — 2005
САТЕЛЛИТЫ И ВИРОИДЫ
Могут ли существовать вирусы с геномами размером в 240 нуклеотидов? А могут ли существовать инфекционные агенты вообще без генома? Если первое еще можно себе представить, то гипотеза о существовании инфекционных агентов без генома вроде бы подрывает основы основ молекулярной биологии. Как это ни странно, и те и другие агенты существуют и вызывают заболевания растений, животных и человека.
В последние годы все чаще говорят о сателлитах, вироидах и прионах. Это необычные инфекционные агенты, которые характеризуются тем, что обладают очень маленьким геномом, а в случае прионов — не обладают им вообще.
Сателлиты (сателлитные вирусы, сателлитные РНК) — это маленькие молекулы РНК, которые абсолютно нуждаются для своего размножения в присутствии в клетке вируса, выступающего в качестве вируса-помощника. Таким образом, даже вирусы имеют своих паразитов. Большинство сателлитов ассоциированы с вирусами растений, но некоторые из них ассоциированы с бактериофагами или вирусами животных. Примером последних могут служить аденоассоциированные вирусы, которые, как следует из названия, сопутствуют аденовирусам.
Типичные свойства сателлитов:
- геном сателлитов (одноцепочечная РНК) имеет размер около 500-2000 нуклеотидов;
- они вызывают специфические проявления заболеваний у растений, которые не обнаруживаются при инфекции тех же хозяев только вирусами-помощниками;
- геномы сателлитов по первичной структуре не похожи на геномы вирусов-помощников.
Вироиды — это очень маленькие (200-400 нуклеотидов) палочкообразные молекулы РНК, которые обладают характерной вторичной структурой (рис. 4.1).
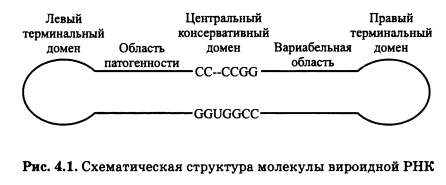
Они не имеют капсида и оболочки и состоят только из одной молекулы нуклеиновой кислоты. Вироиды вызывают заболевания растений и отличаются от сателлитов по ряду характеристик (табл. 4.1).
Таблица 4.1. Характеристика сателлитов и вироидов

Первым открытым и наиболее изученным вироидом является вироид, вызывающий веретеновидность клубней картофеля. Вироиды не кодируют никаких белков и реплицируются при помощи РНК-полимеразы клетки-хозяина. Детали репликации еще до конца не выяснены, но похоже, что она протекает по механизму «катящегося кольца» с последующим аутокаталитическим расщеплением и лигированием. Вироиды различаются по первичной структуре, и это служит основанием для разделения их на те или иные виды. Однако все вироиды несут общую последовательность нуклеотидов, которая расположена в центральной части молекулы и, как полагают, важна для репликации (см. рис. 4.1).
Неясно, как вироиды вызывают симптомы заболеваний, но не вызывает сомнения, что это является результатом нарушения нормального метаболизма клетки. Они демонстрируют сходство по первичной структуре с некоторыми последовательностями в геноме эукариотической клетки-хозяина, в частности с интроном, расположенным между 5,88 и 25S рРНК. Отсюда предположено, что вироиды могут нарушать посттранскрипционный процессинг РНК-инфицированной клетки.
Большинство вироидов передаются от клетки к клетке при вегетативном размножении хозяев, т.е. делении инфицированных растений, хотя некоторые могут распространяться и при помощи насекомых-переносчиков или механическим путем. Поскольку вироиды не имеют преимущества защитной оболочки, вироидные РНК имеют исключительный риск деградировать во внешней среде. Однако их малый размер и высокий процент вторичной структуры в достаточной степени их защищают, и они способны существовать вне клетки-хозяина в течение достаточно долгого периода, чтобы успеть переместиться в другого хозяина.
Происхождение вироидов загадочно. По одной из версий, они являются пережитком — примитивным геномом, сохранившимся с тех времен, когда еще не было ДНК. По другой гипотезе, вироиды возникли «совсем недавно» и олицетворяют собой крайнюю степень паразитизма. Похоже, что мы никогда не узнаем, какая из этих альтернатив истинна. Ясно одно — вироиды существуют и вызывают заболевания растений.
К уникальным в своем роде агентам следует отнести вирус гепатита дельта (ВГО). Он представляет собой молекулу РНК, обладающую свойствами как сателлита, так и вироида. ВГБ для своей репликации нуждается в вирусе- помощнике, в качестве которого выступает вирус гепатита В (ВГВ). Поэтому неудивительно, что ВГБ находят только в клетках, инфицированных ВГВ. Переносится ВГБ тем же путем, что и ВГВ, извлекая при этом выгоду из наличия защитной оболочки, состоящей из липида и белка ВГВ. Вирусные препараты, полученные из ВГВ/ВГБ-инфицированных клеток, содержат гетерогенные частицы, которые представляют собой капсид ВГВ, содержащий ковалентно замкнутую кольцевую РНК ВГБ, имеющую форму стержня, характерную для всех вироидов. Однако, в отличие от всех других вироидов, РНК ВГБ кодирует белок — 8-антиген, который является фосфопротеином. Считается, что геном ВГБ реплицируется путем РНК-зависимого синтеза РНК с использованием ДНК-за- висимой РНК-полимеразы.
Похоже, что ВГБ усугубляет патогенные эффекты инфекции ВГВ. Например, скоротечная форма гепатита (летальность около 80%) в 10 раз чаще регистрируется в случае смешанной инфекции по сравнению с моноинфекцией только ВГВ. Специфической терапии ВГБ не существует, однако, поскольку он требует для репликации присутствия в клетке ВГВ, его можно контролировать путем вакцинации против ВГВ.
ПРИОНЫ
Терминология. Прионы — это инфекционные агенты, которые вызывают трансмиссивные спонгиформные (от «спонги», что в переводе означает губка) энцефалопатии человека и животных. Среди них: скрейпи овец, губчатая энцефалопатия крупного рогатого скота (коровье бешенство), трансмиссивная энцефалопатия норок, болезнь Крейцфельда-Якоба (БКЯ) и куру человека.
Для всех этих заболеваний характерно:
- накопление в мозгу амилоидоподобных образований, при этом ткань мозга принимает пористую форму наподобие губки;
- полное отсутствие воспалительных явлений.
У больных наблюдаются деменции, потеря координации движения, конвульсии конечностей. Патологический процесс протекает медленно, но неизменно заканчивается летальным исходом. Средства специфической лекарственной терапии отсутствуют.
Скрейпи — болезнь, известная уже несколько столетий. Название происходит от английского слова «scrape» — скоблить, тереть. Дело в том, что больные животные соскребают с себя почти всю шерсть. В 1935 г. французские исследователи доказали, что болезнь можно передать от одной овцы к другой путем прививки. Возможность трансмиссии указывала на существование инфекционного агента.
Скрейпи оставалось заболеванием, известным лишь ветеринарам, до 1959 г., когда было замечено, что скрейпи и куру — родственные болезни. О куру мир узнал двумя годами раньше из работ Гейдушека. Этот исследователь доказал, что заболевание, встречающееся у жителей Новой Гвинеи, связано с ритуальным каннибальским обрядом, который состоял в поедании мозга умерших родственников. Инфекционную природу куру Гейдушек продемонстрировал, сумев передать заболевание от умершего человека обезьяне. Вскоре Гейдушек показал, что обезьянам от человека можно передавать и БКЯ.
Сходство проявлений упомянутых выше и других подобных заболеваний навело исследователей на мысль о родственности этих патологий. Сейчас уже известно, что все эти заболевания могут возникать не только в результате инфекции — описаны спорадические и наследственные их формы. При этом существенно, что независимо от происхождения заболевания, оно может быть передано здоровому реципиенту инфекционным путем.
Химическая природа прионов. Прионы не задерживаются бактериальными фильтрами. Это характерный признак вирусов. Однако у прионов гораздо больше таких свойств, которыми вирусы не обладают. Более того, по физическим свойствам они не соответствуют ни одному из известных биологических объектов.
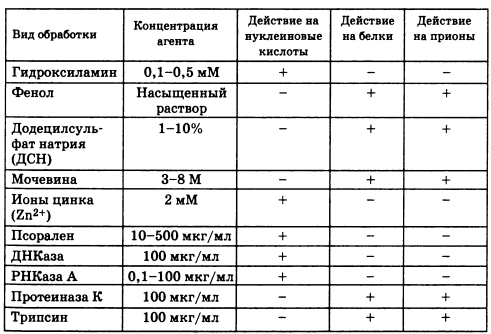
- Прионы устойчивы к тепловой инактивации. Инфек- ционность не исчезает после прогревания до 90°С в течение 30 мин. Инфекционность падает, но не исчезает совсем даже при автоклавировании (135°С; 18 мин).
- Прионы устойчивы к повреждающему действию коротковолнового УФ-облучения и ионизирующей радиации. Такая обработка вызывает инактивацию всех известных патогенных организмов, поскольку повреждает их геномы. Существует обратная зависимость между размерами молекулы ДНК (мишень) и дозой радиоактивности или
УФ-облучения, необходимой для их инактивации. Иначе говоря, большие молекулы чувствительны к гораздо меньшим дозам, чем те дозы, которые губительны для маленьких молекул. Эксперименты по облучению агента скрей- пи показали, что если он и содержит нуклеиновую кислоту, то она не может быть больше 80 нуклеотидов.
- Прионы устойчивы к ДНКазам, РНКазам и многим другим агентам в условиях, разрушающих нуклеиновые кислоты и все известные вирусы, сателлиты и вироиды.
- Прионы чувствительны к обработке мочевиной, доде- цилсульфатом натрия, фенолом и другими химическими соединениями, денатурирующими белки.
Совокупность приведенных выше свойств (а также данных табл. 4.2) указывает на то, что исследуемый агент является, скорее, белком, чем нуклеиновой кислотой или вирусом. Действительно, единственным компонентом, связанным с инфекционным началом приона, оказался белок и этот белок получил обозначение РгР60. Биохимическая очистка патогена скрейпи приводит к препаратам, высоко обогащенным белком РгР60, и, наоборот, по мере очистки препаратов РгР60 увеличивается их инфекционность.
Таблица 42. Отношение прионов к некоторым химическим соединениям и ферментам
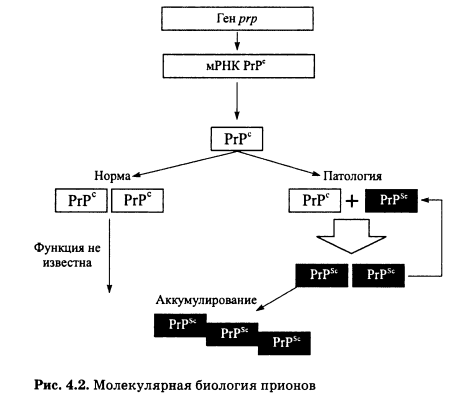
В 1984 г. С. Прузинер определил последовательность в 15 аминокислот на конце очищенного PrPSc. Это привело к открытию того факта, что все клетки млекопитающих содержат ген ргр, который кодирует белок, идентичный по первичной структуре PrPSc. Этот белок нормальных клеток принято обозначать РгРс. Таким образом, очищенный инфекционный агент оказался белком, первичная структура которого закодирована в геноме хозяина.
В отличие от нормальных клеток, инфицированные прионом клетки содержат только PrPSc. При заражении экспериментальных животных прионом, как и в случае других инфекционных агентов, существует зависимость доза-эффект, которая демонстрирует четкую корреляцию между количеством PrPSc в инокулюме и продолжительностью инкубационного периода до развития болезни.
Чувствительность того или иного организма к прионовой инфекции определяется наличием гена ргр. Мутанты, у которых этот ген отсутствует или поврежден, не способны воспринимать прионовую инфекцию.
В настоящее время установлено существование, по крайней мере, 15 различных штаммов РгР80 (с идентичной первичной структурой этого белка, но различающихся по величине инкубационного периода развития болезни).
Прионовая гипотеза является революционной и закономерно была встречена поначалу многими скептически. Хотя свидетельства в ее пользу постоянно накапливаются, есть данные, которые ей противоречат. Например, данная гипотеза очень трудно сочетается с существованием при- оновых штаммов.
В течение многих лет исследования спонгиформных энцефалитов тянулись чрезвычайно медленно, потому что каждый эксперимент отнимал по меньшей мере один год. С началом молекулярно-биологического этапа эти исследования превратились в быстро прогрессирующую область науки.
Однако пока рациональная терапия заболеваний, вызванных прионами (как и заболеваний, вызванных сателлитами и вироидами), не разработана. Привычная стратегия борьбы с вирусными инфекциями, основанная на лекарственных препаратах и вакцинах, не имеет в случае этих необычных агентов никакого эффекта. Ясно, что перед тем как будут найдены способы лечения прионовых патологий, необходимо всестороннее и доскональное изучение химии и биологии прионовых белков.
Как же может клеточный белок, безобидный в норме, вызывать болезнь? Никаких химических различий, в том числе в первичной структуре, между РгРс и прионом не было обнаружено. На основании этих данных было предположено, что фундаментальное отличие между инфекционной формой приона (РгР80) и непатогенной эндогенной формой (РгРС) скрыто в конформации этих белковых молекул.
В настоящее время считается доказанным, что во вторичной структуре РгРс преобладает а-спираль. Прион, напротив, имеет преимущественно складчатую p-структуру. Было предположено, что молекула РгРс, взаимодействуя с прионом, сама превращается в прион (рис. 4.2). Это приводит к амплификации приона и исчезновению пула белка- предшественника. Процесс носит характер цепной реакции.
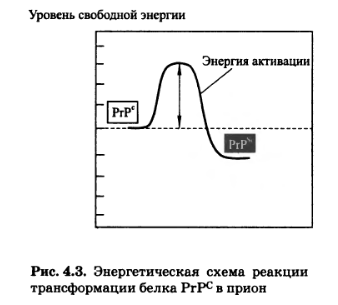
Очень редко имеет место спонтанное перерождение молекулы РгРс в прион. В принципе такая трансформация (рис. 4.3) энергетически выгодна, однако кинетически она сильно затруднена из-за большого активационного барьера, препятствующего самопроизвольному превращению белка РгРс в белок РгР&°. Вот почему самопроизвольные формы прионовых заболеваний чрезвычайно редки (приблизительно один случай на 1 ООО ООО человек). Тем не менее они имеют место и являются, как полагают, следствием соматической мутации в гене ргр. Понятно, что мутация не задевает структурную часть гена, кодирующую первичную структуру белка. Мутация понижает энергию активации на пути перехода РгРс в PrPSc, что делает появление PrPSc в организме статистически вероятным.
Суммируем факты, которые согласуются с гипотезой приона:
- при всех прионовых заболеваниях наблюдается сверхпродукция белка РгР&°;
- животные, которые в результате мутации не способны к образованию в организме белка РгРс, проявляют абсолютную невосприимчивость к прионовой инфекции;
- увеличение экспрессии гена ргр, напротив, способствует возникновению заболеваний.
Итак, белок-предшественник приона РгРс является нормальным клеточным белком, функция которого пока не известна. В инфекционного агента РгР80 он превращается в результате любого из двух событий: а) при контакте с прионом и б) спонтанно (крайне редко). В обоих случаях при этом происходит только изменение конформации молекулы.
Уникальная особенность этих заболеваний состоит в том, что они могут возникать не только в результате инфекции. Известны спорадические и наследственные формы таких патологий. Причем независимо от происхождения заболевания оно может быть передано инфекционным путем. Таким образом, мы как бы имеем дело с самозарождением инфекции.
Согласно современным представлениям, прион — особая изоформа нормального клеточного белка, отличающаяся от него плохой растворимостью и склонностью к агрегации, которая и является причиной образования амилоидов в тканях мозга.
Прион, попадая в клетку или спонтанно в ней возникая, способствует путем белок-белковых взаимодействий превращению клеточной формы РгРс в форму PrPSc. В целом процесс трансформации напоминает цепную реакцию.
Существование наследственных форм прионовых заболеваний в рамках этой концепции может объясняться повышенной способностью «мутантных» белков к спонтанному превращению в прионовую форму.
Все перечисленные факты полностью согласуются с гипотезой о белковом материальном носителе прионовых заболеваний. Животные, лишенные гена ргр, не заболевают просто потому, что их клетки не содержат предшественника, способного к конформационной перестройке. При увеличении количества молекул этого белка должна возрастать вероятность спонтанного перехода какой-либо из молекул в патогенную форму. Пониженная инфекционность чужого приона при межвидовом заражении может объясняться ухудшенной способностью белка PrPSc передавать свое патогенное состояние белку РгРс, несколько отличающемуся от него по первичной структуре.
При всей привлекательности гипотезы приона есть факты и наблюдения, которые с ней пока не согласуются. Например, одно из наиболее удивительных свойств прионов — это существование различных штаммов (при неизменной первичной структуре!). Каждый штамм у генетически однородных (линейных) животных вызывает заболевание, отличающееся по продолжительности инкубационного периода и некоторым другим параметрам. Существование различных штаммов было подтверждено биохимически. Оказалось, что различные штаммы прионов несколько различаются по своей вторичной структуре.
В настоящее время установлена первичная структура прионов, изолированных из многих организмов. Она оказалась высококонсервативной. У разных видов млекопитающих прион лишь незначительно отличается по первичной структуре. Тем более удивительным является факт наличия межвидовых барьеров на пути передачи.
Долгое время изучение прионов представляло исключительно теоретический интерес. Однако в конце прошлого века проблема прионов приобрела существенное практическое значение в связи со вспышками соответствующих эпизоотий среди сельскохозяйственных животных в некоторых европейских странах, а также с появлением наблюдений о возможности передачи этих заболеваний от животных к человеку.
В заключение следует отметить, что феномен прионов распространен в природе шире, чем это считалось до недавних пор. В последнее время появились данные о существовании прионов у дрожжей Saccharomyces cerevisiae. Некоторые их нехромосомно наследуемые детерминанты имеют свойства, полностью укладывающиеся в прионовую модель.
Если у млекопитающих заболевания, вызываемые при- онами, представляют собой пример молекулярных патологий, то вопрос о том, является ли возникновение прионов болезнью дрожжей или их существование имеет для дрожжей биологический смысл, остается пока открытым. Дело в том, что переход предшественников прионов в прионы изменяет фенотип клетки, при этом расширяется набор азотсодержащих соединений, которые клетка может ассимилировать, что приводит к увеличению ее адаптивных возможностей.
В свете новых данных прионы можно определить как белки, способные через взаимодействие друг с другом передавать свое конформационное состояние от одной молекулы к другой. В этом случае определение «прионы» может быть распространено и на соответствующие белки дрожжей и подобные белки других организмов, которые, несомненно, будут еще открыты в будущем.
