ВЕРОЯТНЫЕ ФУНКЦИИ БЕЛКОВ, СИНТЕЗИРУЮЩИХСЯ ПРИ ГИПОТЕРМИИ
Белки низкотемпературного стресса растений. Колесниченко А.В. 2003
- Дегидрины и ABA — регулируемые белки
- Белки, препятствующие льдообразованию (антифризные белки)
- Регулируемые холодом белки (COR- белки)
- Молекулярные шапероны
- Многофункциональные белки, принимающие участие в процессах транскрипции и трансляции
- Белки, разобщающие окисление и фосфорилирование в митохондриях и вызывающие термогенез во время гипотермии
Несмотря на большое количество рассмотренных выше работ, показывающих вероятную связь закаливания растени к холоду с синтезом белков (Браун, 1983; Карасев и др., 1993; Касперска-Палач, 1983; Graham, Patterson, 1982), в настоящее время много неясного в биохимических механизмах реализации это связи. Имеется относительно мало данных о природе и функциях белков, синтез которых стимулируется гипотермией. В большинстве работ показана только корреляция процесса закаливания к холоду с синтезом белка. В то же время эта корреляция позволяет предполагать важную роль белков в формировании закаленного состояния растения (Хатано, 1983; Касперска-Палач, 1983). Предполагается, что одним из непременных факторов, требующихся для индукции морозоустойчивости озимой ржи, является усиленное образование протоплазмы и клеточных мембран (Siminovitch, Clounter, 1982).
В ряде работ показано влияние генов, локализованных в определенных хромосомах ядра, на активность митохондри при гипотермии (Усова, Федотова, 1979; Войников, 1989). Было установлено, что охлаждение морозоусто чивых растени озимых злаков вызывает значительные изменения в интенсивности работы дыхательно цепи митохондри и в степени сопряженности процессов окисления и фосфорилирования (Войников, 1978). Впоследствии был показан ядерный контроль за проявлением этого признака, поскольку введение в малохолодоусто чивы генотип озимо пшеницы хромосом из Х-генома высокоморозоусто чивого пырея сопровождалось реакцие митохондри на охлаждение, типично для высокоморозосто ких форм, то есть быстрым переходом митохондри в низкоэнергетическое состояние. Замена же хромосом Х-генома пырея на хромосомы пырейного D-генома в клетках пшенично-пырейного гибрида замедляла эту реакцию митохондрий на охлаждение (Войников, 1978; Усова, Федотова, 1979). Исследования, проведенные на митохондриях 43 хромосомных (42 хромосомы пшеницы + 1 хромосома генома Х пырея) линий показали, что гены, контролирующие данны признак митохондри , локализованы, вероятно, в двух хромосомах Х-генома. Изучение линий с межсортовым замещением хромосом, при котором все пары хромосом D-генома, а также некоторые хромосомы А- и В-геномов озимой пшеницы Безостая 1 были замещены на соответствующие пары хромосом высокоморозоусто чиво пшеницы сорта Альбидум 114, показало, что только две хромосомы (1D и 6D) генома пшеницы Альбидум 114 контролируют энергетическую активность митохондрий при гипотермии (Войников, 1987). Таким образом, поскольку, как показано выше, блокировка цитоплазматического синтеза белка не позволяет пере ти митохондриям при гипотермии в низкоэнергетическое состояние, можно выдвинуть предположение, что ядро посредством изменения синтеза белков участвует в регуляции митохондриальной активности при гипотермии (Войников, 1987).
Дегидрины и ABA -регулируемые белки
В последнее время большой интерес исследователе привлекает изучение изменений в синтезе дегидринов (DHN) под действием холодовой акклиматизации. Изменение транскрипции генов белков LEA (Late Embryogenesis Abundant), RAB (responsive to ABA) и DHN было первоначально отмечено при действии водного стресса и после обработки растений абсцизовой кислотой. Все эти группы белков характеризуются высокой гидрофильностью белковой молекулы. Во время обезвоживания клетки под действием водного стресса эти белки за счет свое высоко гидрофильности препятствуют потере клеткой воды и стабилизируют клеточные белки (Skriver, Mundy, 1990). Впоследствии было обнаружено, что синтез этих белков усиливается и во время холодовой акклиматизации. Дегидрины при этом, по-видимому, препятствуют образованию льда в клетках и также стабилизируют клеточные белки (Guy et al., 1992а).
Среди белков, накапливающихся в растениях в ответ на обезвоживающее возде ствие или де ствие низких температур, наиболее интенсивно исследуются дегидрины семейства LEA D ii. Дегидрины состоят из различных типичных для белков данного вида доменов, соединяющихся в несколько наиболее распространенных вариантов полипептидов, а также многочисленных редко встречающихся вариаций. Эти домены включают в себя один или более небольших регионов альфа-спиралей амфипатичных остатков, остатки серина (место фосфорилирования) и N-терминальную последовательность. До сих пор неизвестны все биохимические функции дегидринов, но значительное число исследований, посвященных выяснению локализации дегидринов в клетке при помощи клеточного фракционирования и иммунолокализации, установили, что дегидрины могут локализоваться и в ядре, и в цитоплазме. Более того, полученные данные показывают, что этот класс белков ассоциируется с макромолекулами нуклеопротеинового комплекса в ядре и с мембранами цитоплазмы. В настоящи момент считают, что дегидрины являются факторами, предотвращающими коагуляцию ряда макромолекул, сохраняя их структурное единство во время стрессового воздействия (Close, 1997).
При исследовании отвечающих на охлаждение дегидринов ежевики (Arora et al., 1997) было установлено, что обработка низкими закаливающими температурами (15/12 0С в течение двух недель) вызывает холодовую акклиматизацию растени , а также накопление трех дегидриноподобных белков с молекулярными массами 65, 60 и 14 кДа. Денситометрия геле показала тесную взаимосвязь между содержанием дегидринов и степенью холодово закалки всех трех исследованных сортов ежевики. Авторы делают вывод, что изменения в экспрессии дегидринов более тесно связаны с холодовым закаливанием, чем с состоянием покоя растения.
Улучшенное восстановление промороженных меристем и каллусов смородины (Ribes aureum Pursh и R. Ciliatum Humb. & Bonpl.) было получено после 2 часов предварительно обработки в сахарозе, пролине, RAB — белках (RAB P), или бычьем сывороточном альбумине (БСА). Двухчасовое погружение в 0.4 M RIB-SM до промораживания существенно улучшило отрастание меристемы по сравнению с 0, 1, 3 и 4 часовым погружением. Двухчасовое погружение меристем в 5 и 10% пролин, растворенный в 0.4 M RIB-SM, значительно улучшило отрастание после промораживания. Первичный тест с экстрактами сырого RAB P из семян пшеницы показал, что отрастание промороженных апикальных меристем смородины улучшается после 2 часов предварительно обработки погружением с максимумом выживания в 1% RAB P. RAB P препараты, содержащие эквивалентные белки (1% сырой или 0.2% диализованны RAB P), имели аналогичное де ствие на отрастание, что указывает на то, что эффект зависел от присутствия белков, а не сахаров и других углеводов в сырых экстрактах RAB P. Аналогичные результаты показывают меристемы и каллусы, предварительно обработанные 5 или 10% пролином, 1% раствором RAB P или 1% БСА в 0.4 M растворе сахарозы. Предварительно обработанные меристемы продолжили прирост через 3 дня после согревания и достигли максимума отрастания через 1 неделю, по сравнению с 2 неделями для предварительно необработанного контроля (Luo, Reed, 1997).
При исследовании де ствия короткого дня на Betula pubescens было установлено, что в дополнении к различным конститутивно синтезируемым дегидринам на коротком дне обнаруживались два специфических полипептида с молекулярными массами 34 и 36 кДа (Welling et al., 1997).
Из библиотеки кДНК, полученной из корней всходов проростков Triticum durum, подвергнутых водному стрессу, были охарактеризованы четыре клона дегидринов. Два из них, ptd27e и ptd 16, кодируют белки с классическими характеристиками дегидринов, т.е. консенсусным мотивом KIKEKLPG, который присутствует за пределами последовательности сериновых остатков у карбоксильного конца. Белки, кодируемые Tddhn15 и Tddhn16, имеют сходство с последовательностями белков Triticum aestivum. Клоны ptd25a и ptd38 кодируют дегидрины, которые не имеют последовательности сериновых остатков и обладают сходством последовательности с Cor- белками T. aestivum. Чтобы скоррелировать устойчивость T. durum к засухе с экспрессией генов дегидринов, для четырех сортов было проведено сравнение накопления транскриптов дегидринов в корнях и побегах всходов в ответ на водны стресс и экзогенную абсцизовую кислоту. Исследование де ствия водного стресса во времени показало, что накопление транскриптов дегидринов запаздывает в засухоусто чивых сортах. При этом уровень аккумулированных транскриптов был более высоким в засухоустойчивых, чем в засухочувствительных сортах. Аналогичные результаты был отмечены после обработки экзогенной абсцизовой кислотой (Labhilili et al., 1995).
Роль такого гормона, как абсцизовая кислота (ABA) в устойчивости растени к низким температурам изучалась у Arabidopsis путем использования мутантов, у которых был изменен либо биосинтез, либо режим де ствия данного гормона. Различные мутанты использовались для анализа роли ABA в развитии и прорастании семени и устойчивости к стрессу. Мутанты были выделены премущественно по измененным характеристикам прорастания и роста проростков. Ген зеаксантинэпоксидазы, кодируемый геном aba1, клонировался по гомологии с геном Nicotiana plumbaginifolia, блокированным на той же биосинтетическо ступени. При этом были выявлены биохимические повреждения мутантов aba1, aba2 и aba3. ABA-нечувствительные мутанты (abi1 и abi2) также имеют фенотип, на который влияют различные ABA- зависимые процессы и, таким образом, позволяют предполагать, что они либо кодируют ранние ступени в передаче сигнала ABA, либо они влияют на специфические ступени (такие, как abi3, abi4, abi5). Гены abi1 и abi2 кодируют фермент протеинфосфатазу 2с и ген abi3 кодирует фактор транскрипции со специфическо экспрессие в семенах. Гиперчувствительны к абсцизово кислоте мутант era1 имеет нарушение в фарнезилтрансферазе (Koornneef et al., 1998).
В два раза было улучшено восстановление криоконсервированных in vitro концов побегов березы повислой (Betula pendula Roth) при помощи включения абсцизово кислоты в культуральную среду во время холодового закаливания материнских побегов. Уровень восстановления концов побегов после холодового закаливания в течение 28 дней при +5 0C в 8/16 (свет/темнота) часовом фотопериоде на среде, содержавшей 10 -4 M абсцизовой кислоты был более 40%. Абсцизовая кислота была эффективно только в сочетании с низко температуро и коротко длино дня, хотя в ходе экспериментов и были отмечены большие генотипические различия. Абсцизовая кислота имела два различных варианта влияния: усиление холодово закаленности и усиление формирования каллуса во время регенерации криоконсервированных концов побегов (Ryynanen, 1998).
Белки, препятствующиельдообразованию (антифризные белки)
Одной из функций белков, синтезирующихся в растениях при гипотермии, в частности, при де ствии отрицательных температур, является препятствование процессу льдообразования. Хотя, как было отмечено выше, в основном снижение температуры начала льдообразования происходит за счет накопления в растительно клетке сахаров в результате усиления синтеза и повышения активности соответствующих ферментов, в растительных клетках при гипотермии происходит также и синтез специфических белков, непосредственно влияющих на температуру начала льдообразования и рост ледяных кристаллов.
Способность контролировать внеклеточное образование льда во время замораживания является критическо для выживаемости толерантных к замораживанию растени . Антифризные белки, которые являются белками, способными тормозить рост кристаллов льда, недавно были отождествлены как самые распространенные апопластные белки в листьях акклиматизированной к холоду озимой ржи (Secale cereale L.). Сравнения амино-терминальных последовательностей, иммуно-перекрестной реактивности и ферментативно активности показали, что эти антифризные белки сходны с членами трех классов белков, относящихся к патогенезу, а именно, с эндохитиназами, эндо-бета-1,3-глюканазами и тауматин-подобными белками. Апопластные эндохитиназы и эндо-бета-1.3-глюканазы сильно индуцируются патогенами в чувствительном к замораживанию табаке и не обладают антифризной активностью. Полученные данные позволяют предлагать, что в патогенез-связанных белках могли развиться тонкие структурные различия, которые позволили этим белкам получить возможность связываться со льдом (Hon et al., 1995).
В листьях озимо ржи наблюдался синтез белка, продуцируемого эндогенно и выделяющегося в вакуоли и межклеточное пространство, которы значительно изменял картину роста ледяных кристаллов и понижал температуру замерзания раствора (Griffith et al., 1992). В дальне шем этими же авторами из апопласта листьев озимо ржи были выделены шесть антифризных белков, обладающих способностью абсорбироваться на поверхности льда и подавлять рост кристаллов. Антифризные белки ржи накапливались во время холодовой акклиматизации и сходны с растительными белками, связанными с патогенезом, включая два эндоглюканазоподобных, два хитиназоподобных и два тауматинподобных белка. Иммунолокализация эндоглюканазоподобных белков показала, что они накапливаются на межклеточно поверхности клеточных стенок мезофилла, в опектиненных районах, во вторичных клеточных стенках ксилемных сосудов и в эпидермальных клеточных стенках. Поскольку антифризные белки ржи локализованы в местах, где возможен их контакт со льдом, они могут выполнять функцию барьера на пути распространения льда или подавлять рекристаллизацию льда. Антифризные белки, сходные с патогенез- связанными белками, были также обнаружены в других видах трибы Triticae, но не у морозоустойчивых двудольных растений. Было установлено, что у озимо пшеницы накопление антифризных белков и развитие холодоустойчивости регулируются пятой хромосомой (Griffith et al., 1997).
Синтез значительного количества апопластных белков с молекулярными массами от 15 до 109 кДа наблюдался в процессе повышения морозоустойчивости озимой ржи (Griffith et al., 1993). Для определения того, является ли накопление этих антифризных белков общим явлением для травянистых растени , были исследованы антифризная активность и общее содержание белка в экстракте апопласта листьев ряда видов растени , растущих при низких температурах, включая как однодольные (озимая и яровая пшеница, озимы ячмень, ярово овес, кукуруза), так и двудольные (шпинат, озимый и яровой рапс, капуста, табак). Белки апопласта разделялись SDS-ПААГ электрофорезом и с помощью иммуноблоттинга определялось, де ствительно ли растения отвечают на низкие температуры накоплением белков, связанных с патогенезом. Полученные результаты показывают, что значительны уровень антифризно активности присутствовал только в апопласте морозоусто чивых однодольных растени после холодовой акклиматизации при 5/20С. Более того, во время холодовой акклиматизации только тесно связанная группа растени — рожь, пшеница и ячмень — накапливали антифризные белки, сходные со связанными с патогенезом белками. При этом накопление антифризных белков является специфическим ответом, который может быть скорее важен в холодоусто чивости некоторых видов растени , чем как общи ответ всех растений на низкотемпературный стресс (Antikainen, Griffith, 1997).
Два антифризных белка ржи с молекулярными массами 32 и 35 кДа аналогичны в их аминокислотных последовательностях и эпитопах бета-1,3-эндоглюканазе. Локализация этих антифризных белков, которые были обозначены как глюканазо-подобные белки (GLP), была установлена с использованием иммунной сыворотки, полученной против антифризного белка 32 кДа. Иммуноэлектронная микроскопия высокого разрешения листьев акклиматизированных к холоду растени выявила высокое содержание GLP в стенках клеток мезофилла, в стенках клеток, смежных с межклеточными пространствами, и во второстепенных сосудах ксилемы. Учитывая отсутствие GLP в вакуолях, эти результаты подтверждают накопление апопластных антифризных белков в акклиматизированных к холоду растениях озимой ржи. В пределах клетки GLP локализовались в цистернах шероховатого эндоплазматического ретикулума, аппарате Гольджи и плазматической мембране, что указывает на то, что GLP выделяются через экзоцитозный путь. Наличие высокого содержания GLP в листьях акклиматизированных к холоду растени , их низкое содержание в листьях неакклиматизированных растени и недостаток GLP в корнях позволяют считать, что имеется корреляция между возрастающим накоплением GLP и повышением морозоустойчивости этих растений. Кроме того, локализация GLP в непосредственно близости к магистралям для свободно воды в пределах ткане подтверждает, что эти белки играют важную роль в кристаллизации и/или рекристаллизации воды при ее замораживании (Pihakaskimaunsbach et al., 1996).
Антифризные белки обладают способностью тормозить образование льда. Для того, чтобы объяснять их роль в данном процессе, были проведены определение их концентрации и иммунолокализация этих белков в листьях, побегах и корнях озимой ржи. Каждый из общих растворимых белков, экстрагированных из акклиматизированных к холоду ржаных листьев, стебле и корне , обладал антифризно активностью, в то время как отсутствие антифризно активности наблюдалась в экстрактах из неакклиматизированных растени ржи. Антитела, полученные против трех апопластных антифризных белков из ржи, соответствующих глюконазоподобному белку (GLP, 32 кДа), хитиназоподобному белку (CLP, 35 кДа) и тауматиноподобному белку (TLP, 25 кДа), были использованы для обработки тканевых отпечатков. При этом было показано, что антифризные белки локализуются в эпидермисе и в клетках, окружающих межклеточные пространства, у акклиматизированных к холоду растений. Хотя GLP, CLP и TLP присутствовали в неакклиматизированных растениях, они обнаруживались в других местах и не обладали антифризно активностью, что подтверждает, что при низко температуре производятся другие изоформы связанных с патогенезом белков. Локализация антифризных белков у ржи может предотвращать вторичное повреждение клеток эпифипическим льдом или льдом, распространяющимся через ксилему. Распространение белков, связанных с патогенезом, и белков GLP, CLP, и TLP, накапливающихся под действием холода, аналогично и может отражать общие пути, которыми как патогены, так и лед входят и распространяются по тканям растения (Antikainen et al., 1996).
Синтетически ген антифризного белка экспрессировался в растениях и, как показали результаты экспериментов, снижал утечку электролита из листьев при температуре замерзания почвы. Синтетически антифризны белок экспрессировался в качестве слитого с сигнальным пептидом, направляющим его к межклеточному пространству, где вначале проявляется кристаллизация льда. Ген был введен в Solanum tuberosum L. Cv. Russet Burbank при помощи Agrobacterium-опосредованной трансформации. Трансформанты идентифицировались при помощи PCR — скрининга и экспрессия введенного белка проверялась иммуноблоттингом. Анализ высвобождения электролитов из листьев трансгенных растени выявил корреляцию между уровнем экспрессии трансгенного белка и степенью выносливости к замерзанию почвы (Wallis et al., 1997).
Применение методик, основанных на изучении рекристаллизации льда, позволило в последнее время установить в ряде видов растени наличие белков, обладающих антифризной активностью. В частности в корне акклиматизированной к холоду моркови (Daucus carota L.) был выделен и идентифицирован новы индуцируемы холодом антифризны белок с молекулярной массой 36 кДа (Smallwood et al., 1999). В ходе изучения его сво ств было установлено, что этот белок подавляет рекристаллизацию льда и обладает термогистерезисной активностью.
Показано, что этот полипептид существует в растворе в виде N- гликозилированного мономера. Белок , так же как и остальные известные антифризные белки, локализован в апопласте. Соответствующий этому белку ген, как показали результаты исследований, является уникальным и индуцируется холодом.
Регулируемыехолодом белки (COR- белки)
Во время холодовой акклиматизации Arabidopsis thaliana синтезируются различные регулируемые холодом (COR) полипептиды, которые не имеют или имеют очень небольшое сходство с другими известными белками. Регулируемые холодом гены cor15а и cor6.6 кодируют, соответственно, 15 и 6.6 кДа полипептиды. Известно, что полипептид COR15а транспортируется в хлоропласты и во время импорта процессируется в 9.4 кДа полипептид, обозначенный как COR15ам. Полипептид COR6.6, как считается, локализуется в цитозоле. Кодирующие последовательности той5ам и cor6.6 были перенесены под промотор фага Т7 и экспрессированы в E. coli. Рекомбинантные полипептиды COR15аm(r) и COR6.6(r) были очищены до почти гомогенного состояния с использованием комбинации фракционирования сульфатом аммония, ионообменно хроматографии и адсорбционно хроматографии на гидроксиапатите. COR15аm(r) и большинство образцов COR15аm совместно мигрировали как на двумерном электрофорезе по O’Farrell, так и на неденатурирующем электрофорезе. Эти данные подтверждают место процессинга COR15а и показывают отсутствие различий в четвертичной структуре между COR15аm(r) и большинством видов COR15аm в растениях. Напротив, миграция пятен COR6.6(r) и COR6.6 на двумерных гелях показывает, что значительная часть популяции COR6.6 в растениях модифицируется (Gilmor et al., 1996). При дальнейшем исследовании этих двух белков были определены их гидратационные характеристики и их де ствие на переходы смеси фосфолипидов из жидкокристаллического в гелеобразное состояние и из ламеллярной фазы в гексагональную II фазу. После обезвоживания при осмотическом давлении от 8 до 150 МПа содержание воды в COR- полипептидах было меньше, чем в БСА, причем COR15ам был гидратирован меньше, чем COR6.6. Ни COR6.6, ни COR15ам не изменяли температуру вызванного дегидратацией перехода как дипальмитоилфосфатидилхолина, так и диолеилфосфатидилхолина (DOPC) из гелеобразного в жидкокристаллическое состояние. В мультиламеллярных везикулах, состоящих из смеси дипальмитоилфосфатидилхолин:(DOPC) (1:1, моль: моль), ни COR15ам, ни COR6.6, ни БСА не влияли на вызванное обезвоживанием образование инвертированно гексагонально фазы как на функцию осмотического давления. Тем не менее, в смеси дипальмитоилфосфатидилхолин:(DOPC), дегидратировавшейся в присутствии COR15аm, наблюдалось специфическое ультраструктурное изменение — образование определенно поверхностно морфологии в ламеллярных доменах. Тем не менее, ни COR15ам, ни COR6.6, по-видимому, не участвуют в специфическом белково — фосфолипидном взаимодействии, изменяющим вызванное дегидратацией состояние фаз фосфолипидных везикул (Webb et al., 1996). Было проверено, действуют ли COR15ам и COR6.6 на индуцируемое холодом слияние или целостность мембран небольших униламеллярных везикул, состоящих как из различных видов фосфатидилхолина, так и из смеси диолеилфосфатидилхолина, диолеилфосфатидилэтаноламина и свободных стеролов (1:1:1, моль:моль), а также на общий липидный экстракт плазматических мембран как неакклиматизированных, так и акклиматизированных к холоду листьев риса. Когда везикулы были суспендированы в буферном растворе, как COR15ам, так и COR6.6 значительно уменьшали вызванное замораживанием слияние вне зависимости от их липидного состава. В то же время, когда везикулы были суспендированы в сахарозе или в среде, содержащей NaCl, COR-белки не оказывали влияние на индуцируемое холодом слияние. Более того, COR- белки не оказывали влияние на уменьшение вызванных холодом утечек, были ли везикулы суспендированы в чистом буфере либо в буфере с добавками NaCl или сахарозы. Фактически, действие COR-белков на везикулы, составленные из отдельных видов фосфатидилхолина, суспендированных в буфере, выражалось в аномальном увеличении вызванных замораживанием утечек. Таким образом, было установлено, что ни COR15ам, ни COR6.6 не имеют прямого криопротекторного действия на везикулы, замороженные in vitro (Uemura et al., 1996).
Многие растения, в том числе Arabidopsis, увеличивают устойчивость к замораживанию после возде ствия низких незамораживающих температур. Данны ответ, называемы холодово акклиматизацией, опосредован ДНК-регулирующим элементом «C-повтор/засухоотзывчивый элемент» (CRT/DRE) и связан с индукцией генов COR (регулируемые холодом гены). Усиление экспрессии у Arabidopsis CBF1, транскрипционального активатора, связывающегося с последовательностью CRT/DRE, индуцировало экспрессию генов COR и увеличивало усто чивость к замораживанию неакклиматизированных растений Arabidopsis. На основании этих данных был сделан вывод, что CBF1 представляет собой вероятный регулятор холодовой акклиматизации, контролирующи уровень экспрессии генов COR, и содействует повышению устойчивости к промораживанию (JagloOttosen et al., 1998).
Молекулярныге шапероныг
Друго возможно функцие белков, синтезирующихся в ответ на гипотермию и закаливание растений к холоду, является шапероновая активность. Первоначально шапероны были открыты как класс белков, участвующих в процессе формирования трехмерно структуры других полипептидов, но не являющихся компонентами конечно функциональной структуры этих полипептидов (Gatenby, Viitanen, 1994). Впоследствии было обнаружено, что шапероны с молекулярными массами 60, 70 и 90 кДа являются стрессовыми белками, синтезирующимися под де ствием высокотемпературного стресса, так называемыми «белками теплового шока» (БТШ). Было установлено, что во время действия теплового шока шапероны восстанавливают исходную укладку денатурировавших под де ствием теплового шока белков и таким образом, восстанавливая исходную трехмерную структуру ферментов и структурных белков, способствуют выживанию клетки в условиях высокотемпературного стресса. Таким образом, в настоящее время шаперон определяется как белок, которы формирует и стабилизирует в ином случае нестабильную конформацию другого белка и путем его контролируемо трехмерно укладки и освобождения субстратного белка соде ствует правильно его судьбе in vivo, то есть укладке, олигомерно сборке и транспорте в определенные субклеточные компартменты или контролирует переключение между его активно /неактивно конформацией (Hendrick, Hartl, 1993).
Хотя в абсолютном большинстве данные о синтезе и функциональной активности шаперонов относятся к случаю теплового стресса, имеются данные и о том, что некоторые белки, обладающие шапероново активностью, синтезируются и во время гипотермии и адаптации растени к низким температурам. В частности, было установлено, что под де ствием холодового шока индуцируется синтез белков с молекулярными массами 70 и 94 кДа (Гималов и др., 1991), которые, возможно, являются аналогами БТШ70 и БТШ90, обладающими шапероновой активностью. Индукция белков со сходными молекулярными массами (74 и 67 кДа) наблюдалась Г.С. Карасевым с соавторами (Карасев и др., 1993) при адаптации растени к морозу. Ими же была установлена индукция синтеза белка с молекулярно массо 24 кДа, что соответствует молекулярно массе димера белка cpn 10 (Hendrick, Hartl, 1993). Данные, указывающие на то, что белки, обладающие шапероново активностью, принимают участие в процессе закаливания, были получены при исследовании регуляции синтеза белков BiP и БТШ 70 во время холодового закаливания шпината (Anderson et al., 1993). При помощи РНК-блот-анализа было обнаружено, что, хотя матричная РНК BiP обнаруживается при «нормальной» температуре, количество мРНК BiP увеличивается при холодово акклиматизации. После прекращения де ствия гипотермии уровень матричной РНК BiP понижался до уровня ее содержания в незакаленных листьях. Этими же авторами был охарактеризован клон ДНК-копии, отвечающи за второ белок семе ства БТШ70 — 4L. Матричные РНК, кодирующие белок 4L, не были выявлены при комнатно температуре, но обнаруживались во время холодовой акклиматизации. Эти матричные РНК, кодирующие белок 4L, исчезали после одного дня раззакаливания. Очищенный белок BiP при хроматографировании разделялся на три фракции: мономер (90 кДа), димер (220 кДа) и высокомолекулярный агрегат с молекулярной массой более 700 кДа. При анализе всех фракций методом SDS-электрофореза все они давали в спектре одну полосу с молекулярной массой 79 кДа.
Один из молекулярных шаперонов у E. coli -триггер-фактор (TF) обладает особыми свойствами: он имеет пропил-изомеразную активность, ассоциируется с полипептидами рибосом, связывается с GroEL и вызывает дегидратацию определенных полипептидов. Однако в отличие от большинства шаперонов, которые являются белками теплового шока, содержание TF прогрессирующе увеличивается при снижении температуры с 420С до 160С и даже при хранении клеток при 40С, подобно множеству белков холодового шока. Таким образом, имеются все основания предполагать, что TF является одним из холодовых защитных белков. Более того, выдвинуто предположение, что дифференциальная индукния TF при низких температурах и БТШ при высоких позволяет осуществлять селективную защиту клеток от экстремальных температур (Kandror, Goldberg, 1997).
Многофункциональные белки, принимающие участие в процессах транскрипции и трансляции
Недавно полученные данные показывают, что существенные взаимозависимости могут существовать между транскрипционными и посттранскрипционными процессами. Во-первых, выдвинуты предложения, что специфические промоторы влияют на посттранскрипционную судьбу траскриптов, что указывает на взаимосвязи между белковыми комплексами, собирающимися на ДНК, и образующе ся пре-мРНК. Во-вторых, все большее количество белков оказывается многофункциональными, участвующими в транскрипционных и посттранскрипционных событиях. Классический пример этому — TFIIIA, необходимый как для транскрипции генов 5 s гРНК ТАК и для упаковки 5 s гРНК. TFIIIA теперь присоединяются к семейству Y-box белков, которые связываются с ДНК (с функциями активация и репрессии транскрипции) и РНК (упаковка мРНК). Более того, супрессор опухолей WT1, который, как первоначально считалось, представляет собо типичны фактор транскрипции, может также быть вовлечен в сплайсинг. Напротив, hnRNP K, типичны пре-мРНК-связывающи белок, выступает как фактор транскрипции. В данный момент самая приемлемая та точка зрения, что некоторые белки, которые первоначально идентифицировались в качестве факторов транскрипции, могут точно так же легко идентифицироваться в качестве сплайсинг- факторов, hnRNP, mRNP белками и наоборот. Более нельзя рассматривать экспрессию гена в качестве серии разделенных процессов. Вместо этого, похоже на то, что многофункциональные белки способны координировать различные стадии экспрессии гена (Ladomery, 1997).
В ходе экспериментов была клонирована и охарактеризована кДНК из Schistosoma mansoni, кодирущая основной белок — гомолог человеческого Y-box связывающего белка 1 (YB-1). 1.3-kb транскрипт YB-1 из S. Mansoni, который экспрессируется на различных этапах цикла жизни паразита, кодирует белок размером 217 аминокислот, содержащи на своем N-терминальном конце связывающий нуклеиновые кислоты мотив, известный как домен холодового шока (CSD). Этот домен на 64% идентичен домену холодового шока других членов семе ства Y- box связывающего белка и на 43% идентичен белку холодового шока CspA из Escherichia coli. В S. mansoni YB-1, домен холодового шока обладает некоторыми структурными характеристиками, которые позволяют образовываться димеру, как это происходит у белка холодового шока CspB из Bacillus subtilis. C-терминальная область YB-1 из S. Mansoni отличается от других Y-box связывающих белков из-за присутствия двойных повторени Arg и Gly, предположительно образующих фиброин-подобную структуру бета-сандвича. Это новы тип складывания для C- терминальной области YB-1 из S. Mansoni, что позволяет предположить специфическую функцию для этого белка у паразита (Franco et al., 1997).
Белки, разобщающие окисление и фосфорилирование в митохондриях и вызыгвающие термогенез во время гипотермии
Среди механизмов защиты растени от низкотемпературного стресса выделяется один механизм, связанны с термогенезом в митохондриях, которы , как считалось раньше, присущ только животным организмам. Однако в митохондриях растени были также обнаружены системы, способные диссипировать энергию с образованием тепла.
Исторически первой из этих систем была открыта альтернативная цианидрезистентная оксидаза. Еще в 60-е годы было установлено, что во время цветения ароидных лили в их цветках происходит активация цианидрезистентного дыхания, сопровождающаяся термогенезом, за счет чего температура цветка способна подняться на несколько градусов (Meeuse, 1975). Лилейные используют этот термогенез для испарениия аттрактантов с целью привлечения насекомых — опылителей (Meeuse, Buggeln, 1969). В ходе исследований было установлено, что этот термогенез обусловлен активацие альтернативно цианидрезистентно оксидазы, которая к настоящему времени обнаружена у всех исследованных видов растени и многих эукариотических водросле (Siedow, Umbach, 2000). Альтернативная оксидаза обнаружена также у многих, но не у всех грибов (Vanlerberghe, McIntosh, 1997). Первые попытки выделения альтернативно оксидазы позволили идентифицировать ее как хинолоксидазу (Huq, Palmer, 1978; Rich, 1978). Впоследствии D.M. Rhoads и L. McIntosh выделили первы клон кДНК, соответствующий гену альтернативной оксидазы Aox1, используя поликлональные антитела против частично очищенно альтернативно оксидазы, изолированной из Sauromatum guttatum (Rhoads, McIntosh, 1992, 1993).
В дальне шем при изучении структуры и механизмов регуляции альтернативной оксидазы было установлено, что, если у грибов функционально единице является мономер, то у растени альтернативная оксидаза функционирует в виде димера (Umbach, Siedow, 1993; Siedow, Umbach, 2000). В ходе изучения путей регуляции активности альтернативно оксидазы было установлено, что in vivo активность фермента очень сильно зависит от содержания белка альтернативно оксидазы, а следовательно, и степени экспрессии его гена, а также от концентрации его субстрата — восстановленного убихинона (Siedow, Umbach, 2000). В последние годы большое внимание уделялось изучению механизмов посттрансляционно регуляции активности данного фермента. В частности, было установлено, что в растениях альтернативная оксидаза существует в виде димера, и, когда его субъединицы ковалентно связаны дисульфидным мостом, то фермент практически неактивен (Umbach, Siedow, 1993). Восстановление дисульфидных связей дитиотриетолом резко повышает активность фермента (Umbach, Siedow, 1993). В то же время известно, что в изолированных митохондриях активность альтернативной оксидазы заметно усиливается при добавлении а- кетокислот, особенно пирувата (Day et al., 1994; Millar et al., 1993). Ряд авторов предполагает наличие связи между этими двумя регуляторными механизмами, поскольку установлено, что альтернативная оксидаза не
стимулируется а-кетокислотами при образовании дисульфидных связе между субъединицами (Siedow, Umbach, 2000) (рис. 5).
Таким образом, имеющиеся в литературе данные свидетельствуют о том, что альтернативная оксидаза является высокорегулируемым ферментом, причем его активация позволяет растению весьма эффективно переключать поток электронов с основно электронтранспортно цепи на диссипирующий энергию альтернативный путь. Данные о термогенезе у Ароидных лилий (Meeuse, 1975; Leach et al., 1996; Considine et al., 2001), участии альтернативно оксидазы в термогенезе во время созревания плодов манго (Kumar et al., 1990) а также о влиянии инфильтрации KCN проростков усто чивых озимых пшениц на их температуру во время низкотемпературного стресса (Войников, Корзун, 1984; Vojnikov et al., 1984) позволили предположить, что альтернативная оксидаза может принимать участие и в генерации тепла в так называемых «нетермогенных» растениях во время низкотемпературного стресса (Vojnikov et al., 1984; Ordentlich et al., 1991; Moynihan et al., 1995). Хотя ряд авторов считает, что это не может приводить к физиологически значимому увеличению теплопродукции (Меденцев и др., 1999), по-видимому, альтернативная оксидаза принимает участие в защите растения от низкотемпературного стресса.
Митохондриальные разобщающие белки (англ. транскрипция — uncoupling proteins, UCP) были открыты при изучении бурого жира млекопитающих. В начале 60-х годов, когда ряд групп исследователей смогли изолировать митохондрии из бурого жира и приступили к изучению их биоэнергетических характеристик, было установлено, что эти митохондрии были способны быстро окислять ряд субстратов, но классически дыхательны контроль в них отсутствовал (Nicholls, Rial, 1999). В то же время было установлено, что добавление пуриновых нуклеотидов, а также удаление эндогенных свободных жирных кислот возвращало эти митохондрии в «сопряженное» состояние. В ходе изучения влияния пуриновых нуклеотидов на дыхательны контроль митохондри было предположено, что они связываются с определенным белком, которы и отвечает за повышенную протонную проводимость внутренне мембраны митохондри . Впоследствии при помощи синтетических радиоактивно меченых аналогов пуриновых нуклеотидов было установлено, что, кроме адениннуклеотидтранслокатора эти аналоги связываются с еще одним белком с молекулярной массой 32 кДа. Последующая очистка и изучение свойств этого белка показали, что именно он ответственен за чувствительную к ГДФ протонную проницаемость митохондриальной мембраны (Lin, Klingenberg, 1982).
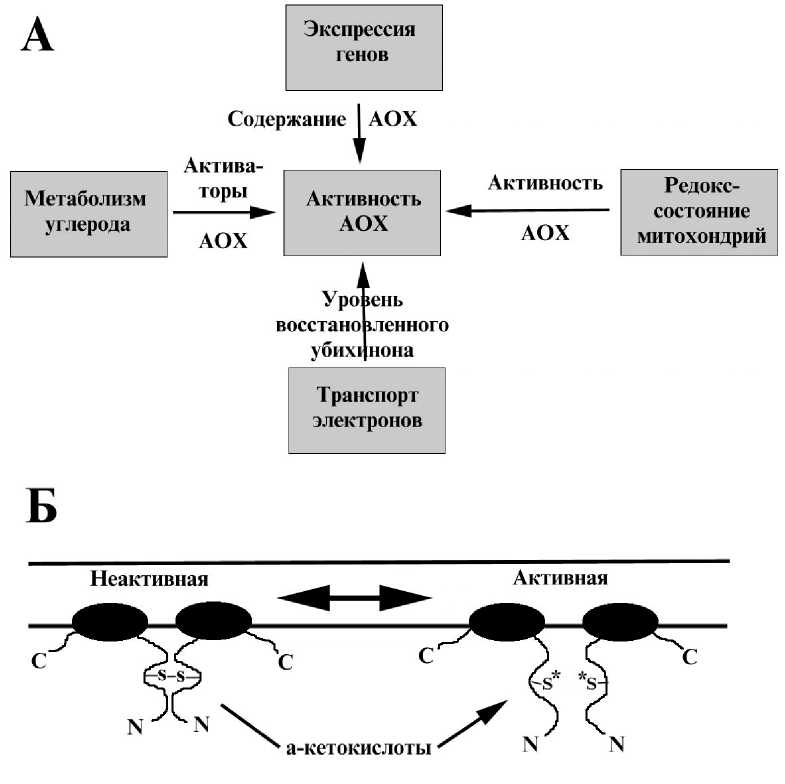
Рис. 5.
А. Основные факторы, влияющие на активность альтернативной оксидазы в митохондриях высших растений.
Б. Схема регуляции активности альтернативной оксидазы в митохондриях высших растений.
Разобщающие белки в настоящее время обнаружены как в митохондриях животных и человека, так и в растительных органеллах (Скулачев, 1989; Vercesi et al., 1995; Samec et al., 1998; Jezek et al., 1998; Jezek et al., 2000; Bouillaud et al., 2001; Raimbault et al., 2001). Эти белки, как предполагают, являются филогенетически специализированными протеинами, с помощью которых осуществляется регулируемое разобщение процессов окисления и фосфорилирования (Fleury, Sanchis, 1999; Bouillaud et al., 2001). Все известные разобщающие белки принадлежат к семе ству митохондриальных переносчиков и являются белками внутренней мембраны органелл (Jezek et al., 1998; Garlid et al., 2000; Garlid et al., 2001).
Кроме UCP1, которы й, в соответствии с имеющимися в настоящий момент данными, локализован исключительно в митохондриях бурого жира, у животных было обнаружено семейство UCP-подобных белков, локализованных в разных тканях. Это белки UCP-2 (Gimeno et al., 1997; Fleury et al., 1997), UCP-3 (Boss et al., 1997; Fleury et al., 1997; Dulloo et al., 2001) и UCP-4 (Mao et al., 1999), с уменьшающейся степенью гомологии между ними. Митохондриальные разобщающие белки UCP2 и UCP3 были открыты в 1997 году при помощи методов молекулярной биологии на основании их гомологии с UCP1. Г ен UCP2 обнаружен в геноме человека и мыше , а его мРНК идентифицирована в сердце, буром и белом жире, скелетных мышцах, почках, легком, плаценте и в тканях иммунно системы, таких как лейкоциты и макрофаги (Fleury et al., 1997; Jezek et al., 1998). UCP2, как предполагают, может быть вовлечен в регуляцию веса тела и энергетического баланса и может защищать от де ствия оксидантов (Fleury et al., 1997; Jezek et al., 1998; Samec et al., 1998; Porter, 2001). Разобщающий белок UCP3 на 57% идентичен UCP1 человека. Этот белок, как считают, является специфическим белком скелетных мышц и бурого жира и служит, главным образом, для обеспечения несократительного термогенеза (Boss et al., 1997; Jezek et al., 1998; Samec et al., 1998; Cholley et al., 2001; Garcia-Martinez et al., 2001; Porter, 2001; Simonyan et al., 2001). В то же время в настоящее время появляются данные, свидетельствующие о том, что белок UCP3 может принимать участие в регуляции энергетического обмена и играет значительную роль в регуляции ожирения и инсулиннезависимого диабета (Diehl, Hoek, 1999; Ricquier, Bouillaud, 2000b; Dulloo et al., 2001; Crowley, Vidal-Puig, 2001; Dalgaard, Pedersen, 2001; Garcia-Martinez et al., 2001; Himms-Hagen, Harper, 2001).
Поскольку степень гомологии между этими UCP-подобными белками составляет только от 60 до 30%, они считаются скорее вариантами разобщающего белка, чем его изоформами (Klingenberg, 1999; Bouillaud et al., 2001; Porter, 2001). Все эти UCP-подобные белки имеют специфическую тканевую локализацию. Если UCP1 обнаруживается исключительно в буром жире, то UCP2 распространен в тканях более широко (Jezek et al., 1999), UCP3 обнаруживается в основном в скелетных мышцах (Muzzin et al., 1999; Giacobino, 2001), а UCP4 обнаружен практически исключительно в мозге (Klingenberg, 1999; Ricquier, Bouillaud, 2000; Bouillaud et al., 2001). Данные о распространении UCP-подобных белков в тканях основаны на анализе уровней содержания их мРНК, поэтому действительные уровни содержания белка оценить трудно. Известно, что уровни содержания мРНК UCP2 и UCP3 в тканях сильно индуцируются различными стрессовыми условиями (Muzzin et al., 1999; Klingenberg, 1999). Интересно отметить, что изучение экспрессии UCP1, UCP2 и UCP3 в дрожжах показало, что все эти белки вызывали разобщение окисления и фосфорилирования в митохондриях (Klingenberg, 1998). В то же время клетки дрожже й, в которых экспрессировался UCP3, по сравнению с клетками, в которых экспрессировался UCP1, очень слабо реагировали на свободные жирные кислоты и нуклеотиды, хотя дрожжи, содержащие UCP2 и UCP3, росли значительно слабее, чем содержащие UCP1, вследствие постоянной активности этих белков (Hinz et al., 1999). Дальнейшее изучение показало, что, если активность UCP1 была низкой вследствие низкого содержания свободных жирных кислот, то UCP3 оставался высокоактивным даже в их отсутствие (Klingenberg, 1999). Еще более интересным было различие в реакции UCP1 и UCP3 на добавление АДФ и АТФ. Если для UCP1 более сильным ингибитором были нуклеотидтрифосфаты, то для UCP3 в восемь раз более сильным ингибитором были нуклеотиддифосфаты (Klingenberg, 1999). Авторы предполагают, что эти факты могут быть объяснены, основываясь на различиях в физиологическо роли и локализации данных белков. Если UCP1 является основным термогенным фактором митохондрий бурого жира и функционирует в условиях, когда митохондрии в значительно степени разобщены, то в скелетных мышцах термогенез и разобщение требуется только при отдыхе, когда отношение АТФ/АДФ является низким, т.е. UCP3 активируется при низком содержании АДФ. Таким образом, авторы предполагают различия в механизмах функционирования этих разобщающих белков (Klingenberg, 1999). Разобщающие белки были обнаружены и у других организмов, отличных от млекопитающих. В частности, они были обнаружены у птиц (Raimbault et al., 2001) и простейших (Jarmuszkiewicz et al., 1999). Поиск иммунохимически родственных UCP белков выявил наличие разобщающего белка в несбраживающих паразитических дрожжах Candida parapsilosis (Jarmuszkiewicz et al., 2000). Этот белок получил название CpUCP. Активность CpUCP стимулировалась свободными жирными кислотами (линоленовой кислото й) и ингибировалась ГТФ, так же как и активность UCP. Активация CpUCP вызывала увеличение дыхания в состоянии 4 и уменьшение А ¥и отношения АДФ/О (Jarmuszkiewicz et al., 2000).
UCP1, ранее известный как UCP или термогенин, является в этом смысле «классическим» митохондриальным разобщающим белком, специфичным для митохондрий бурой жировой ткани млекопитающих (Palou et al., 1998; Nicholls, Rial, 1999; Klingenberg, 1999; Klingenberg, Huang 1999; Stuart et al., 1999; Ricquier, Bouillaud, 2000). Этот белок кодируется ядерным геномом. Мол. масса термогенина у всех исследованных видов животных и человека приблизительно равна 33 кДа. UCP1 представляет собой мономер, состоящий из 305 аминокислот у человека и 306 аминокислот у мыши (Jezek, Garlid, 1998). Функциональная единица белка является гомодимером (Palou et al., 1998; Ricquier, Bouillaud, 1998). Изучение структуры UCP1 показало, что он состоит из из трех трансмембранных доменов (Miroux et al., 1993; Jezek, Garlid, 1998; Palou et al., 1998). Подобная тройничная структура имеется и у других UCP- подобных разобщающих белков (Fleury, Sanchis, 1999).
Бурая жировая ткань, как известно, представляет собо особую ткань млекопитающих, специализированную на выработке тепла. Своим цветом буры жир обязан митохондриям, содержащимся в огромных количествах в клетках этой ткани. Митохондрии бурого жира имеют уникальную особенность — в их внутренне мембране содержится разобщающи белок (UCP1). Активностью этого белка в основном и обусловлена термогенная функция бурого жира (Скулачев, 1989; Garlid et al., 1998; Jezek et al., 1998; Palou et al., 1998). UCP1 функционирует как высокорегулируемый переносчик протонов через внутреннюю мембрану митохондрий, который ингибируется пуриновыми нуклеотидами и активируется жирными кислотами (Скулачев, 1989; Palou et al., 1998). В активированном состоянии UCP1 служит промежуточным звеном возврата протонов в матрикс. В результате протонны потенциал, образуемы дыхательно цепью, рассеивается в виде тепла и происходит разобщение дыхания и фосфорилирования (рис. 6).
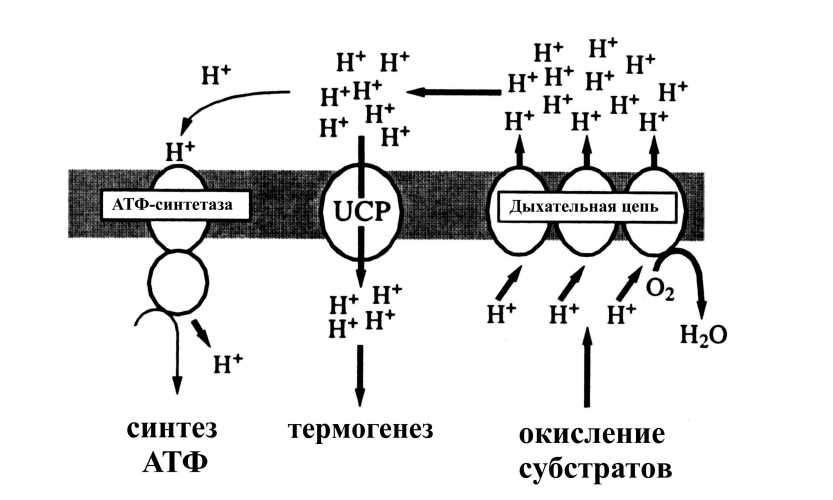
Рис. 6 Участие разобщающего белка в генерации тепла митохондриями при гипотермии (Palou et al., 1998).
В некотором отношении UCP1 функционирует как элементарный Н+ транспортер. Его функционирование не связано с котранспортом или обменом ионов, как у Н+-№ антипортера. Этот белок не является АТФ- зависимой транспортной машиной. Транспорт Н+ у этого белка направляется только мембранным потенциалом и в этом сходен с механизмом функционирования мембранных каналов (Klingenberg, 1999). Все же UCP1 функционирует более как переносчик, чем как канал по причине очень низкой концентрации ионов Н+ и участии в этом процессе свободных жирных кислот.
К настоящему времени предложено две модели, объясняющие эффект стимулирования UCP1 жирными кислотами. Согласно перво й модели, UCP1 рассматривается как переносчик протонов, а жирные кислоты служат аллостерическими активаторами этого транспорта (Nicholls, Rial, 1999; Klingenberg, 1999; Klingenberg et al., 2001). В этой модели предполагается, что молекула свободно жирно кислоты проникает из
липидной фазы свое карбоксильно группо в канал транслокации Н . Там она взаимоде ствует как донор/акцептор с карбоксильными группами UCP1. Путь транспорта Н+ согласно этой гипотезе состоит из широкой водной поры и узкой части, локализованной на стороне матрикса (рис. 7). Именно в этом месте происходит ингибирование транспорта Н+ под влиянием связывания нуклеотидов (Klingenberg, 1999).
Согласно второй модели, UCP1 выступает посредником, облегчающим трансмембранны перенос анионов жирных кислот (Palou et al., 1998; Garlid et al., 1998; Jezek, 1999; Skulachev, 1999; Stuart et al., 2001). Облегчение трансмембранного перемещения анионов жирных кислот имеет принципиальное значение для разобщающего де ствия жирных кислот, поскольку их анионные формы задерживаются на поверхности раздела мембрана/вода, ориентируясь карбоксилом в сторону воды, а жирным «хвостом» — в сторону липида. Именно поэтому мембраны плохо проницаемы для анионов жирных кислот и хорошо проницаемы для их нейтральных (протонированных) форм (Скулачев, 1989; Jezek et al., 1998). По это гипотезе механизм разобщения жирными кислотами с участием разобщающего белка кратко сводится к следующему. Анионы жирных кислот переносятся к внешнему участку внутренне мембраны митохондрий с помощью UCP1, отталкиваясь от него, становятся протонированными и возвращаются в не трально форме, перенося при этом ионы водорода. Этот этап сопровождается разобщением окислительного фосфорилирования и выделением тепла. Таким образом, согласно гипотезе «циклического оборота жирных кислот», жирные кислоты выступают как циклические протонофоры (Jezek et al., 1998; Palou et al., 1998; Skulachev, 1999) (рис. 7).
Циклический оборот жирных кислот, опосредованный участием разобщающих белков, может регулироваться различными способами — разными для каждого белка. Другая важная характеристика разобщения при помощи жирных кислот состоит в том, что здесь не требуется специального механизма для прекращения разобщающего эффекта.
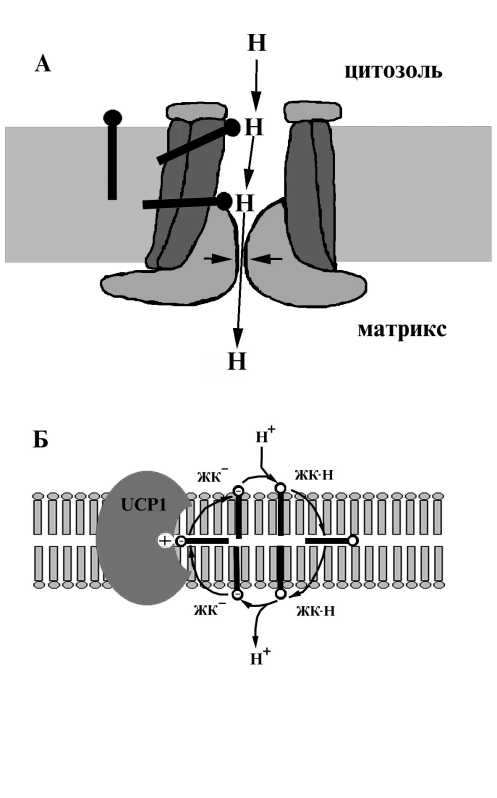
Рис. 7. Механизмы функционирования митохондриального разобщающего белка UCP1: как канала (А) (Klingenberg, 1999) и в соответствии с гипотезой «циклического оборота жирных кислот» (Б) (Jezek, 1999).
Разобщение исчезнет само по себе, как только скорость поступления жирных кислот в митохондрии станет меньше скорости их окисления (Скулачев, 1989; Jezek et al., 1998; Palou et al., 1998; Skulachev, 1999). Ряд авторов считает, что участие разобщающих белков в обороте жирных кислот экспериментально подтверждено для UCP1 и PUMP и предсказано для UCP2 и UCP3 (Jezek et al., 1998; Palou et al.,1998; Jezek, Garlid, 1998; Garlid et al., 1998).
Изучение геномов растений позволило установить, что в них присутствуют гены, кодирующие белки, имеющие высокую гомологию с UCP1 и UCP2. Эти белки были названы растительными митохондриальными разобщающими белками (plant mitochondrial uncoupling proteins — PUMP) (Vercesi et al., 1995; Vercesi et al., 2001). Растительный разобщающий митохондриальный белок PUMP вначале был выделен из клубне картофеля, затем с помощью иммунологических методов был обнаружен в различных фруктах и кукурузе как полипептид с мол. массой 32 кДа и димер с молекулярной массой 64 кДа (Laloi et al., 1997; Jezek et al., 1998). Скрининг библиотеки генов картофеля привел к открытию белка StUCP, который на 44% гомологичен UCP1 (Laloi et al., 1997).
Впоследствии анализ геномов многих растени показал присутствие в них генов, кодирующих PUMP. В частности, такие гены были обнаружены у Арабидопсиса. Анализ выделенной кДНК показал, что этот ген кодирует белок, состоящий из 306 аминокислот с предсказанной молекулярной массой 32.7 кДа (Maia et al., 1998). Этот предсказанный полипептид был на 81% идентичен StUCP картофеля и имел мотив, общий для всех митохондриальных транспортеров. Было обнаружено, что ген AtPUMP экспрессируется во всех тканях и его экспрессия сильно индуцируется холодовой обработкой, в связи с чем было предположено, что этот белок может принимать участие в защите растения от низкотемпературного стресса при помощи термогенеза (Maia et al., 1998). При дальнейшем изучении генома Арабидопсиса был обнаружен еще один ген, кДНК которого имела все характеристики известных UCP-подобных белков (Watanabe et al., 1999). В то же время было установлено, что этот ген, в отличие от генов других растительных разобщающих белков, не индуцировался холодом. На основании этих данных авторами было предположено, что у растени , так же как и у животных, семе ство UCP- подобных белков мультигенно (Watanabe et al., 1999). Впоследствии при помощи вестерн-блоттинга белок PUMP был обнаружен у значительного количества исследованных видов растений (Jezek et al., 2000).
В дальне шем две индуцируемые холодом кДНК, кодирующие растительные разобщающие белки, были изолированы из початков Symplocarpus foetidus (Ito, 1999). Эти кДНК были обозначены как SfUCPa и SfUCPb. SfUCPa кодирует белок из 303 аминокислот с предсказанной молекулярной массой 32.6 кДа, а SfUCPb кодирует белок из 268 аминокислот с предсказанно молекулярно массо 29.0 кДа. В то время как белок SfUCPa имел шесть трансмембранных доменов и тройничную структуру, SfUCPb имел только пять трансмембранных доменов, и, следовательно, имел отличающуюся топологию (Ito, 1999). Экспрессия мРНК обоих генов наблюдалась только в початках, но не в листьях, причем сильно индуцировалась в ответ на низкотемпературны стресс. Этот факт позволяет предположить, что SfUCPa и SfUCPb могут играть важную роль в термогенезе в початках Symplocarpus foetidus (Ito, 1999).
Изучение активности белка PUMP на разных стадиях онтогенеза показало, что он участвует в окончании синтетических процессов при созревании фруктов и во время климактерического подъема дыхания (дыхание перед полным созреванием плодов) (Jarmuszkiewicz et al., 1998; Jezek et al., 1998). Сравнение энергетических параметров митохондрий, изолированных из зеленых и зрелых плодов томатов (Licopersicon esculentum Mill.), показало, что, если митохондрии, изолированные из зеленых плодов, обладали высоко степенью сопряжения окисления и фосфорилирования, то митохондрии, изолированные из красных зрелых плодов, были в значительной степени разобщены (Costa et al., 1999). Для сопряжения этих митохондрий требовалось добавление БСА и АТФ, что свидетельствует о том, что это разобщение опосредовано активностью белка PUMP (Costa et al., 1999). Прямое доказательство увеличения содержания PUMP во время созревания плодов томата было получено A.M. Almeida с соавторами, наблюдавшими при помощи вестерн- блоттинга с антителами против PUMP увеличение содержания этого белка по мере созревания плодов (Almeida et al., 1999). Сходные данные были получены и для созревающих плодов манго (Considine et al., 2001).
Изучение механизма функционирования PUMP было проведено путем встраивания изолированного белка PUMP в липосомы и последующего изучения потоков К+ и Н+ и влияния на них свободных жирных кислот (Jezek et al., 1997). Полученные данные свидетельствуют, что свободные жирные кислоты, не способные к флип-флоп переходам, в частности, фенилвалериановая кислота, не могут вызывать эффект протонно проводимости мембраны со встроенным в нее белком PUMP. На основании этих данных авторы делают вывод о функционировании белка PUMP в соответствии с механизмом «циклического оборота жирных кислот» (Jezek et al., 1997). Интересно также отметить, что при изучении влияния активации PUMP свободными жирными кислотами на функционирование альтернативно оксидазы было установлено, что активация PUMP вызывает ингибирование альтернативной оксидазы (Sluse et al., 1998; Almeida et al., 1999).
Следует отметить, что почти все обнаруженные в растениях UCP- подобные разобщающие белки, в частности StUCP (Laloi et al., 1997) и PUMP в клубнях картофеля при хранении (Nantes et al., 1999), AtPUMP у арабидопсиса (Maia et al., 1998), а также SfUCPa и SfUCPb в початках Symplocarpus foetidus (Ito, 1999) индуцируются холодом. В связи с этим имеются все основания предполагать, что эти белки принимают участие в защите растени от низкотемпературного стресса при помощи термогенеза (Laloi et al., 1997; Maia et al., 1998; Ito, 1999) и, следовательно, могут считаться стрессовыми белками растений (Колесниченко и др., 2000).
Третье системо , вызывающе при своем функционировании разобщение окисления и фосфорилирования в митохондриях растений, является стрессовый белок БХШ 310. Молекулярная масса этого нативного белка составляет 310 кДа. Показано, что этот белок состоит из двух типов субъединиц с молекулярными массами 56 и 66 кДа (Колесниченко и др., 1996). Показано увеличение содержания данного белка в клетках холодоусто чивых озимых злаков под де ствием низкотемпературного стресса (Колесниченко и др., 1996; Колесниченко и др., 1997).
Использование лини нехолодосто кого сорта озимо пшеницы Безостая 1 с замещением хромосом от холодостойкого сорта Альбидум позволило установить, что конститутивны синтез этого белка контролируется 1 и 6 хромосомами D-генома мягкой пшеницы (Войников и др., 1998).
В ходе изучения влияния низкотемпературного стресса на содержание БХШ 310 в проростках озимой пшеницы установлено, что существует зависимость содержания этого белка от интенсивности низкотемпературного стресса. Наибольшее увеличение содержания БХШ 310 показано при температуре 30С (Колесниченко и др., 1996). При закаливании растений к холоду происходит изменение содержания БХШ 310 в клетках озимых злаков. Значительное увеличение его содержания происходит в течение первого часа гипотермии. Затем в течение первых суток воздействия закаливающей температуры содержание БХШ 310 снижается. По данным рокет-иммуноэлектрофореза, отмечается повторное увеличение содержания БХШ 310 после третьих суток воздействия закаливающей температуры (Колесниченко и др., 1997). Необходимо отметить, что в ходе дальне ших исследовани было показано, что у закаленных растени термогенез, которы является одно из основных функци БХШ 310, выражен в значительно меньше степени, чем у незакаленных (Kolesnichenko et al., 2001e). Поскольку в ходе изучения функционирования БХШ 310 в митохондриях выявлено различие разобщающе способности конститутивно синтезируемо и стрессово форм данного белка (Pobezhimova et al., 2001), то можно предполагать, что синтезирующаяся у закаленных растений конститутивная форма БХШ 310 не переходит в стрессовую. В таком случае, функции БХШ 310 в ходе закаливания растени к низко температуре должны отличаться от тех, которые он выполняет во время кратковременно гипотермии.
Содержание БХШ 310 в незакаленных проростках высокоустойчивых сортов и генотипов озимо пшеницы выше, чем у неусто чивых (Колесниченко 1988; Колесниченко и др., 1990). Этот факт позволяет сделать вывод, что уровень конститутивного синтеза БХШ 310 оказывает влияние на уровень усто чивости сорта озимо пшеницы. Это можно также связать с наличием двух форм данного белка, причем конститутивно синтезируемая форма в данном случае выступает как «депо», позволяющее более усто чивым сортам быстрее отвечать на возде ствие низко температуры (Kolesnichenko et al., 2001g).
При изучении функций БХШ 310 в растительной клетке во время кратковременно гипотермии показано, что этот стрессовы белок является посредником в ядерно-митохондриальных взаимодействиях, разобщая окисление и фосфорилирование в митохондриях и вызывая термогенез (Побежимова и др., 1997; Voinikov et al., 1998). В ходе изучения функций стрессового белка БХШ 310 установлено, что белок, синтезирующийся у трехсуточных проростков озимой ржи конститутивно, обладает более слабой разобщающей активностью, чем находящийся в клетке во время низкотемпературного стресса (Pobezhimova et al., 2001).
Показано, что БХШ 310 по-разному воздействует на комплексы дыхательно цепи митохондри . Наиболее сильное увеличение нефосфорилирующего дыхания отмечено при функционировании первого комплекса дыхательной цепи (Рис. 8). На остальные комплексы митохондриальной дыхательной цепи этот белок влияет в значительно меньшей степени (Grabelnych et al., 2001a). Показан эффект термогенеза, вызываемого добавлением к митохондриям БХШ 310 (Voinikov et al., 2001).
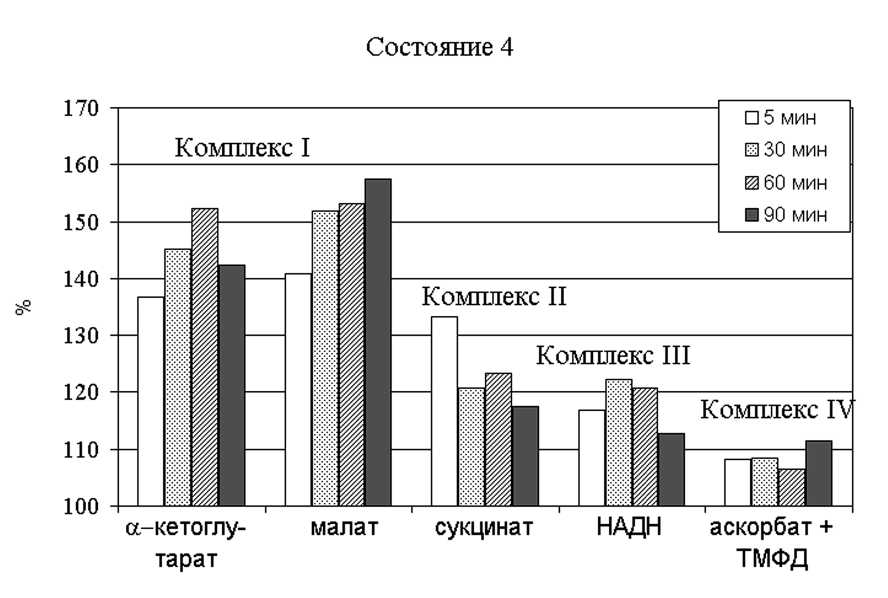
Рис. 8. Изменение относительной скорости нефосфорилирующего дыхания митохондри озимо пшеницы при окислении ими различных субстратов цикла трикарбоновых кислот во время инкубации органелл in vitro при 00С с БХШ 310 (цит. по Grabelnych et al., 2001a).
При изучении влияния ингибиторов известных растительных разобщающих белков (PUMP и StUCP) на разобщающую активность БХШ 310 установлено, что бычи й сывороточный альбумин в концентрациях, связывающих свободные жирные кислоты и полностью подавляющих активность известных разобщающих белков, не оказывает влияния на разобщающую активность БХШ 310 (Войников и др., 2001а; Kolesnichenko et al., 2002). В то же время показано, что БХШ 310 не является активатором альтернативно цианидрезистентно оксидазы, поскольку вызванное его добавлением увеличение нефосфорилирующего дыхания и термогенез ингибируется KCN (Войников и др., 2001 б). В связи с этим выдвинуто предположение, что механизм разобщающего действия БХШ 310 отличается от механизма де ствия известных разобщающих растительных белков. В то же время показано, что при инкубации изолированных митохондри с данным белком при 0 0С происходит быстрая и сильная ассоциация БХШ 310 с митохондриями. Установлено, что эта ассоциация не зависит от AW, и таким образом, энергонезависима (Kolesnichenko et al., 2001с).
Поиск белков, иммунохимически родственных БХШ 310, в клеточных фракциях показал, что у озимо ржи имеется целы ряд иммунохимически родственных БХШ 310 белков, состоящих из двух типов субъединиц с мол. массами 56 и 66 кДа (Kolesnichenko et al., 2000a). Изучение состава этих белков в цитоплазматической, митохондриальной и ядерной фракциях показало, что состав высокомолекулярных белков этого семе ства различен в этих фракциях. Если белки с мол. массами 230, около 140 и 56 и 66 кДа обнаружены во всех клеточных фракциях, то в цитоплазме присутствовали также белки с мол. массами 470 и 310 кДа, в ядерной фракции — белки с мол. массами 470 и 320-330 кДа, а в митохондриальной фракции — белок с мол. массой 310 кДа (Kolesnichenko et al., 2000a). Окраска геле бромистым этидием позволила установить, что цитоплазматически белок с молекулярно массо 310 кДа и ядерные белки с мол. массами 320 — 330 кДа и 470 кДа являются нуклеопротеинами (Kolesnichenko et al., 2000a; Kolesnichenko et al., 2001g).
Под де ствием холодового шока в цитоплазме происходит увеличение содержания высокомолекулярных белков с мол. массами 310 и 470 кДа, и в то же время значительно уменьшается содержание иммунохимически родственных БХШ 310 белков с мол. массами 230 и около 140 кДа. В ядерно фракции при гипотермии уменьшается содержание белка с мол. массой 470 кДа, но увеличивается содержание белка с мол. массой 320 кДа. В митохондриально фракции холодово шок вызывает появление белков с мол. массами 320 и 470 кДа, отсутствующих в белках контрольных проростков озимо ржи. При этом по данным вестерн- блоттинга с антителами на БХШ 310, содержание низкомолекулярных иммунохимически родственных ему белков во всех клеточных фракциях резко снижается (Kolesnichenko et al., 2000a).
Полученные при изучении влияния низкотемпературного стресса на состав и характеристики белков семейства БХШ 310 данные представляют интерес в связи с тем, что, как отмечалось в обзоре литературы, бактериальные белки холодового шока (CSPs), по существующим в настоящее время представлениям, являются РНК-шаперонами и принимают участие в регуляции и обеспечении функционирования процессов трансляции во время низкотемпературного стресса (Jiang et al., 1996). В связи с этим можно предположить, что цитоплазматический белок с мол. массо 470 кДа, которы под де ствием низкотемпературного стресса начинает связывать нуклеиновые кислоты, также может участвовать в регулировании процессов трансляции во время низкотемпературного стресса. В то же время тот факт, что некоторые белки семейства БХШ 310 под действием низкотемпературного стресса высвобождают нуклеиновые кислоты, связанные с ними ранее, позволяет выдвинуть предположение, что эти нуклеиновые кислоты могут быть «маскированными» РНК, синтез белков с которых происходит во время низкотемпературного стресса. Полученные данные также позволяют говорить о существовании в цитоплазме озимо ржи двух форм стрессового белка БХШ 310 — «конститутивно синтезируемо й», связанной с нуклеиновой кислотой и «стрессовой», не связанной с нуклеиновой кислотой (Pobezhimova et al., 2001; Kolesnichenko et al., 2001g). Этот вывод подтверждает также тот факт, что при исследовании влияния этих двух форм БХШ 310 на энергетическую активность митохондрий было показано различие в способности разобщать окисление и фосфорилирование в митохондриях этих двух форм белка БХШ 310 (Pobezhimova et al., 2001).
При изучении полиморфизма иммунохимически родственных БХШ 310 белков у ряда культурных и дикорастущих злаков — озимо ржи, озимо пшеницы, кукурузы и пыре ника — был выявлен значительны полиморфизм среди белков цитоплазматическо фракции (Kolesnichenko et al., 1999; Колесниченко и др., 2000а). У всех изученных злаков были
обнаружены низкомолекулярные иммунохимически родственные БХШ 310 белки с мол. массами 230 кДа и ниже. В высокомолекулярной области у озимой ржи обнаружено присутствие в цитоплазме белков с мол. массами 470 и 310 кДа, у озимой пшеницы — 310 кДа, а у пырейника ряд белков с мол. массами 320-380 кДа. В то же время при изучении митохондриальных иммунохимически родственных БХШ 310 белков выявлен значительны консерватизм — митохондрии всех изученных видов содержали один и тот же набор белков с мол. массами 310, 230, около 140 и 56 и 66 кДа. Установлено, что во всех исследованных видах растений иммунохимически родственные БХШ 310 белки состоят из двух типов субъединиц с мол. массами 56 и 66 кДа (Kolesnichenko et al., 1999; Колесниченко и др., 2000а). Результаты этих экспериментов позволяют сделать вывод, что в цитоплазме озимо ржи и, в несколько меньше степени, в цитоплазме озимо пшеницы, существует своего рода «депо» малоактивной формы БХШ 310, которая во время низкотемпературного стресса переходит в активную и быстро переводит митохондрии в низкоэнергетическое состояние, характеризующееся разобщением окисления и фосфорилирования.
При изучении влияния БХШ 310 на процессы ПОЛ в митохондриях озимой пшеницы было установлено, что, в отличие от UCP-подобных разобщающих растительных белков (Kowaltowski, Vercesi, 1999), добавление экзогенного БХШ 310 к митохондриям вызывает значительную индукцию перекисного окисления в условиях искусственно вызванного окислительного стресса при помощи активации ферментативного и неферментативного ПОЛ (Zykova et al., 2000; Зыкова и др., 2000). При этом была отмечена сильная зависимость индукции неферментативно и ферментативной систем ПОЛ от концентрации экзогенного БХШ 310 в среде инкубации митохондри . В то же время необходимо отметить, что стрессовы белок БХШ 310 не оказывал индуцирующего влияния на ПОЛ в неактивных митохондриях и в модельном эксперименте с индукцие ПОЛ в эмульсии линолево кислоты, что позволяет предположить, что этот белок не обладает прямо прооксидантно активностью, а оказывает влияние на ПОЛ в митохондриях путем регулирования их энергетическо активности (Kolesnichenko et al., 2001i; Zykova et al., 2001a,b). Полученные в ходе экспериментов результаты позволяют предположить, что БХШ 310 обладает апоптической активностью, и что одна из функций БХШ 310 состоит, возможно, в «разборке» определенно части митохондри , наиболее пострадавших от действия температурного стресса, путем активации ПОЛ и последующих митоптоза и апоптоза (Скулачев, 1998). В связи с этим необходимо отметить, что к настоящему времени в растениях, в отличие от животных, не обнаружены каспазы (caspase), каскад которых является основным компонентом механизма апоптоза. Считается также, что в растениях реализуется несколько отличны вариант программируемой клеточной смерти, определяемы как «программируемый онкозис» (Jones, 2000). В то же время известно, что необходимым условием апоптоза является выход из митохондри в цитоплазму цитохрома с (Reed, 1997), который является «апоптическим фактором — 2» (Apaf-2) (Jones, 2000). В связи с этим, а также принимая во внимание наличие в наружно и внутренне митохондриальных мембранах иммунохимически родственных БХШ 310 полипептидов и быструю его ассоциацию с митохондриями (Kolesnichenko et al., 2000b), можно предположить, что БХШ 310 в растении связывается с мембранными белками и образует комплекс, подобны известно митохондриальной поре (PTP). При этом в поврежденных во время стресса митохондриях этот комплекс вызывает усиление образования ими АФК.
Несмотря на то, что при изучении влияния экзогенного БХШ 310 на ПОЛ в изолированных митохондриях был установлен факт возможности определенного прооксидантного действия экзогенного БХШ 310, эксперименты с изучением влияния на ПОЛ антисыворотки против данного белка, преципитирующей эндогенный БХШ 310 и устраняющей его разобщающую активность, показали, что добавление к митохондриям антисыворотки против БХШ 310 значительно индуцирует ПОЛ в митохондриях (Kolesnichenko et al., 2001d). Эксперименты in vivo показали, что инфильтрация проростков стрессовым белком БХШ 310 вызывает значительное уменьшение уровня ПОЛ в проростках во время последующего низкотемпературного стресса (Kolesnichenko et al., 2001i; Zykova et al., 2001b), что свидетельствует о том, что из двух активностей (прооксидантно и антиоксидантно ) в целом растении во время низкотемпературного стресса превалирует антиоксидантная активность (Рис. 9).
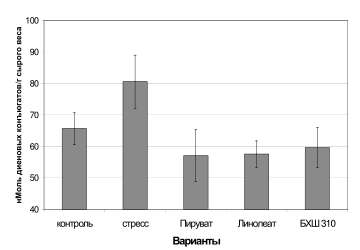
Рис 9. Влияние активаторов известных растительных разобщающих систем на перекисное окисление липидов в митохондриях озимой пшеницы во время низкотемпературного стресса (цит по Kolesnichenko et al., 2001i).
Эти результаты позволяют сделать вывод, что эндогенный БХШ 310 в митохондриях, также как и известные к настоящему времени растительные UCP-подобные разобщающие белки (Kowaltowski, Vercesi, 1999), оказывает антиоксидантный эффект за счет общего снижения содержания кислорода в растительно клетке вследствие разобщения окисления и фосфорилирования в митохондриях. В этом случае можно считать, что, в соответствии с гипотезой В.П. Скулачева (1994, 1998), любые белки, разобщающие окисление и фосфорилирование в митохондриях во время низкотемпературного стресса, являются частью антиокислительно защиты клетки.
Интересные данные, хорошо согласующиеся с данными о влиянии БХШ 310 на энергетическую активность растительных митохондрий, были получены при изучении влияния БХШ 310 и антисыворотки против этого белка на ПОЛ при функционировании различных комплексов дыхательной цепи митохондрий (Kolesnichenko et al., 2001d). Эксперименты по изучению влияния БХШ 310 на функционирование различных комплексов дыхательно цепи митохондри показали, что наиболее чувствительным к разобщающему действию БХШ 310 является комплекс I митохондриальной дыхательной цепи (Grabelnych et al., 2001a). Результаты экспериментов по изучению влияния этого белка на ПОЛ в митохондриях свидетельствуют, что экзогенный БХШ 310 оказывает статистически достоверное влияние на интенсивность ПОЛ только при функционировании I комплекса дыхательно цепи митохондри озимо пшеницы (Kolesnichenko et al., 2001d) и I и II комплекса дыхательной цепи митохондрий кукурузы (Kolesnichenko et al., 2001a). При этом необходимо отметить, что влияние, оказываемое экзогенным БХШ 310 на ПОЛ в митохондриях кукурузы, было сильнее, чем в митохондриях пшеницы.
При сравнении влияния антисыворотки против БХШ 310 на ПОЛ в митохондриях при функционировании различных комплексов дыхательно цепи установлено, что присутствие в среде инкубации митохондрий антисыворотки против БХШ 310, преципитирующей этот белок и оказывающе сопрягающее де ствие на митохондрии (Pobezhimova et al., 2001), приводит к индукции процессов ПОЛ в митохондриях как пшеницы, так и кукурузы (Kolesnichenko et al., 2001d). При этом активация ПОЛ меньше зависела от использованного субстрата дыхательно цепи митохондри .
Эксперименты по изучению влияния антисыворотки против БХШ 310 на ПОЛ в митохондриях, изолированных из стрессированных проростков показали, что сыворотка оказывает более сильное индуцирующее влияние на ПОЛ в митохондриях стрессированных проростков как озимой пшеницы, так и кукурузы, по сравнению с митохондриями, выделенными их контрольных проростков (Kolesnichenko et al., 2001d; Zykova et al., 2001a,b).
Таким образом, на основании полученных результатов можно сделать вывод, что в условиях in vivo БХШ 310 во время низкотемпературного стресса в неповрежденных митохондриях выполняет, так же как и другие известные разобщающие белки, антиокислительную функцию. В то же время в поврежденных митохондриях БХШ 310 может принимать участие в их апоптическо «разборке» путем активации в поврежденных митохондриях процессов ПОЛ.
Установлено, что добавление к изолированным митохондриям злаков антисыворотки, полученной против БХШ 310, позволяет устранить разобщающий эффект этого стрессового белка (Войников и др., 2001а; Kolesnichenko et al., 2001c). Поскольку антитела могут преципитировать антиген только на поверхности наружно мембраны митохондри , то данны факт позволяет сделать вывод о том, что БХШ 310, вызывающи разобщение окисления и фосфорилирования, локализован снаружи митохондрий (Kolesnichenko et al., 2001c). При изучении влияния антисыворотки на митохондрии показано, что даже при выделении митохондри из «контрольных» растени из-за охлаждения растительного материала в процессе выделения происходит ассоциация БХШ 310 с митохондриями и разобщение окислительного фосфорилирования.
Показано отсутствие in vivo разобщающей активности БХШ 310 в митохондриях двудольных растений (Grabelnych et al., 2001c). В модельных экспериментах на митохондриях гороха продемонстрирован разобщающий дыхание и фосфорилирование эффект добавления к ним БХШ 310 и возможность элиминировать этот эффект добавлением антисыворотки против БХШ 310 (Войников и др., 2001а). Отсутствие in vivo разобщающего эффекта БХШ 310 у исследованных двудольных растений (Grabelnych et al., 2001c) позволяет утверждать, что механизм разобщения окисления и фосфорилирования во время низкотемпературного стресса с участием этого белка является специфичным для злаков и представляет собо относительно недавнее эволюционное приобретение.
Установлено, что добавление к БХШ 310 митохондриям озимой пшеницы вызывает термогенез и, как следствие этого термогенеза, повышение температуры суспензии митохондри по сравнению с контрольно суспензие , инкубируемо без добавления белка (Во ников и др., 2001б; Voinikov et al., 2001). Добавление к митохондриям антисыворотки против БХШ 310, преципитирующей эндогенный БХШ 310 и повышающей степень сопряжения окисления и фосфорилирования митохондри , вызывает снижение температуры в яче ке по сравнению с контрольными митохондриями. Изучение влияния KCN на термогенез в суспензии митохондрий показало, что термогенез, вызванный добавлением БХШ 310, полностью подавляется KCN, и, следовательно, зависит от функционирования комплекса IV дыхательно цепи митохондри (Войников и др., 2001б; Voinikov et al., 2001).
Данные о влиянии интенсивности холодового шока на температуру проростков озимо пшеницы свидетельствуют об увеличении выработки тепла побегами проростков озимой пшеницы (Войников, Корзун, 1984; Vojnikov et al., 1984; Kolesnichenko et al., 2001e). Этот факт позволяет предположить, что процесс генерации тепла проростками озимо пшеницы является одним из физиологически регулируемых механизмов защиты растения от низкотемпературного стресса, а не является вторичным эффектом изменения метаболизма растительно клетки во время низкотемпературного стресса. При этом необходимо отметить, что образование льда в убитых незакаленных проростках озимо пшеницы происходило при то же температуре, что и у живых проростков, но быстрее. Следовательно, можно предположить, что генерация тепла проростками озимо пшеницы позволяет им получить дополнительное время на подготовку к повреждающему де ствию образующегося льда.
Таким образом, имеющиеся к настоящему времени данные позволяют утверждать, что разобщение окисления и фосфорилирования в митохондриях растени является регулируемым физиологическим процессом. В отличие от животных, обладающих одно системо , регулирующей степень разобщения окисления и фосфорилирования, у растени в митохондриях имеется несколько систем, регулирующих степень сопряжения окислительного фосфорилирования. У всех растений обнаружены альтернативная цианидрезистентная оксидаза и растительные UCP-подобные митохондриальные разобщающие белки. У злаков в дополнение к ним обнаружен белок БХШ 310. Все эти обнаруженные у растени белки являются белками ядерного кодирования, что позволяет говорить о ядерном контроле степени сопряжения окисления и фосфорилирования в митохондриях.
Функции, выполняемые разобщающими митохондриальными системами в растениях, в общем, совпадают с теми, которые они выполняют у животных. Ими являются термогенез, снижение образования активных форм кислорода митохондриями и регуляция энергетического и метаболического баланса. Все митохондриальные разобщающие системы участвуют в ответе растения на различные типы стрессовых возде стви , в связи с этим их можно рассматривать как специфические стрессовые системы. Несмотря на то, что растительные разобщающие системы в настоящее время активно изучаются рядом групп исследователе , все же они изучены недостаточно и для исследователе остается широкое поле де ствия.
