Транспорт веществ через мембрану
Биомембранология Болдырев А.А., Кяйвяряйнен Е.И., Илюха В.А.
- Характеристика транспортных процессов
- Транспорт воды
- Ионный гомеостаз клетки
- Молекулярные основы первично–активного транспорта ионов
- Натрий-калиевая-АТФаза
- Водородная-АТФаза
- Кальциевая-АТФазы
ТРАНСПОРТ ВОДЫ
Трансмембранный обмен воды протекает с высокой скоростью. Он является необходимым условием, обеспечивающим осмотическое равновесие клетки со средой. В большинстве случаев перемещение воды через биологические мембраны индуцируется изменением или гидростатического давления, или концентрации растворенного вещества, для которого мембрана менее проницаема, чем для воды. Второй случай известен под названием «уравнивание осмотического давления».
Осмос – основная движущая сила при транспорте воды через мембраны клеток животных. Осмос – преимущественное движение молекул воды через полупроницаемые мембраны (непроницаемые для растворенного вещества и проницаемые для воды) из областей с меньшей концентрацией растворенного вещества в области с большей его концентрацией. Осмос играет большую роль во многих биологических явлениях. Явление осмоса обусловливает гемолиз эритроцитов в гипотонических растворах и тургор в тканях растений.
ИОННЫЙ ГОМЕОСТАЗ КЛЕТКИ
Среди неорганических компонентов, в той или иной степени участвующих в метаболизме клеток и тканей, первое по важности место принадлежит ионам металлов (рис. 47). Накапливаемые клетками в определенных соотношениях или выбрасываемые из клеток в окружающую среду ионы металлов играют роль специфических регуляторов ферментных систем.
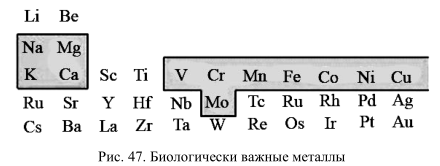
Для всех перечисленных элементов, по-видимому, существуют способы, благодаря которым клетки регулируют их содержание. Для некоторых элементов системы аккумуляции или выброса из клетки так мощны, что обнаруживается яркая неравномерность в распределении ионов по обе стороны клеточной мембраны (табл. 9). Так, клетки всех тканей животных характеризуются электрохимическим градиентом ионов Na, К и Са. Ионы Na выбрасываются из клетки, а ионы К накапливаются там, при этом создается трансмембранный потенциал клетки величиной 90–120 мВ. Ионы Са способны как выбрасываться из клеток, так и аккумулироваться во внутриклеточных депо, благодаря чему концентрация ионизированного Са 2+ в «покоящейся» клетке составляет ~10 -7 М.
Натрий и калий. Причина, по которой живые системы «выбрали» одновалентные ионы для создания ионной асимметрии, проста: это наиболее распространенные ионы в неживой природе. Кроме того, эти ионы отличаются важными особенностями. Оба указанных элемента имеют низкий потенциал ионизации внешнего электрона (так называемый первый потенциал ионизации), а образующийся ион обладает конфигурацией атома инертного газа, то есть является сферическим и слабо поляризуемым.
Таблица 9 . Содержание основных ионов в клетках и внеклеточной жидкости некоторых животных в сравнении с ионным составом морской воды (мМ)
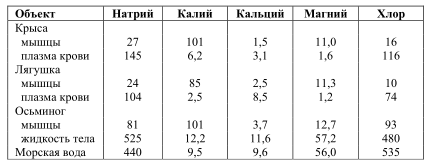
Второй потенциал ионизации для этих элементов достаточно высок. По этой причине, трудно предположить существование других окисленных форм этих металлов; в действительности они неизвестны. В биологических жидкостях натрий и калий представлены преимущественно в ионной форме. В водной фазе рассматриваемые вещества бурно ионизируются с восстановлением водорода воды, а образующиеся ионы легко гидратируются. Натрий и калий вместе с Н, Li, Rb, Cs, Fr входят в состав I группы элементов таблицы Менделеева. Все они (кроме газообразного водорода) – металлы и относятся к группе щелочных металлов. Общим для них является наличие избыточного (сверх конфигурации инертных газов) S-электрона.
Несмотря на высокую подвижность Na+ и К+, они не распределены в живых системах равномерно. Напротив, как уже отмечалось, существует определенная избирательность в распределении этих ионов между клетками и внеклеточной средой. Натрий в интерстициальной жидкости регулирует осмотический баланс организма и содержание воды в тканях. Ионы Na участвуют также в поддержании кислотно-щелочного равновесия в организме, а в возбудимых тканях (нервная и мышечная) – участвуют в формировании электрического потенциала. В последнее время установлены и другие важные для организма функции Na + , направленные на изменение упаковки нуклеиновых кислот и белков, поскольку связывание натрия ионными центрами макромолекул может стабилизировать их в определенных конформациях. Способность К + стабилизировать структуру макромолекул резко отличается от таковой у Na + .
Таблица 10. Физико-химические свойства ионов натрия и калия

Калий также необходим для растений и животных. Поскольку многие его функции аналогичны таковым у Na+, эти ионы до некоторой степени взаимозаменяемы. Однако в большинстве случаев действие К+ оказывается противоположным действию Na+ . Так, при возбуждении Na+ обеспечивает фазу деполяризации клетки, а К+ восстанавливает исходный потенциал на мембране. Для ряда ферментов гликолиза К+ является активатором, в то время как Na+ ингибирует их. По-разному влияют эти ионы и на конформационное состояние макромолекул. В основе их действия, видимо, лежит множественное связывание с анионными центрами крупных молекул, так как оптимальные активирующие концентрации одновалентных катионов очень высоки, они составляют 50–100 мМ.
Кроме того, натрий и калий в ионизированном состоянии не отличаются друг от друга по заряду, размеру и числу создаваемых ими координационных связей, но существенно отличаются по величине предельной температуры, то есть той температуры, выше которой разрешена их гидратация (Т пред ). Для натрия она составляет +20°С, а для калия +70°С. Таким образом, по крайней мере в диапазоне температур выше +20°С, в котором функционируют большинство живых организмов, натрий легко взаимодействует с молекулами воды, образуя гидратную оболочку, а калий отталкивает воду (табл. 10). Таким образом, ион калия по своим свойствам является более гидрофобным, чем ион натрия.
Поскольку гидратированный ион натрия близок по размерам к негидратированному иону калия, то ни по заряду, ни по размерам эти ионы не отличаются друг от друга, и наиболее существенным различием для их дискриминации является величина гидрофобности. Количественно эта величина может быть выражена энергией гидратации, которая при комнатной температуре составляет для натрия +1,03 кДж/моль, а для калия – -1,05 кДж/моль. Очевидно, биологические молекулы могут использовать именно этот параметр для отбора и распознавания ионов.
Липиды хорошо различают Na + и К + , вероятно, именно благодаря различиям в их гидрофобности. Если приготовить везикулы из смеси природных липидов (такой упрощенный прообраз клеточных структур называют липосомами), оказывается, что скорость простой диффузии через их мембраны будет в 3–7 раз выше для калия, чем для натрия (в зависимости от состава липидов, ионной силы и других условий). Таким образом, «неживые» липосомы способны создавать градиент одновалентных ионов на своей мембране, похожий на тот, что создается живыми клетками.
Нуклеиновые кислоты, несущие информацию о синтезе белков и тем самым определяющие белковое «лицо» клетки, тоже реагируют на изменение ионного состава среды, в которой они функционируют. Так, ионы натрия влияют на упаковку и взаимодействие нуклеотидов в двойной спирали, а ионы калия регулируют прочность контактов между рибосомами и РНК, с участием которых происходит синтез полипептидной цепи. Белковые молекулы также не являются исключением. Они способны различать натрий и калий в водных растворах. Интенсивность многих ферментативных процессов в клетке зависит от ионов натрия и калия: в большинстве случаев ион калия является активатором, а ион натрия – ингибитором клеточных реакций. Исключение составляют процессы синтеза липидов, активируемые натрием.
Магний и кальций. Ионы Mg и Са входят в состав II группы элементов таблицы Менделеева; эта группа открывается бериллием (Be). Бериллий обладает совершенно особыми свойствами, обусловленными малым металлическим радиусом (0,89 Å) и потенциалами ионизации (9,32 и 18,21 эВ). Таким образом, Be значительно менее электроположителен, чем Li. По этим причинам ионных форм Be в растворах не существует.
Несмотря на то, что электронное строение элементов группы щелочно-земельных металлов подобно электронному строению Be, больший размер их атомов уменьшает влияние заряда ядра на валентные электроны. Ионная природа их соединений возрастает в ряду Mg 2+ , Ca 2+ , Sr 2+ ; и хотя некоторые соединения Mg 2+ еще имеют ковалентный характер, все соединения Са 2+ обладают, по существу, ионными свойствами. Как и в случае элементов I группы, радиусы гидратированных ионов элементов II группы значительно больше их кристаллографических радиусов. Mg 2+ , Ca 2+ , Sr 2+ образуют ряд, в котором наблюдается систематическое изменение свойств в соответствии с изменением ионной и электроположительной природы элементов. Некоторые примеры этих систематических изменений таковы: изменение тенденции к гидратации кристаллических солей; уменьшение растворимости сульфатов, нитратов, хлоридов (но не фторидов); увеличение способности реагировать с водородом; способность стабилизировать перекисные и надперекисные анионы.
Из всех элементов группы щелочно-земельных металлов лишь Mg 2+ и Са 2+ широко используются в живых организмах; остальные в большей или меньшей степени токсичны. Главная причина токсичности этих элементов заключается, видимо, в их высокой склонности образовывать ковалентные связи, и способности вытеснять ионы Mg и Са из биологических структур и необратимым связыванием с этими структурами. Именно по этой причине особенно токсичен Be. Стронций мало распространен в биологических системах, однако его радиоактивный изотоп 90 Sr 2+ достаточно опасен: он накапливается в костях, в результате чего возможно возникновение лейкемии. Барий встречается чаще стронция, его действие на организм не изучено, известно лишь, что соли Ва 2+ влияют на обмен Са 2+ в тканях; это не относится лишь к BaSO 4 , имеющему незначительную растворимость.
При обычной диете у людей не бывает дефицита Mg 2+ , за исключением случаев резкого снижения содержания белка в пище или хронического алкоголизма. Суточная потребность человека в Mg 2+ составляет 200–300 мг, а общее количество Mg 2+ в организме взрослого человека составляет около 20 г. Более половины этого количества оседает в костях в виде фосфорных солей. В некоторых случаях фосфат магния может оседать в мочевыводящих канальцах. Почти весь остальной Mg 2+ является внутриклеточным. Содержание Са 2+ в организме человека и животных определяется соотношением эффективности систем аккумуляции и выброса Са 2+ из организма. Дефицит Са 2+ возникает весьма редко. Он чаще всего может быть вызван дефектом метаболизма, при котором реализуется склонность Са 2+ образовывать нерастворимые соли с анионами, широко распространенными в пище, – оксалатом и фосфатом. Чаще всего встречается гиперкальциемия. Нарушения обмена Са 2+ , приводящие к колебаниям его уровня в кровяном русле, вызывают нарушения многих процессов жизнедеятельности, в том числе возбудимости нервной и мышечной тканей.
Значение Mg 2+ для метаболизма может объясняться его свойствами как промотора структуры макромолекул, как субстрат-связывающего иона и как переносчика электронов. Последнее качество для Mg 2+ мало существенно, так как он не имеет переменной валентности. Первое свойство также не особенно широко распространено, хотя установлена способность Mg 2+ связываться с ДНК in vitro. Наиболее широко известна роль Mg 2+ в образовании комплекса с АТФ – субстратом аденозинтрифосфатазных реакций; в этой роли магний является незаменимым. Mg 2+ вступает во взаимодействие с фосфатными заряженными группами АТФ, поляризуя их и повышая реакционную способность системы, облегчая нуклеофильную атаку на терминальный фосфат АТФ. Наконец, есть длинный список Mg-зависимых ферментов, начиная от пируватдекарбоксилазы и кончая ДНКазой, где роль Mg 2+ связана с формированием активного (каталитического) центра фермента.
Магний как наиболее широко распространенный катион во внутриклеточном пространстве выступает природным активатором большинства ферментов, которые действуют на фосфорилированные субстраты, гидролизуя ангидриды фосфорной кислоты. Существует более 100 ферментов, для которых необходимы ионы Mg как кофактор катализируемых ими реакций. В большинстве случаев Са 2+ является его антагонистом. Так, в гладких мышцах ионы магния обеспечивают покоящееся (расслабленное) состояние волокон, а Са 2+ является активатором их сократительного ответа. По содержанию ионов Na, К, Са и Mg цитоплазма клеток отличается от интерстициальной жидкости, которая, особенно в случае морских животных, приближается к составу морской воды. Чему служит такое селективное распределение ионов? Перечисленные здесь ионы в большинстве своем участвуют в осуществлении важных пусковых или контрольных механизмов клетки. Так, Са 2+ запускает работу кальмодулин-зависимых систем, а также сократительный аппарат, Na + может регулировать интенсивность белкового синтеза; градиент одновалентных ионов является источником энергии для процессов возбуждения, а также вторично-активного транспорта субстратов в клетку; вход Mg 2+ в ядро нейтрализует заряд фосфата ДНК и стабилизирует двойную спираль. Эти данные означают, что изменение ионного гомеостаза может вызвать определенные биохимические последствия.
Часто в эксперименте, изучая роль ионов в той или иной ферментативной реакции, исследователи пытаются подменить одни ионы другими. Ферменты «замечают» подмену, причем характер изменения их свойств может дать важную информацию. Так, ионы Mg, которые необходимы для всех ферментативных реакций, включающих перенос фосфатной группы (фосфатазы, киназы, полимеразы), можно заменить ионами Мn 2+ более эффективно, чем ионами Ni 2+ , хотя у последнего ионный радиус ближе к радиусу Mg 2+. В ряде случаев лантан может заменять кальций, несмотря на разницу в их зарядах. Таллий обладает даже большим сродством к Na/K-АТФазе, чем калий. Железо в дыхательной цепи частично можно заменить на гадолиний. Такой подход перспективен для исследования взаимодействия межбелковых комплексов, поскольку марганец является парамагнитным ионом-тушителем спинового сигнала, гадолиний эффективно тушит белковую флуоресценцию.
Связывание Mg 2+ с заряженными группами нуклеиновых кислот хорошо имитируется ионами Сu 2+ , но с отличным от Mg 2+ результатом: медь дестабилизирует двойную спираль, способствуя ее раскручиванию, так как связывается не только с фосфатными группами, но и с азотистыми основаниями. Создание ионной асимметрии клетки обеспечивается активным транспортом Na+, К+, Са 2+ и Н+. Этот процесс осуществляется специальными транспортными системами.
МОЛЕКУЛЯРНЫЕ ОСНОВЫ ПЕРВИЧНО-АКТИВНОГО ТРАНСПОРТА ИОНОВ
В большинстве случаев источником энергии для первично-активного транспорта ионов является АТФ. Вот почему большинство ионных насосов одновременно являются ферментами, гидролизующими АТФ, – АТФазами. Все транспортные АТФазы прокариотических и эукариотических клеток делятся на АТФазы Р-, Vи F-типа.
Общим свойством АТФаз Р-типа является способность образовывать ковалентный фосфорилированный интермедиат (Р), участвующий в реакционном цикле. К этим АТФазам относятся Nа/К-АТФаза, Са-АТФаза и Н-АТФаза плазматической мембраны эукариотических клеток, а также Са-АТФаза эндо(сарко) плазматического ретикулума и К-АТФаза наружной мембраны прокариот (Е. coli, Streptococcus faecalis). Предполагают, что высокоспецифичное (К m = 10–30 мкМ) поглощение ионов калия клетками растений может обеспечиваться К + ,Н + -АТФазой, К + -АТФазой и(или) К + ,Н + -симпортером. Эти переносчики начинают активно действовать при микромолярных концентрациях калия во внешней среде, а насыщение наступает при концентрации ионов К + более 200 мкМ. Скорость обращения этих переносчиков составляет 102 — 104 ионов в секунду. Они способны аккумулировать калий клетками при 106 -кратном градиенте его концентрации на мембране.
В процессе функционирования АТФаз Р-типа при гидролизе АТФ остаток фосфорной кислоты переносится на карбоксильную группу аспартата активного центра и образуется фосфорилированная форма фермента (Е-Р). Эффективным ингибитором АТФаз Р-типа является ванадат-ион, который способен замещать фосфат в активном центре фермента. Различные АТФазы Р-типа отличаются друг от друга по чувствительности к любым другим модификаторам, кроме ванадата, который является сильным ингибитором именно этого типа транспортных АТФаз. Например, Н + -АТФаза плазматических мембран ингибируется диэтилстильбестролом (ДЭС) и высокими концентрациями дициклогексилкарбодиимида (ДЦКД), Nа/K-АТФаза — сердечными гликозидами, Са 2+ -АТФаза плазмалеммы активируется белком кальмодулином и угнетается рутениевым красным, SH-реагентами (мерсалил, N-этилмалеимид и др.) и эритрозином В, а Са-АТФаза саркоплазматического ретикулума – тапсигаргином.
Ион-транспортирующие АТФазы V-типа относятся к мембраносвязанным структурам, которые отличаются от митохондрий и эндоплазматического ретикулума. Они обнаруживаются в вакуолях дрожжей и тонопластах растений, а также в лизосомах, эндосомах и секреторных гранулах. Большинство этих АТФаз являются переносчиками протонов и участвуют в транспорте анионов, аминокислот, репарации мембран при эндо- и экзоцитозе. Для них не установлено образования ковалентно-связанного интермедиата в ходе каталитического цикла. Кроме ДЦКД, АТФазы V-типа блокируются нитратом, хаотропными веществами (КSCN) и SH-реагентами. Ни ванадат (ингибитор Р-типа АТФаз), ни олигомицин (ингибитор F-AТФаз) не действуют на эти системы.
На рис. 48 приведена схема функционирования электрогенных протонных насосов тонопласта. Транспорт ионов водорода внутрь вакуоли осуществляется двумя ферментами, один из которых использует энергию АТФ (Н-АТФаза), а второй – пирофосфата (Н-РРаза). Оба фермента катализируют электрогенный транспорт протона из цитозоля в вакуоль, создавая на тонопласте электрический (от +20 до +50 мВ) и химический (от 1,5 до 4,5 единиц рН) градиенты. Эта энергия используется в процессе вторичного активного транспорта ионов в режиме унипорта или антипорта. Ионы Cl — , NO 3 — и малата (Mal 2-) входят в вакуоль, а ионы Са выходят из вакуоли по градиенту электрического потенциала. Ионы Na, Са и сахара входят внутрь вакуоли в обмен на Н+. Следует отметить, что на долю Н + -РРазы приходится от 1 до 10% белков тонопласта, поэтому она способна создавать почти такой же (если не больший), как и Н-АТФаза, градиент концентрации протонов на мембране тонопласта.
АТФазы F-типа (называемые (F0 +F1)-АТФазами) обнаруживаются в мембранах бактерий, в хлоропластах и митохондриях. Они имеют очень сложное устройство: содержат водорастворимую часть F 1 , состоящую из нескольких субъединиц и обладающую каталитической активностью (способна катализировать как синтез, так и гидролиз АТФ), и гидрофобную часть F 0 , участвующую в транслокации Н+. Основные различия между этими ферментами обнаруживаются не в структуре F 1 -части, а в гидрофобном F 0 -компоненте, погруженном в мембрану. Число полипептидов в F 0 может колебаться от 3 до 8. Активность F-АТФаз подавляется олигомицином, ДЦКД, вентурицидином, ионами кадмия. В клетке ферменты первых двух типов выступают как потребители, а третьего – как продуценты АТФ. Ниже рассмотрены наиболее подробно изученные транспортные АТФ-азы.
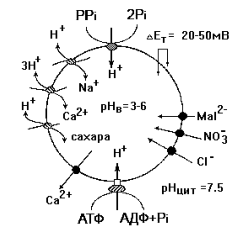
Рис. 48. Электрогенный транспорт ионов водорода водородной-АТФазой и водородной-пирофосфатазой (Н + -РРазой)
Натрий-калиевая-АТФаза
Натрий-калиевая-АТФаза представляет собой сложный белок, встроенный в наружную мембрану клетки и имеющий центры связывания для ионов натрия и калия, а также активный центр, где осуществляются связывание и гидролиз АТФ (рис. 49).

Функциональная единица фермента состоит из двух полипептидных цепей: большей (α-субъединицы) и меньшей (β-субъединицы), входящих в состав ферментного комплекса в соотношении 1:1. Меньшая субъединица пересекает мембрану только один раз, в то время как большая – много раз, образуя 5 двойных петель, при этом оба конца пептидной цепи обращены в цитоплазму. Активный центр фермента также обращен в цитоплазму и доступен для цитоплазматического АТФ. Центры связывания переносимых ионов локализованы в петле между второй и третьей спиралями, пронизывающими мембрану.
Таким образом, α-субъединица может выполнять функцию насоса независимо от β-субъединицы. Однако оба полипептида образуют компактную глобулу, насквозь пронизывающую мембрану. Та часть β-субъединицы, которая обращена во внеклеточную среду, несет на себе ковалентно присоединенные углеводные фрагменты. По массе и наличию углеводов этот полипептид можно отнести к лектинам – мембранным гликопротеинам, которые отвечают за межклеточное узнавание и адгезию. В процессе белкового синтеза обе субъединицы встраиваются в мембрану одновременно. Существуют данные, согласно которым β-субъединица обеспечивает правильную ориентацию α-субъединицы в мембране.
Гидролизуя АТФ, чтобы обеспечить энергией активный транспорт ионов, натрий-калиевая-АТФаза осуществляет сложную многостадийную реакцию, в которой участвуют ионы натрия, калия и магния, а также АТФ. Фермент имеет лабильную структуру. Он легко изменяет свою конформацию (так называют взаимное расположение и упаковку отдельных частей молекулы белка в пространстве) в зависимости от того, какой ион к нему присоединяется.
Уже в ранних исследованиях было показано, что в присутствии натрия фермент легко взаимодействует с АТФ, в результате чего терминальный фосфат АТФ переносится на карбоксил аспарагиновой кислоты белковой цепи, образуя фосфорилированный фермент (Е–Р, где Е обозначает молекулу белка-фермента, а Р – фосфорильный остаток). Фосфофермент является промежуточным продуктом АТФазной реакции. Он может находиться в двух конформационных состояниях, условно обозначаемых как Е 1 и Е 2 . Первая форма обладает повышенным сродством к ионам натрия, а вторая – к ионам калия. Переход между ними сопровождается изменением сродства белковой молекулы к переносимым катионам. В настоящее время цикл натрий-калиевой-АТФазы охарактеризован более подробно. Основные стадии можно описать следующим образом (рис. 50).

Когда фермент находится в состоянии Е1 , он способен взаимодействовать с ионами натрия и АТФ с внутренней стороны мембраны. В результате фосфорилирования молекулы образуется E1P, а АДФ высвобождается из активного центра и возвращается в цитоплазму. Фосфорилированный белок переходит в состояние, при котором ионы натрия не способны высвобождаться ни по внутреннюю, ни по внешнюю стороны мембраны – они недоступны для обмена, окклюдированы.
Переход фермента в следующую стадию активируется ионами магния. Хотя специальных центров связывания магния на молекуле фермента не обнаружено, его эффект очень важен – он заключается в ускорении перехода фосфорилированного фермента из конформации E1 в конформацию Е2. Эта стадия отражает молекулярные перемещения отдельных частей белковой глобулы, связанные с непосредственным переносом ионов натрия через мембрану. Таким образом, этот процесс осуществляется синхронно с конформационным переходом E1 – Е2. Вследствие этого окружение центра связывания ионов становится более гидрофобным, и ионы натрия диссоциируют от фермента по другую сторону мембраны, где с этим же центром связываются ионы калия. Калий подвергается такой же окклюзии, что и натрий, и в ходе этого процесса осуществляется перенос ионов калия через мембрану.
Конформационная перестройка, претерпеваемая белком при переходе E1 – Е2 , обеспечивает перестройку ионных центров и последующее перемещение петли, содержащей центр связывания ионов, внутрь мембраны. Это приводит к изменению сродства к переносимым ионам и одновременно делает ионный центр доступным для внешней или внутренней среды. Комплекс Е2Р отличается от своего предшественника тем, что окружение фосфатной группировки становится более гидрофильным и фосфат оказывается доступным для атаки молекулой воды. Происходят водный гидролиз Е–Р (дефосфорилирование фосфофермента) и высвобождение неорганического фосфата во внутриклеточную среду. После этого ионы калия также диссоциируют от центра связывания, высвобождаясь в цитоплазму. Последняя стадия цикла одновременно подготавливает фермент для начала нового цикла – конформер Е2 превращается в конформер E1 , вновь приобретающий способность взаимодействовать с ионами натрия. Этот процесс ускоряется АТФ, повышающим сродство фермента к натрию и понижающим его сродство к калию.
Таким образом, за полный гидролитический цикл происходят выброс из клетки трех ионов натрия, обогащение цитоплазмы двумя ионами калия и гидролиз одной молекулы АТФ. Так происходит активный транспорт ионов натрия из клетки и калия в клетку, а энергия АТФ тратится на оплату перехода фермента из одной конформации в другую. Таким образом, в ходе ферментативного процесса перенос ионов натрия и калия осуществляется одним и тем же ионным центром фермента, последовательно изменяющим свое сродство к переносимым ионам при изменении конформации натрий-калиевой-АТФазы.
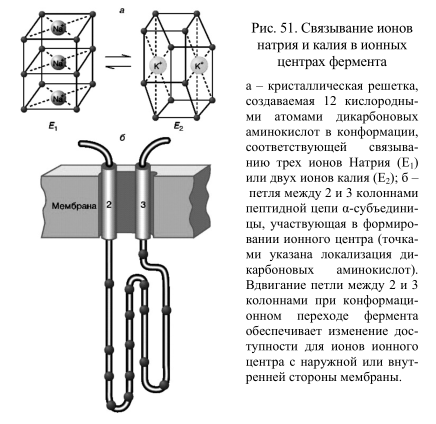
Ионные центры фермента расположены в петле между 2 и 3 α-спиральными участками фермента, пересекающими мембрану. Взаимодействие ионов с этими центрами обеспечивается благодаря координационным связям с атомами кислорода, принадлежащими дикарбоновым аминокислотам белка – аспарагиновой и глутаминовой. В образовании координационных связей с ионами должны принимать участие 12 атомов кислорода карбоксильных групп дикарбоновых аминокислот белка. Точная упаковка этой петли не установлена, однако в ее состав входят 15 дикарбоновых аминокислот, так что выбор групп для образования центра связывания ионов вполне достаточен. Кислород способен осуществлять координационные взаимодействия с лигандами, образуя решетку одного из двух типов. В одном случае получается рыхлая и доступная для молекул воды структура, а в другом атомы упакованы более плотно и не доступны для гидрофильных группировок. В первом случае ионный центр может связать три иона натрия, а во втором – два иона калия. Этим и объясняется тот факт, что при гидролизе одной молекулы АТФ фермент обменивает три иона натрия на два иона калия (рис. 51).
Оценивая размеры белковых глобул Na/K-АТФазы на электронно-микроскопических фотографиях, исследователи обнаружили, что размеры фермента превышают молекулярную массу протомера, рассчитанную из его первичной структуры. Это противоречие можно было объяснить таким образом, что отдельные функциональные единицы фермента в мембране (протомеры) «сплываются», образуя более крупные ансамбли из нескольких молекул, называемые олигомерами. Если допустить в первом приближении, что каждая функциональная единица Na/K-АТФазы представляет собой пронизывающий мембрану цилиндр, то электронно-микроскопические размеры белковых глобул соответствуют тому, что в состав белкового олигомера входят четыре таких цилиндра – (α + β)-протомера.
Сопоставление скоростей реакции, катализируемой ферментом, работающим в виде олигомерного ансамбля (при гидролизе АТФ) или в виде независимых протомеров (при гидролизе других субстратов, например, ГТФ), показывает, что, объединяясь в ансамбли, молекулы фермента демонстрируют большую скорость функционирования. В этом и заключается биологическое значение олигомерной структуры фермента. Интересно, что олигомеры образуются лишь в случае использования АТФ. Это показывает, что кроме роли источника энергии АТФ может выполнять в клетке дополнительную регулирующую роль, которая заключается в синхрониизации работы отдельных протомеров Na/K-АТФазы в виде олигомерного ансамбля.
Активность натрий-калиевой-АТФазы в клетке регулируется многими факторами. На первом месте стоят соотношение Na/K и доступность АТФ – это факторы так называемой краткосрочной регуляции активности. Содержание АТФ в клетке, как правило, мало изменяется в нормальных условиях, хотя может резко снижаться при патологических нарушениях. В таком случае снижение уровня АТФ будет критическим для поддержания достаточной активности Na/K-насоса. Соотношение натрий/калий в клетках зависит от многих факторов и, в свою очередь, является фактором, регулирующим функционирование Na/K-насоса.
В клетке натрий-калиевая-АТФаза подвергается фосфорилированию рядом протеинкиназ (ферментов, которые переносят терминальный фосфат АТФ на белки-мишени и тем самым модифицируют их активность). Установлено, что в молекуле натрий-калиевой-АТФазы протеинкиназы могут фосфорилировать остатки треонина или серина. Эти фосфорилирующиеся участки расположены вне активного центра; функциональное значение данного явления окончательно не установлено. Показано, что фосфорилирование натрий-калиевой-АТФазы протеинкиназами уменьшает ее активность. Возможно, что механизм подавления активности вызывается стерическим препятствованием фосфорилированного протомера образовать олигомерный ансамбль. Таким образом, этот пример можно считать иллюстрацией долгосрочной регуляции активности. Восстановить свою активность после атаки протеинкиназ натрий-калиевая-АТФаза может при помощи других регуляторных ферментов – фосфатаз, которые обеспечивают дефосфорилирование белков. К долгосрочным механизмам можно отнести и гормональную регуляцию синтеза натрий-калиевой-АТФазы, осуществляющуюся на уровне генетического аппарата (например, активацию синтеза фермента гормоном, регулирующим минеральный обмен, – альдостероном).
Интересную проблему представляет ингибирование Na/K-АТФазы сердца уабаином и другими сердечными гликозидами. Механизм действия уабаина и родственных ему алкалоидов растительного происхождения на организм человека и животных был долгое время неясным, хотя их длительное применение в медицине в качестве кардиотонических препаратов оправдывало присвоение им названия сердечных гликозидов. Изоформа Na/K-АТФазы, обнаруживаемая в клетках сердца, гораздо более чувствительна к уабаину, чем, например, изоформа фермента, обнаруживаемая в почечной ткани. Причины различий сродства к уабаину разных изоформ фермента кроется в первичной структуре – точечные замены делают α1-субъединицу резистентной, а α2 и α3 – чувствительными к нему. Благодаря этому ткани, содержащие уабаин-чувствительные формы фермента (сердечная мышца, мозг) приобретают способность реагировать как на экзогенные, так и на эндогенные гликозиды, избирательно понижающие насосные функции клеток.
Биологическое значение наличия уабаин-чувствительных форм Na-насоса разнообразно. Одна из форм участия этого фермента в передаче внутриклеточных сигналов будет рассмотрена ниже. Здесь мы обратим внимание на то обстоятельство, что, как правило, уабаин-чувствительная АТФаза экспрессируется в тех же клетках, в которых имеется Na/Ca-обменник. Частичное ингибирование Na-насоса приводит к росту внутриклеточного уровня натрия и позволяет восстановить уровень внутриклеточного кальция с помощью этого механизма. Вот почему применение уабаин-подобных лекарственных препаратов (например, экстракта наперстянки) устраняет сердечную недостаточность.
Водородная-АТФаза
Н + -АТФаза использует энергию, освобождающуюся при гидролизе АТФ для того, чтобы переносить через клеточную мембрану ионы водорода. Особая роль Н + -АТФазы у растений заключается в том, что, выкачивая протоны из клетки наружу, она не только поддерживает рН цитоплазмы близкий к нейтральному (что очень важно для протекания многих ферментативных процессов), но и создает на мембране разность потенциалов, во многом определяя электрические свойства высших растений. В отличие от этого Н + -АТФаза лизосом животных и вакуоли растений выкачивает протоны из цитоплазмы, но не наружу, а в эти компартменты клетки. Водородная-АТФаза – это интегральный белок, полипептидная цепь которого так же, как и Na/K-АТФаза, десять раз пересекает поверхностную (плазматическую) мембрану. Молекулярная масса одной субъединицы фермента – 104 кД. Полагают, что в мембране Н + -АТФаза функционирует в виде олигомера и состоит из двух субъединиц. В молекуле Н + -АТФазы различают несколько доменов, из которых основные – это домен, связывающий АТФ четырьмя местами связывания, и домен, имеющий отношение к переносу протона (включающий протонный канал). Истинным субстратом Н + АТФазы, как и для Na/K-АТФазы, является не сама АТФ, а ее комплекс с магнием (Mg-АТФ). В процессе работы Н + -АТФаза подвергается фосфорилированию – дефосфорилированию и обратимо меняет свою конформацию:

При этом она переходит из формы Е 1 в форму Е 2 . В форме Е 1 она связывает протон на внутренней стороне мембраны, а в форме Е 2 освобождает его на наружной стороне. На 1 мкм 2 поверхности мембраны приходится 104 молекул Н + -АТФазы. Каждая молекула работает со скоростью от 20 до 100 оборотов в секунду и переносит от 105 до 106 протонов в секунду на 1 мкм 2 . Как правило, отношение количества перенесенных протонов к количеству гидролизованных молекул АТФ равно 1.
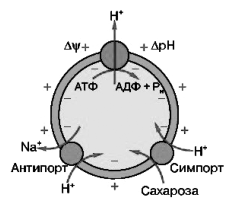
Рис. 52. Роль водородной-АТФазы во вторично активном транспорте. Водородная-АТФаза создает на мембране градиенты. Системы вторично активного транспорта используют их для переноса внутрь клетки протона и веществ (симпорт) или протона внутрь и веществ наружу (антипорт).
С функционированием водородной-АТФазы в растительной клетке связана работа вторичных систем активного транспорта (рис. 52). Водородная-АТФаза путем генерации электрического и концентрационного градиентов обеспечивает энергией работу самых разнообразных систем вторичного активного транспорта, находящихся в клеточной и вакуолярной мембранах.
Кальцевые-АТФазы
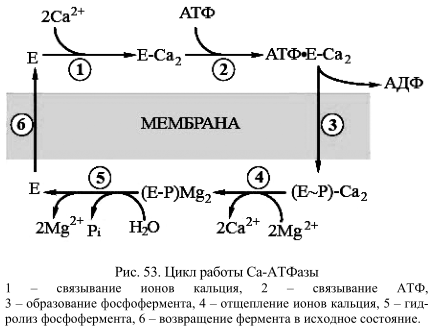
Кальциевые АТФазы, входящие в состав цитоплазматических или внутриклеточных мембран, различаются по ряду свойств. Все они представляют собой мономерные белки, то есть состоят из единственной полипептидной цепи, хотя несколько различаются по молекулярной массе. Так, кальциевая-АТФаза саркоплазматического ретикулума имеет молекулярную массу 108 кД, а кальцевая -АТФаза плазматической мембраны – 120 кД. Хотя они имеют определенную гомологию в структуре и безусловно близки по функциональным свойствам, интересно отметить, что они образуются при участии различных генов. И в каждом случае в образование молекулы насоса вовлекается несколько генов. Лучше всего изучена кальциевая-АТФаза саркоплазматического ретикулума поперечнополосатых мышц. В общих чертах расшифрована последовательность стадий при работе кальциевой-АТФазы (рис. 53).
Работа насоса замечательна тем, что стадии гидролиза АТФ чередуются со стадиями переноса кальция:
- связывание двух ионов кальция на поверхности АТФазы, обращенной в цитоплазму;
- связывание на той же поверхности молекулы АТФ;
- фосфорилирование белка (образование ЕР) и высвобождение АДФ;
- высвобождение ионов кальция с поверхности АТФазы, происходящее во внутреннюю полость СР;
- гидролиз фосфатной связи;
- переход молекулы фермента в исходное состояние (центры связывания кальция оказываются опять на цитоплазматической стороне СР).
Кальцевая-АТФаза саркоплазматического ретикулума скелетных мышц пронизывает мембрану (рис. 54). Более короткая петля расположена между 2 и 3, более длинная – между 4 и 5 α-спиралями. Длинная петля содержит АТФ-связывающий участок, включающий остаток аспарагиновой кислоты, к которому присоединяется фосфат. Связывание ионов кальция происходит на участке, образованном малой петлей (между 2 и 3 α -спиралями), возможно, с участием аминокислотных остатков, прилежащих к 1 и 4 спиралям. В местах связывания собрано несколько остатков аспарагиновой кислоты, несущих отрицательные заряды.

Кальциевая-АТФаза плазматических мембран в отличие от АТФазы СР содержит дополнительную полипептидную петлю, экспонированную в цитоплазму и образуемой С-концом. На этом домене имеется центр связывания кальмодулина – регуляторного белка, который помимо других функций регулирует активность кальциевой-АТФазы плазматической мембраны. Белком-регулятором кальциевых-АТФаз эндоплазматических мембран (в частности, СР) является фосфоламбан, который присоединяется к Са-АТФазе неподалеку от места фосфорилирования и тормозит работу фермента за счет уменьшения сродства участков связывания к Са 2+ .
Специальные внутриклеточные регуляторные системы контролируют связь фосфоламбана с АТФазой за счет фосфорилирования фосфоламбана специфическими протеинкиназами. Фосфорилированный фосфоламбан не обладает способностью связываться с кальциевой-АТФазой и снижать ее активность. Таким образом, Са-насос в клетке находится под множественным контролем. Несмотря на противоположное действие, кальмодулин и фосфоламбан имеют схожую структуру – сравнение аминокислотных последовательностей показывает, что многие участки полипептидной цепи у них совпадают. Обращает на себя внимание, что для всех известных транспортных АТФаз, переносимые ими ионы могут рассматриваться как субстрат наряду с магниевой-АТФ. При этом переносимый ион должен рассматриваться с одной стороны мембраны как субстрат, а с другой стороны – как продукт транспортного процесса. Однако такие представления требуют привлечения кинетики двух-субстратных реакций и оказываются слишком сложны для анализа.
