Терапия и профилактика вирусных инфекций
Основы молекулярной биологии вирусов и антивирусной терапии. Зинченко А.И., Паруль Д.А. — 2005
- Способы контроля вирусных инфекций
- Вакцинотерапия и вакцинопрофилактика
- Принцип вакцинации
- Типы вакцин
- Вакцины, находящиеся в употреблении в настоящее время
- Клиническое применение интерферона и его индукторов
- Химиотерапия вирусных инфекций
- Понятие о химиотерапевтическом индексе антивирусных препаратов
- Разработка и испытания противовирусных препаратов
- Успехи химиотерапии. Противовирусные препараты
- Сложность борьбы с вирусными инфекциями
- Вирулицидные препараты
- Препараты, ингибирующие адсорбцию, проникновение и раздевание вирусов
- Препараты, ингибирующие синтез вирусных нуклеиновых кислот
- Ингибирование экспрессии вирусных генов
СПОСОБЫ КОНТРОЛЯ ВИРУСНЫХ ИНФЕКЦИЙ
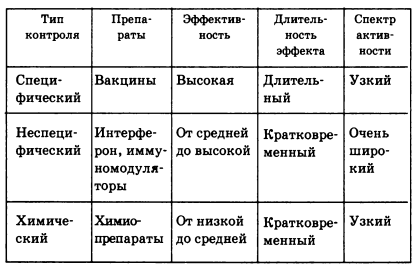
К антивирусным препаратам относятся препараты, обладающие этиотропным эффектом. Контроль вирусных инфекций включает следующие способы (табл. 5.1):
- специфический, достигаемый с помощью вакцин;
- неспецифический, когда стимуляция резистентности организма достигается с помощью интерферона, его индукторов и иммуномодуляторов ;
- химический — при использовании химиопрепаратов, избирательно подавляющих репродукцию вирусов.
Каждый из перечисленных способов имеет свои достоинства и недостатки. Так, вакцины, обладая максимальной эффективностью и длительностью защиты, отличаются узкой направленностью и пригодны в основном для профилактики. Напротив, интерферон, характеризующийся универсально широким спектром действия, пригоден для терапии и менее эффективен в качестве средства профилактики. Еще в большей мере это относится к химиопрепаратам, для которых характерны, за редким исключением, узкая направленность действия и кратковременный эффект.
Таблица 5.1. Характеристика способов контроля вирусных инфекций
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ ИНТЕРФЕРОНА И ЕГО ИНДУКТОРОВ
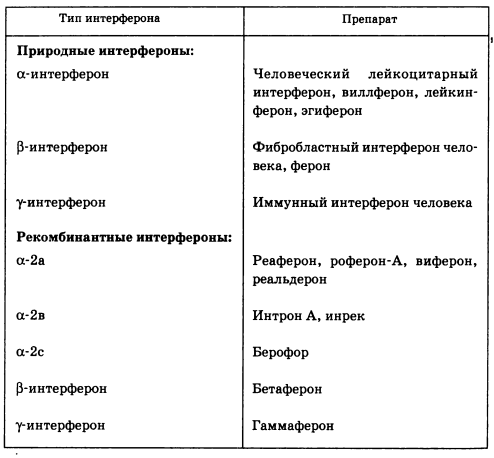
Интерферон. Существующие медицинские препараты интерферона делятся: по типу активного компонента — на а-, Р” и у-интерфероны; по способу получения и, следовательно, времени создания и начала клинического применения — на природные (или интерфероны первого поколения) и рекомбинантные (или интерфероны второго поколения) (табл. 5.3).
Таблица 5.3. Применяемые препараты интерферона
Спектр заболеваний, при которых показано применение интерферона, можно разделить на три большие группы: вирусные инфекции (табл. 5.4), болезни злокачественного роста и прочие заболевания.
Таблица 5.4. Эффективность использования интерферона при терапии некоторых вирусных инфекций
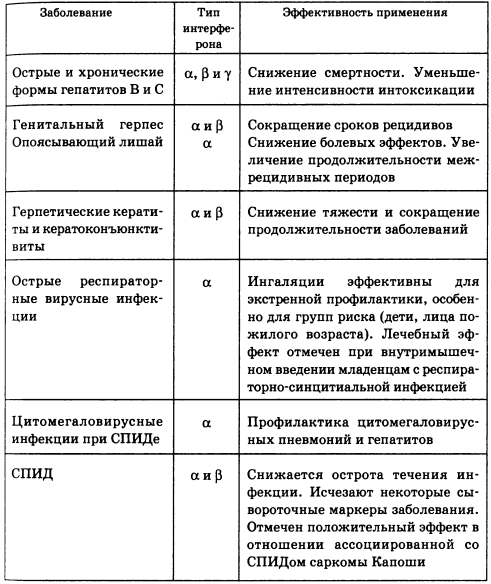
К перечню, представленному в табл. 5.4, можно добавить вирусные осложнения, часто наблюдающиеся при трансплантации органов и на фоне приема иммунодепрессантов. Применение интерферона такими больными приводит к улучшению общего состояния, уменьшению или снижению симптомов интоксикации и т.д.
Особо следует отметить, что самым эффективным средством для терапии такого грозного заболевания, как хронический гепатит С, является разрешенная к применению с 1998 г. комбинация «рекомбинантный а-интерферон + виразол » (препарат «Ребетрон»).
Индукторы интерферона. Индукторы интерферона представляют собой разнородную по составу группу высоко- и низкомолекулярных природных и синтетических соединений, объединенных способностью вызывать в организме образование эндогенного интерферона. Многие соединения этой группы обладают противовирусной, анти- пролиферативной и иммуномодулирующей активностью, т.е. всеми характерными для интерферона эффектами. В табл. 5.5 представлены примеры имеющихся в настоящее время нескольких весьма перспективных для медицины индукторов интерферона, пригодных для профилактики и лечения вирусных инфекций.
Таблица 5.5. Индукторы интерферона, пригодные для клинического применения

Изучение эффективности индукторов интерферона при различных экспериментальных вирусных инфекциях и при клиническом применении позволило выявить важнейшее свойство индукторов — универсально широкий диапазон противовирусной активности, а также то, что их активность, в целом, совпадает с антивирусными эффектами экзогенных интерферонов. При этом наиболее активными индукторами интерферона зарекомендовали себя очищенная природная двухцепочечная РНК и искусственные двухцепочечные полинуклеотиды (при обязательном условии их достаточно высокой молекулярной массы).
Ранее индукторы интерферона применяли главным образом местно, однако в настоящее время есть все основания предполагать, что в недалеком будущем будет широко распространено и системное применение этих препаратов.
Наконец следует отметить, что препараты, которые индуцируют синтез эндогенного интерферона, имеют ряд преимуществ перед экзогенным интерфероном.
- Индукторы относительно стабильны, дешевы и доступны. Они не обладают антигенностью.
- Естественный (хотя и стимулированный) синтез эндогенного интерферона не вызывает гиперинтерфероне- мии, которая нередко возникает при введении экзогенных (особенно рекомбинантных) интерферонов и приводит к тяжелым побочным явлениям.
- Однократное введение индуктора интерферона обеспечивает длительную циркуляцию интерферона на терапевтическом уровне. Для достижения такого уровня экзогенного интерферона требуется многократное введение высоких его доз, поскольку время полужизни интерферона в крови составляет всего 20-40 мин.
- Широко применяемые сейчас интерфероны (рекомбинантные) являются препаратами только а-интерферона, что существенно ограничивает их противовирусные свойства, так как для эффективной противовирусной защиты необходимо наличие всех трех классов интерферонов, синтез которых и вызывается применением индукторов интерфероногенеза.
В заключение разговора об интерфероне следует подчеркнуть, что интерферон является хотя и мощным, однако не «высокоточным оружием». Образно говоря, это оружие стреляет по площадям. Как следствие — интерфероновая терапия сопровождается серьезными побочными эффектами (лихорадка, тошнота и другие недомогания). На основании этого многие исследователи считают, что интерферон никогда не будет широко применяться для лечения тривиальных вирусных инфекций типа простуды. Однако для терапии угрожающих жизни заболеваний (например, эндогенные гепатиты) применение его будет со временем лишь возрастать.
ХИМИОТЕРАПИЯ ВИРУСНЫХ ИНФЕКЦИЙ
Понятие о химиотерапевтическом индексе антивирусных препаратов
Химиотерапия вирусных инфекций (ХВИ) — это раздел вирусологии, основными задачами которого являются поиск, испытание и отбор противовирусных лекарственных средств синтетического или природного происхождения. В настоящее время эта наука, развивая классический скрининг препаратов, использует достижения молекулярной биологии, генетики и биохимии вирусов для разработки научно обоснованного подхода к решению данной проблемы. В связи с тем что вирусы являются облигатными внутриклеточными паразитами, основной принцип ХВИ заключается в избирательном подавлении репродукции вирусов без существенного нарушения жизненных функций клетки-хозяина и макроорганизма в целом.
Следует отметить, что это классическое положение ХВИ в последнее время существенно расширено. К антивирусным химиопрепаратам сейчас многие относят не только препараты, которые селективно ингибируют отдельные этапы вирусной репродукции в клетке, но и вирулицидные вещества, инактивирующие внеклеточный вирус, а также вещества, которые влияют на структуры клетки, принимающие участие в механизмах репродукции вируса. Наконец, к антивирусным химиопрепаратам часто относят и такие препараты, которые действуют на зараженные вирусом клетки и приводят к элиминации их из организма.
Основное требование, которое предъявляется к антивирусным препаратам, — специфичность. Именно поэтому главным показателем клинической пригодности препаратов служит их химиотерапевтический индекс (ХТИ).
Химиотерапевтический индекс в его классическом понимании обычно изображается в виде следующей формулы:

Величина частного определяет качество химиопрепарата. Дадим пояснения. Чем больше числитель, тем более это свидетельствует о хорошей переносимости химиопрепарата, а значит, и о возможности безопасно повышать его дозу. Другими словами, высокий числовой показатель числителя — это показатель малой токсичности препарата и, следовательно, ценности его как антивирусного средства.
Знаменатель указывает на минимальную лечебную дозу. Нетрудно понять, что здесь благоприятствующее для оценки препарата значение будет определяться обратным отношением к числителю: чем меньшая доза необходима для получения лечебного эффекта, тем выше ценность препарата. Из всего вышеизложенного следует, что идеальным химиопрепаратом будет такой, который характеризуется большим цифровым показателем в числителе и очень малым — в знаменателе.
Практика показывает, что соотношение рассматриваемых параметров чрезвычайно важно. Нередко из-за резкого нарушения в этом соотношении препарат оказывается негодным, его практически нельзя применять — очень невысокая толерантность организма к препарату, определяемая небольшой цифрой в числителе, характеризует его высокую органотропность. С другой стороны, высокий цифровой показатель в знаменателе указывает на необходимость сильно поднимать дозы для получения терапевтического эффекта, что свидетельствует о низком этио- тропном свойстве препарата.
Справедливости ради следует заметить, что существует проблема с унификацией критериев активности и токсичности противовирусных соединений. Не вдаваясь в детали проблемы, отметим, что различными исследователями параметры, располагающиеся в числителе и знаменателе формулы ХТИ, рассчитываются по-разному, что несколько затрудняет сопоставление данных, полученных различными авторами.
Разработка и испытания противовирусных препаратов
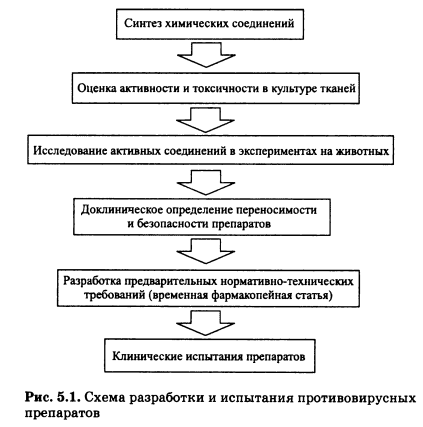
Как правило, разработка противовирусных препаратов должна вестись в порядке, который в немного упрощенном виде иллюстрирует рис. 5.1.
Задача начального этапа испытаний — объективно и точно выявить первичную специфическую противовирусную активность соединения и дать заключение о его перспективной значимости и целесообразности испытаний в опытах на животных. Практика показала, что наиболее дешево и быстро можно получить такие данные, используя тканевые культуры.
Противовирусную активность препаратов в культуре ткани (КТ) выявляют с помощью тех же тестов, что используются для оценки репродукции вируса: цитопатический эффект, феномен гемагглютенации, феномен гемадсорбции, метод флюоресцирующих антител, метод электронной микроскопии и метод бляшек (негативных колоний). При этом наиболее часто в последние 20-25 лет активность препаратов в КТ определяют методом редукции бляшек.
Популярной модификацией метода подавления бляшек является методика градиента концентрации исследуемого вещества в агаре, которое вносится в лунку, высеченную в центре чашки Петри, с инфицированными клетками. По этой методике можно определять минимальную активность исследуемого вещества с одновременной оценкой его токсичности для клеток.
Широко используется также дисковый метод подавления образования негативных колоний, состоящий в том, что исследуемое соединение вносится в составе фильтровального диска в культуру клеток с агаровым покрытием.
На стадии первичного отбора противовирусных препаратов особую ценность приобретают системы для одновременной оценки большого числа соединений. Описана методика исследования противовирусной активности химиопрепаратов с использованием культуры ткани в микрообъемах. По этой методике культуру клеток выращивают в пластиковых панелях с 96 лунками, в каждую из которых вносят по 0,1 мл вируссодержащей среды. После 72 ч инкубирования культуру клеток микроскопируют для определения цитопатического действия (ЦПД). По такой методике можно исследовать сразу большое число препаратов при небольших расходах питательных сред и изучаемых соединений.
Можно упомянуть и один из ускоренных методов оценки противовирусной активности соединений, который основан на определении интенсивности включения 3Н-уридина или 3Н-тимидина в нуклеиновые кислоты соответственно РНК-содержащих или ДНК-содержащих вирусов. В суспензию клеток вносят исследуемый вирус и спустя 30-60 мин распределяют по лункам панелей. Предварительно в каждую лунку наливают раствор испытуемого вещества и один из указанных выше радиоактивно меченных предшественников вирусной нуклеиновой кислоты. Пробы инкубируют 5 ч при 37°С. Затем радиоактивность, включившаяся в высокополимерную (кислотонерастворимую) фракцию клеточных лизатов, замеряется в жидкостном сцинтилляционном счетчике. При помощи этого метода один работник за 3 ч может исследовать до 100 образцов различных соединений. Считается, что оценка противовирусной активности соединений методом ингибирования синтеза вирусных нуклеиновых кислот более точная, чем методом редукции бляшек.
При отборе антивирусных средств большое значение имеет правильная оценка токсичности соединений. Наиболее широко распространенным и простым является метод прижизненного морфологического исследования клеток культуры ткани, которая инкубируется 48 ч в присутствии тестируемого соединения. Морфологическая оценка цитотоксичности основана на использовании результатов световой, фазово-контрастной и люминесцентной микроскопии.
В качестве критерия токсического поражения клеток используются результаты теста на жизнеспособность. Доза препарата оценивается как нетоксичная, если культура клеток после смены среды, содержащей препарат, способна репродуцировать вирус в том же титре, что и интактная культура. Этот метод определения токсичности химиопрепаратов считается более чувствительным, чем метод прижизненного морфологического исследования. Минимальная доза препарата, полностью прекращающая размножение в клетках вируса, рассматривается как токсичная.
Критерий эффективности антивирусных препаратов — ХТИ — в экспериментах с использованием культуры ткани определяется, как отношение среднетоксичной концентрации вещества (СТ50) к среднеэффективной вирусинги- бирующей концентрации (ЕД50). Соединения с ХТИ более 8 считаются перспективными для дальнейших исследований в опытах на животных.
Здесь уместно сделать следующее замечание. В англоязычной литературе для обозначения ХТИ приняты индексы TI (therapeutic index) или SI (selectivity index). Их рассчет производится из отношения 1С50/ЕС5о, где 1С50 — концентрация ингибитора, подавляющая рост клеток или жизнеспособность неинфицированных клеток на 50%, а ЕС50 — концентрация ингибитора, подавляющая на 50% продукцию вируса, инфекционность вируса или вирусиндуцированный цитопатический эффект.
Далее на животных исследуют специфическую активность, а также острую и хроническую токсичность препаратов после различных способов их введения. Критерием эффективности служит процент выживаемости и ХТИ. Препараты, обеспечивающие выживаемость (защиту) не менее 50% животных от 10 ЛД5о, считаются перспективными для дальнейшего изучения.
Острую и хроническую токсичность новых препаратов нужно изучать не менее чем на трех видах животных, включая собак. Аналоги известных химических соединений допускается изучать на животных двух видов, один из которых не относится к грызунам. В качестве подопытных животных для изучения противовирусных препаратов используются самые разнообразные животные, в том числе белые мыши, хлопковые крысы, морские свинки, кролики, хомяки, хорьки, поросята, собаки, обезьяны.
Оценка на животных является абсолютно необходимой хотя бы потому, что между активностью препарата in vitro и in vivo далеко не всегда существует корреляция. Чем это можно объяснить? Универсального ответа не существует. Это может быть плохая всасываемость препарата (т.е. биодоступность), подверженность препарата непродуктивному метаболизму в макроорганизме и т.д.
Следует отметить, что экспериментальная модель вирусной инфекции для оценки противовирусной активности препаратов должна как можно точнее воспроизводить заболевание человека. Чем больше сходство, тем выше корреляция между результатами, полученными на лабораторных животных и у человека. К сожалению, удовлетворительных моделей такого типа для большинства вирусных инфекций мало.
В схемах оценки препаратов при изучении на животных моделях предусматривается введение их до и после заражения — для определения профилактического и лечебного эффекта. Обычно ХТИ в опытах на животных выражается отношением ЛД50 к ЕД50, где ЕД50 — суточная доза препарата, защищающая 50% животных. Принято, что препараты с ХТИ меньше 2 — неактивны, а с 4 и выше — перспективны для дальнейшего изучения в клинике.
Следует отметить, что кроме высокой специфичности к антивирусным препаратам предъявляется много других требований, а именно:
- хорошая растворимость в водной среде;
- сохранность структуры при введении в организм;
- скорость адсорбции слизистыми и элиминации из организма;
- способность проникать в ткани-мишени;
- стабильность при хранении;
- доступность сырья и простая технология производства и т.д.
По поводу последнего по списку (но не по значимости!) требования необходимо отметить, что именно из-за отсутствия подходящей технологии производства часто внедрение препаратов в практику здравоохранения задерживается на десятки лет.
