СВЯЗЬ НИЗКОТЕМПЕРАТУРНОГО СТРЕССА С ДРУГИМИ ТИПАМИ СТРЕССА — ОБЕЗВОЖИВАНИЕМ И ОКИСЛИТЕЛЬНЫМ СТРЕССОМ
Белки низкотемпературного стресса растений. Колесниченко А.В. 2003
Поскольку, как отмечалось выше, одно из стратегий, применяемых растениями для выживания во время низкотемпературного стресса, является обезвоживание цитоплазмы, то действие низкотемпературного стресса и засухи на растения в значительной степени совпадают. Обезвоживание растительной клетки под действием низкотемпературного стресса имеет ряд опасных последствий, которые могут привести ее к гибели. Это, во-первых, повышение концентрации растворенных веществ, и прежде всего солей. Во-вторых, обезвоживание вызывает изменение рН внутриклеточных растворов. В-третьих, оно вызывает образование ковалентных связей между макромолекулами и вызывает конформационные изменения структуры макромолекул из-за снижения содержания стабилизирующих их молекул воды и, наконец, приводит к нарушению структуры мембран и вызывает повреждение структуры протоплазмы при обратном поглощении воды (Левитт, 1983).
Поскольку внеклеточное замерзание воды предотвращает образование внутриклеточного льда, но вызывает при этом обезвоживание макромолекулярной структуры клетки, предполагается, что процесс закаливания включает в себя следующие механизмы:
- облегчение оттока воды из клетки через мембраны;
- защиту клеточных компонентов от действия обезвоживания.
Обеспечение оттока воды через мембраны может обеспечиваться путем повышения ненасыщенности липидов (de la Roche et al., 1972; Smolenska, Kuiper, 1977). Изменения содержания фосфолипидов также влияют на свойства мембран и повышают их проницаемость для воды, а быстрое снижение содержания фосфолипидов при замораживании вызывает усиленный отток воды в межклетники и защищает клетку от внутриклеточного льдообразования (Касперска-Палач, 1983).
Повреждения, вызываемые обезвоживанием при замораживании у закаленных растений могут быть предотвращены следующими путями:
- 1) структурными и конформационными изменениями компонентов клетки, которые они претерпевают в процессе закаливания (при этом происходит как переход макромолекул в устойчивые, выдерживающие сильное обезвоживание, формы, так и индуцируемы гипотермией синтез специфических макромолекул, устойчивых к обезвоживанию);
- 2) защитой компонентов клетки от обезвоживания взаимодействием с низкомолекулярными веществами
- 3) функционированием определенных стрессовых белков.
Отмечено, что низкотемпературны стресс, высокая концентрация кислорода и озона в атмосфере, некоторые дефолианты, такие как паракват, и обезвоживание растения вызывают в клеточных мембранах повреждения со сходными симптомами, которые включают повышенную вязкость мембран, формирование областей гелевой фазы, деградацию фосфолипидов и наколенией свободных жирных кислот (McKersie et al., 1988; McKersie, 1991). Все эти симптомы можно наблюдать in vitro, если изолированные мембраны обработать супероксидом. Уровни содержания перекиси водорода и малонового диальдегида увеличиваются во время низкотемпературного стресса, особенно при замерзании растений, что предполагает индукцию перекисного окисления липидов (Loubaresse et al., 1991).
Эти наблюдения подтверждают гипотезу, что общие симптомы повреждения клеток являются следствием развития окислительного стресса, и что устойчивость к окислительному стрессу является важным компонентом устойчивости к низкотемпературому стрессу (Kendall, McKersie, 1989). В дальнейшем было также установлено, что акклиматизация злаков к низким температурам роста стимулирует не только увеличение морозоустойчивости, но также усиливает устойчивость к действию свободных радикалов, образующихся при обработке рядом гербицидов, таких как паракват и ацифлюорфен. В связи с этим было предположено, что мембраны акклиматизированных к холоду проростков накапливают липидорастворимые антиоксиданты, эффективно удаляющие активированный кислород и ингибирующие реакции перекисного окисления (Kendall, McKersie, 1989).
Повреждения при охлаждении, как и при замерзании, частично обусловлены действием свободных радикалов кислорода как агентов, вызывающих вторичные повреждения в мембранах и фотосистемах. С одно стороны, предполагается, что активация кислорода фотосистемами при интенсивном свете является основным сайтом образования свободных радикалов в листьях (Parkin et al., 1989). В то же время другие электроннотранспортные системы, включая системы в митохондриях или плазмалемме, также могут производить активные формы кислорода, особенно в нефотосинтезирующих тканях. В частности, было показано, что митохондрии являются основным источником супероксида в чувствительных к охлаждению растительных тканях при низких температурах (Purvis et al., 1995).
В соответствии с терминологией, предложенной J. Raison и J. Lyons (1986), окислительный стресс может рассматриваться как вторичный ответ на первичное повреждение в редокс-ферментной системе. Развитие симптомов повреждения при низкотемпературном стрессе совпадает с развитием процесса перекисного окисления жирных кислот (Parkin et al., 1989). R. Shewfelt и M. Erickson (1991) предположили, что перекисное окисление липидов (ПОЛ) изменяет физические свойства мембран и ингибирует функционирование мембранно-связанных белков, что способствует развитию визуальных симптомов повреждения при низкотемпературном стрессе.
В частности, при охлаждении на свету теплицы с проростками огурца до 5 0С наблюдали следующие симптомы:
- снижение фотосинтеза в течение 2 часов;
- образование продукта ПОЛ — этана;
- уменьшение содержания токоферола на 80%;
- уменьшение содержания хлорофиллов a и b и каротиноидов;
- уменьшение содержания глутатиона;
- уменьшение содержания аскорбата на 70%.
В других экспериментах при обработке низко температурой устойчивого к охлаждению гороха подобные изменения, напротив, не происходили (McKersie, 1996).
При изучении морозоустойчивого дикого томата (Lycopersicon hirsutum) и культивированного генотипа (L. esculentum cv.H722) также наблюдалось уменьшение содержания антиоксидантов во время охлаждения растений в течение 72 часов при 2 0С (Walker, McKersie, 1993). Содержание токоферола, аскорбата и глутатиона снижалось у L. esculentum в большей степени, чем у L. hirsutum. В действительности, у L. hirsutum содержание каротиноидов, аскорбата и глутатиона после охлаждения даже увеличивалось, что указывает скорее на акклиматизацию, чем на повреждение растений низкой температурой (Walker, McKersie, 1993). Тем не менее, авторы не связывают видовую устойчивость растений к холоду с абсолютным уровнем содержания антиоксидантов до охлаждения.
Воздействие на некоторые чувствительные к холоду виды растений различными типами стресса может вызывать у них устойчивость к повреждению при охлаждении. Например, было показано, что охлаждение вызывает накопление Н2О2 в колеоптиле, листе и мезокотилей проростков кукурузы выращенных в темноте, но не вызывает накопления Н2О2 в их корнях (Anderson et al., 1994). В то же время у предварительно обработанных Н2О2 семян симптомы повреждения холодом были незначительны. При этом в акклиматизированных проростках наблюдалось повышение содержания глутатиона и каталазы, что может быть защитой от генерируемой в митохондриях Н2О2 (Anderson et al., 1994). Более высокая при низких температурах активность ферментов, связанных с синтезом глутатиона, способствует увеличению содержания глутатиона при акклиматизации растений (Brunner et al., 1995; Kocsy et al., 1996).
Данные, полученные при использовании методов молекулярной биологии также показывают, что между охлаждением, образованием свободных радикалов и акклиматизацией растений существует связь. Действительно, промотор гена цитозольной Cu/Zn-СОД, индуцировался в клетках табака после охлаждения и после обработки растений сульфидриловыми антиоксидантами, такими как редуцированны глутатион и цистеин (Herouart et al., 1994). В настоящее время считается, что в цитозоле экспрессия СОД прямо связана со специфичным для клеток образованием излишков радикалов супероксида.
Таким образом, имеющиеся литературные данные позволяют считать, что низкотемпературны стресс находится в тесно связи с другими видами стресса, такими как обезвоживание и окислительный стресс. Под действием низкотемпературного стресса происходят изменения в структуре и составе клеточных мембран и изменения в метаболизме, приводящие к увеличению образования активных форм кислорода в растительной клетке. В связи с этим во время низкотемпературного стресса и процесса адаптации растения к действию низко температуры включаются многочисленные и разнообразные защитные механизмы.
НИЗКОТЕМПЕРАТУРНЫЙ СТРЕСС И ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ
В отсутствие экстремальных эндо- или экзогенных факторов процесс ПОЛ протекает в клетках сбалансировано. Концентрация продуктов ПОЛ удерживается на постоянном, низком уровне (Барабой и др., 1992). АФК и перекиси липидов вовлекаются в нормальны метаболизм клетки, участвуют в синтезе ряда веществ, разборке поврежденных мембранных структур (Бурлакова, Храпова, 1985). Показано, что О2*_, Н2О2, NO при низких концентрациях являются физиологическими модуляторами в митохондриях, регулируя транспорт Са2+ (Richter et al., 1995). АФК участвуют также в лигнификации клеточной стенки, защите растений от микрофлоры (Albert et al., 1986). Перекиси липидов могут выступать в роли аллостерических эффекторов, активируя или ингибируя деятельность некоторых ферментов. Кроме того, ПОЛ — процесс, связанный с изменением структуры мембран и может использоваться клеткой как механизм регуляции активности мембраносвязанных ферментов (Бурлакова, Храпова, 1985). Предполагается, что ПОЛ в интактных клетках принимает участие в транспорте веществ через мембрану (Владимиров, Арчаков, 1972). Стационарность скорости реакций ПОЛ поддерживается антиоксидантными системами. В условиях стресса происходит нарушение равновесия про- и антиоксидантов в клетке.
Многочисленные исследования, проведенные к настоящему времени, не оставляют сомнения в том, что в стрессовых условиях в организме возникают повреждения, связанные с окислительными процессами. Активация реакций ПОЛ наблюдается при стрессах различной природы: интоксикации О3, БО2, NО2, ионизирующей и УФ радиации, авитаминозах, гипер- и гипотермии, гипероксии и гипоксии, засолении, водном дефиците и т.д. (Владимиров, Арчаков, 1972; Козлов, 1973; Иванов и др., 1975; Тарусов, Веселовский, 1978; Меерсон, 1986; Куликов и др., 1988; Мерзляк, 1989; Веселовский, Веселова, 1990; Владимиров и др., 1991; Барабой и др., 1992, Bohnert, Sheveleva, 1998; Gueta-Dahan et al., 1997).
В 50-60х годах были разработаны методы регистрации световых потоков крайне низкой интенсивности. Исследования показали, что окисление ненасыщенных липидов сопровождается свечением. Б. Тарусов и В. Веселовский (1978) регистрировали вспышку свечения при охлаждении растений до температуры ниже 0оС. Ими было установлено, что чем морозоустойчивее организм, тем при более отрицательной температуре возникала вспышка излучения. Работа проводилась на корнях и этиолированных побегах проростков злаков. Ингибитор свободнорадикальных реакций (пропилгаллат) уменьшал интенсивность низкотемпературно вспышки свечения. Окисление липидов мембран во время низкотемпературного стресса связывают с активацией липолитических ферментов (Родионов, 1978), а также с процессами ПОЛ (Белоус, Бондаренко, 1982; Parkin et al., 1989).
В работе В.К. Жирова с соав. (Жиров и др., 1982) показано, что замораживание-оттаивание вызывает в тканях листьев гороха разрушение полиненасыщенных жирных кислот и пигментов, а также накопление малонового диальдегида (МДА). Важно отметить, что у растений акклиматизированных к температуре 100С по сравнению с растениями, выращенными при температуре 200С, интенсивность ПОЛ была ниже. Сравнение содержания уровня МДА у растений с различно чувствительностью к низким температурам не выявило накопления МДА у высокоустойчивых растений. Таким образом, эти данные указывают на то, что морозоустойчивость растений может быть связана со способностью клеток препятствовать развитию ПОЛ мембранных липидов.
Рядом исследователей было отмечено, что при действии низких положительных температур на теплолюбивые растения в клетках развивается окислительный стресс (McKersie, 1996; De Santis et al., 1999). Повреждения холодочувствительных растений могут быть сопряжены с активацией ингибитора каталазы, в результате чего в тканях накапливается Н2О2 (Patterson et al., 1984). X. Hasselt в 1974 г. также продемонстрировал фотоокислительное повреждение термофильных растений (Cucumis) при температуре 1 0С. На свету в клетках происходило разрушение пигментов, полиненасыщенных жирных кислот и увеличение содержания ТБК- активных продуктов (McKersie, 1996). Т.В. Жигалова с сотр. (Жигалова и др., 1989) связывают повреждение хлоропластов у чувствительного к водному стрессу сорта с активацией ПОЛ.
Активация процессов ПОЛ отмечается и в условиях загрязнения атмосферы. Озон, являясь сильным окислителем, способен реагировать с ненасыщенными липидами и инициировать ПОЛ (Мерзляк, 1989).
Некоторые исследователи устанавливают зависимость токсического действия низких концентраций озона с продуктами его распада. Озон, растворяясь в воде, образует свободные радикалы О2*—, НО2*, НО* — и Н2О2. Показано, что после 30-ти минутного воздействия озона возрастает содержание МДА в листьях гороха (Веселовский, Веселова, 1990).
Активацию перекисного окисления липидов наблюдали при действии многих гербицидов (Мерзляк, 1989). Токсический эффект гербицида может реализовываться по нескольким механизмам. При обработке растений паракватом происходит быстрое увядание листа, за которым через 24 часа следует некроз. Этот гербицид функционирует, как катализатор в переносе восстановленных эквивалентов к кислороду (McKersie, 1996). Некоторые гербициды участвуют в фотоокислительных процессах, связанных с образованием синглетного кислорода (Мерзляк, 1989; McKersie, 1996).
Для клетки в состоянии стресса характерно увеличение содержания антиоксидантов. При действии УФ радиации в клетках пшеницы накапливается а-токоферол (Веселовский, 1982). Низкие температуры и гипероксия вызывают многократное увеличение концентрации токоферола в тканях эвглены (Ruggeri et al., 1985). Содержание токоферолов в зерне яровой пшеницы увеличивается после воздействия весенних заморозков на 25%, осенних — на 32% (Винтер, 1980). Считается, что устойчивость растений к озону тем выше, чем больше в тканях содержится СОД. Наряду с СОД при фумигации возрастает количество пероксидазы, аскорбатоксидазы (Веселовский, Веселова, 1990). В клетках корня кукурузы в условиях гипотермии также возрастает активность пероксидазы (Акимова, Родченко, 1976). Таким образом, накопление различных антиоксидантов можно отнести к проявлению обще неспецифической защитной реакции клетки (Куликов и др., 1988). Ряд авторов отводят активации ПОЛ роль ключевого звена в патогенезе стресса (Барабой, 1991; Барабой и др., 1992). В связи с этим рассматривают три последовательные фазы стресс-реакции, соответствующие классическим. Во время первой фазы (фаза тревоги) происходит резкая активация липопероксидации. На второй стадии реакции стабилизируется про- и антиокислительное равновесие на уровне, близком к исходному. Ее можно охарактеризовать как стадию резистентности, в ходе которо снижается интенсивность ПОЛ за счет увеличения антиоксидантных ресурсов. Для третьей фазы реакции типична вторичная индукция ПОЛ и соответствующее снижение суммарной антиоксидантной активности. Эту стадию стресса можно рассматривать как проявление определенного истощения антиоксидантных ресурсов.
ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ В МИТОХОНДРИЯХ
Несмотря на доказанную универсальность механизма ПОЛ в биологических мембранах, обнаружены некоторые отличия этого процесса в разных клеточных органеллах. По мнению Ю.А. Владимирова и А.И. Арчакова (Владимиров, Арчаков, 1972), они обусловлены в основном особенностями структурно-функционально организации мембран этих органелл.
Митохондрии являются «энергетическими станциями», обеспечивающими клетки энергией, необходимо для их функционирования. Это обязательные органеллы эукариотических клеток. Они образованы двумя мембранами, разделенными межмембранным пространством. В матриксе митохондрий содержатся ДНК, рибосомы, ферменты цикла Кребса, в-окисления, а также ферменты, обеспечивающие синтез белков и репликацию генетического материала митохондрий (Войников и др., 1991; Douce, 1985). В этих органеллах осуществляется окислительное фосфорилирование, в результате чего в ходе окисления субстратов (например, НАДН или сукцината) образуется АТР. Внешняя мембрана отделяет внутреннюю часть митохондрий от цитоплазмы. Она гладкая, не имеет складок и перегибов, содержит ферменты и белки, образующие неспецифические поры, способные пропускать вещества с молекулярной массой не более 10 кДа. Внутренняя мембрана имеет большое число складок — крист. Она проницаема только для воды и небольших нейтральных молекул, но непроницаема для катионов К+, Na+, Mg2+, анионов Cl—, Br—, NO3—, сахаров и большей части аминокислот, а также для НАД+, НАДФ+, НАДН, НАДФН, для нуклеотид-5′-моно-, ди- и трифосфатов, коэнзима А и его эфиров (Douce, 1985). Во внутренней мембране митохондрий локализованы дыхательные цепи и АТФ-синтетаза. Этот ферментный комплекс функционирует как окислительно-восстановительная протонная помпа (Войников, 1987; Войников и др., 1991).
Дыхательная цепь митохондрий растений и животных имеет сходную организацию, основные отличия касаются цианид (CN^-резистентного пути переноса электронов и строения НАДН-дегидрогеназного сегмента дыхательной цепи. Растительные митохондрии способны окислять как эндогенный, так и экзогенный НАДН (Douce, 1985). Все переносчики электронов в митохондриях сгруппированы в четыре комплекса.
Комплекс I осуществляет перенос электронов от НАДН к убихинону. Он содержит ротенончувствительную НАДН-убихинон-оксидоредуктазу. В его состав входят ФМН и железо-серные центры. Согласно современным данным на поверхности внутренне мембраны локализована ротенон- нечувствительная НАДН-дигидрогеназа (Palmer, Ward, 1985). Благодаря деятельности это «внешне » НАДН-дегидрогеназы растительные митохондрии способны напрямую окислять цитозольные НАД(Ф)Н. Митохондрии животных используют для это цели челночные механизмы, работающие с затратой энергии (Douce, 1985).
Комплекс II (сукцинат-убихинон-оксидоредуктаза) осуществляет транспорт электронов от сукцината к убихинону. В его состав входят ФАД и три железо-серных центра. Перенос электронов на данном этапе ингибируется малонатом и оксалоацетатом; активируется сукцинатом, АТФ, АДФ, НАДН и др. агентами. Имеются сведения, что торможение активности сукцинатдегидрогеназы оксалоацетатом, появляющееся после 2-6-ти часового охлаждения, выступает в качестве одного из механизмов, позволяющих растениям адаптироваться к действию низких температур (Войников, 1987).
Комплекс III (убихинон-цитохром с-оксидоредуктаза) переносит электроны от восстановленного убихинона к цитохрому с. Его структурная организация в митохондриях растений изучена пока слабо. Известно, что в его состав входят цитохромы b560 и b566, цитохром с1 и железо-серны белок Риске. Этот комплекс чувствителен к антимицину А (Шугаев, 1991).
В терминальном комплексе IV (цитохром с-оксидаза) электроны переносятся от цитохрома с к кислороду. Он содержит два цитохрома — а и а3, а также два атома меди. Цитохром с-оксидаза блокируется цианидом, азидом. Известно, что у растений и грибов, в отличие от животных, имеется альтернативны путь переноса электронов, который называется цианид-резистентным дыханием (Шугаев, 1991). Оно обусловлено активностью цианид-резистентной оксидазы (альтернативная оксидаза). Предполагается, что местом ответвления альтернативно оксидазы от основной дыхательной цепи является убихинон, и в ее состав входит медьсодержащий флавопротеид. Перенос электронов по этому пути не сопровождается фосфорилированием (Войников и др., 1991; Шугаев, 1991).
Согласно одно из гипотез о механизме переноса протонов в дыхательной цепи (модель петель) выброс протонов из матрикса происходит в результате транспорта электронов между переносчиками Н- атомов и чисто электронными переносчиками. К атомным переносчикам относят ФМН, убихинон, цитохром с- оксидазу. По теории Митчелла электрохимический трансмембранны потенциал ионов водорода является источником энергии для синтеза АТФ за счет обратного тока протонов через канал мембранной АТФ-синтетазы (Скулачев, 1989).
Таким образом, большая часть кислорода в митохондриях восстанавливается цитохромоксидазой в митохондриальной электроннотранспортной системе с образованием воды. Митохондрии растений имеют дополнительны сайт восстановления кислорода на альтернативно оксидазе, отличающейся от цитохром оксидазы ее резистентностью к цианиду. Считалось, что ни один из этих сайтов не образует значительное количество супероксида (Rich, Bonner, 1978). Действительно, в нормально функционирующих митохондриях освобождение АФК во время восстановления кислорода цитохром с оксидазой не происходит в связи с его высоким сродством с цитохромом с (Turrens, 1997). Ввиду этого образование супероксида путем моноэлектронного восстановления кислорода на уровне цитохром с оксидазы несущественно. Однако в последнее время получено значительное количество данных, свидетельствующих о том, что митохондрии постоянно генерируют супероксид и перекись водорода (1-2% от общего потребления кислорода дыхательной цепи митохондрий) (Скулачев, 1998; Richter et al., 1995; Turrens, 1997; Liu, 1997; Kowaltowski, Vercesi, 1999). Генерация этой активной формы кислорода происходит при участии НАДН-дегидрогеназы (Turrens, Boveris, 1980), флавопротеина (комплекс I) и частично убихинона и цитохрома b (комплекс III) (Cadenas et al., 1977) (рис. 10). В нормально функционирующей дыхательной цепи электроны переносятся от НАДН к окисленно форме убихинона, при этом получаются восстановленные формы убихинона. Эта форма затем передает электроны на цитохром с оксидазу и превращается обратно в окисленную форму, проходя через форму свободного радикала — аниона семихинона (UQ*—). Этот процесс вначале происходит на цитоплазматической поверхности внутренней митохондриально мембраны, а затем повторяется на матриксной поверхности мембраны. Антимицин А, который блокирует электронный поток после убихинона, усиливает восстановление кислорода (Rustin et al., 1984). При этом антимицин А блокирует образование UQ*— на матриксной поверхности мембраны, что вызывает аккумуляцию UQ*— на ее цитоплазматической поверхности. Вероятно, другие условия, которые увеличивают восстановление убихинона, также благоприятствуют восстановлению кислорода в районе цепи убихинон — цитохром b (Rich, Bonner, 1978). Имеются данные, что образование митохондриями АФК в присутствии ротенона, который переводит НАДН-дегидрогеназу в постоянно восстановленное состояние, значительно стимулируется при добавлении сукцината, восстанавливающего убихинон (Kowaltowski et al., 1994). Разные Fe-S белки и НАДН- дегидрогеназа также вовлечены как возможные сайты образования супероксида и перекиси водорода (Turrens, Boveris, 1980; Turrens et al., 1982). В митохондриях, обладающих высокой интенсивностью цианид-резистентного дыхания, эффективность образования О2*— может достигать значительных величин (10% от общего потребления кислорода у аронника пятнистого) (Rustin et al., 1984).
Таким образом, в митохондриях имеется все необходимое для протекания процессов ПОЛ: источники активного кислорода, субстраты перекисного окисления — ненасыщенные жирные кислоты митохондриальных мембран. В митохондриях присутствует железо в геминовой и негеминовой форме. Следовательно, в условиях, когда генерация супероксида митохондриями возрастает, либо когда ослаблены антиоксидантные системы, в органеллах может накапливаться Н2О2, и это приведет к возникновению окислительного стресса. В данной ситуации Н2О2 может реагировать с митохондриальным Fe2+, образуя высокоактивный радикал гидроксида (НО^) путем реакции Фентона (Sutton, Winterbourn, 1989; Halliwell, Gutteridge, 1989).
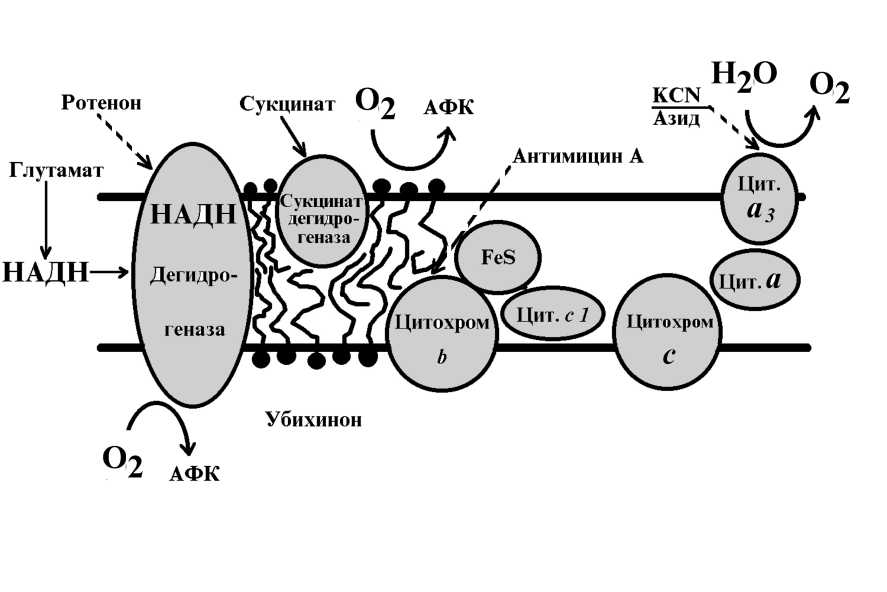
Рис. 10 Генерация активных форм кислорода митохондриями.
Основной источник АФК в митохондриях — электронтранспортная цепь, локализованная во внутренней митохондриальной мембране (по Chakraborti et al., 1999).
При физиологических условиях, кроме геминовогой железа и железа в форме FeS-белков, в митохондриях содержится еще приблизительно 1.7 н моль Fe на 1 мг митохондриального белка. Это железо хелатированой такими веществами, как АТФ, АДФ, ГТФ и цитрат (Tangeras et al., 1980). Эти низкомолекулярные комплексы железа способны инициировать процесс ПОЛ в митохондриальной мембране и, как предполагается, принимают участие в механизмах повреждения клетки во время различных стрессовых и болезненных состояний (Bacon, Britton, 1990). В последнее время изучение этих низкомолекулярных комплексов железа, особенно Fe(II)-цитрата и Fe(II)-АТФ привлекают значительное внимание исследователе , поскольку установлено их присутствие в матриксе в различных физиологических, стрессовых и болезненных состояниях (Bacon, Britton, 1990; Minotti, Aust, 1987; Halliwell, Gutteridge, 1990). Установлено, что механизм, при помощи которого происходит индукция ПОЛ этими низкомолекулярными комплексами железа, требует наличия микромолярных концентраций Ca2+ (Hermes-Lima et al., 1995; Halliwell, Gutteridge, 1989; Castilho et al., 1994; Castilho et al., 1995б). В то же время имеются данные, свидетельствующие о том, что генерация АФК в данном случае не зависит от функционирования дыхательной цепи митохондрий (Castilho et al., 1995a). Процессы ПОЛ в митохондриях, индуцированные низкомолекулярными комплексами железа, вызывают изменения в спектрах мембранных белков, в частности, исчезновение белков с мол. массами 65 и 116 кДа и образование ряда дополнительных полос, по- видимому, из-за образования шиффовых оснований между продуктами ПОЛ и аминными группами белков (Castilho et al., 1994).
Свободнорадикальные продукты ПОЛ и карбонильные соединения, например, малоновый диальдегид, обладают сильным повреждающим действием на митохондриальны геном. С эффектом именно этих соединений связывают нарушения структуры и экспрессии митохондриального генома растений в условиях in vivo (Константинов и др., 1989а,б).
Продукты ПОЛ способны вызывать увеличение неспецифической протонной проводимости внутренне мембраны митохондрий. Их относят к эффективным природным разобщителям (Владимиров, Арчаков, 1972). Активация процессов ПОЛ в митохондриях может вызвать нарушение окислительного фосфорилирования, поскольку эффект процесса синтеза АТФ зависит от структурной целостности внутренней мембраны (Kowaltowski, Vercesi, 1999).
Длительное протекание ПОЛ при стимуляции железом в митохондриях приводит к образованию так называемых «митохондриальных теней». Такие частицы не имеют дыхательного контроля и не способны к окислительному фосфорилированию (МсKnight et al., 1965). Поврежденные митохондрии теряют барьерную функцию и способность накапливать ионы кальция. Ионы Ca2+ активируют многие внутриклеточные процессы, например, повышают активность мембранных фосфолипаз (Kowaltowski et al., 1999; Grijalba et al., 1999; Kavanagh et al., 2000). Это приводит к накоплению свободных жирных кислот и лизофосфатидов, нарушающих структурную организацию липидных и белковых комплексов в мембранах, что в свою очередь увеличивает интенсивность ПОЛ. В результате недостатка энергии может наступить гибель клетки.
В митохондриях высших растений, так же, как и в митохондриях животных, выделяют три системы ПОЛ: неферментативные реакции, активируемые аскорбатом, ферментативные НАДН- и НАДФН-зависимые реакции (Константинов и др., 1989а). Максимальная скорость накопления МДА в растительных митохондриях наблюдалась при концентрации ионов железа Fe3+ 20 мкМ. В экспериментах с изолированными митохондриями проростков кукурузы было показано, что прооксидантное действие Fe3+ усиливается при добавлении их к суспензии митохондрий в комплексе с аденозиндифосфатом (Константинов и др., 1989б).
При изучении зависимости скорости перекисного окисления от концентраций аскорбата, НАДН, НАДФН установлено, что при одинаковых концентрациях восстановителей (1 мМ) скорость реакций пиридиннуклеотид-зависимого ПОЛ в 3-4 раза превышала таковую для аскорбат-зависимого процесса. Системы ПОЛ митохондрий растений отличаются также отношением к ингибиторам. Неферментативная система ПОЛ проявляет высокую чувствительность к ЭДТА и ионолу. НАДН- зависимое ПОЛ чувствительно к цианиду; ионол в это системе вызывал значительное ингибирование процесса при более низких концентрациях, чем в опытах с ферментативной системой (Константинов и др., 1989б).
В связи с тем, что в митохондриях в физиологических условиях постоянно происходит генерация супероксида, митохондрии обладают эффективной собственной антиоксидантной системой, имеющей в своем составе супероксид дисмутазу, глутатион пероксидазу, глутатион редуктазу, глутатион, НАД(Ф)Н-трансгидрогеназу, НАД(Ф)Н, витамин Е и С (Sutton, Winterbourn, 1989; Halliwell, Gutteridge, 1989), тиол пероксидазы, такие как SP-22 (Watabe et al., 1997), и собственно митохондриальное дыхание (Guidot et al., 1995).
Уровень генерации митохондриями супероксида изменяется в зависимости от многих физиологических или стрессовых условий (Turrens, 1997). Как отмечалось выше, образование АФК усиливается при восстановлении убихинона в присутствии антимицина А (Turrens et al., 1985; Kowaltowski et al., 1995; Korshunov et al., 1997). Быстрое изменение редокс-состояния убихинона также стимулирует образование АФК митохондриями (Korshunov et al., 1997). Хотя разобщение окисления и фосфорилирования в митохондриях обычно уменьшает образование ими АФК, при некоторых специфических условиях оно может возрастать. Например, протонофоры усиливают генерацию АФК при ингибировании дыхательной цепи антимицином А (Boveris, Chance, 1973; Cadenas, Boveris, 1980) или в том случае, когда в митохондриях заингибирован Ca2+ унипортер и блокированы потоки кальция (Kowaltowski et al., 1996a,b). С другой стороны, протонофоры и такие разобщающие белки как UCP млекопитающих, PUMP растений и альтернативная оксидаза растений способны при своем функционировании уменьшать образование АФК митохондриями (Boveris, Chance, 1973; Korshunov et al., 1997; Negre- Salvayre et al., 1997; Popov et al., 1997; Kowaltowski et al., 1998). Этот факт может быть объяснен тем, что разобщение окисления и фосфорилирования усиливает митохондриальное дыхание, уменьшает время жизни радикала семихинона и, следовательно, вероятность образования супероксида за счет передачи электрона от радикала семихинона на кислород (Skulachev, 1996).
Поскольку внутренняя мембрана митохондрий содержит большое количество (до 75% от общего содержания) белков, то считается, что они являются одно из первичных мишеней АФК в митохондриях (Kowaltowski, Vercesi, 1999). Действительно, тиоловые группы мембранных белков подвержены сильному окислению в условиях Ca2+ индуцированного митохондриального окислительного стресса (Castilho et al., 1995a,b; Kowaltowski et al., 1996a,b).
В присутствии ионов Ca2+ окислительные повреждения в белках внутренне митохондриальной мембраны вызывают явление неспецифической проницаемости внутренне митохондриальной мембраны вследствие открытия пор (англ. транскрипция: “mitochondrial permeability transition” — MPT) (Gunter et al., 1994; Zoratti, Szabo, 1995;
Vercesi et al., 1997). Это явление характеризуется прогрессирующим увеличением проницаемости внутренне митохондриальной мембраны, которая последовательно становится проницаемо для протонов, ионов, осмотиков и даже небольших белков (Zoratti, Szabo, 1995; Vercesi et al., 1997). Убедительное доказательство тому, что MPT может быть прямой причиной апоптоза, представлено P. Petit с соавторами (1996). Они показали, что индукция МРТ приводит к высвобождению из межмембранного пространства находящегося там белка, «фактора индукции апоптоза». Этот белок вызывает при добавлении апоптические изменения в изолированных ядрах и также, в свою очередь, способен вызывать МРТ (Susin et al., 1997). Таким образом, индуцированный MPT апоптозис может быть одним из механизмов защиты клетки от выработки избыточных количеств АФК (Скулачев, 1998; Negre-Salvayre et al., 1997; Skulachev, 1998).
Таким образом, на основании имеющихся к настоящему времени данных можно считать, что, прежде всего, митохондрии растений во время низкотемпературного стресса являются одним из основных источников АФК, вызывающих окислительные повреждения мембранных липидов, белков и нуклеиновых кислот. При этом во время низкотемпературного стресса генерируемые митохондриями АФК могут принимать участие в апоптозе. В то же время в митохондриях имеются мощные антиокислительные системы, позволяющие растительной клетке регулировать образование АФК и, вследствие этого, контролиролировать интенсивность процессов ПОЛ. Одной из этих систем являются недавно открытые в растениях митохондриальные разобщающие белки.
