СТАРЕНИЕ И РАК: ВЗАИМОСВЯЗЬ И ПРОФИЛАКТИКА
2.1. Старение и чувствительность к канцерогенам
В последнее время значительное внимание уделяется анализу связей между старением и канцерогенезом. Взаимосвязь между этими процессами подтверждается, в частности, данными об идентичности уравнений кривых смертности от любых причин и смертности от рака у людей в возрасте от 10 до 80 лет. На двойной логарифмической шкале зависимость между частотой опухолей и возрастом описывается прямой линией, наклон которой равен показателю степени возраста. Этот показатель, например, для рака желудка, равен 4 — 7, тогда как для рака предстательной железы — 11. Вместе с тем, возрастное увеличение частоты новообразований различных локализаций и гистогенеза происходит неодинаково, то есть имеет место органная и тканевая специфичность такого распределения. Причины этих различий мало изучены. Прежде всего, нельзя исключить колебания в интенсивности воздействия канцерогенных агентов в отдельные периоды жизни человека. Есть основания полагать также, что возрастные различия в заболеваемости раком обусловлены различиями в cкорости дифференцировки и старения отдельных тканей или их чувствительности к эндогенным или экзогенным канцерогенным воздействиям.
Согласно многостадийной модели канцерогенеза, с возрастом в различных тканях накапливаются клетки, подвергшиеся случайным воздействиям канцерогенных факторов и прошедшие более чем одну стадию на пути к ее полной малигнизации. При этом предполагается, что канцероген, эффект которого усиливается пропорционально возрасту в момент воздействия, действует на уже частично трансформированные в различной степени клетки. В этом случае опухоль разовьется быстрее или с большей частотой в молодом возрасте. В пользу такого предположения свидетельствуют результаты многочисленных экспериментов, в которых применение опухолевых промоторов различной тропности у старых животных, не подвергавшихся ранее воздействию инициирующих агентов, неизменно вызывало новообразования в тканях-мишенях с большей частотой, чем у молодых животных. Если же канцерогенный эффект при воздействии в разном возрасте был одинаков, то это может означать, что в клетках-мишенях для использованного агента не накапливаются с возрастом какие-либо изменения, ведущие к опухолевой трансформации.
Анализ результатов многочисленных экспериментов, в которых животных подвергали однократному или хроническому воздействию канцерогенных агентов в различном возрасте показал, что наблюдаются существенные различия в возрастной динамике чувствительности отдельных тканей к канцерогенному действию агентов различной природы (химической, радиационной, вирусной). Например, у крыс чувствительность некоторых тканей к канцерогенному действию с возрастом снижается (эпителий
молочной железы, кишечника, щитовидной железы и др.), некоторых — повышается (подкожная клетчатка, шейка матки, влагалище) или остается неизменной (легкие, кроветворная ткань). Имеющиеся в литературе противоречия результатов экспериментов обусловлены подчас различиями в схемах опытов с использованием канцерогенов прямого и непрямого действия, различающихся также по химическому строению и механизмам действия; имеют значение и выбранные для сравнения возрастные интервалы и особенности объектов (вид, линия, пол использованных животных).
Одним из ключевых событий в механизме химического канцерогенеза является образование аддуктов ДНК в тканях-мишенях. В этой связи большой интерес привлекают данные о том, что ДНК различных тканей интактных крыс содержит подобные аддуктам соединения, которые закономерно накапливаются в них с возрастом. Предполагается, что аддуктоподобные вещества, получившие название I-соединений, если они биологически эквивалентны аддуктам ДНК, могут играть критическую роль в инициации спонтанного канцерогенеза и cтарения. С другой стороны, возрастное накопление I-соединений в клеточной ДНК может определять нарушение состояния дифференцировки при старении. Образование I-соединений не обусловлено специфическими модифицирующими ДНК ферментами, близкими к цитозин-5-метилтрансферазе, а может по аналогии с активацией экзогенных канцерогенов вовлекать микросомальные оксидазы или другие метаболизирующие ксенобиотики ферменты. Важным свойством I-соединений является их способность приводить к различного типа мутациям (точковым и типа сдвига рамки считывания), разрывам цепи ДНК и генным реаранжировкам.
Кроме того, было показано существенное увеличение с возрастом накопления в ядерной и митохондриальной ДНК метилированного аддукта 7-метилгуанина, что также может играть определенную роль в процессах старения и канцерогенеза. Таким образом, накапливающиеся в литературе данные свидетельствуют о существенных изменениях в строении и функции отдельных структур ДНК, развивающихся в процессе нормального старения. Характер этих изменений различается в разных тканях, что, на наш взгляд, может быть важной причиной неравномерного старения тканей и, соответственно, неодинакового характера возрастного увеличения спонтанных новообразований в различных органах. Это же обстоятельство может играть фундаментальную роль в объяснении неодинакового характера возрастных изменений чувствительности тканей к канцерогенам.
В последние годы получены данные, свидетельствующие о том, что не наблюдается универсальной картины изменения с возрастом экспрессии различных протоонкогенов в различных тканях. Так, не было обнаружено корреляции между экспрессией онкогена На-ras в нормальных фибробластах человека и возрастом доноров. Не было различий в экспрессии K-ras, myc или src протоонкогенов и в фибробластах животных разного возраста, хотя у крыс было отмечено возрастное снижение экспрессии в селезенке v-has/bas, v-raf, v-src, но не c-myc, c-myb и актина. Уровень транскрипции c-myc, но не c-sis или c-src увеличивался в печени, но не в мозге крыс с 4 до 22 мес. их жизни. При изучении возрастных изменений метилирования ДНК на генном уровне было обнаружено, что характер метилирования протоонкогена c-myc изменяется у мышей в селезенке и печени, но не в мозге. Эти же авторы показали, что возрастные изменения в метилировании ДНК имеют место лишь в ограниченной тканеспецифичной области гена. Принципиальное значение, на наш взгляд, имеет то обстоятельство, что экспрессия некоторых протоонкогенов и ее возрастная динамика существенно варьируют в различных органах и рис.5).
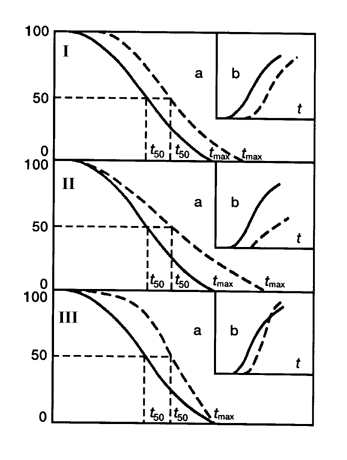
Вещества и воздействия, замедляющие скорость старения популяции, уменьшают частоту и увеличивают латентный период развития новообразований, тогда как при воздействии агентов, ускоряющих старение, т.е. придающих кривой выживаемости более прямоугольный характер, может наблюдаться увеличение частоты развития опухолей, причем, в самых старших возрастных группах). Таким эффектом, например, обладают хелатные агенты, селенит, малые дозы окиси трития.
Важно подчеркнуть, что наблюдаемый на протяжении ХХ века у человека тип изменения кривой выживаемости соответствует III типу по приведенной выше классификации, чему и в эксперименте и в эпидемиологических наблюдениях соответствует увеличение заболеваемости злокачественными новообразованиями. Другими словами, за увеличение продолжительности жизни, достигаемое снижением риска умереть в детском и молодом возрасте, человечество «расплачивается» в старости увеличением вероятности развития опухолей и некоторых других болезней цивилизации, в частности, атеросклероза и сахарного диабета. Применение воздействий с антипромоторными свойствами, нормализующих развивающиеся по мере естественного старения гормонально-метаболические и иммунологические сдвиги и тем самым замедляющие реализацию генетических программ старения, может дать наиболее значительный геропротекторный и предупреждающий развитие опухолей эффект. Среди таких воздействий наиболее перспективным представляется ограничение калорийности питания, а среди препаратов — препараты шишковидной железы, в частности, эпиталамин. Следует отметить, что воздействия, направленные на устранение взаимодействия канцерогена с тканями организма и препятствующими инициирующему действию повреждающих агентов (антиоксиданты, антимутагены), могут служить важным дополнительным средством профилактики новообразований и преждевременного старения в условиях повышенного риска воздействия на организм неблагоприятных факторов внешней среды (рис. 6).
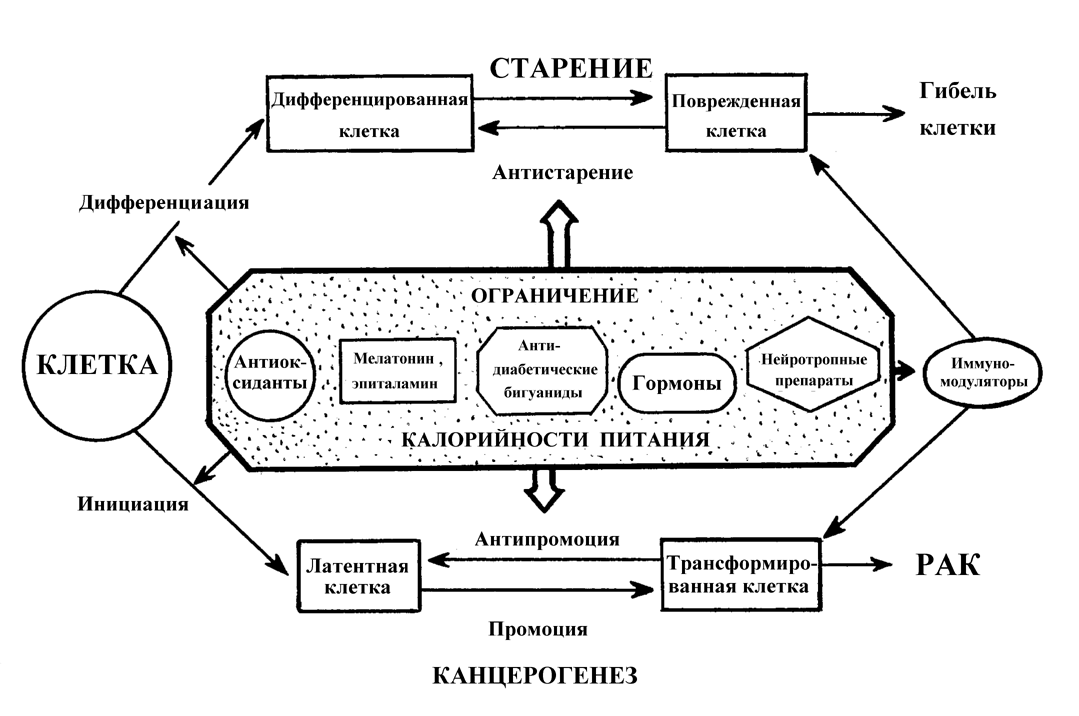
Рассматривая указанные закономерности с точки зрения представлений многостадийной модели канцерогенеза, можно прийти к выводу, что геропротекторы того или иного типа могут замедлять или увеличивать скорость перехода клетки, экспонированной к канцерогену, из одного состояния в другое. Если это так, то эффективность геропротекторов как средств, предупреждающих развитие новообразований, будет снижаться по мере увеличения возраста, в котором было начато их применение. Такому выводу соответствуют результаты ряда экспериментов. Напротив, при синдромах преждевременного старения у человека или применении в эксперименте средств, ускоряющих скорость его, наблюдается увеличение частоты развития новообразований. Важно подчеркнуть, что геропротекторы, замедляющие старение по 2-му типу, оказывают свое действие, прежде всего влияя на основные регуляторные системы организма — нервную, эндокринную и иммунную, тем самым замедляя возрастные изменения в микроокружении клеток, подвергающихся случайным или индуцированным канцерогенами агентами повреждениям.
