Современные подходы к исследованию клеточных мембран
Биомембранология Болдырев А.А., Кяйвяряйнен Е.И., Илюха В.А.
- 5.1. Выделение и характеристика мембранных фракций
- 5.2. Методы исследования мембранных структур
- 5.2.1. Дифракция рентгеновских лучей
- 5.2.2. Электронная микроскопия
- 5.3. Методы изучения динамического поведения мембранных систем и липид-белковых взаимодействий
- 5.3.1. Микровязкость мембран и применимость мембранных зондов
- 5.3.2. Электронный парамагнитный резонанс (ЭПР)
- 5.3.3. Деполяризация флуоресценции
- 5.3.4. Ядерно-магнитный резонанс (ЯМР)
- 5.3.5. Метод кругового дихроизма
- 5.3.6. Метод сканирующей калориметрии
- 5.3.7. Флуоресцентная спектроскопия
Клеточные мембраны даже в клетках одного типа значительно отличаются друг от друга как по составу, так и по осуществляемым ими функциям. По этой причине первоочередной задачей исследования обычно является получение клеточных фракций в достаточно чистом виде.
ВЫДЕЛЕНИЕ И ХАРАКТЕРИСТИКА МЕМБРАННЫХ ФРАКЦИЙ
Исследование мембран, как правило, сопряжено с их очисткой, причем для каждого типа мембран характерны свои условия препаративного выделения. Нужно подобрать оптимальные условия разрушения клеток и отделения мембран, представляющих интерес, от других клеточных компонентов. Особого внимания заслуживают критерии чистоты выделенных мембран. Для получения мембран клетки сначала разрушают, используя один из следующих методов: осмотический шок, растирание нарезанных кусочков ткани с кварцевым стеклом или стеклянными шариками или размельчение гомогенизаторами различных типов.
Метод разрушения клеток и длительность обработки выбирают в зависимости от типа ткани. Бактериальные протопласты и эритроциты обычно подвергают осмотическому шоку. Мягкие ткани (печень, мозг) разрушают с помощью стеклянного гомогенизатора Поттера, более плотные – ножевым гомогенизатором, жабры рыб растирают с кварцевым песком. Если полученную путем гомогенизации смесь органелл и мембранных фрагментов подвергнуть центрифугированию, то частицы, имеющие различную плотность и размеры, будут осаждаться с различной скоростью. При постоянном центробежном ускорении скорость осаждения будет прямо пропорциональна массе частиц и разности между их плотностью и плотностью среды. Разрушенные клеточные мембраны способны замыкаться и образовывать пузырьки (везикулы) диаметром 0,3–3,0 мкм.
В качестве примера можно привести
- микросомы, получаемые из плазматической мембраны, эндоплазматического ретикулума (ЭР) или специализированных систем;
- субмитохондриальные частицы из внутренней митохондриальной мембраны;
- синаптосомы, образующиеся при отрыве нервных окончаний в области синаптических контактов;
- бактериальные мембранные везикулы, образующиеся из плазматической мембраны Е.coli.
Везикулы образуются и из других мембранных систем, например, из мембран аппарата Гольджи. Некоторые мембраны, в частности, мембраны боковых поверхностей соприкасающихся друг с другом животных клеток, не образуют везикул. При разрушении таких клеток происходит отрыв пары смежных мембранных фрагментов, удерживаемых вместе областью контакта. Наличие таких контактов предотвращает замыкание фрагментов в везикулы, поэтому мембраны выделяются в виде пластин или лентообразных структур. В таблице 6 приведены данные о размерах и плотности различных органелл и получаемых из них фрагментов.
Таблица 6. Клеточные компоненты печени крыс
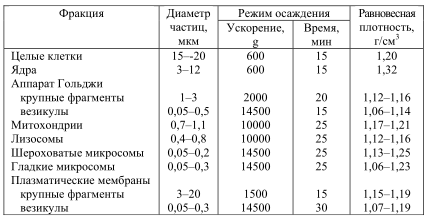
Видно, что если гомогенат какой-либо ткани центрифугировать с небольшим ускорением (например, в режиме 600 g, 15 мин), то 76 осядут только ядра и неразрушенные клетки, при больших ускорениях (10000 g, 15 мин) можно осадить фракцию, содержащую преимущественно митохондрии, а затем – смешанную микросомальную фракцию. После центрифугирования в режиме 100000 g, 1 час) в супернатанте остаются только растворимые белки (фракция цитозоля); все мембранные фрагменты выпадают в осадок. Метод избирательного осаждения клеточных фрагментов называют методом дифференциального центрифугирования, а получаемые с его помощью препараты – субклеточными фракциями.
Фракции, полученные при однократном центрифугировании, никогда не бывают чистыми. Так, митохондриальная фракция кроме митохондрий и их фрагментов будет содержать в различных количествах лизосомы, везикулы, образованные из плазматической мембраны и мембран ЭР). Результаты фракционирования зависят от способа разрушения, состава среды и типа клеток, так как эти факторы определяют характер разрыва мембран и, следовательно, размеры образующихся фрагментов. После выделения субклеточных фракций необходимо их идентифицировать и проверить степень загрязненности другими органеллами. Для этого применяют несколько методов. При выяснении морфологии мембранных фракций важную роль сыграли два метода: дифракция рентгеновских лучей и электронная микроскопия. Но следует иметь в виду, что при выяснении детальной картины молекулярной организации мембран оба этих метода сталкиваются с рядом ограничений.
Микроскопию с фазовым контрастом применяют в первую очередь для идентификации ядерной фракции. Митохондриальные фрагменты или везикулы шероховатого ЭР, содержащие на своей поверхности рибосомы, легко распознаются морфологически. Определение активности маркерных ферментов. Фермент может служить маркером определенного типа мембран, если он прочно связан с мембраной, не инактивируется при выделении данной фракции и локализуется исключительно в данных органеллах.
К сожалению, многие маркерные ферменты (например, Na/K-АТФаза. 5-нуклеотидаза, сукцинатдегидрогеназа) при выделении или хранении могут терять активность. Кроме того, большинство встроенных в мембрану ферментов характеризуется асимметричной локализацией активного центра. По этой причине их активность в замкнутых фрагментах часто не удается определить из-за недоступности для субстрата. Это так называемая «латентная активность фермента». Она может быть выявлена в присутствии низких концентраций детергента или ионофоров (типа аламетицина), образующих крупные каналы в замкнутых мембранных везикулах. В таблице 7 приведены маркерные ферменты различных субклеточных фракций.
Таблица 7. Биохимические маркеры различных клеточных мембран
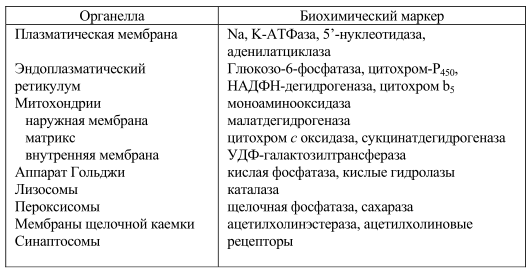
Для определения происхождения той или иной субклеточной фракции или степени ее чистоты недостаточно использовать один тест, а желательно иметь подробное описание полученной фракции. В то же время, определяя активность маркерных ферментов, можно оценить степень загрязненности используемой фракции мембран примесями.
МЕТОДЫ ИССЛЕДОВАНИЯ МЕМБРАННЫХ СТРУКТУР
ДИФРАКЦИЯ РЕНТГЕНОВСКИХ ЛУЧЕЙ
Этот метод в применении к изучению высокоупорядоченных кристаллических образований позволяет с высоким разрешением получать информацию о структуре. В случае малоупорядоченных препаратов возможности этого метода ограничены. Некоторые специализированные мембранные системы имеют регулярную структуру, поэтому их можно изучать рентгеноструктурными методами. Наиболее распространенным примером такого рода служит миелиновая оболочка, которая многократно оборачиваясь вокруг аксона, формирует регулярную систему из концентрических мембранных структур. Исследования дифракции рентгеновских лучей на миелине, проведенные еще в 1930 г., подтверждают адекватность бислойной модели мембран. К такому же выводу приводит и изучение наружного сегмента палочек сетчатки позвоночных, которые представляют собой упорядоченные диски.
Этот метод применим и для изучения искусственно упорядоченных систем, которые образуются при коллапсировании в условиях центрифугирования мембранных везикул, полученных из митохондрий и эритроцитов. Однако рентгеноструктурные данные, полученные для разных мембран, различаются лишь незначительно, несмотря на большие различия в содержании белка (от 20 до 80%). Хотя рентгеноструктурные данные позволяют получить некоторую информацию о том, как расположена в мембране основная масса мембранных белков (интегральных или периферических), в целом метод рентгеноструктурного анализа не дает детальной молекулярной картины.
В 1971 г. М. Уилкинс и соавторы показали, что метод дифракции рентгеновских лучей применим и для изучения водных дисперсий мембран и фосфолипидов. И в этом случае мембранные препараты, полученные из разных источников, дали сходную дифракционную картину, что подтверждает универсальность бислойной модели. Этот метод может быть весьма полезен при исследовании упорядоченных липидно-водных систем, но невозможность получения детальной молекулярной картины с его помощью ограничивает его использование для изучения биологических мембран.
ЭЛЕКТРОННАЯ МИКРОСКОПИЯ
Просвечивающая электронная микроскопия тонких срезов миелина, как и многих других мембранных структур, выявляет характерную картину, состоящую из двух электроноплотных полос, разделенных промежутком около 80 Å. Такая картина получается в результате обработки мембранных препаратов четырехокисью осмия, обычно применяемой в этом методе. Дж. Робертсон назвал наблюдаемую картину «унитарной», чтобы подчеркнуть ее универсальность, и хотя молекулярные механизмы прокрашивания мембран осмием до сих пор не известны, эта структура долгое время рассматривалась как основное подтверждение справедливости бислойной модели мембраны.
Однако в этом методе есть существенный артефакт – при подготовке препаратов для анализа мембраны подвергаются неблагоприятным воздействиям. Обработка четырехокисью осмия приводит к значительной потере белка из эритроцитарной мембраны. И хотя наблюдаемая при этом трехслойная структура до некоторой степени отражает организацию бислойных мембран, более детальные сведения относительно локализации белков в мембране этим методом получить не удается.
Некоторую информацию о расположении мембранных белков дали новые электронно-микроскопические методы, ставшие теперь уже классическими – методы замораживания-скалывания и замораживания-травления. В этом случае препараты быстро замораживают, не подвергая их каким-либо повреждающим действиям. Процесс подготовки препарата включает следующие операции (рис. 32):
1. После замораживания образец, представляющий собой суспензию клеток или мембран, скалывают с помощью ножа при низкой температуре (–100 0 С) в глубоком вакууме. При этом мембрана раскалывается по своей срединной области и расщепляется на две половинки. В результате на образовавшихся плоскостях скола обнажается внутренняя область мембраны.
2. При необходимости образец подвергают травлению – проводят обычную возгонку льда в вакууме. Это позволяет лучше визуализировать поверхностные структуры клеточных мембран.
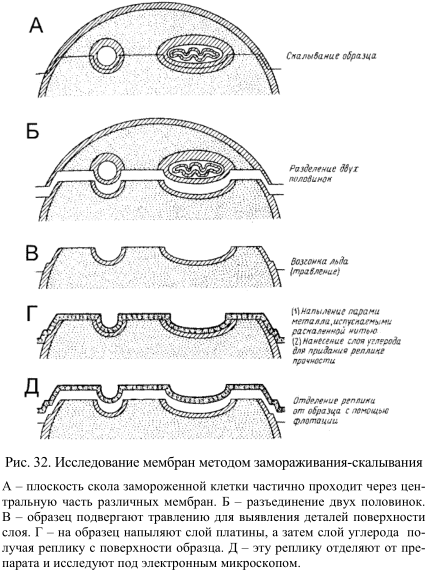
Рис. 32. Исследование мембран методом замораживания-скалывания
3. После этого получают так называемую реплику с обнаженной поверхности (именно эту реплику и исследуют под электронным микроскопом). Для получения реплики сначала напыляют на образец платину под углом около 45о, чтобы выявить топологические характеристики препарата. Затем платиновой реплике придают механическую прочность, нанеся на нее слой углерода. После этого препарат оттаивают, реплика всплывает и подвергается анализу.
Наиболее характерные структуры, наблюдаемые при изучении мембран методом замораживания – скалывания, – это многочисленные внутримембранные частицы диаметром от 80 до 100 Å, лежащие в плоскости мембранных сколов. Обычно они расположены хаотично, но иногда образуют группы. Вероятнее всего, эти частицы являются мембранными белками. При электронной микроскопии тонких срезов подобные структуры не обнаруживаются. Реплики, полученные от двух половинок расщепленной мембраны, не всегда топологически комплементарны. Это означает, что некоторые частицы связаны только с одной из половин мембраны. Данные, полученные методом замораживания-скалывания, широко использовались С. Сингером и Дж. Никольсоном при создании жидкостно-мозаичной модели мембран, поскольку они убедительно показывали, что глобулярные белки находятся не только на поверхности мембраны, но и внутри бислоя.
Кроме органелл, характерных для большинства клеток, имеются и специализированные мембранные системы, такие как саркоплазматический ретикулум мышечных клеток, миелиновая оболочка периферических нервных волокон, тилакоидные мембраны хлоропластов и мембраны дисков в палочках сетчатки. У прокариотических организмов также имеются мембраны, хотя и не настолько сложно устроенные, как у эукариотических организмов. Грам-положительные бактерии, например, Bacillus subtilis, имеют лишь цитоплазматическую мембрану, а грам-отрицательные бактерии (Escherichia coli) – еще и наружную оболочку, расположенную поверх тонкой пептидогликановой клеточной стенки. В клетках прокариот обнаружены также некоторые специализированные органеллы (в частности, хроматофоры, содержащие фотосинтезирующий аппарат у пурпурных бактерий Rhodobacter sphaeroides).
