Составление уравнений окислительно-восстановительных реакций.
Глава 8. Окислительно-восстановительные процессы
Для составления уравнений окислительно-восстановительных реакций и определения коэффициентов применяют два метода: метод электронного баланса и ионно-электронный метод (метод полуреакций).
Метод электронного баланса является более простым и учитывает изменение степени окисления элементов в реакциях. Ионно-электронный метод учитывает характер химической связи в молекуле и наличие тех ионов, которые в действительности существуют в растворе, например, MnO4—, SO42-, Cr2O72-. При реакциях окисления-восстановления электроны не берутся откуда-то со стороны, а только переходят от одних атомов или ионов к другим, поэтому число электронов, принятых окислителем, равно числу электронов, отданных восстановителем. При составлении уравнений окислительно-восстановительных реакций для того, чтобы правильно написать продукты реакции, необходимо знать свойства реагирующих веществ.
8.3.1.Метод электронного баланса.
Подбор коэффициентов в реакции методом электронного баланса осуществляется по следующей схеме:
1) Составить схему реакции
P+HNO3разб. →
Разбавленная азотная кислота с а) неактивными металлами (Cu), б) неметаллами (P, As, S) и в) производными этих неметаллов (AsH3, PH3, As2S3) образует оксид азота (II), понижая свою степень окисления:
P+HNO3разб.→ NO +
Атом элемента в своей высшей положительной степени окисления является окислителем, следовательно, окислитель
N5+ + 3ē → N2+
Атом фосфора проявляет восстановительные свойства в данной реакции, отдавая электроны с последнего энергетического уровня и повышая свою степень окисления до +5.
P0 – 5ē → P+5
Следовательно, молекулярное уравнение реакции имеет следующий вид:
P + HNO3 разб.→ NO + H3PO4
2) Определить величину и знак степени окисления элементов до реакции и после реакции.
![]()
3) Составить электронный баланс
![]()
4) Подставить найденные коэффициенты в уравнение реакции.
5HNO3 + 3P + 2H2O → 5NO + 3H3PO4
5) Подсчитать количество атомов водорода в правой и левой части равенства и уравнять их за счет добавления молекул воды в ту часть равенства, где их недостаточно.
6) Подсчитать количество атомов кислорода.
При правильно написанном и решенном уравнении количество атомов кислорода в правой и левой части равенства совпадает.
Пример 1. Написать уравнение окислительно-восстановительной реакции, подобрав коэффициенты к нему: FeSO4 + KMnO4 + H2SO4→ Fe2(SO4)3 + + MnSO4 + K2SO4 + H2O. Определяем степень окисления элементов до реакции и после реакции.
+2 +7 +3 +2
FeSO4 + KMnO4 + H2SO4→ Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
Составляем уравнения электронного баланса
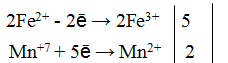
Подставляем найденные коэффициенты в уравнение реакции. Подсчитываем количество групп в правой части уравнения (15+2+1=18), добавляем в левую часть равенства недостающие -группы в виде коэффициента при H2SO4. уравниваем число атомов водорода в правой и левой части равенства.
Правильность написанного уравнения проверяем по числу атомов кислорода в правой и левой части равенства.
10FeSO4 + 2KMnO4 + 8H2SO4→ 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
8.3.2. Ионно-электронный метод.
При составлении электронно-ионных уравнений следует исходить не из изменения степени окисления элементов в реагирующих веществах, а нужно учитывать действительно существующие ионы в водном растворе с точки зрения теории электролитической диссоциации. Например, если реакция происходит с участием перманганата калия, то в реакции окислителем будут ионы MnO4—, а не ионы Mn7+, так как перманганат калия в водном растворе диссоциирует KMnO4↔K++MnO4—. При этом вещества неионного характера и недиссоциирующие изображаются в электронных уравнениях в виде молекул: NH3, CO, NO2, SiO2, P.
В окислительно-восстановительных реакциях могут получаться различные продукты реакции в зависимости от характера среды – кислой, щелочной, нейтральной. Для таких реакций в молекулярной схеме необходимо указывать окислитель, восстановитель и вещество, характеризующее реакцию среды (кислоту, щелочь, воду). В этом случае в ионном уравнении необходимо руководствоваться правилами стяжения, указывать ионы, характеризующие реакцию среды: H+, OH—, H2O. Правила стяжения сводятся к следующему:
1. В кислой среде избыток ионов O+2 образует с ионами H+ молекулы воды:
Изб. O2–+2H+=H2O
2. В нейтральной или щелочной среде избыток ионов O2- образует с молекулами воды гидроксид – ионы:
Изб. O2–+ H2O=2OH–
3. В щелочной среде недостаток ионов O2– компенсируется двумя ионами OH—, одновременно образуется одна молекула воды:
2OH–H2O+O2–
| Реакция среды | Избыток ионов О2– | Недостаток ионов О2– |
| окислитель | восстановитель | |
| Кислая | Н+ Н2О | Н2O 2Н+ |
| изб. O2– + 2H+ = Н2О | Н2О 2Н+ + O2– | |
| Нейтральная | H2O OH– | Н2O 2Н+ |
| изб. О2– + Н2О 2OН– | Н2О 2Н+ + О2– | |
| Щелочная | Н2O ОН– | 2OН– Н2О |
| изб. О2– + Н2O 2OН– | 2OН– Н2О + О2– |
Разберем на конкретных примерах.
Пример 1. Составить уравнение реакции, которая протекает при пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnO4
При протекании реакции малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементарной серы из сероводорода:
H2S S +2H+
В этой схеме число атомов одинаково в левой и правой частях. Для уравнивания зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
H2S – 2 = S+2H+
Эта первая полуреакция — процесс окисления восстановителя H2S.
Обесцвечивание раствора связано с переходом иона МnО—4 (он имеет малиновую окраску) в ион Mn2+ (почти бесцветный и лишь при большой концентрации имеет розоватую окраску), что можно выразить схемой
MnO4– Mn2+
Опыт показывает, что в кислом растворе кислород, входящий в состав ионов MnO—4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
МnО—4 + 8H+ Мn2+ + 4Н2О
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные — два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO—4 + 8H++5e— = Mn2++4H2О
Это вторая полуреакция – процесс восстановления окислителя – иона MnO—4.
Для составления общего (суммарного) уравнения реакции надо уравнение полуреакций почленно суммировать, предварительно уравнять число отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются равенства полуреакций. Сокращенно запись проводится так:
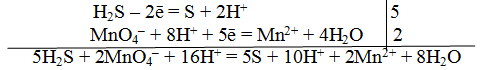
Сократив на 10 Н+, окончательно получим
5Н2S + 2МnО—4 + 6Н+ =5S + 2Mn2+ + 8Н2О
Проверяем правильность составленного ионного уравнения. В примере число атомов кислорода в левой части 8, в правой 8; число зарядов в левой части (2-) + (6+) == 4+, в правой 2(2+) = 4+. Уравнение составлено правильно.
Методом полуреакций составляется ионное уравнение реакции. Чтобы от ионного уравнения перейти к молекулярному, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону — анион. Затем такие же ионы в таком же количестве записываем и в правую часть уравнения, после чего ионы объединяем в молекулы:
Пример 2. Реакция среды кислая
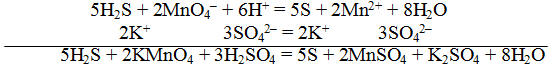
1. Составить схему реакции
K2SO3 + KMnO4 + H2SO4 K2SO4 + MnSO4 + H2O
SO32- + MnO4— + 2H+ SO42- + Mn2+
Из опытных данных знаем, что окислителем является КМnO4. Ион MnO4— восстанавливается в кислой среде до Мn2+ (фиолетово-малиновая окраска иона MnO4— становится бесцветной, переходя в Мn2+ — ион), следовательно, ион SO32 — будет являться восстановителем, переходя в ион SO42-.
2. Составить электронно-ионные уравнения
а) для окислителя
MnO4— + 8H+ = Mn2+ + 4H2O
Из ионной схемы видно, что, ион MnO4— – превращается в ион Мn2+, при этом освобождаются ионы О2-, которые по правилу стяжения в кислой среде связываются ионами Н+, образуя молекулы Н2O.
б) для восстановителя
SO32- + H2O = SO42- + 2H+
Из ионной схемы видно, что ион SO32- превращается в ион SO42-. Для этого превращения необходимо добавить ион О2-, который берется из молекулы H2O (реакция протекает в водной среде), при этом освобождаются два иона Н+.
3. Подсчитать число зарядов в правой и левой части равенства, добавляя или уменьшая необходимое число электронов. Алгебраическая сумма зарядов в обеих частях равенства должна быть одинакова.
MnO4— + 8H+ + 5ē = Mn2+ + 4H2O
SO32- + H2O — 2ē = SO42- + 2H+
4. Найти основные коэффициенты, т. е. коэффициенты при окислителе и восстановителе:
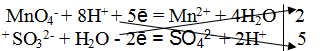
5. Написать суммарное электронно-ионное уравнение, учитывая найденные коэффициенты:
2MnO4— + 16H + + 5SO32- + 5H2O =2Mn2+ + 8H2O + 5SO42- + 10H+.
6. Сократить в левой и правой части уравнения 10 Н+ и 5Н2O. Получается ионное уравнение:
2MnO4— + 6H+ + 5SO32- = 2Mn2+ + 5SO42- + 3H2O
7. По ионному уравнению составить молекулярное уравнение реакции:
2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O
8. Число ионов и атомов каждого элемента в правой и левой части равенства, должно быть равно.
Пример 3. Реакция среды щелочная.
1. Составить схему реакции
KCrO2 + Br2 + KOH → K2CrO4 + KBr +H2O
CrO2– + Br2 + OH– → CrO42– + Br +H2O
Окислителем в данной реакции является молекула брома, следовательно, восстановителем будет являться метахромит калия, а именно ион СrO2 –.
2. Составить электронно-ионное уравнение
а) для окислителя
Вr2 → 2Вr –
б) для восстановителя
СrO2– + 4OН– → СrО42– + 2Н2О
Из ионной схемы видно, что ион CrO2– превращается в ион СгО42–. Каждый недостающий ион О2– берется по правилу стяжения из двух гидроксильных ионов (среда щелочная ОН—), при этом одновременно образуется одна молекула воды.
3. Подсчитать число зарядов в правой и левой части равенства. Найти коэффициенты при окислителе и восстановителе.
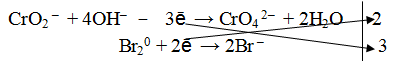
4. Написать суммарное уравнение, учитывая найденные коэффициенты:
2CrO2 – + 8OH– + 3 Br20 → 2CrO4 2– + 6Br + 4H2O
5. По ионному уравнению составить молекулярное уравнение реакции.
2KcrO2 + 8KOH + 3Br2 → 2K2CrO4 + 6KBr + 4H2O
6. Число атомов и ионов каждого элемента в правой и левой части уравнения должно быть равно.
Пример 4. Реакция среды нейтральная.
1. Составить схему реакции
K2SO3 + KMnO4 + H2O → MnO2 ↓ + K2SO4
SO32– + MnO4– + H2O → MnO2 + SO42–
Окислителем является КМnO4, так как ион элемента в своей высшей степени окисления не способен более отдавать электроны (Мn+7). Восстановителем является сульфит калия K2SO3.
2. Составить электронно-ионное уравнение
а) для окислителя
МnO4— + 2Н2O→ MnO20 + 4OН—
В нейтральной среде избыток ионов кислорода стягивается с молекулами воды, образуя гидроксид-ионы.
б) для восстановителя
SO32- + Н2O → SO42- + 2Н+
Из ионной схемы видно, что ион SО32- превращается в ион SO42- , для этого необходимо добавить один ион О2- , который берется из молекулы Н2O (реакция протекает в водной среде). При этом освобождаются два иона Н+.
3. Подсчитать число зарядов в правой и левой части равенства. Найти коэффициенты при окислителе и восстановителе.
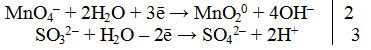
4.Написать электронно-ионное уравнение, учитывая найденные коэффициенты:
2MnO4– + 3SO32– + 7H2O → 2MnO2 + 3SO42– + 8OH + 6H+
или
2MnO4– + 3SO32– + 7H2O → 2MnO2 + 3SO42– + 6H2О + 2OH–
Сокращаем левую и правую часть равенства на 6Н20. Получаем окончательное ионное уравнение.
2МnO4— + 3SO32- + Н2O 2МnО2 + 3SO42- + 2OН—
5. По ионному уравнению составить молекулярное уравнение реакции.
2КМnO4 + ЗК2SО3 + H2O 2МnО2 + 3K2SO4 + 2КОН
6. Число атомов и ионов каждого элемента в правой и левей части уравнения должно быть равно.
Пример 5. Исходя из степени окисления (п) азота, серы и марганца в соединениях NН3, HNO2, HNO3, H2S, Н2SO3, Н2SО4, MnO2 и КМnO4, определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства.
Решение. Степень окисления азота в указанных соединениях соответственно равна: -3 (низшая), +3 (промежуточная), +5 (высшая); n(S), соответственно, равна: -2 (низшая), +4 (промежуточная), +6 (высшая); n(Мn), соответственно, равна: + 4 (промежуточная), +7 (высшая). Отсюда: NН3, H2S — только восстановители; HNO3, H2SO4, КMnО4 — только окислители; НNО2, Н2SО3, MnO2 — окислители и восстановители.
Пример 6. Могут ли происходить окислительно-восстановительные реакции между следующими веществами: a) H2S и HI; б) H2S и Н2SО3; в) Н2SО3 и НС1O4?
Решение:
а) Степень окисления в Н2S n(S) = -2; в HI n(I) = -1. Так как и сера и иод находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут;
б) в H2S n(S) = -2 (низшая), в H2SO3 n(S) = +4 (промежуточная).
Следовательно, взаимодействие этих веществ возможно, причем, Н2SО3 является окислителем;
в) в Н2SO3 n(s) = +4 (промежуточная); в НС1O4 n(Сl) = +7 (высшая). Взятые вещества могут взаимодействовать, Н2SО3 в этом случае будет проявлять восстановительные свойства.
Пример 7. Составьте уравнения окислительно-восстановительной реакции, идущей по схеме:
Решение. Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
![]()
![]()
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов 10. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид:
2KMnO4 + 5H3PO3 + 2H2SO4 = 2MnSO4 + 5H3PO4 + K2SO4 + 3H2O
Пример 8. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитывая максимальное восстановление последней.
Решение. Цинк, как любой металл, проявляет только восстановительные свойства. В концентрированной серной кислоте окислительная функция принадлежит сере (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как p-элемента VIA-группы равна -2. Цинк как металл IIВ-группы имеет постоянную степень окисления +2. Отражаем сказанное в электронных уравнениях:
Составляем уравнение реакции:
![]()
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
Перед H2SO4 стоит коэффициент 5, а не 1, ибо четыре молекулы H2SO4 идут на связывание четырех ионов Zn2+.
