4.2. Скорость ферментативных реакций
Биология — Тейлор Д., Грин Н., Стаут У. 1 том — 2013
Мерой скорости ферментативных реакций служит количество субстрата, подвергшегося превращению в единицу времени, или количество образовавшегося продукта. Скорость определяют по углу наклона касательной к кривой на начальной стадии (а на рис. 4.5) реакции. Чем круче наклон, тем больше скорость. Со временем скорость реакции обычно снижается, по большей части в результате снижения концентрации субстрата (см. след. разд.).
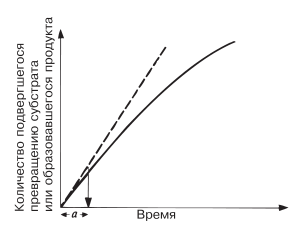
Рис. 4.5. Скорость ферментативной реакции.
4.3. Факторы, влияющие на скорость ферментативных реакций
4.3.1. Концентрация фермента
4.3.2. Концентрация субстрата
4.3.3. Температура
4.3.4. pH
4.3.5. Лабораторные работы
Для изучения влияния какого-либо фактора на скорость реакции все прочие факторы должны оставаться неизменными и по возможности иметь оптимальное значение. Измерять следует только начальные скорости, как указано выше.
4.3.1. Концентрация фермента
При высокой концентрации субстрата и при постоянстве других факторов, таких, например, как температура и pH, скорость ферментативной реакции пропорциональна концентрации фермента (рис. 4.6). Катализ осуществляется всегда в условиях, когда концентрация фермента гораздо ниже концентрации субстрата. Поэтому с возрастанием концентрации фермента растет и скорость ферментативной реакции.
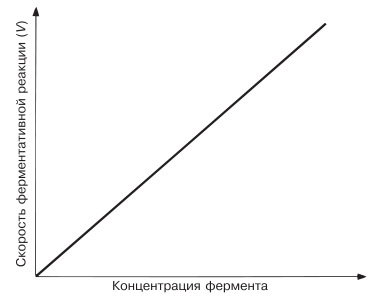
Рис. 4.6. Зависимость скорости ферментативной реакции от концентрации фермента.
4.3.2. Концентрация субстрата
При данной концентрации фермента скорость ферментативной реакции возрастает с увеличением концентрации субстрата (рис. 4.7).
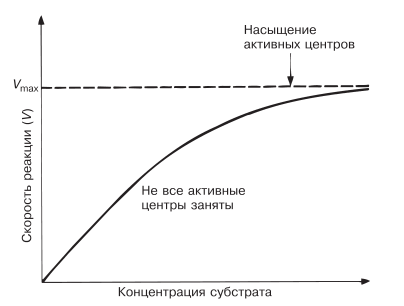
Рис. 4.7. Зависимость скорости ферментативной реакции от концентрации субстрата.
Теоретическая максимальная скорость реакции V max никогда не достигается, но наступает момент, когда дальнейшее увеличение концентрации субстрата уже не влечет за собой сколько-нибудь заметного изменения скорости реакции. Это следует объяснить тем, что при высоких концентрациях субстрата активные центры молекул фермента в любой данный момент оказываются практически насыщенными. Таким образом, сколько бы ни было в наличии избыточного субстрата, он может соединиться с ферментом лишь после того, как образовавшийся ранее ферментсубстратный комплекс диссоциирует на продукт и свободный фермент.
4.3.3. Температура
С повышением температуры ускоряется движение молекул, вследствие чего у молекул субстрата и фермента оказывается больше шансов столкнуться друг с другом. В результате увеличивается и вероятность того, что реакция произойдет.
Температура, обеспечивающая максимальную активность, называется оптимальной температурой. Если температура поднимается выше этого уровня, скорость ферментативной реакции снижается, несмотря на увеличение частоты столкновений. Происходит это вследствие разрушения вторичной и третичной структур фермента, иными словами, вследствие того, что фермент претерпевает денатурацию (рис. 4.8). Молекула фермента развертывается и его активный центр постепенно утрачивает присущую ему форму. Наиболее чувствительны к воздействию высокой температуры водородные связи и гидрофобные взаимодействия.
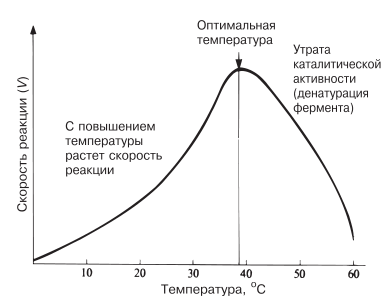
Рис. 4.8. Зависимость скорости ферментативной реакции от температуры.
Температурный оптимум для большинства ферментов млекопитающих лежит в пределах 37–40 °C. Существуют, однако, ферменты с более высоким температурным оптимумом; у бактерий, живущих в горячих источниках, он может, например, превышать 70 °C. Именно такие ферменты используются в качестве добавок к стиральным порошкам для стирки в горячей воде.
Когда температура приближается к точке замерзания или оказывается ниже ее, ферменты инактивируются, но денатурации при этом не происходит. С повышением температуры их каталитическая активность вновь восстанавливается. В наше время для длительного хранения пищевых продуктов широко используют такой способ, как быстрое их замораживание. Оно предотвращает рост и размножение микроорганизмов, а также инактивирует их пищеварительные ферменты, так что они оказываются уже не в состоянии вызвать разложение пищевых продуктов. Инактивируются также и ферменты, находящиеся в самих пищевых продуктах. Замороженные продукты необходимо хранить при низких температурах, не допуская их размораживания. Последнее следует делать непосредственно перед приготовлением пищи.
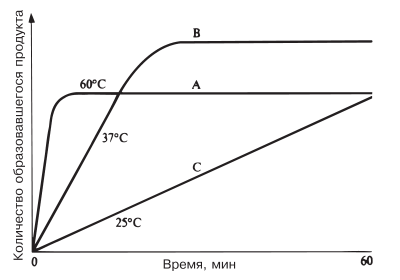
Рис. 4.9. Ход ферментативной реакции при разных температурах.
Температурный коэффициент Q 10
Влияние температуры на скорость ферментативной реакции может быть выражено через температурный коэффициент Q 10:

В пределах от 0–40 °C Q 10 ферментативной реакции равен 2. Иными словами, при каждом повышении температуры на 10 °C скорость реакции удваивается.
4.3.4. pH
При постоянной температуре любой фермент, как правило, работает наиболее эффективно в узких пределах pH. Оптимальным считается то значение pH, при котором реакция протекает с максимальной скоростью (рис. 4.10 и табл. 4.1).
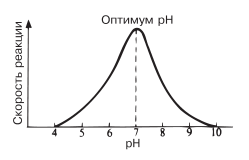
Рис. 4.10. Зависимость скорости ферментативной реакции от pH.
Таблица 4.1. Оптимум pH для некоторых ферментов

При более высоких и более низких pH активность фермента снижается. С понижением pH возрастает кислотность и увеличивается концентрация H+ ионов. Увеличивается, следовательно, количество положительных зарядов в среде.
Сдвиг pH меняет заряд ионизированных кислотных и основных групп, что ведет к разрушению ионных связей, участвующих в поддержании специфичной формы молекул фермента (разд. 3.5.3). В результате изменяется форма молекул фермента и в первую очередь форма его активного центра. При слишком резких сдвигах pH фермент денатурирует.
4.3.5. Лабораторные работы
Опыт 4.1. Изучение влияния концентрации фермента на гидролиз сахарозы, катализируемый сахаразой (инвертазой)
Материалы и оборудование
- 2%-ный раствор сахарозы 1-, 0,75- и 0,5%-ный растворы сахаразы (инвертазы)
- Реактив Бенедикта
- 12 пробирок со штативом
- Водяные бани с температурой 38 и 100 ° C
- Стеклянные палочки
- Таймер
- Дистиллированная вода
- Этикетки
- Бунзеновская горелка
Методика
1. Добавьте 2 мл прозрачного синего реактива Бенедикта к 2 мл прозрачного бесцветного 1%-ного раствора сахаразы. Нагрейте смесь на водяной бане при 100 °C в течение 5 мин (реакция Бенедикта).
2. Повторите процедуру 1 с 2 мл прозрачного бесцветного 2%-ного раствора сахарозы, а затем с 2 мл дистиллированной воды.
3. 5 мл 1%-ного раствора сахаразы доведите до кипения.
4. В восемь чистых сухих пробирок с этикетками 1–8 налейте по 1 мл реактива Бенедикта.
5. Налейте 5 мл 2%-ного раствора сахарозы в пробирку с этикеткой S и поместите на водяную баню, в которой на протяжении всего эксперимента поддерживается температура 38 °C.
6. Налейте 5 мл 1%-ного раствора сахаразы в пробирку с этикеткой Е и поместите ее в водяную баню с температурой 38 °C.
7. Выдержите обе пробки вместе с их содержимым в водяной бане в течение 5 мин для того, чтобы они приобрели нужную температуру.
8. Добавьте раствор фермента к раствору сахарозы и переверните пробирку, чтобы хорошо перемешать эти два раствора.
9. Сразу же включите отсчет времени и вновь поставьте пробирку, содержащую реакционную смесь, в водяную баню.
10. В течение всего опыта непрерывно перемешивайте реакционную смесь.
11. После 30 с инкубации перенесите 1 мл смеси в пробирку 1.
12. С интервалом в 30 с отберите такие же пробы и перенесите их по очереди в пробирки 2—8.
13. Нагрейте пробирки 1—8 в водяной бане с температурой 100 °C в течение 5 мин. Отметьте время первого появления кирпично-красного осадка, свидетельствующего о положительной реакции на редуцирующий сахар.
14. Повторите тот же эксперимент, использовав на этот раз прокипяченый раствор фермента (см. п. 3).
15. Повторите всю последовательность процедур дважды: с 0,75%-ным и 0,5%-ным растворами сахаразы.
16. Запишите ваши наблюдения и объясните полученные результаты.
Опыт 4.2. Изучение распределения каталазы в намоченных семенах гороха и влияния температуры на активность этого фермента
Каталаза — это фермент, катализирующий разложение пероксида водорода с образованием молекулярного кислорода, выделяющегося в виде пузырьков газа:
![]()
Пероксид водорода образуется в некоторых растительных и животных клетках в качестве побочного продукта метаболизма. Соединение это токсично для клеток, и каталаза обеспечивает эффективное его удаление. Каталаза — один из наиболее быстро работающих ферментов.
Материалы и оборудование
- Горсть намоченного гороха
- Раствор пероксида водорода
- Пробирки со штативом
- Водяные бани с температурой 40, 50, 60, 70, 80 и 100 ° C
- Часы
- Термометр
- Скальпели, ножницы и пинцеты
- Держатель для пробирок
- Стеклянная палочка
- Белая кафельная плитка
Методика
1. Убедитесь в наличии каталазы. Для этого разомните одну горошину и нанесите на нее несколько капель пероксида водорода.
2. Снимите с трех горошин кожуру и проверьте на каталазу по отдельности кожуру и семядоли.
3. Поставьте две пробирки с дистиллированной водой в водяную баню с температурой 40 °C.
4. Прокипятите в отдельной пробирке три целые горошины, а затем поместите их в одну из пробирок на водяной бане.
5. В другую пробирку на водяной бане положите три горошины, не подвергавшиеся кипячению.
6. Выдержите пробирки в водяной бане в течение времени, достаточного для того, чтобы они приняли ее температуру (около 10 мин).
7. Проверьте каждую из горошин на каталазную активность.
8. Повторите тот же эксперимент при 50, 60, 70, 80 и 100 °C.
9. Запишите ваши наблюдения и объясните полученные результаты.
Опыт 4.3. Изучение влияния различных значений pH на активность фермента
Материалы и оборудование
- Реактив Бенедикта
- Буферные растворы с pH 3, 5, 7, 9 и 11 1%-ный раствор крахмала
- Водяная баня с температурой 38 ° C
- Бунзеновская горелка
- Асбест
- Держатель для пробирок, штатив с пробирками
- Градуированные пипетки на 5 мл
- Термометр
- Таймер
- Дистиллированная вода
- Исходный раствор амилазы (такой, какая содержится в слюне)
Методика
1. Сполосните рот 5 мл дистиллированной воды и выплюньте эту воду.
2. Наберите в рот 10 мл дистиллированной воды, пополощите в течение 1 мин и эту жидкость соберите.
3. Доведите объем этого раствора амилазы слюны до 40 мл дистиллированной водой.
4. Проверьте растворы амилазы, крахмала и буферные растворы на присутствие в них редуцирующих сахаров с помощью реактива Бенедикта.
5. Пометьте этикеткой «pH 3» одну из пробирок и внесите в нее 2 мл раствора крахмала.
6. Добавьте в ту же пробирку 2 мл буферного раствора с pH 3 и тщательно перемешайте оба раствора.
7. Прокипятите не менее 4 мл раствора фермента и влейте 4 мл этого раствора в пробирку с соответствующей этикеткой.
8. В другую пробирку, также снабженную этикеткой, влейте 4 мл раствора фермента, не подвергавшегося кипячению; поставьте все три пробирки в водяную баню и выждите некоторое время (около 1 мин) для того, чтобы они успели нагреться до 38 °C.
9. Влейте небольшое количество реактива Бенедикта в каждую из 11 пробирок и пометьте их цифрами 1—11. Следующие три этапа должны быть проведены очень быстро.
10. Когда растворы в водяной бане примут ее температуру, влейте забуференный раствор крахмала в некипяченый раствор фермента.
11. Хорошо перемешайте оба раствора, переворачивая пробирку, а затем снова поставьте пробирку в водяную баню.
12. Включите отсчет времени и сразу же перенесите небольшое количество реакционной смеси (примерно равное по объему взятому реактиву Бенедикта) в пробирку 1.
13. На протяжении всего опыта энергично встряхивайте смесь.
14. По истечении 1 мин перенесите в пробирку 2 вторую порцию реакционной смеси (приблизительно того же объема, что и первая).
15. Повторяйте ту же процедуру с интервалами 1 мин в течение еще 9 мин (т. е. заполните отобранными пробами пробирки 3–11).
16. Отметьте для пробирок 1–11 продолжительность инкубации, требуемой для появления первых признаков положительной реакции Бенедикта (выпадения кирпично-красного осадка).
17. Повторите тот же опыт с прокипяченым раствором фермента, начиная от п. 7.
18. Повторите весь опыт целиком с каждым из остальных буферных растворов.
19. Постройте график зависимости времени гидролиза от pH и объясните полученные результаты.
