СИСТЕМА МАТЬ-ПЛАЦЕНТА-ПЛОД
Клинические лекции по акушерству (учебное пособие)
- Этапы формирования функциональной системы мать-плацента-плод
- Формирование околоплодного пространства. Состав околоплодных вод
Система мать-плацента-плод — единая функциональная система, которая образуется сразу же после зачатия и обеспечивает поддержание оптимальных условий развития эмбриона и плода в организме беременной женщины. Ее формирование связано с возникновением сложных и взаимообусловленных адаптационных процессов и образованием плаценты, определяющих взаимосвязь организма матери и плода до момента его рождения.
Учение о функциональных системах было создано П.К. Анохиным в 30-60 гг. XX в. Определяя функциональную систему как динамическую, саморегулирующуюся организацию, избирательно объединяющую структуры и процессы на основе нервных и гуморальных механизмов регуляции для достижения важных для системы и организма в целом приспособительных результатов, П.К. Анохин (1968) распространил содержание этого понятия на структуру любого физиологического процесса. Функциональная система имеет разветвленный морфофизиологический аппарат, обеспечивающий за счет присущих ей закономерностей как эффект гомеостаза, так и саморегуляции. Выделяют два типа функциональных систем. Функциональные системы первого типа обеспечивают постоянство определенных констант внутренней среды за счет системы автономной регуляции, звенья которой не выходят за пределы самого организма. Примером может служить функциональная система поддержания постоянства кровяного давления, температуры тела и т.п. Такая система с помощью разнообразных механизмов автоматически компенсирует возникающие сдвиги во внутренней среде. Функциональные системы второго типа используют внешнее звено саморегуляции. Они обеспечивают приспособительный эффект благодаря выходу за пределы организма через связь с внешним миром и изменения поведения. С физиологической точки зрения понятие «функциональная система» обуславливает не просто сосуществование отдельных ее элементов, но и их взаиморегулирующее и взаимозависимое содействие. На основании вышесказанного можно выделить несколько особенностей функциональной системы мать-плацента-плод:
- время существования указанной системы ограничено сроком беременности, т.е. временем развития эмбриона/плода до окончания гестационного процесса (преждевременные, своевременные, запоздалые роды; самопроизвольное или искусственное прерывание беременности);
- только организм женщины с присущими ему физиологическими особенностями способен к формированию данной функциональной системы;
- в процессе становления и развития функциональной системы мать-плацента-плод принимают участие как нормальные с точки зрения анатомии и физиологии процессы, так и патологические, но необходимые для прогрессирования гестационного процесса и развития плода (инвазивный рост трофобласта, гестационные изменения спиральных артерий и др.);
- в ее становлении и развитии существуют «критические периоды», определяющие либо само дальнейшее ее существование, либо существенные отклонения в нормальном развитии плода;
- функциональная система мать-плацента-плод имеет своей конечной целью не только рождение живого доношенного жизнеспособного новорожденного, но и оптимальную адаптацию организма женщины к гестационному процессу (т.е. физиологическое течение беременности).
Таким образом, все указанные особенности отличают данную систему от других функциональных систем.
Этапы формирования функциональной системы мать-плацента-плод
В процессе формирования функциональной системы мать-плацента-плод выделяют целый ряд принципиально важных этапов, определяющих как возможность дальнейшего ее существования и развития, так и нормальное развитие плода и физиологическое течение беременности.
Оплодотворение. В течение каждой фолликулярной фазы менструального цикла женщины под влиянием фолликулостимулирующего гормона (ФСГ) гипофиза в яичнике начинает расти от 5 до 15 примордиальных фолликулов, но обычно только один из них достигает полной зрелости и овулирует, остальные дегенерируют и становятся атретичными. К моменту овуляции ооцит находится в начале своего второго мейотического деления и окружен zona pellucida и гранулезными клетками. Двигательная активность фимбрий маточной трубы продвигает яйцеклетку в ее просвет.
Перед тем как сперматозоид приобретает способность оплодотворять яйцеклетку, должна произойти капацитация (в течение которой из головки сперматозоида удаляется гликопротеиновый покров и белки цитоплазмы сперматозоида) и акросомальная реакция (когда акрозин и трипсиноподобные ферменты освобождаются для последующей пенетрации zona pellucida). В момент оплодотворения сперматозоид должен пенетрировать corona radiata, zona pellucida и клеточную мембрану ооцита. Как только сперматозоид проникает в яйцеклетку, она заканчивает свое второе мейотическое деление и формирует женский пронуклеус. Zona pellucida становится непроницаемой для других сперматозоидов. Головка сперматозоида отделяется от хвоста и формирует мужской пронуклеус. После того как оба пронуклеуса завершат репликацию ДНК, хромосомы матери и отца смешиваются и продольно расщепляются, вступая далее в митотическое деление, давая начало двухклеточной зиготе. Таким образом, в процессе оплодотворения восстанавливается диплоидный набор хромосом, происходит детерминация пола и начинается дробление.
Дробление — серия митотических делений, результатом которых является увеличение числа клеток, бластомеров, с каждым последующим делением уменьшающихся в размерах. После трех делений клетки становятся плотно сгруппированными, разделяясь на внешний и внутренний слои. Уплотненные бластомеры делятся и формируют 16-клеточную морулу. Как только морула входит в матку на 3 или 4-й день после оплодотворения, в ней начинает появляться полость и образовывается бластоциста. Внутренний слой клеток, который будет далее развиваться в собственно эмбрион, находится на одном полюсе бластоцисты. Внешний слой клеток, окружающий внутренние клетки и полость бластоцисты, будет формировать трофобласт.
Нидация и имплантация. Для успешной имплантации необходимо, чтобы в эндометрии появились все требуемые изменения дифференциации клеток слизистой для образования «окна имплантации», которое в норме наблюдается на 6-7-й день после овуляции, а также определенная степень зрелости бластоцисты и активация протеаз, способствующих продвижению бластоцисты в эндометрий. Рецептивность эндометрия — кульминация комплекса временных и пространственных изменений в эндометрии, регулируемая стероидными гормонами. Процессы появления «окна имплантации» и созревания бластоцисты должны быть синхронными. Если этого не произойдет, то имплантация не состоится или беременность прервется на ранних стадиях ее развития.
Перед имплантацией поверхностный эпителий эндометрия покрыт муцином, который предотвращает преждевременную имплантацию бластоцисты и защищает от инфекции, особенно Muclepisialin, играющий барьерную роль в различных аспектах физиологии женской репродуктивной системы. К моменту открытия «окна имплантации» муцин разрушается протеазами, продуцируемыми эмбрионом.
Имплантация бластоцисты включает два этапа: 1 этап — адгезия двух клеточных структур, 2 этап — децидуализация стромы эндометрия, при этом в процессе адгезии ведущую роль играют интегрины. Особенно значимым является интегрин-βι, экспрессия которого возрастает в момент имплантации. Кроме интегринов, адгезивными молекулами являются также протеины: трофинин, бустин и тастин. Чрезвычайно большая роль отводится различным факторам роста [инсулиноподобный фактор роста (IGFBP), гепарин-связывающий эпидермальный фактор роста (HB-EGF), фактор роста фибробластов (FGF), костный морфогенный протеин (BMP) и др.]. После адгезии трофобласта к эндометрию начинается фаза инвазии трофобласта. Клетки трофобласта выделяют ферменты протеазы, лизируя внеклеточный матрикс металлопротеазой.
К началу 2-й нед развития бластоциста частично погружается в строму эндометрия (рис. 1).
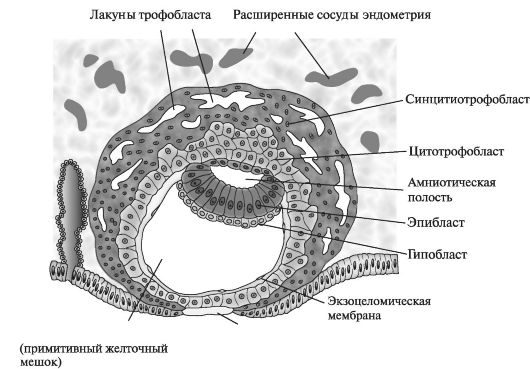
Рис. 1. Строение бластоцисты человека. 9-й день эмбрионального развития
Трофобласт дифференцируется на внутренний, активно пролиферирующий слой — цитотрофобласт и наружный — синцитиотрофобласт, активно эрозирующий ткани матери. К 9-му дню развития в цитотрофобласте формируются лакуны. Постепенно материнские синусоиды эрозируются синцитиотрофобластом, материнская кровь поступает в лакунарную сеть. К концу 2-й нед беременности начинается маточно-плацентарное кровообращение. В это время цитотрофобласт формирует скопления клеток, окруженных синцитием и в него проникающих. Эти образования являются первичными ворсинами. К концу 2-й нед бластоциста полностью погружена в эндометрий, а дефект слизистой оболочки в месте ее внедрения заживает.
Внутренний слой клеток или эмбриобласт дифференцируется на эпибласт и гипобласт, образующие вместе двухслойный зародышевый диск. Клетки эктодермы продолжаются в амниобласт. Вместе они окружают новую полость — амниотическую. Клетки эндодермы образуют мембрану экзоцелома. Они вместе окружают «первичный» желточный мешок.
К концу 2-й нед экстраэмбриональная мезодерма заполняет пространство между трофобластом снаружи и амнионом с экзоцеломической мембраной изнутри. Когда в этой ткани образуются вакуоли, формируется экстраэмбриональный целом, или хориальная полость. Вторая неделя эмбрионального развития еще называется неделей «двух»: трофобласт дифференцируется на два слоя — цитотрофобласт и синцитиотрофобласт. Эмбриобласт формирует два слоя — эпибласт и гипобласт. Образуются две полости — амниотическая и полость желточного мешка. Имплантация происходит в конце 1-й нед эмбрионального развития. Клетки трофобласта прорастают в эпителий и подлежащую строму эндометрия с помощью протеолитических ферментов. Имплантация может происходить вне полости матки (в позадиматочном пространстве брюшины, на брюшине, в маточной трубе, яичнике, шейке матки) — при этом возникает эктопическая беременность (рис. 2).
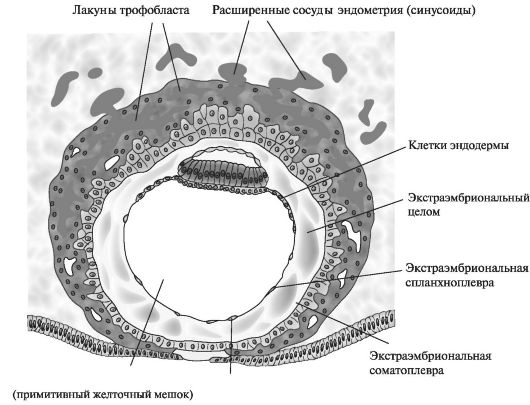
Рис. 2. Строение бластоцисты человека. 12-й день эмбрионального развития
Период плацентации. К началу 3-й нед эмбрионального развития трофобласт характеризуется наличием первичных ворсин, образованных цитотрофобластом, покрытым синцитиальным слоем клеток.
Далее мезодермальные клетки проникают в первичные ворсины и растут по направлению к децидуальной оболочке. Новообразованные структуры получают название вторичных ворсин. К концу 3-й нед мезодермальные клетки, образующие сердцевину ворсин, начинают дифференцироваться в клетки крови и мелкие кровеносные сосуды, образуя капиллярную систему ворсин. С этого момента ворсины получают название третичных или окончательных ворсин плаценты. Капилляры в третичных ворсинах формируют соединения с капиллярами, развивающимися в мезодерме хорионической пластины и в соединительном стебле (в дальнейшем формирующем пуповину).
Указанные сосуды, в свою очередь, соединяются с внутриэмбриональной циркуляторной системой, соединяя плаценту и эмбрион. Таким образом, к моменту начала сердечной деятельности эмбриона на 4-й нед развития сосудистая система ворсин достаточно сформирована для адекватного обеспечения растущего организма кислородом и питательными веществами.
В то же время клетки цитотрофобласта ворсин прогрессивно проникают во внешний синцитиальный слой до тех пор, пока они не достигнут эндометрия. Здесь они соединяются с аналогичными отростками соседних ворсин, образуя тонкую внешнюю трофобластическую оболочку. Эта оболочка плотно прикрепляет хориальную пластину к эндометрию.
Ворсины, растущие от хориальной пластины к базальной децидуальной оболочке (децидуальная пластина — часть эндометрия, где формируется плацента), называются якорными ворсинами. Те ворсины, ветви которых свободно располагаются в межворсинчатом пространстве и посредством которых в дальнейшем осуществляется газообмен и обмен питательными веществами, называются свободными (терминальными ворсинами) (рис. 3). Постепенно хориальная полость увеличивается в размерах и к 19-20-му дню эмбрион прикреплен к своей трофобластической оболочке только посредством узкого соединительного тяжа, который позднее развивается в пупочный канатик, соединяющий плаценту и эмбрион.
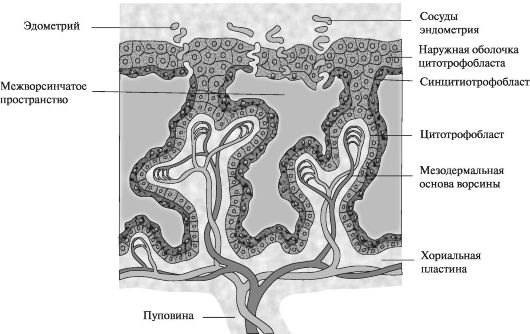
Рис. 3. Строение ворсины в конце 3-й нед эмбрионального развития
Превращение вторичных ворсин в третичные является важнейшим критическим периодом в развитии эмбриона, поскольку от их васкуляризации зависит газообмен и транспорт питательных веществ в системе мать-плацента-плод.
Врастание цитотрофобласта в стенку сосудов децидуальной оболочки приводит к вскрытию просвета спиральных артерий, излитию крови между ворсинами и образованию межворсинчатого пространства. Вскрытие просвета спиральных артерий происходит в конце 6-й нед беременности и обуславливает возникновение маточно-плацентарного кровообращения.
Период плацентации заканчивается к 12-14-й нед беременности. К этому времени сформированы лишь основные структурные элементы плаценты и в морфофункциональном отношении она остается незрелой. Основной структурной единицей сформированной плаценты является котиледон, образованный стволовой ворсиной и ее разветвлениями, содержащими сосуды плода. Свою функциональную зрелость плацента приобретает к 16-й нед беременности, когда она принимает на себя все типичные для нее функции — респираторную, трофическую, гормонпродуцирующую, иммунную, выделительную (рис. 4).
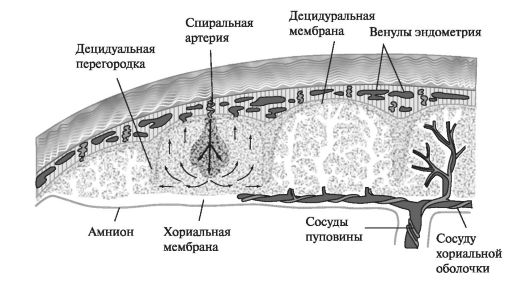
Рис. 4. Строение плаценты во второй половине беременности
II триместр беременности характеризуется ростом и дифференцировкой русла кровообращения плода (фетализация плаценты), с которыми тесно связаны изменения стромы и трофобласта ветвистого хориона. В этом периоде онтогенеза рост плаценты опережает развитие плода.
С 22 по 36-ю нед беременности увеличение массы плаценты и плода происходит неравномерно за счет преимущественного роста плода. К 36 нед плацента достигает полной функциональной зрелости. В конце беременности наступает так называемое физиологическое старение плаценты, являющееся, по сути, отражением гормон-зависимых процессов в организме плода, способствующих созреванию его легочной ткани и приобретению им морфофункциональной зрелости.
Таким образом, наиболее важные морфологические изменения, приводящие к формированию плаценты, можно представить в виде таблицы (табл. 1).
Таблица 1. Развитие плаценты человека (Система мать-плацента-плод)
| Дни после овуляции | Морфофункциональные изменения |
| 6-7 | Имплантация бластоцисты |
| 7-8 | Пролиферация трофобласта и его инвазия |
| 9-11 | Лакунарный период. Вскрываются просветы концевых отделов эндометриальных венул и капилляров. Циркуляция материнской крови в них происходит с очень низкой скоростью |
| 13-18 | Формирование первичных и вторичных ворсин, стебля тела эмбриона и амниона |
| 18-21 | Формирование третичных ворсин, 2-3 мм длиной, 0,4 мм толщиной. (Инвазия мезобласта в ворсины, формирующего ее сердцевину; капилляры образуются in situ и соединяются с сосудами стебля тела эмбриона (сосудами пуповины), распространяющимися по бластодерме.) Устанавливается фетоплацентарная циркуляция. Циркуляция материнской крови в лакунах происходит с очень низкой скоростью |
| 21-40 | Формирование chorion frondosum и хориальной пластин. Образование якорных ворсин и стволовых ворсин, имеющих вид «перевернутого дерева» |
| 40-50 | Формирование структурных единиц плаценты — котиледонов:
1. Кавитация. Инвазия трофобласта приводит к вскрытию просвета 40-60 спиральных артерий. Дальнейшая его инвазия приостанавливается. Кровь из спиральных артерий изливается в пространство между котиледонами, образующими chorion frondosum. Устанавливается маточно-плацентарный кровоток. 2. Рост и ветвление стволовых ворсин, ориентированных концентрически вокруг просвета спиральной артерии. 3. Завершение формирования сосудов плодовой части плаценты. 4. Сохраняется около 150 рудиментарных котиледонов. Циркуляция материнской крови вокруг них происходит с очень низкой скоростью под небольшим давлением (5-8 мм рт.ст.) |
| 80-225 | Продолжается рост сформированной плацентарной ткани. Формируется 10-12 больших котиледонов (кровоток в центре межворсинчатого пространства происходит под высоким давлением — 40-60 мм рт.ст.); 40-50 котиледонов среднего размера и небольших и около 150 рудиментарных. Базальная пластина плаценты формирует перегородки между котиледонами — септы |
| 226-267 | Прекращается пролиферация клеток, но продолжается их гипертрофия |
Примечание. *Maternal-placental-fetal unit; fetal & early neonatal physiology / Obstetrics and gynecology by Appleton & Lange, 1994 (p. 157).
Предопределяющими для неосложненного течения гестационного процесса являются последовательные гистофизиологические изменения спиральных артерий. На границе миометрия и эндометрия спиральные артерии снабжены мышечным слоем и имеют диаметр 20-50 мкм, по прохождении основной пластинки при впадении в межворсинчатое пространство они теряют мышечные элементы, что приводит к увеличению их диаметра почти в 10 раз. Кровоснабжение межворсинчатого пространства происходит в среднем через 150-200 спиральных артерий. При нормальной беременности спиральные артерии развиваются с такой интенсивностью, что могут обеспечить кровоснабжение плода и плаценты в 10 раз больше необходимого. К физиологическим изменениям, которым подвергаются спиральные артерии по мере прогрессирования беременности, относятся эластолиз, дегенерация мышечного слоя и фибриноидный некроз. За счет этого уменьшается периферическая резистентность и, соответственно, давление крови. Именно наличие и степень выраженности указанных гестационных изменений спиральных артерий играет ключевую роль в нормальном либо патологическом течении беременности. Отток крови из межворсинчатого пространства осуществляется через 72-170 вен, расположенных на поверхности хориальной пластинки, и, частично, в краевой синус, окаймляющий плаценту и сообщающийся как с венами матки, так и с межворсинчатым пространством. Величина давления в сосудах маточно-плацентарного круга в радиальных артериях составляет 80/30 мм рт.ст., в децидуальной части спиральных артерий — 12-16 мм рт.ст., в межворсинчатом пространстве — около 10 мм рт.ст. Градиент давления с учетом интенсивности потока крови составляет приблизительно 2 мм рт.ст. Кроме того, существует небольшая разница давления в межворсинчатом пространстве и венозной системе матки.
Сосуды матки имеют автономную иннервацию, наличие адренергических рецепторов в сосудах обуславливают изменчивость маточного кровотока под влиянием медиаторов как парасимпатической, так и адренергической систем. Маточно-плацентарные сосуды относительно рефрактерны к ангиотензину II и высокочувствительны к α-адренергическому эффекту катехоламинов. Стимуляция α-адренорецепторов приводит к снижению маточно-плацентарного кровотока, а их блокада — к повышению. Очевидно, это обуславливает способность маточно-плацентарного кровотока к ауторегуляции в ответ на снижение перфузии матки. Таким образом, потеря спиральными артериями мышечно-эластической оболочки приводит к потере их чувствительности к адренергической стимуляции, способности к вазоконстрикции, что обеспечивает оптимальное кровоснабжение межворсинчатого пространства.
Количество крови, притекающей к матке во время беременности, возрастает в 17-20 раз. Объем крови, протекающей через матку, составляет около 750 мл/мин. Величина маточного кровотока зависит от включения или выключения резерва крови (миометрального шунта), составляющего 25% всей маточной перфузии. В миометрии распределяется 15% поступающей крови, 85% ее объема направляется непосредственно в маточно-плацентарный круг кровообращения. Объем межворсинчатого пространства составляет 170-300 мл, а скорость кровотока в нем около 140 мл/мин на 100 мл объема. Постоянство кровотока в межворсинчатом пространстве поддерживается многоступенчатой цепью регуляторных механизмов, к которым относятся адаптивный рост маточно-плацентарных сосудов, система ауторегуляции органного кровотока, сопряженная плацентарная гемодинамика на материнской и плодовой сторонах, наличие циркуляторной буферной системы плода. Последняя включает в себя сосудистую сеть плаценты, пуповины и самого плода.
Изменения маточно-плацентарного кровотока определяются целым рядом факторов: действие гормонов, изменение объема циркулирующей крови, внутрисосудистое давление, изменение периферического сопротивления. Доказана сопряженность маточно-плацентарной и плодовоплацентарной гемодинамики. Регуляция кровотока в межворсинчатом пространстве на материнской стороне определяется давлением крови и маточными сокращениями, на стороне плода — ритмичным пульсированием капилляров ворсин под влиянием сердечных сокращений плода, влиянием гладкой мускулатуры ворсин и периодическим освобождением межворсинчатого пространства. Одним из регуляторных механизмов является усиление сердечной деятельности плода и повышение его артериального давления. Пупочный канатик формируется из мезенхимального тяжа (амниотическая ножка), в который врастает аллантоис, несущий пупочные сосуды. При соединении ветвей пупочных сосудов, растущих из аллантоиса, с местной сетью кровообращения начинается циркуляция крови в третичных ворсинках, что совпадает с началом сердечных сокращений эмбриона.
Пуповина содержит две артерии и одну вену. Артерии анастомозируют в хорионической пластинке, пенетрируют ее, разветвляются на стволовые артерии и дают начало артериальной системе второго и третьего порядка, повторяя строение котиледона. Котиледонные артерии являются конечными сосудами с тремя порядками деления и развитием сети капилляров, кровь из которых собирается в венозную систему. Анастомозов между артериями в одном и том же котиледоне нет. В некоторых областях кровь проходит через артериовенозные шунты, минуя капилляры, в результате чего одной вене по оси ворсин соответствует несколько артериальных сосудов. Таким образом, внутри котиледонов имеется две капиллярные системы, анастомозирующие друг с другом: внутриворсинчатая и параваскулярная. Артериовенозные анастомозы и параваскулярная сеть образуют буферную систему, регулирующую давление крови, скорость кровотока, сердечную деятельность плода. Такое строение плодового сосудистого русла полностью формируется уже в I триместре беременности до 12-й нед гестации. В последующие сроки рост плаценты характеризуется пролиферацией терминального сосудистого русла, возрастанием функциональной обменной поверхности хориальных ворсин.
Между интенсивностью маточного и плацентарного кровообращения существует прямо пропорциональная зависимость. Пуповинный кровоток регулируется перфузионным давлением, определяемым соотношением давления в аорте и пупочной вене плода. Пуповинное кровообращение получает примерно 50-60% общего сердечного выброса плода. В отличие от других сосудистых систем пуповинная система не имеет иннервации и быстро реагирующих артериол для ауторегуляции кровотока. Очевидно, быстрое изменение пуповинного кровотока происходит только за счет изменения артериального давления плода и его сердечной деятельности. Сосудистое сопротивление плаценты снижается по мере прогрессирования беременности. Содержание кислорода в артерии пуповины не меняется при колебаниях кровотока от 150 до 200 мл/мин/кг и уменьшается при его снижении до 100 мл/мин/кг.
На величину пуповинного кровотока влияют физиологические процессы плода — дыхательные движения, двигательная активность. Наличие баро- и хеморецепторов в каротидном синусе, дуге аорты обеспечивает быстрые изменения сердечной деятельности плода. Доказано влияние на сердечную деятельность плода центральной нервной системы, гормонов, изменение объема циркулирующей крови, особенностей центральной гемодинамики матери, лекарственных препаратов.
Кровообращение плода во внутриутробном периоде имеет ряд особенностей. До рождения кровь из плаценты (насыщенная кислородом на 80%) возвращается к плоду по вене пуповины. По мере прохождения крови плода от плаценты к его органам и тканям она постепенно теряет высокое содержание кислорода, смешиваясь с дезоксигенированной. Смешивание крови плода происходит через следующие шунты:
- в печени, с небольшим количеством крови из портальной системы;
- в нижней полой вене, с венозной кровью от нижних конечностей, таза, почек;
- в правом предсердии, с венозной кровью от головы и верхних конечностей;
- в левом предсердии, с венозной кровью от легочной ткани;
- в месте впадения артериального протока в нисходящую аорту. После рождения кровообращение плода претерпевает ряд существенных изменений:
- облитерация пупочных артерий (дистальная часть их формирует медиальные пупочные связки, проксимальная — верхние пузырные артерии);
- облитерация пупочных вен и венозного протока (с образованием круглой связки печени и венозной связки);
- закрытие артериального протока (с образованием артериальной связки);
- закрытие овального окна, вызванное повышением давления в левом предсердии и снижением давления в правом (рис. 5, 6).
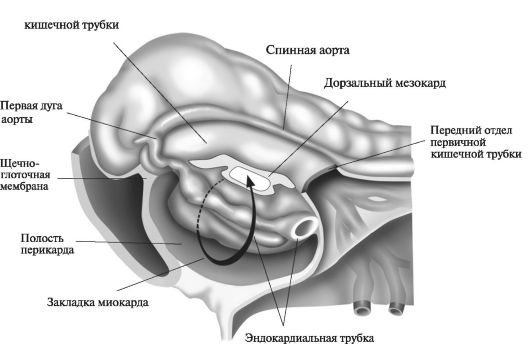
Рис. 5. Строение сердца в начале 3-й нед эмбрионального развития
Таким образом, формирование и функционирование сердечнососудистой системы плода необходимо рассматривать в неразрывной связи с маточно-плацентарным и плодово-плацентарным кровообращением. Единая гемодинамическая функциональная система призвана обеспечить нормальное развитие плода, создать большие компенсаторные возможности его гомеостаза. Немаловажное значение имеет адекватное анатомо-функциональное становление системы мать-плацента-плод в физиологической адаптации организма женщины к беременности. Нормальное развитие маточно- и плодово-плацентарного звеньев системы обеспечивает физиологическое (неосложненное) течение гестационного процесса.
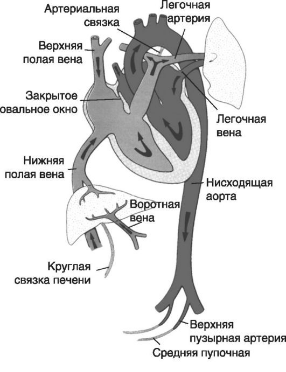
Рис. 6. Система кровообращения новорожденного (стрелками указано направление движения крови)
ФОРМИРОВАНИЕ ОКОЛОПЛОДНОГО ПРОСТРАНСТВА. СОСТАВ ОКОЛОПЛОДНЫХ ВОД
В развитии компонентов околоплодной среды рационально выделить 3 основных этапа:
- ранние взаимоотношения оболочек, зародыша и эмбриона человека во время имплантации, плацентации, которые описаны выше. Важно подчеркнуть, что наиболее быстрые темпы характерны для увеличения объема амниотической полости. В ранние сроки количество амниотической жидкости небольшое: на 6-й нед после оплодотворения — 5 мл, на 10-й нед — 30 мл;
- становление основных компонентов плодных оболочек, слияние их с париетальным эндометрием и кровеносной системой матки.
В течение II триместра — между 15-17-й нед беременности — гладкий хорион вместе с истонченной d. capsularis начинает тесно примыкать к париетальному эндометрию и в конце 20-й нед полностью сливается с ним.
В морфологическом отношении этот сложный процесс взаимодействия плодных и материнских тканей изучен недостаточно, хотя он не менее интересен, чем формирование системы мать-плацента-плод.
После 16-й нед в результате частичного слияния оболочек объем амниотической жидкости быстро увеличивается: 16 нед — 180 мл, 20 нед — 350 мл, 22 нед — 650 мл, 28 нед — 950 мл. В эти сроки беременности объем околоплодных вод увеличивается в среднем на 44 мл каждую неделю. После 28-й нед и до конца беременности их объем убывает: 30 нед — 900 мл, 40 нед — 750 мл.
Известно несколько способов оценки количества амниотической жидкости при УЗИ. Наиболее широкое распространение получил способ определения индекса амниотической жидкости по Фелану. Для этого полость матки мысленно делят на 4 квадранта двумя взаимно перпендикулярными плоскостями, проходящими через пупок беременной. Далее производят измерение вертикального диаметра наибольшего пакета свободной амниотической жидкости в каждом квадранте. Индекс амниотической жидкости (ИАЖ) представляет собой сумму полученных измерений. Нормативные значения индекса амниотической жидкости представлены в табл. 2.
В 8 нед объем амниотической жидкости увеличивается со скоростью 10 мл/нед, в 13 нед — 25 мл/нед, в 21 нед — 60 мл/нед; затем скорость снижается и доходит до 0 мл/нед в 33 нед беременности.
Быстрые темпы прироста объема околоплодных вод во II триместре обусловлены не только анатомическим становлением плодных оболочек, но и дифференцировкой их гистологических компонентов. Со стороны просвета амниотической полости к 16-й нед эпителий становится кубическим, между амниоцитами появляются вакуоли, после 20-й нед их число заметно увеличивается. В компактном веществе нарастает число фибробластов и коллагеновых волокон. Непосредственная зона контакта плодных оболочек и париетального эндометрия остается рыхлой, в ней содержится много редуцирующихся эндометриальных желез, ворсин, клеток и кровеносных микрососудов матки. Таким образом, начиная с 17-20-й нед, структурное объединение d. capsularis с париетальным эндометрием приводит к главному результату — сформиро ванные плодные оболочки контактируют с капиллярной и венулярной сетью эндометрия, т.е. околоплодная среда начинает осуществлять функции параплацентарного обменного органа.
Таблица 2. Нормативные значения индекса амниотической жидкости
| Гестационный срок, нед | Индекс амниотической жидкости, см | ||
| 5% | 50% | 95% | |
| 14 | 2,8 | 5,0 | 8,6 |
| 16 | 3,6 | 5,8 | 9,6 |
| 18 | 4,6 | 6,8 | 10,1 |
| 20 | 5,5 | 8,0 | 12,9 |
| 22 | 6,3 | 9,3 | 14,9 |
| 24 | 7,0 | 10,7 | 16,9 |
| 26 | 7,5 | 12,0 | 18,7 |
| 28 | 7,6 | 13,0 | 19,9 |
| 30 | 7,5 | 13,6 | 20,6 |
| 32 | 7,1 | 13,6 | 20,6 |
| 34 | 6,4 | 12,9 | 19,4 |
| 36 | 5,6 | 11,8 | 17,9 |
| 38 | 4,7 | 10,3 | 15,9 |
| 40 | 3,7 | 8,6 | 13,9 |
Обмен амниотической жидкости происходит через плодную поверхность плаценты, т.е. через амнион и хориальную пластинку. В регуляции объема и состава околоплодных вод принимает участие пролактин. Одним из источников образования околоплодных вод считается как пассивная транссудация из крови матери, так и транссудация, происходящая под влиянием основных биологических механизмов в соответствии с осмотическим и гидростатическим градиентом и разностью потенциалов.
Так называемый недиффузионный процесс протекает на основе осмоса и гидростатического градиента двумя путями: через поры и канальцы мембран и тканей без затраты энергии и через неполные или частично полупроницаемые мембраны. Транспорт жидкости возможен при очень большом осмотическом градиенте между тканями, равном 10 мосмоль на 1 кг воды. За последние годы проведены фундаментальные исследования амниотической жидкости при нормальной и осложненной беременности, приходящиеся в основном на II и III ее триместры, в результате которых накоплены сведения как о качественных, так и о количественных изменениях состава околоплодных вод. По мнению различных авторов, биохимический состав околоплодных вод относительно постоянен. Наблюдаются незначительные колебания концентрации минеральных и органических веществ в зависимости от срока беременности (табл. 3).
Таблица 3. Состав околоплодных вод в I триместре неосложненной беременности

Количество минеральных веществ в околоплодных водах составляет 0,71%. В них содержатся все электролиты, имеющиеся в организме матери. Натрий обеспечивает осмотическую концентрацию околоплодных вод. В ранние сроки беременности уровень натрия в околоплодных водах близок к таковому в крови матери.
Осмотическую концентрацию околоплодных вод создают, кроме электролитов, и другие компоненты. К ним относятся глюкоза и мочевина. При сроке беременности 7-12 нед концентрация глюкозы в околоплодных водах составляет 3,12 ммоль/л. Относительно высокая концентрация глюкозы в I триместре беременности объясняется неспособностью печени плода синтезировать из глюкозы гликоген. По мере функционального созревания печени уровень глюкозы снижается (табл. 4).
Таблица 4. Состав околоплодных вод во II триместре неосложненной беременности

В сроки беременности 15-25 нед происходит постепенное снижение рН околоплодных вод от 7,17±0,004 до 7,14±0,04. Одновременно с увеличением срока беременности происходит снижение содержания натрия и калия в околоплодных водах. С развитием беременности происходит прогрессивное уменьшение содержания кальция в околоплодных водах. Содержание общего кальция в основном уменьшается, а ионизированного — не изменяется, концентрация его такая же, как в крови матери.
Содержание глюкозы в околоплодных водах и ее взаимосвязь с метаболическими процессами у плода во II триместре беременности представляют большой интерес. По мере прогрессирования беременности отмечается снижение содержания глюкозы на фоне роста содержания мочевины. Уже в 25 нед беременности концентрация мочевины в околоплодных водах значительно выше, чем в крови матери и плода.
Таким образом, во время II триместра нормальной беременности, после становления закладок основных органов и систем эмбриона, происходит дальнейший их рост, специализация функций и формирование межорганных связей. Этому в значительной мере способствует усложнение ряда околоплодных структур. Так, в системе мать-плацента-плод реализуется вторая волна инвазии цитотрофобласта, которая приводит к увеличению площади контакта плаценты и матки, вовлечению в гестационную перестройку более крупных по калибру миометриальных сегментов спиральных артерий и, соответственно, значительному увеличению притока артериальной материнской крови в межворсинчатое пространство.
Одновременно формируются плодные оболочки, вокруг плода быстро увеличивается объем околоплодных вод, т.е. образуется параплацентарный путь транспорта. В плаценте продолжается дифференцировка стволовых и промежуточных ветвей. В целом околоплодные структуры обеспечивают морфофункциональные возможности для быстрого роста плода, который на 16-17 нед опережает по массе плаценту и в дальнейшем уже не уступает ей «пальму первенства».
Итак, сформированная, находящаяся в динамическом равновесии и саморегулирующаяся функциональная система мать-плацента-плод выполняет во время беременности многообразные функции. Через плаценту осуществляются питание и газообмен плода, выделение продуктов метаболизма, формирование гормонального и иммунного статуса плода. В процессе беременности плацента заменяет ему недостающие функции гематоэнцефалического барьера, защищая нервные центры и весь организм плода от воздействия токсических факторов. Она обладает также антигенными и иммунными свойствами. Немаловажную роль в выполнении этих функций играют околоплодные воды и плодные оболочки, образующие вместе с плацентой единый комплекс.
Будучи посредником в создании гормонального комплекса системы мать-плод, плацента играет роль железы внутренней среции и синтезирует гормоны, используя материнские и плодовые предшественники. Вместе с плодом она формирует единую эндокринную систему. Гормональная функция плаценты способствует сохранению и прогрессированию беременности, изменениям активности эндокринных органов матери. В ней происходят процессы синтеза, среции и превращения ряда гормонов белковой и стероидной структуры. Уже в предимплантационном периоде на стадии бластоцисты зародышевые клетки сретируют прогестерон, эстрадиол и хорионический гонадотропин, имеющие большое значение для нидации плодного яйца. В процессе органогенеза гормональная активность плаценты возрастает. Затем плацента сретирует большие количества гормонов в течение всей беременности.
Существует взаимосвязь между организмом матери, плодом и плацентой в продукции гормонов. Одни из них сретируются плацентой и транспортируются в кровь матери и плода. Другие являются производными предшественников, попадающих в плаценту из организма матери и плода. Прямая зависимость синтеза эстрогенов в плаценте от андрогенных предшественников, продуцируемых в организме плода, позволила Е. Diczfalusy (1962) сформулировать понятие о фетоплацентарной системе. Через плаценту могут транспортироваться и неизмененные гормоны. Плацентарные гормоны синтезируются в синцитио- и цитотрофобласте, а также децидуальной ткани. Плацента синтезирует хорионический гонадотропин, плацентарный лактоген и пролактин, а также иммунореактивный эндорфин, меланоцитостимулирующий гормон и пропиомелакортин (предшественник АКТГ). Из гормонов стероидной природы синтезируются гестагены и эстрогены.
Из гормонов белковой природы в развитии беременности ведущее значение имеет плацентарный лактоген (ПЛ). Он обладает активностью пролактина и иммунологическими свойствами гормона роста, дает лактогенный и лютеотропный эффект, поддерживая стероидогенез в желтом теле яичника в I триместре беременности. Основная биологическая роль ПЛ заключается в регуляции углеводного и липидного обмена, усилении синтеза белка в организме плода, от чего в определенной мере зависит его масса. Он синтезируется клетками трофобласта и по структуре близок к гормону роста. ПЛ поступает в организм матери, где быстро метаболизируется.
Чрезвычайно короткий период полураспада (20 мин), отсутствие суточного ритма среции и наличие единственного источника его синтеза (плацента) позволяют использовать ПЛ для диагностики функционального состояния этого органа. ПЛ выявляют в крови матери уже на 5-6-й нед беременности. ПЛ практически не проникает к плоду. В околоплодных водах уровень ПЛ в 8-10 раз ниже, чем в крови матери. Отмечена прямая зависимость между уровнями ПЛ в крови матери и амниотической жидкости, между содержанием гормона в крови и массой плода и плаценты. Это послужило основанием для оценки состояния плаценты и плода по уровню ПЛ в крови и околоплодных водах.
Хорионический гонадотропин (ХГ) — продукт синтеза стероидов в синцитиотрофобласте. Он относится к гликопротеидам, имеет молекулярную массу 36 000-40 000, по строению и биологическому действию сходен с лютеинизирующим гормоном (ЛГ), состоит из двух субъединиц α- и β-ХГ — мономеров, образующихся при диссоциации ХГ. Биосинтез каждой из них зависит от индивидуального гена и осуществляется на полирибосомах синцитиотрофобласта. Эти субъединицы различаются по углеводному и аминокислотному составу и биологическому значению. Наиболее точно функцию плаценты отражает β-ХГ. В ранние сроки беременности ХГ стимулирует стероидогенез в желтом теле яичника, во второй половине — синтез эстрогенов в плаценте, участвуя в ароматизации андрогенов. Существует мнение, что ХГ усиливает стероидогенез в коре надпочечников плода, а также тормозит сократительную активность миометрия. ХГ может участвовать в механизмах дифференцировки пола плода. В конце беременности и при некоторых ее осложнениях в крови обнаруживают особые формы субъединиц ХГ — так называемые свободные субъединицы α- и β-ХГ. Они являются предшественниками зрелых форм молекулы ХГ. Их появление связывают со «старением» плаценты, эндокринопатиями и трофобластическими опухолями. ХГ, как и ПЛ, транспортируется преимущественно в кровь матери. В крови плода его уровень в 10-20 раз ниже, чем в крови беременной, где ХГ обнаруживают сразу после имплантации плодного яйца. β-ХГ в крови выявляются, начиная с 1-й нед беременности.
Плацента, наряду с гипофизом матери и плода, продуцирует пролактин. Физиологическая роль его сходна с таковой ПЛ. Он имеет определенное значение в продукции легочного сурфактанта и фетоплацентарной осморегуляции. Большую роль в развитии беременности играет прогестерон-стероидный гормон, продуцируемый плацентой. Прогестерон синтезируется, начиная с ранних сроков беременности, в синцитиотрофобласте из холестерина, содержащегося в крови матери. Из плаценты он поступает в кровь матери и лишь 4-5 часть его — плоду. В организме матери (в основном в печени) прогестерон быстро метаболизируется, около 10-20% его выделяется с мочой в виде прегнандиола. В надпочечниках и печени плода прогестерон превращается в нейтральные стероиды (главным образом в дегидроэпиандростерон (ДЭА) и его производные), которые с кровью плода поступают в плаценту и через андростендион и тестостерон трансформируются в эстрогены. Ведущая роль плаценты в синтезе прогестерона проявляется, начиная с 5-6-й нед беременности. К 7-8 нед концентрация прогестерона возрастает в 2 раза и продолжает постепенно повышаться до 37-38 нед.
Эстрогены (эстрадиол, эстрон и эстриол) также относятся к стероидным гормонам плаценты. Они различаются по своему строению и биологической активности. Эстрогены воздействуют на обменные процессы и рост матки, вызывая гиперплазию и гипертрофию эндометрия и миометрия, принимают активное участие в развитии родового акта. Непосредственное влияние эстрогенов на плод изучено недостаточно. Полагают, что эстрогены способствуют росту плода.
Местом выработки эстрогенов является синцитиотрофобласт. Продукция их находится в прямой зависимости от состояния маточно-плацентарного кровообращения и наличия предшественников, вырабатываемых в организме матери и плода. Эстрогены по праву относят к гормонам фетоплацентарного комплекса. Особенно это касается эстриола, поскольку его синтез осуществляется при активном участии плода. Содержание эстриола возрастает почти в 10 раз с 7-8-й до 25-26-й нед беременности и продолжает увеличиваться до конца беременности. Метаболизм эстрогенных гормонов в организме матери и плода заключается в основном в конъюгации их с остатками глюкуроновой и серной кислот и образовании глюкуронидов и сульфатов, причем метаболизм их у плода происходит чаще с образованием сульфатов. В метаболизме гормонов, кроме печени, участвуют слизистая оболочка кишечника и почки. Таким образом, в крови матери и плода содержатся неконъюгированные формы эстрогенов, количество которых не зависит от состояния печени, кишечника и функции почек и отражает функцию плаценты и фетоплацентарной системы. Почки экскретируют только конъюгированные формы гормона. На их содержание в моче матери и плода и в околоплодных водах оказывает влияние состояние печени, почек и слизистой оболочки кишечника обоих организмов.
Вторым гормоном фетоплацентарного комплекса, продуцируемым в большой мере при участии надпочечников и печени плода, является кортизол. На основании концентрации кортизола и других гормонов в крови матери можно оценить состояние плода. Концентрация кортизола постепенно увеличивается и накануне родов в 5 раз превышает первоначальный уровень.
Защитная (барьерная) функция плаценты ограничена. Так, переход от матери к плоду белков, жиров, углеводов и других метаболитов, постоянно содержащихся в крови матери, регулируется механизмами, возникающими в плаценте в процессе фило- и онтогенеза. По отношению к веществам, введенным извне или случайно попадавшим в кровь матери, барьерная функция плаценты выражена меньше или может даже отсутствовать. Вследствие этого через плаценту легко проникают наркотические средства, алкоголь, никотин и многие другие токсичные вещества, а также практически все лекарственные средства.
Проницаемость плаценты изменяется в течение беременности в соответствии с возрастающими потребностями плода. Имеются данные о повышении проницаемости плаценты к концу беременности, что связано с изменениями в структуре пограничных мембран, в том числе с исчезновением цитотрофобласта и постепенным истончением синцитиотрофобласта ворсин плаценты. В то же время в первые месяцы беременности проницаемость плацентарной мембраны достаточна для прохождения эритроцитов. Плацента препятствует прохождению ряда материнских клеток и цитотоксических антител к плоду. Главную роль в этом процессе играет перицеллюлярный фибриноид, покрывающий клетки трофобласта.
Физиологическое развитие беременности обеспечивает комплекс защитных механизмов и иммунных реакций, одним из компонентов которого является иммунный (биологический) барьер между материнским организмом и плодом, образованный плацентой. Плаценту (в основном трофобласт) считают главным органом, предотвращающим прерывание беременности. Этому способствует отсутствие комплекса гистонесовместимости в трофобласте. Вещества, синтезируемые плацентой, оказывают влияние на различные отделы иммунокомлетентной системы матери. Они подавляют активность лимфопоэза, блокируют рецепторы воспринимающих клеток (клеток-эффекторов), способствуют развитию и дифференцировке иммунокомпетентной системы плода. В первые недели эмбриогенеза четко дифференцируется групповая, изоантигенная специфичность тканей трофобласта, зародыша, околоплодных вод и плодных оболочек.
Задолго до появления у плода иммунокомпетентных клеток вступает в действие система, участвующая в иммунологических реакциях. Эта система, синтезирующая белок-супрессор, локализуется в трофобласте. Белок обладает свойствами биологически активного вещества и тормозит иммунный ответ беременной женщины.
Иммуномаскирующее действие оказывает «щеточная кайма» синцитиотрофобласта, которая содержит кислые мукополисахариды, сиаломуцин и другие гликопротеиды, предотвращающие контакт антигенов плода и антител матери.
Плацента не является барьером, совершенно непроницаемым для белковых веществ. Установлено, что в организм матери проникают плодовые белки, такие как α-фетопротеин (α-ФП). Его концентрация в крови матери коррелирует со сроком гестации и массой плода и позволяет судить о степени его зрелости. При физиологической беременности концентрация α-ФП прогрессивно увеличивается до 33-34 нед, а затем снижается к 41-42 нед гестации.
Беременность сопровождается выраженной перестройкой системы гуморального иммунитета. Биологические сдвиги в организме беременной и защита материнского организма от антигенов плода обусловливают специфические («блокирующие аллоантитела» и супрессорные клетки) и неспецифические (α2-глобулины, глюкокортикоидные и половые гормоны, ПЛ и ХГ, специфические белки «зоны беременности») факторы. α-ФП подавляет активность лимфоцитов; α2-глобулины — специфический белок беременности. Трофобластический β-гликопротеид (ТБГ) является мощным биологически активным агентом, тормозящим функции иммунокомпетентных тимусзависимых лимфоидных клеток. Плацента определяет формирование иммунитета в организме плода и играет большую роль в его иммунной защите.
Плод, лишенный собственных систем, синтезирующих иммуноглобулины, получает их необходимый запас из организма матери. Роль плаценты в балансе иммуноглобулинов выражается в том, что молекулы иммуноглобулинов (Ig) разных классов распознаются клетками трофобласта, селективно сортируются и направленно сретируются в кровоток плода. Через плаценту быстро проходят молекула IgG и ее фрагмент Fc. В трофобласте и ворсинах хориона обнаружены IgG. Они содержатся в цитоплазме синцития и отложениях фибриноида на поверхности ворсин. Найдены в большом количестве С3- и С4-иммунопротеины, а также комплемент.
Синтез плацентарных иммуноглобулинов и барьерная функция плаценты являются тканевоспецифическими факторами защиты. К ним относится и гемостатическая способность синцитиотрофобласта, заключающаяся в предотвращении выпадения фибрина из материнской крови при наличии неповрежденного эпителиального покрова ворсин. При нарушении целости трофобласта антикоагуляционные свойства поврежденного участка утрачиваются, что приводит к пристеночному выпадению фибрина, содержащего белки плазмы, гликопротеиды, γ-глобулин. Отложение фибрина вокруг поврежденных ворсин предотвращает поступление в межворсинчатое пространство плацентарных и плодовых антигенов.
Из тканевоспецифических факторов большое значение имеют протеолитические свойства трофобласта, способствующие инактивации чужеродных белков. Благодаря протеолитической активности клеточных элементов плацента связывает и нейтрализует изоантитела системы АВО крови матери, антилейкоцитарные антитела и др.
В процессе беременности активируется синтез среторных белков плаценты, большинство из которых обладает иммунодепрессивными свойствами. К ним относятся специфические протеины плаценты: ТБГ, SPi, протеин А (РАРР-А), плацентарный протеин 5 (РР-5), протеин 10 (гликопротеин, РР-10), новый протеин РР-15, антиген α2-микроглобулин и др. Все известные специфические протеины и гликопротеины продуцируются в синцитиотрофобласте и сретируются преимущественно в кровоток матери.
Из белков плаценты особого внимания заслуживает трофобластический глобулин. Он состоит из двух единиц — α и β, различающихся периодом полураспада и молекулярной массой. ТБГ не обладает гормональной и ферментативной активностью, но дает выраженный иммуносупрессивный эффект и обеспечивает тем самым защиту плода. ТБГ появляется в крови беременных на 13-й день после овуляции, что позволяет осуществить раннюю диагностику беременности, особенно у женщин, которые получали гормональные препараты. Концентрация ТБГ в крови прогрессирует в течение беременности и резко снижается накануне родов. При патологической беременности значительно изменяются уровень и характер среции этого гликопротеина, что позволяет использовать его для диагностики патологии плаценты.
Нарушение защитной и иммунной роли плаценты приводит к возникновению патологических взаимоотношений в системе мать-плацента-плод. Плацента выполняет сложную функцию газообмена и транспорта питательных веществ, которые зависят от многих факторов, но в большей степени от состояния плацентарной мембраны, ее способности регулировать транспорт различных веществ в системе мать-плод и поддерживать концентрационный градиент по обе стороны мембраны, свойственный каждому метаболиту.
Механизмы перехода веществ различны: ультрафильтрация, простая и сложная диффузия через клеточные и тканевые мембраны, активный транспорт, который осуществляется против градиента концентрации, пиноцитоз и трансформация веществ в плацентарных ворсинах. Трансплацентарный переход химических веществ возможен благодаря их растворимости в липидах, что объясняют сродством химических соединений с высокой липидной растворимостью. Хорошо растворимые в липидах неионизированные соединения сравнительно быстро проникают через плаценту, плохо растворимые — медленно и в ограниченном количестве. Важную роль в осуществлении обмена между матерью и плодом играют ферментные системы плаценты. С помощью содержащихся в эпителии хориона ферментов происходят расщепление и синтез веществ, необходимых для роста и развития плода.
Газообмен в плаценте осуществляется путем проникновения кислорода (О2) к плоду и выведения углекислоты (СО2) из его организма в кровь матери. Плацента не обладает способностью к накоплению кислорода и углекислоты, поэтому их транспорт происходит постоянно. Обмен газов в плаценте аналогичен газообмену в легких, при этом площадь обменной поверхности ворсин в пересчете на 1 кг массы тела более чем в 3 раза превышает площадь поверхности легочных альвеол организма взрослого человека и составляет 3-4 м2/кг. Кислород и углекислота проникают через мембраны, только будучи растворенными в плазме крови. Переход кислорода в углекислоту происходит на участках ворсинчатого хориона, к которым непосредственно подходят эритроциты крови матери.
Снабжение плода кислородом зависит от многих факторов: количества кислорода, поступающего в матку, состояния маточно-плацентарного и фетоплацентарного кровотока, метаболизма плаценты и состояния структурных элементов плацентарной мембраны. Беременная матка потребляет 2100-2250 мл кислорода в час. Частично он утилизируется миометрием, но большая часть кислорода поступает в плаценту, где около половины его используется самой плацентой, а остальная часть — плодом. Зрелая плацента потребляет в 2-3 раза больше кислорода, чем ткани плода.
Транспорт углекислоты в отличие от транспорта кислорода совершается не только путем простой диффузии. Он связан также с переносом кислорода, бикарбонатов, кислых продуктов обмена и других метаболитов. Немалую роль в выведении углекислого газа из организма плода играют околоплодные воды и параплацентарный обмен.
Питание плода осуществляется путем транспорта продуктов метаболизма через плаценту. Ежедневно в ответ на растущие потребности плода для пополнения экстрацеллюлярного пространства и объема околоплодных вод через плаценту проникает большое количество воды. На протяжении беременности она скапливается в матке, и к концу ее количество воды достигает примерно 4 л (2800 мл в организме плода, 400 мл в плаценте и 800 мл в амниотической полости). Ежедневная прибавка воды составляет 30-40 мл. Вода необходима для метаболизма плода и матки. Основная масса воды проходит через плаценту от матери к плоду, при этом транспорт ее может идти против градиента концентрации. Существует несколько теорий, объясняющих механизм транспорта воды в системе мать-плод, однако точно он не установлен.
Обмен электролитов происходит трансплацентарно и через околоплодные воды. По отношению к некоторым электролитам плацента выполняет не только транспортную, но также деионизирующую и выделительную функции. Это относится к кальцию, фосфору, железу и другим микроэлементам, лишь калий, натрий, бикарбонаты и хлориды свободно проникают через плаценту к плоду и обратно в кровь матери, не проявляя склонности к депонированию. На их переход влияет электрический и концентрационный градиент. Возможен также переход Na+ и К+ против градиента концентрации.
Транспорт белков, жиров и углеводов осуществляется в результате сложных процессов ферментативного расщепления и синтеза. Они практически не переходят в неизмененном виде из крови матери к плоду: в плаценте происходит синтез собственных метаболитов, специфичных для плода.
Состояние белкового обмена в системе мать-плод обусловлено многими факторами: составом и свойствами белков, состоянием белоксинтезирующей системы плаценты, активностью ферментов, уровнем гормонов и др. Важную роль в метаболизме белков играет белоксинтезирующий аппарат плаценты. С синтезом белка тесно связана пластическая функция плаценты. Способность трофобласта дезаминировать и переаминировать аминокислоты, синтезировать их из других предшественников обусловливает их активный транспорт в кровь плода. Поглощение плацентой аминокислот матери и белка, расщепление их в плаценте и последующий синтез из продуктов протеолиза специфических для эмбриона и плода белков являются основными этапами транспорта этих продуктов обмена. Через плаценту могут проходить интактные белковые молекулы, при этом плод получает некоторые специфические белки γ- и α-глобулины).
Обменные процессы совершаются в микроворсинчатой части плаценты и по своему механизму близки к пристеночному (мембранному) пищеварению, происходящему в кишечнике. Белки крови матери могут поступать в паренхиму плаценты, минуя фазу пристеночного пищеварения, в связи с наличием в зрелой плаценте участков истончения и отсутствием синцития. Трансплацентарный переход белков к плоду — процесс избирательный и относительно не зависящий от их молекулярной массы.
Считают, что липиды не переходят к плоду из крови матери, а синтезируются плацентой из материнских предшественников. Транспорт липидов (фосфолипиды, нейтральные жиры и др.) к плоду осуществляется после их предварительного ферментативного расщепления.
Следует отметить, что липиды локализуются в основном в цитоплазме синцития ворсин хориона. Из них 2/3 составляют фосфолипиды, которые обеспечивают проницаемость клеточных мембран плаценты, треть — стероиды и небольшое количество нейтральных жиров.
В снабжении плода продуктами углеводного обмена можно выделить два важнейших звена: гликогенобразовательную функцию плаценты и трансплацентарный транспорт глюкозы. По мере развития беременности гликогенобразовательная функция изменяется. До 16 нед беременности, когда печень плода функционирует недостаточно активно, ее роль в углеводном обмене полностью выполняет плацента. С ростом плода количество гликогена в плаценте уменьшается, однако в экстремальных для плода условиях гликоген плаценты расходуется в первую очередь.
Глюкоза транспортируется через плаценту путем не простой, а облегченной диффузии. Уровень ее в крови плода может быть выше, чем у матери, что не исключает возможность использования организмом плода собственных источников образования глюкозы (гликоген печени). Глюкоза при неосложненной беременности почти беспрепятственно проникает через плаценту и является основным питательным веществом для плода. Плацента участвует в снабжении плода витаминами. Она способна накапливать их и регулирует поступление этих веществ в организм плода. Этот процесс зависит от содержания витаминов в организме матери. Витамины способствуют активации биологических процессов, происходящих в хорионе. Витамин А (ретинол) и каротин депонируются плацентой в значительном количестве. К плоду переходит каротин, который в печени плода превращается в витамин А. В плаценте также возможен процесс превращения витамина А в каротин.
Витамины группы В накапливаются в плаценте и транспортируются к плоду чаще всего в соединениях с фосфорной кислотой. Так, витамин B1 (тиамин) депонируется в плаценте в виде кокарбоксилазы (в соединении с фосфорной кислотой тиаминдифосфат). Условием для проникновения витамина в кровь плода является разложение кокарбоксилазы. Витамин В2 (рибофлавин) накапливается в плаценте в несвязанном виде либо в форме флавинадениндинуклеотида (FAD) или флавинмононуклеотида (FMN). После перехода к плоду он в его печени трансформируется в сложные активные соединения. Никотиновая кислота (витамин РР или В3) также содержится в синцитиотрофобласте ворсин хориона в виде никотинамидадениндинуклеотида (НАД) и никотинамидаденин-динуклеотидфосфата (НАДФ). Содержание в плаценте витаминов В6 (пиридоксин) и В12 (фолиевая кислота) колеблется в зависимости от сезона года.
Аскорбиновая кислота (витамин С) находится в плаценте постоянно и обнаруживается в больших количествах (от 73,7 до 2126 мкмоль/л; в крови матери около 56,7 мкмоль/л). В организме плода витамин С накапливается в тканях печени и надпочечников. Широко представлен в плаценте биотин (витамин Н), который в качестве кофермента участвует в процессах карбоксилирования и синтеза жирных кислот и стеринов. Содержание витамина D в плаценте и транспорт его к плоду зависят от уровня этого витамина в организме матери. Витамин D регулирует обмен и транспорт Са2+ в системе мать-плод. Витамин Е (токоферол) необходим для правильного развития беременности и функционирования нервной и мышечной систем. Он содержится в плаценте, но не проходит через плаценту к плоду. Для синтетических препаратов витамина Е плацента проницаема. Витамин К в натуральном виде также не проникает через плаценту, тогда как его синтетический заменитель проникает к плоду.
В снабжении плода питательными веществами и продуктами обмена важную роль играют ферменты. Среди ферментов, характеризующих функцию плаценты, следует выделить группу дыхательных ферментов. К ним относятся оксидазы (моноаминоксидаза, система цитохромоксидаз, ДОПА-оксидаза), каталаза, НАД- и НАДФ-диафоразы, большая группа дегидрогеназ (ДГ). Универсальный источник энергии — АТФ — синтезируется митохондриями, показателем функционального состояния которых служит сукцинат-дегидрогеназа (СДГ). Она играет важную роль в процессе переноса водорода при отщеплении его от углеродов при их аэробном окислении. Активность СДГ в хориальном эпителии отмечена уже в ранние сроки беременности. К 12 нед беременности активность фермента усиливается и сохраняется на таком уровне до конца беременности.
Активность углеводного обмена определяют по наличию ферментов, расщепляющих углеводов. К ним относятся диастаза, инвертаза, лактаза, карбоксилаза, кокарбоксилаза и др. Активность их в плаценте в 4-8 раз выше, чем в печени матери, и повышается по мере развития беременности и увеличения потребностей плода.
Неспецифическим показателем белкового синтеза служат НАД- и НАДФ-диафоразы. НАД-диафораза участвует в восстановлении цитохрома С. Наибольшая активность этих ферментов установлена в эпителии ворсин хориона, особенно в синцитии. В конце 2-го месяца беременности их активность несколько повышается. К концу беременности активность НАДФ- и NAP-диафораз снижается.
Большое значение для клеточного обмена трофобласта имеет активность щелочной фосфатазы, в частности ее термостабильного изофермента (ТЩФ), специфичного для плаценты. При биохимических исследованиях установлено, что активность ТЩФ при беременности в 28-32 нед составляет 2,7±0,3 BE (единицы Боданского), а в родах достигает максимума — 4,6±0,28 BE.
Другим специфическим энзимом, характеризующим состояние трофобласта, является окситоциназа. Ее активность в сыворотке крови определяют с 16-й по 23-ю нед беременности (0,075±0,005 ЕД). В 24-27 нед она увеличивается в 2 раза и, возрастая, достигает максимума в 37-41 нед (0,34±0,01 ЕД). В родах активность окситоциназы снижается. Широко представлены в плаценте и другие биологически активные вещества (системы гистамин-гистаминаза, ацетилхолинацетилхолинэстераза и др.), а также факторы свертывания крови и фибринолиза.
Таким образом, многообразие функций плаценты обеспечивает физиологическое течение беременности и правильное развитие плода.
