Ренопротекция
Лекции по нефрологии — Иванов Дмитрий Дмитриевич — 2010
- 4.1. Понятие ренопротекции
- 4.2. Антигипеотензивная терапия в ренопротекции
4.1. Понятие ренопротекции
Развитие и прогрессирование хронической болезни почек характеризуется ренальным континуумом, а прогноз жизни пациента определяется реализацией факторов риска, главный из которых — кардиоваскулярный. Если хроническая болезнь почек обратима, то до определенного временного/ функционального интервала ее следует трактовать как хроническое заболевание почек. Обратимость хронической болезни почек, исходя из критериев ее диагностики, можно оценивать по СКФ и морфологически. Учет СКФ, безусловно, более практичен и нагляден. Так, потеря каждых 5 мл от СКФ приводит к 26% росту смертности пациентов с хронической болезнью почек.
NKF определен уровень скорости клубочковой фильтрации, с которого в тактике ведения пациентов рекомендуется лечение осложнений хронической болезни почек, — это СКФ менее 60 мл/мин (табл. 4.1). Очевидно, при дальнейшем снижении СКФ хроническая болезнь почек имеет необратимый характер, одновременно экспоненциально начинают расти кардиоваскулярные риски (табл. 4.2).

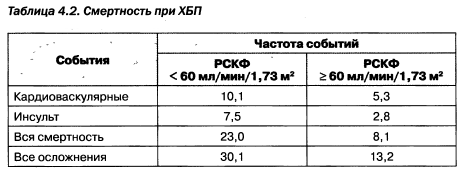
Из табл. 4.1 следует, что NKF постулируется уровень снижения скорости клубочковой фильтрации (менее 60 мл/мин), при котором возможности терапии позволяют замедлить прогрессирование, а в ряде случаев — остановить необратимую потерю функций почек. В связи с этим возникло понятие ренопротективной терапии, или ренопротекции, — комплекса лечебных мероприятий, способствующих замедлению прогрессирования или восстановлению функций почек. Таким образом, превентивная нефрология предполагает назначение ренопротекторной и заместительной терапии (рис.4.1).

По мере прогрессирования хронической болезни почек возможности ренопротекторной терапии уменьшаются, уступая место заместительной терапии (рис. 4.2).
Обсуждение обратимости хронической болезни почек имеет фундаментальный и практический аспект. С научной точки зрения изучается возможность регенерации почечной ткани. В частности, уже доказано, что возможна тубулярная регенерация, а ее активность во многом определяется фармакологическими средствами.
Практический аспект обратимости хронической болезни почек диктует необходимость проведения мультицентровых исследований. В 2005 году ERA-EDTA утверждена программа APRA (Arrest Renal disease Progression Aim), цель которой — подбор идеальной терапии для торможения/прекращения прогрессирования хронической болезни почек и уменьшения ее влияния на конечные кардиоваскулярные точки. Основой для планирования исследования явились данные успешного использования ИАПФ, сартанов и статинов при хронической болезни почек. APRA разработана согласно дизайну PROBE (Prospective Randomized Open, Blinded End-Point).
Наш более чем 10-летний опыт использования ИАПФ, сартанов и более скромный — других препаратов, рассматриваемых в контексте ренопротекции, свидетельствует о возможности обратимости снижения СКФ. При этом скорость восстановления функции почек во многом зависит от следующих показателей (табл. 4.3).

Безусловно, каждое из приведенных в табл. 4.3 положений требует подтверждения. На сегдняшний день лишь доказано, что абсолютная значимость независимого от снижения АД эффекта ренопротекции намного меньше, чем эффект от самого снижения АД (A. Macaulay, 2009).
Двойной блок ренин-ангиотензиновой системы ИАПФ и БРА при начальном уровне СКФ в диапазоне 60-80 мл/мин через 4—5 лет постоянного приема в дозах, обеспечивающих физиологическую гипотензию/нормотензию, при начальной протеинурии менее 1 г/сут позволяет добиться увеличения СКФ 1—3 мл/мин/год. При этом детский и более молодой возраст, более высокая изначальная СКФ, женский пол, отсутствие анемии (лечение эритропоэтинстимулирующим агентом и железом), гипоальбуминемии (рациональное питание и кетокислоты), отсутствие альбуминурии или микроальбуминурия, нормальная или несколько повышенная масса тела и сочетание терапии с моксонидином и сартаном позволяет рассчитывать на скорейшее приостановление потери СКФ с последующим восстановлением в пределах 2—3 мл/мин/год. Следует помнить, что ИАПФ и сартаны с преимущественно почечным путем выведения при низких значениях СКФ, и в особенности при метаболическом синдроме, могут усугублять нарушение функции почек.
Как можно оценить восстановление СКФ спустя 4—8 лет постоянного корректного приема ренопротекторной терапии?
Во-первых, такая терапия безопасна, в том числе и для детей.
Во-вторых, следует продолжать исследования.
На сегодня лишь для антигипертензивных препаратов, в первую очередь для ИАПФ и БРА, установлены свойства убедительной ренопротекции: коррекции АД и антипротеинурический эффект (рис. 4.3). При этом следует оговориться, что снижение АД и ликвидация/снижение протеинурии увеличивают продолжительность жизни пациентов за счет уменьшения кардиоваскулярных рисков, но отнюдь не обязательно за счет сохранения СКФ. Граница, ниже которой препараты не могут остановить снижение СКФ, окончательно не выяснена и, вероятно, находится в пределах 30—60 мл/мин.
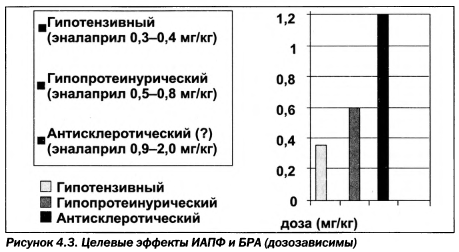
Клинические исследования подтверждают, что при увеличении дозы ИАПФ и БРА возрастает антипротеинурический эффект. Более того, комбинация ИАПФ + БРАу пациентов без признаков ишемической нефропатии и выраженного снижения СКФ может быть также эффективной в ренопротекции. Однако такая комбинация несет риски усугубления ишемической нефропатии, в той или иной мере всегда присутствующей при хронической болезни почек. Возможно, перспективным будет обеспечение полного блока ренин-ангиотензиновой системы с помощью прямых блокаторов ренина, например алискирена. Помимо указаний на более выраженный антигипертензивный эффект, к преимуществам ПИР относят то, что они обеспечивают устойчивое снижение ангиотензина II плазмы крови в отличие от ИАПФ и БРА. Но исследований, демонстрирующих эффективность ПИР при хронической болезни почек, в настоящее время не представлено. В связи с этим основной упор все-таки делается на эффективное использование ИАПФ.
Абсолютно понятно, и это подтверждается данными исследований, что ИАПФ с преимущественно почечным путем выведения обладают более выраженными антигипертензивными, антипротеинурическими и, вероятно, ренопротекторными свойствами. Поэтому использование периндоприла, эналаприла, лизиноприла, рамиприла на 1—2-й стадиях хронической болезни почек рассматривается как весьма перспективная основа ренопротекции.
Таким образом, ренопротекция с помощью ИАПФ и БРА реализуется в снижении/нормализации АД, уменьшении/ликвидации протеинурии, замедлении снижения СКФ и концентрационной функции почек (а возможно, и в улучшении этих функций), а также, вероятно, в сохранении эритропоэтинпродуцирующих свойств перитубулярных клеток. Имеются данные, что и некоторые антагонисты кальция, селективные Р-блокаторы проявляют подобные свойства. Малобелковая диета в сочетании с незаменимыми аминокислотами, антитромбоцитарные препараты, статины также могут в определенной мере способствовать уменьшению протеинурии и сохранению СКФ, однако доказательная база для вынесения рекомендаций еще недостаточна. Использование эритропоэтинстимулирующих агентов, препаратов, влияющих на фосфорно-кальциевый обмен, к настоящему времени не убедительно в сохранении функций почек.
4.2. Антигипеотензивная терапия в ренопротекции
В настоящее время ИАПФ являются самыми назначаемыми препаратами среди всех групп антигипертензивных средств. Очевидно, это связано с широким перечнем показаний к лечению ИАПФ. При этом круг сердечно-сосудистых заболеваний не ограничивается кардиологическими проблемами (ИБС, СН, коронарный синдром, гипертрофия левого желудочка). Согласно известным Британским рекомендациям (ВНР, 2006), ИАПФ являются препаратом первого ряда выбора при АГ у лиц до 55 лет ввиду высокой вероятности ренинового механизма причины развития гипертензии. Рекомендации Украинской ассоциации кардиологов по профилактике и лечению артериальной гипертензии (2008), как и зарубежные аналоги, предполагают назначение ИАПФ при инсульте, транзиторной ишемической атаке, диабете (диабетической болезни почек) и поражениях почек. Согласно рекомендациям NKF (2004), хроническая болезнь почек приравнивается по рискам к ишемической болезни сердца. Следует подчеркнуть, что назначение ИАПФ при диабете и хронических заболеваниях почек не требует наличия гипертензии. Диабетическое поражение почек уже на стадии микроальбуминурии является показанием для использования ИАПФ. Вероятно, еще до появления микроальбуминурии при наличии гиперфильтрации, определяемой с помощью пробы Реберга — Тареева (а не по расчетным формулам MDRD и C-G), уже обосновано назначение ИАПФ. Аналогичная ситуация наблюдается при хронических заболеваниях почек: протеинурия любой степени выраженности, не сопровождающаяся АГ, является показанием для лечения ИАПФ.
Таким образом, наиболее частыми показаниями к назначению ИАПФ являются:
— заболевания с наличием (без наличия) АГ: сердечнососудистые (ИБС, СН, инфаркт, инсульт, транзиторная ишемическая атака), сахарный диабет 1-го и 2-го типа, хронические заболевания почек;
— изолированные синдромы: АГ (особенно в возрасте до 55 лет), микроальбуминурия/протеинурия, атеросклероз (сонных артерий, почечных артерий).
Многообразие состояний и заболеваний, при которых оправданным и эффективным является назначение ИАПФ, обусловлено: механизмом действия ИАПФ; точкой приложения ИАПФ.
Непосредственное ингибирование ангиотензинпревращающего фермента до настоящего времени, очевидно, остается более клинически привлекательным, чем назначение блокаторов рецепторов к ангиотензину или прямых ингибиторов ренина. Точка приложения ИАПФ (крупные или мелкие сосуды, циркулирующий или тканевый ангиотензин) определяет эффективность при столь широком круге заболеваний и синдромов.
Эти механизмы формируют классовоспецифический эффект всех ИАПФ. Вместе с тем способность ИАПФ ингибировать ангиотензин в просвете сосудов, сосудистой стенке и тканях — одна из видоспецифических особенностей конкретных ИАПФ. И, вероятно, причина состоит не только в гидро- и липофильности препарата. Известно, что каптоприл и лизиноприл, в меньшей мере эналаприл, — гидрофильные препараты, оказывающие быстрый антигипертензивный эффект, в то время как периндоприл, рамиприл, моноприл и моэксиприл — липофильные препараты, характеризующиеся выраженным органопротекторным действием. Однако результаты исследования DETAIL свидетельствуют, что эналаприл оказывает значимое и более предпочтительное, чем БРА, ренопротекторное действие при диабетической нефропатии (органопротекторный эффект гидрофильного ИАПФ), а периндоприл (липофильный ИАПФ) проявляет выраженное действие на центральную гемодинамику, формируя уникальный эффект снижения центрального аортального давления (ASCOT-CAFE). Сбалансированность фармакологических свойств отдельных ингибиторов АПФ нередко приводит к отсутствию гипотензии первой дозы (периндоприл, спираприл), что важно в начальном лечении или формировании его отдаленных результатов, например, уменьшения смертности при стабильной ИБС (рамиприл, периндоприл). Таким образом, особенности молекул отдельных ИАПФ дают им определенные преимущества вне классовоспецифических эффектов.
В большинстве случаев монотерапия ИАПФ не является достаточной. Согласно ESH/ESC (2007), признана удачной комбинация ИАПФ с диуретиками и/или антагонистами кальция. При сочетании с тиазидными диуретиками, повышающими уровень ренина, ИАПФ в определенной мере уменьшают этот нежелательный эффект. Вероятно, тиазидоподобные (индапамид, ксипамид) и петлевые (торасемид, фуросемид) диуретики предпочтительнее использовать в комбинации с ИАПФ. Примеров более эффективного применения комбинации ИАПФ + антагонист кальция немало: ASCOT (периндоприл + амлодипин), Nephros Study (фелодипин + рамиприл). Так, в Nephros Study при недиабетической ХБП продемонстрировано замедление снижения СКФ на 3,2 мл/мин при сочетанной терапии ИАПФ + антагонист кальция против 4,7 мл/мин в монотерапии рамиприлом, 4,8 мл/мин при монотерапии фелодипином и 10—12 мл/мин без лечения. Комбинация ИАПФ с препаратами, не относящимися к нефропротекторной группе (амлодипин — ASCOT, атенолол/нитрендипин — G.M. London, 2001), тем не менее приводит к снижению рисков развития нефатального инфаркта миокарда, фатальных коронарных событий, смертности и сопровождается снижением риска поражения почек.
Комбинация «ИАПФ + диуретик + антагонист кальция» показана при резистентной гипертензии. Рекомендации AHA (2008) предполагают при этом назначение одного из препаратов на ночь с целью уменьшения рисков неблагоприятных утренних сердечно-сосудистых событий. ИАПФ входят в комбинацию препаратов (вазодилататоры, диуретики и (3-блокаторы) при злокачественной гипертензии, в лечении гипертензивных кризов, а также в терапии АГ у детей и подростков. Небольшие дозы периндоприла составляют эффективную комбинацию с индапамидом в лечении АГ у людей пожилого возраста. Комбинированная терапия ИАПФ + диуретик (HYVET, 2008) или ИАПФ + антагонист кальция (ACCOMPLISH, ASCOT) является эффективной и безопасной у лиц пожилого возраста. Напротив, сочетание ИАПФ + БРА приводит к увеличению рисков и не имеет дополнительных преимуществ у пациентов высокого кардиоваскулярного риска старше 55 лет в связи с усугублением проявлений ишемической нефропатии (ONTARGET).
Помимо доказательных данных, полученных для отдельных представителей ИАПФ, видоспецифические эффекты обусловлены фармакокинетикой препаратов. В последнее время большое внимание стало уделяться состоянию функции почек как органа, определяющего клиренс медикаментозных средств. Почки имеют самую богатую в организме капиллярную сеть, т.е. являются великолепным плацдармом для действия ИАПФ.
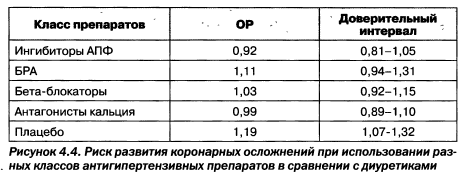
В связи с этим ИАПФ, обладающие преимущественным выведением через почки, формируют более выраженные клинические эффекты. Сегодня не вызывает сомнения, что почечный путь элиминации ИАПФ наделяет их выраженным свойством снижать АД и протеинурию. При этом ИАПФ остаются лучшими препаратами в защите от кардиоваскулярных событий (рис. 4.4).
Помимо инструкций к препаратам, в 2004 году ESC было предложено уменьшение дозы ИАПФ при достижении уровня креатинина крови более 221 мкмоль/л (СКФ < 50 мл/мин) или гиперкалиемии более 5,0 ммоль/л. При этом допускается повышение креатинина до 266 мкмоль/л и калия до 6 ммоль/л в начале терапии ИАПФ, что требует наблюдения. Для зофеноприла, спираприла и фозиноприла (а также не вошедших в эти рекомендации моэксиприла и трандолаприла) не требуется коррекции дозы при клиренсе креатинина 1030 мл/мин. Уменьшение дозы ИАПФ либо перевод на препарат с печеночным путем выведения, очевидно, может привести к уменьшению антигипертензивного и антипротеинурического эффектов, являющихся основой ренопротекции. Отметим, что для достижения максимальной ренопротекции (антисклеротического действия) считается необходимым титрование дозы ИАПФ до максимально переносимой — толерантной.
Считается, что кардиальные риски повышаются при уровне креатинина более 107 мкмоль/л у женщин и более 115 мкмоль/л у мужчин, что соответствует снижению скорости клубочковой фильтрации менее 90 мл/мин. Наличие АГ независимо от ее степени, сопровождающееся поражением почек как органа-мишени, соответствует 2-й стадии АГ. Таким образом, даже при первой степени АГ (140-159/90-99 мм рт.ст.) наличие микро- и протеинурии или повышения уровня креатинина позволяет диагностировать 2-ю стадию АГ. В назначении ИАПФ при сохранной функции почек, очевидно, предпочтение отдается препаратам, имеющим доказательную базу в предотвращении кардиоваскулярных событий, а по мере снижения функции почек — ИАПФ с двойным путем выведения.
При повышении креатинина крови более 133 мкмоль/л у мужчин и более 124 мкмоль/л у женщин следует говорить о снижении СКФ менее 60 мл/мин, что при длительности этого состояния более 3 месяцев указывает на наличие хронической болезни почек. Обратимость почечного процесса возможна в диапазоне СКФ 60—90 мл/мин, тогда вместо термина «ХБП» допустимо использовать обобщающее понятие «хроническое заболевание почек». Вероятно, сохранению функции почек в диапазоне СКФ 60—90 мл/мин могут способствовать высокие дозы ИАПФ или препараты с почечным путем выведения. В частности, такие подтверждения мы находим для эналаприла, рамиприла и нолипрела.
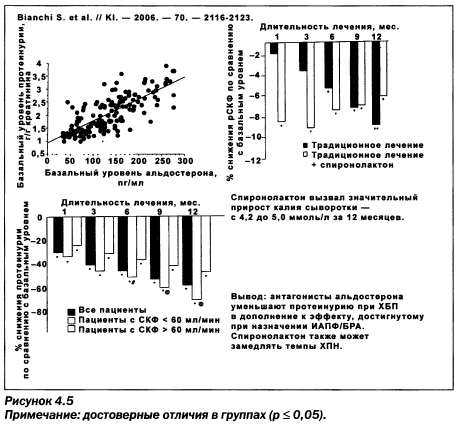
Как при этом поступать с риском гиперкалиемии, когда применение калийсберегающих диуретиков является показанным для усиления подавления ренин-альдостероновой системы? (рис. 4.5). Потенциально опасными следует считать дозы альдостерона свыше 25 мг/сут, рисковой группой — мужской пол старше 70 лет, наличие сахарного диабета. В этом случае оправданным является использование дозы альдостерона 6,25—12,5 мг/сут и, вероятно, эплеренона.
К настоящему времени не получено весомых доказательств, позволяющих отказаться от ИАПФ в пользу БРА или ПИР.
Действительно, в клинической практике отмечены похожие клинические свойства БРА и ИАПФ:
— эффективное снижение АД;
— улучшение течения хронической сердечной недостаточности;
— торможение прогрессирования диабетической нефропатии;
— уменьшение вероятности инсульта;
— снижение уровня альбуминурии;
— предупреждение новых случаев развития диабетической нефропатии;
— предупреждение фибрилляции предсердий.
Однако наибольший метаанализ, представленный в 2007 году, свидетельствует о существенном преимуществе ИАПФ перед БРА (рис. 4.6).

Прямое сравнение рамиприла и телмисартана в 5-летнем исследовании ONTARGET продемонстрировало увеличение неблагоприятных событий при назначении БРА:
— инфаркт миокарда +7 %;
— диабет+12 %;
— госпитализация по поводу СН +12 %;
— поражение почек и хронической почечной недостаточности, требующие диализа +9 %.
Также продемонстрировано уменьшение инсульта на 9 %. Таким образом, целесообразно придерживаться ранее известной формулы, что БРА назначаются при непереносимости ИАПФ.
Известно, что сочетание ИАПФ + БРА способствует более жесткому контролю АД и выраженному снижению протеинурии. Однако результаты исследования ONTARGET показали, что комбинацию ИАПФ + БРА следует очень осторожно использовать у пациентов в возрасте старше 55 лет из-за риска усугубления ишемической нефропатии. Наши наблюдения свидетельствуют, что такая комбинация может чаще приводить к развитию васкулитов мелких артерий носовой полости и появлению болей в ногах при скрытой венозной недостаточности, а также известному побочному действию — нарушению ощущения запахов и притуплению вкусового восприятия пищи.
ИАПФ могут также комбинироваться с селективными Р-блокаторами, определенными ESH/ESC для лечения СН (метопролола сукцинат, бисопролол, небиволол, карведилол) или метаболичесого синдрома (небиволол, карведилол). При прямом сравнении эналаприла и небиволола М.В. Шестаковой и соавт. получены даже некоторые преимущества у пациентов с микроальбуминурией. Сходные нефропротекторные способности известны у лерканидипина у пациентов с хронической почечной недостаточности (исследование ZAFRA) и симпатолитика моксонидина, продемонстрированные в прямом сравнении с нитрендипином (рис. 4.7, 4.8).
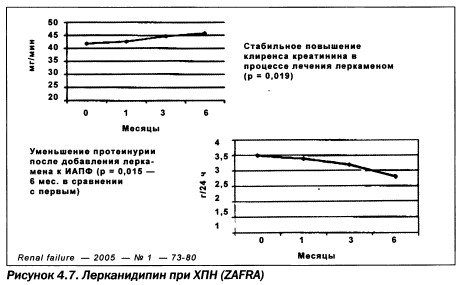
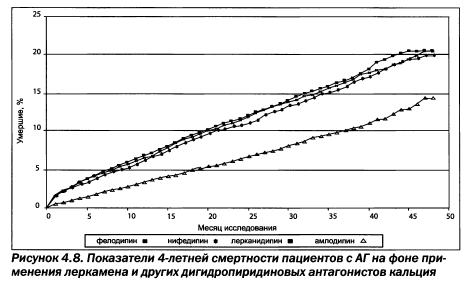
Монотерапия ИАПФ и, в большей мере, комбинированная терапия направлены на достижение целевого АД. Исследование НОТ (Hypertension Optimal Treatment), проводившееся в 26 странах в течение 5,5 года у 18 790 пациентов со средним возрастом 61,5 года при исходном диастолическом АД 100— 115мм рт.ст., позволило установить уровень целевого диастолического АД, при котором максимально снижается риск сердечнососудистых осложнений, — 83 мм рт.ст. Вместе с тем, современные данные свидетельствуют, что смертность пациентов при использовании леркандипина значительно меньше в сравнении с другими антагонистами кальция (рис. 4.8). Систолическое АД, очевидно, тоже имеет диапазон величин, характеризующихся минимальными кардиоваскулярными рисками.
Известно, что систолическое АД определяет U-образную зависимость неблагоприятных сердечно-сосудистых рисков, возрастающих при уменьшении САД менее 110 мм рт.ст. Таким образом, вероятно, рациональным является придерживаться целевого АД 100-125/60-75 мм рт.ст.
Исходя из вышеизложенного, можно сформулировать следующие практические рекомендации:
— рассматривая необходимость назначения антигипертензивной терапии, обратите внимание, имеют ли место признаки повреждения почек. О наличии хронического заболевания/ болезни почек наиболее часто свидетельствуют любая степень микроальбуминурии или протеинурии, повышение креатинина крови свыше 107 мкмоль/л у женщин и более 115 мкмоль/л у мужчин, снижение гемоглобина менее 135 г/л у мужчин и 120 г/л у женщин, диастолическое давление более 90 мм рт.ст.;
— наличие признаков поражения почек предполагает первоочередной выбор ИАПФ среди других антигипертензивных препаратов. При уровне СКФ более 60 мл/мин, вероятно, предпочтение следует отдавать ИАПФ с почечным путем выведения, медленно (в течение месяца) титруя дозу до максимально переносимой с трехкратным контролем уровня креатинина крови и калия каждые 2 недели. Целесообразным является вечерний или двукратный прием ИАПФ с целью снижения риска утренних кардиоваскулярных катастроф;
— эффективной для достижения целевого АД 100—125/60— 75 мм рт.ст. при наличии признаков поражения почек является комбинация ИАПФ с антагонистом кальция (фелодипином, лерканидипином) и/или тиазидоподобным диуретиком (индапамид, ксипамид), либо с периодическим приемом торасемида, которая может быть дополнена селективным вазодилатирующим Р-блокатором.
