Растворы электролитов.
Примерами растворов электролитов могут служить растворы щелочей, солей и неорганических кислот в воде, растворы ряда солей и жидком аммиаке и некоторых органических растворителях, например ацетонитриле.
Растворы электролитов являются ионными проводниками (проводниками второго рода). В них наблюдаются отклонения от законом Рауля и Вант-Гоффа. Например, согласно закона Рауля, при введении 0,1 моль вещества на 1000 г воды температура замерзания должна снижаться на 0,186 К, а фактически снижается на 0,318 К у NaCl и 0,52 К-у MgCl2. Вант-Гофф ввел поправочный коэффициент i, называемый изотоническим коэффициентом и позволяющий использовать это уравнение для любых разбавленных растворов:
РОСМ = iсRT
Изотонический коэффициент характеризует отклонение от законов идеальных растворов вследствие электролитической диссоциации электролитов.
7.3.1. Степень диссоциации электролитов.
В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации. Отношение числа молекул, диссоциированных на ионы, к общему числу молекул растворенного электролита называется степенью диссоциации а. По степени диссоциации в растворах все электролиты делятся на две группы. К первой относят электролиты, степень диссоциации которых в растворах равна единице и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах принадлежит подавляющее большинство солей, щелочей, в также некоторые кислоты.
Электролиты, степень диссоциации которых в растворах меньше единицы и уменьшается с ростом концентрации, называют слабыми электролитами. К ним относят воду, ряд кислот, основания р-, d- и f-элементов. Между этими двумя группами нет четкой границы, одно и то же вещество в одном растворителе проявляет свойства сильного, а в другом — слабого электролита. Например, хлорид лития и иодид натрия, имеющие ионную кристаллическую решетку,
при растворении в воде ведут себя как типичные сильные электролиты,
при растворении же в ацетоне или уксусной кислоте эти вещества
являются слабыми электролитами со степенью диссоциации в раствоpax меньше единицы.
7.3.2. Слабые электролиты. Константа диссоциации.
В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно, к нему может быть применен закон действующих масс. Так, для процесса диссоциации кислоты
НА ↔ Н+ + А –
константа равновесия КС равна

Константа равновесия для процесса диссоциации называется константой диссоциации КД. Например, константа диссоциации уксусной кислоты СН3СООН равна

Константа диссоциации зависит от природы диссоциирующего вещества и растворителя, а также от температурь и не зависит от концентрации раствора. С повышением температуры константа диссоциации обычно уменьшается, что в соответствии с принципом Ле Шателье свидетельствует об экзотермическим характере реакции.
Константа диссоциации указывает на прочность молекул в данном растворе. Чем меньше константа диссоциации в данном растворителе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы.
Степень диссоциации изменяется с концентрацией раствора. Рассмотрим зависимость степени диссоциации от концентрации слабого электролита на примере уксусной кислоты:
СН3СООН ↔ СН3СОО – + Н+
Принимая исходную концентрацию кислоты равной с, а степень диссоциации — а, получаем, что концентрация части кислоты, которая диссоциирована, будет равна ас. Так как при диссоциации одной молекулы кислоты образуется по одному иону Н+ и СН3СОО – , то их концентрации будут равны ас.
Концентрация кислоты, оставшейся в недиссоциированном состоянии, будет равна с – ас2 = с (1 — а). Подставив значения равновесных концентраций ионов и кислоты в уравнение (1), получим:
Уравнение (1) было получено Оствальдом и называется законом Оствальда. Если а « 1, то уравнение упрощается:
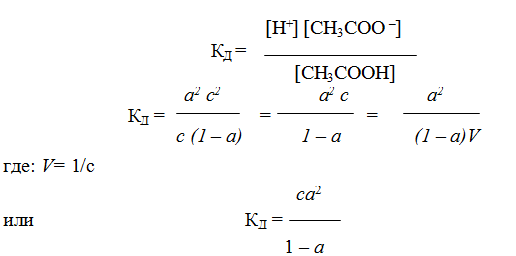

Уравнение (2а, 2б) называется законом разбавления Оствальда. Из него следует, что степень диссоциации уменьшается с увеличением концентрации слабого электролита. Аналогичное уравнение можно получить для слабого основания.
Многоосновные слабые кислоты и основания диссоциируют ступенчато, причем константа диссоциации по каждой последующей ступени всегда на несколько порядков ниже, чем по предыдущей.
7.3.3.Сильные электролиты.
Многие свойства растворов, такие, как осмотическое давление, температура кипения и замерзания, давление насыщенного пара, зависят как от концентрации раствора, т. е. от числа растворенных в нем частиц, так и от взаимного влияния этих частиц друг на друга. Степень взаимодействия частиц в растворе тем выше, чем больше плотность их зарядов и чем меньше среднее расстояние между ними.
В растворах слабых электролитов взаимодействие ионов друг с другом относительно невелико вследствие их незначительной концентрации. Сильные электролиты в растворах диссоциированы практически полностью. Поэтому в уравнении диссоциации электролита стрелка указывает только на прямой процесс, например:
NaCl → Na+ + С1 –
А12 (SO4)3 → 2А13+ + 3 SO42 –
В растворах сильных электролитов из-за полной их диссоциации концентрация ионов велика. Поэтому свойства таких растворов существенно зависят от степени взаимодействия входящих в их состав ионов как друг с другом, так и с полярными молекулами растворителя. Взаимодействие ионов в растворах сильных электролитов приводит к тому, что катионы и анионы испытывают взаимное притяжение, а ионы одного знака заряда будут отталкиваться друг от друга. Поэтому в растворе каждый произвольно выбранный ион окружен в среднем во времени преимущественно противоположно заряженными ионами, как, например, в ионных кристаллах. Однако энергия теплового движения ионов в жидких растворах и значительно выше, чем в кристаллах. Поэтому ионы, взаимодействующие с выбранным центральным ионом, располагаются вокруг него не в виде кристаллической решетки, а в виде сферы, которая, согласно П. Дюбая и Э. Хюккеля, называется ионной атмосферой. В состав ионной атмосферы входят катионы и анионы. Однако преобладают ионы, противоположные по знаку заряда центральному иону. Суммарный заряд ионной атмосферы равен по величине заряду центрального иона и противоположен ему по знаку. Все ионы в растворе равноправны, поэтому каждый из них является центральным ионом и одновременно входит в состав ионной атмосферы другого иона. За счет теплового движения ионы, входящие в состав ионной атмосферы, постоянно меняются местами с ионами, находящимися за ее пределами, т. е. ионная атмосфера имеет статистический характер.
Законы Рауля и Вант – Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов. По мере повышения концентрации растворенного вещества возрастают отклонения от законов идеальных растворов. Эти отклонения обусловлены различного рода взаимодействиями между частицами растворенного вещества, а также растворенного вещества и растворителя. Учет влияния на свойства растворов этих взаимодействий очень сложен. Поэтому было предложено сохранить для описания свойств растворов все общие закономерности, применимые к идеальным растворам, но вместо входящих в них концентраций компонентов ввести активности. Активность а связана с концентрацией следующим соотношением:
а = γс
где γ – коэффициент активности, который формально учитывает все виды взаимодействия частиц в данном растворе, приводящие к отклонению от свойств идеального раствора.

Коэффициенты активности зависят от природы растворителя и растворенного вещества, от концентрации раствора, а также от температуры (табл. 18).
Таблица 18. Коэффициенты активности некоторых электролитов в растворах при 298 К
| Концентрация, моль/1000г Н2О | Коэффициент активности для электролитов | ||||||
| NaCl | KCl | NaOH | KOH | HCl | H2SO4 | CaCl2 | |
| 0,001
0,01 0,1 0,5 1,0 2,0 5,0 |
0,965
0,874 0,778 0,681 0,657 0,668 0,874 |
0,966
0,901 0,769 0,651 0,607 0,576 — |
0,966
0,900 0,776 0,693 0,679 0,700 1,060 |
0,966
0,900 0,766 0,712 0,735 0,683 1,670 |
0,966
0,904 0,796 0,758 0,809 1,010 2,380 |
0,830
0,544 0,265 0,156 0,132 0,128 0,208 |
0,840
0,580 0,518 0,448 0,500 0,792 0,890 |
Как видно из табл. 18 коэффициенты активности меняются в очень широких пределах: в области разбавленных растворов они стремятся к единице, в то время как в области высококонцентрированных растворов они могут достигать единиц, десятков и даже сотен. В области разбавленных растворов (ниже 0,1 моль/л) коэффициенты активности зависят главным образом от концентрации и заряда ионов, присутствующих в растворе, и мало зависят от природы растворенных веществ. Эта закономерность известна в теории растворов иод названием правила ионной силы. Согласно этому правилу, ионы одинаковой зарядности, независимо от их природы, в разбавленных растворах с одинаковой ионной силой имеют равные коэффициенты активности. Ионной силой раствора называется полусумма произведений концентраций всех ионов, присутствующих в растворе, на квадрат их заряда:
I = 0,5 Σ cizi2 (3)
Правило ионной силы позволяет рассчитать коэффициенты активности отдельных ионов в разбавленных растворах. Коэффициенты активности ионов уменьшаются с увеличением ионной силы растворов и заряда ионов.
Коэффициенты активности позволяют, используя простейшие соотношения, быстро и легко рассчитать реальные свойства растворов. Для расчета константы равновесия любого обратимого процесса, протекающего в растворе, вместо концентраций используются соответствующие активности. Так, для обратимого процесса
AnBm ↔ nAm+ + mBn –
отражающего, например, диссоциацию слабого электролита в растворе в присутствии сильного электролита, константа равновесия будет равна:
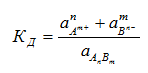
Итак, поведение растворов слабых электролитов описывается законом Оствальда, а разбавленных растворов сильных электролитов — моделью ионной атмосферы Дебая — Хюккеля. Однако общая теория растворов электролитов, охватывающая все виды растворов электролитов и весь диапазон концентраций, до сих пор не создана.
7.3.4. Ионное произведение воды. Водородный показатель.
Вода является слабым электролитом. Процесс диссоциации воды может быть записан с помощью уравнения:
Н2О + Н2О ↔ Н3О+ + ОН –
Этот процесс называется самоионизацией или автопротолизом.
Реакцию диссоциации воды часто записывают в более простом виде:
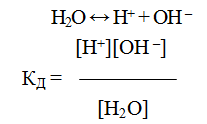
Учитывая, что при комнатной температуре на ионы распадается лишь одна из примерно 108 молекул воды, активности ионов в уравнении могут быть заменены их концентрациями, а концентрацию нераспавшихся молекул воды можно считать равной общей концентрации молекул воды. Концентрацию молекул можно рассчитать, разделив массу 1 л воды на массу ее моля:
1000/18 = 55,5 моль/л
Считая эту величину постоянной, можно уравнение (4) записать в виде:
[Н+][ОН –] = КД 55,5 = КВ (5)
где КВ — ионное произведение воды.
Так как, в соответствии с уравнением диссоциации, концентрации ионов Н+ и ОН – в воде одинаковы, их можно определить, зная ионное произведение воды. При 295 К ионное произведение воды равно 10 – 14 . Отсюда

Для характеристики кислотности (щелочности) среды введен специальный параметр — водородный показатель, или рН. Водородным показателем, или рН, называется взятый с обратным знаком десятичный логарифм активности ионов водорода в растворе:
pH = -lgaH+ (7)
Водородный показатель определяет характер реакции раствора.
Например, при 295 К она нейтральна; при рН = 7 (ан+ = 10–7 моль/л). При
рН < 7 (ан+ > 10–7 моль/л), реакция раствора кислая, при рН > 7
(ан+< 10–7 моль/л) – щелочная. По известным значениям активности ионов Н+ рассчитать можно активность ионов ОН – :
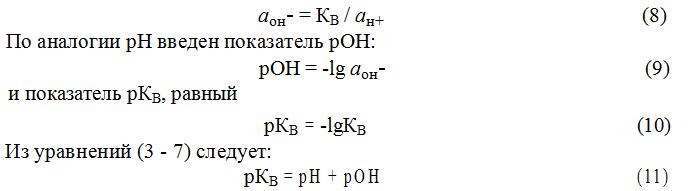
Таким образом, зная рОН, можно легко рассчитать рН, и наоборот, по известному значению рН легко определяется рОН. Водородный показатель имеет важное значение для понимания большинства процессов, протекающих в жидкой фазе, так как ионы Н+ и ОН- непосредственно участвуют во многих из этих процессов. Кроме того, эти ионы являются гомогенными катализаторами многих реакций. Величина рН может служить критерием силы кислоты или основания. В ряду кислот более сильной будет та, у которой при одинаковой молярной концентрации активность ионов Н+ выше (рН ниже). Так, рН 0,1 М растворов уксусной и соляной кислот будут 2,87 и 1,088 соответственно. Для оснований подобная зависимость имеет обратный характер.
Водородный показатель играет важную роль в жизнедеятельности
организма. Так, в норме рН сыворотки крови равен 7,40 ± 0,05, слез —
7,4 ± 0,1, слюны — 6,35 ÷ 6,85, желудочного сока — 0,9 ÷ 1,1. Отклонение рН от нормальных значений приводит к расстройству деятельности организма. Существенно влияние на урожайность оказывает рН почвы, на экологию водоема — рН воды.
При расчете рН слабых электролитов обычно принимают, что ан+ ≈ [Н+]. В этом случае
значения рН в этом случае находят по уравнению (11).

Пример 1. Определите концентрацию ионов ОН – в 0,01 М NH4OH. Рассчитайте рН этого раствора при 295 К.
Решение. Гидроксид аммония — слабый электролит и диссоциирует обратимо: NH4OH ↔ NH4+ + ОН –. В соответствии с законом Оствальда степень диссоциации а равна:

Расчет рН сильной кислоты проводят по уравнениям (7), (9) и (11). Для этого необходимо определить ионную силу по уравнению (3) и коэффициент активности ионов водорода или гидроксида по табл. 18.
Пример 2. Рассчитайте рН раствора, содержащего 0,01 моль/л НС1 и 0,01 моль/л СаС12.
Решение. Так как НС1 и СаС12 сильные электролиты, то они диссоциируют полностью:
НС1 → Н+ + С1– , CaCl2 → Са2+ + 2С1–
Соответственно рН раствора определяем по формуле:
рН = -1g ан+= -1gγн+[н+]
Для расчета коэффициента активности необходимо определить ионную силу раствора:
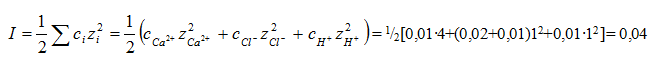
На основании табл. 18 путем интерполяции находим γн+ = 0,86, следовательно,
pH = -lg (0,86 ∙ 0,01) = 2,07
