Угольная кислота
Хлорангидрид угольной кислоты – фосген:
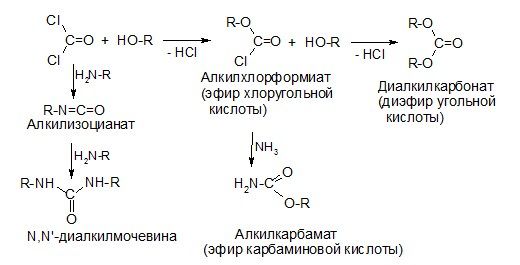
Как и все хлорангидриды, фосген обладает высокой ацилирующей способностью:
Амиды угольной кислоты
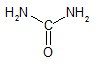
1) Карбаминовая кислота
Карбаминовая кислота – полуамид (кислый амид) угольной кислоты — неустойчива:
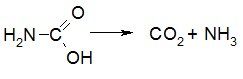
2) Мочевина
Мочевина – карбамид, диамид угольной кислоты:
Мочевина — важнейший конечный продукт белкового обмена у млекопитающих. Взрослый человек за сутки выделяет с мочой 20-30 г мочевины.
Синтез Вёлера (1828 г.).
Промышленный способ получения мочевины
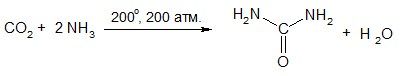
Мочевина — многотоннажный продукт химической промышленности (мировое производство более 100 млн. тонн в год). Широко применяется как азотное удобрение и для получения мочевиноформаль-дегидных смол. В химико-фармацевтической промышленности используется для получения барбитуратов.
Химические свойства мочевины
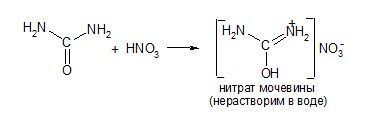
1) Основность:
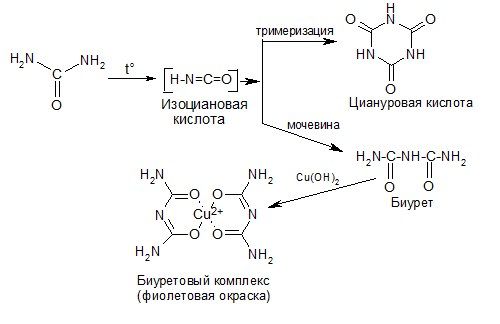
2) Разложение при нагревании:
3) Разложение под действием азотистой кислоты
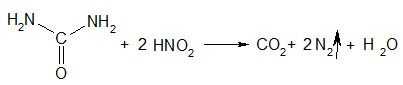
По количеству выделившегося азота можно количественно определить мочевину
(метод Ван-Сляйка).
3) Гуанидин

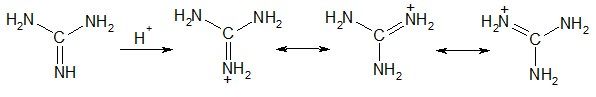
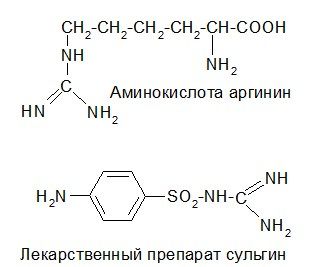
Гуанидин обладает необычно высокой основностью, сравнимой с основностью неорганических щелочей. Это связано с высокой степенью структурной симметрии его протонированной формы и максимальной делокализацией (+)-заряда:
Остатки гуанидина содержатся в некоторых природных соединениях и лекарственных веществах, например:
СЕРОСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Сера в составе органических соединений имеет различную степень окисления.
Тиолы и тиоэфиры
При замене галогена на SH-группу образуются тиолы:
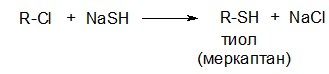
Тиолы обладают кислотностью более высокой, чем у спиртов:

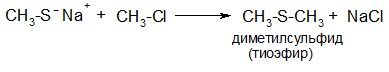
Тиолят-анионы – сильные нуклеофилы, при взаимодействии с галогенопроизводными они образуют тиоэфиры:
Атом серы в тиоэфирах – центр основности и нуклеофильности, при взаимодействии с галогенопроизводными тиоэфиры образуют соли триалкилтиония:
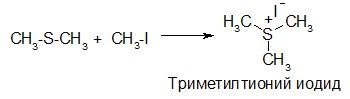
Тиолы в мягких условиях легко окисляются, образуя дисульфиды:
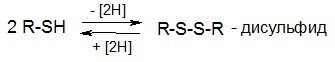
Направление реакции меняется при изменении
ОВ-потенциала среды: при высоком ОВ-потенциале – вправо, при низком ОВ-потенциале – влево. Взаимопревращения «тиол-дисульфид» играют большую роль в формировании структуры и регулировании функций природных белков.
Сульфоксиды и сульфоны
При окислении тиоэфиров атом серы присоединяет кислород, при этом последовательно образуются сульфоксиды и сульфоны:
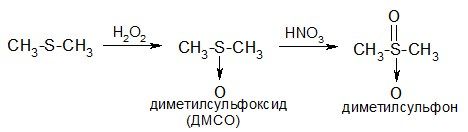
Диметилсульфоксид (ДМСО, димексид) – бесцветная жидкость с температурой кип. 189° С, растворим в воде и в органических растворителях. Широко применяется в органическом синтезе как полярный апротонный растворитель.
Благодаря своей способности быстро диффундировать через кожу, пронося растворенные в нем вещества, используется в фармации как компонент лекарственных мазей.
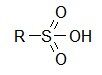
Сульфоновые кислоты (сульфокислоты)
Сульфоновыми кислотами (или сульфокислотами) называются соединения, содержащие сульфогруппу:
Способы получения сульфокислот
1) Алифатические сульфокислоты
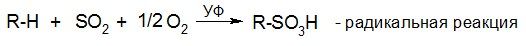
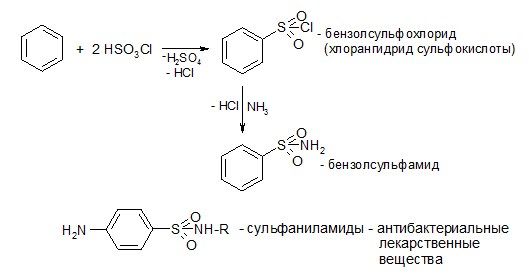
2) Ароматические сульфокислоты получаются сульфированием бензола и его производных (см. «Химические свойства аренов»)
Химические свойства сульфокислот
Сульфогруппа –
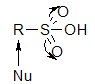
1) сильный электроноакцептор;
2) она обладает высокой кислотностью (сравнима с серной кислотой);
3) при нуклеофильной атаке по соседнему С-атому может замещаться на другие остатки.
4) Высокая полярность и способность к гидратации — причина растворимости сульфокислот в воде.
1) Кислотность
В водной среде сульфокислоты практически полностью ионизированы:
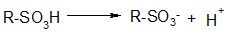
Со щелочами они образуют растворимые в воде соли:
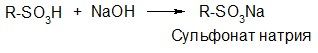
2) Замена сульфогруппы на другие остатки
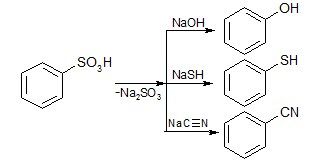
3) Образование производных по сульфогруппе