ПРОИЗВОДНЫЕ ПТЕРИДИНА И ИЗОАЛЛОКСАЗИНА
ПРОИЗВОДНЫЕ ПТЕРИДИНА
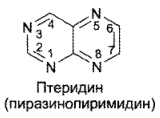
Производными птеридина являются витамины группы фолиевой кислоты и синтетические антивитамины (аминоптерин, аметоптерин, метотрексат). В основе химической структуры данных соединений лежит птеридиновое ядро, представляющее собой бициклическую конденсированную систему пиримидинового и пиразинового колец.
Птеридин — светло-желтый кристаллический порошок, хорошо растворимый в воде и органических растворителях. Введение гидроксильных или аминогрупп резко понижает растворимость из-за наличия внутри- и межмолекулярных водородных связей, возникающих между атомами водорода функциональных групп и гетероатомами азота:
Большинство природных птеридиновых соединений являются производными 2-амино-4-оксиптеридина или птерина.
Птеридины широко распространены в природе. Их наличием обусловлена окраска крыльев и глаз у насекомых, а также окраска кожи амфибий.
К этой же химической группе принадлежат и птериновые витамины, главным представителем которых является кислота фолиевая:
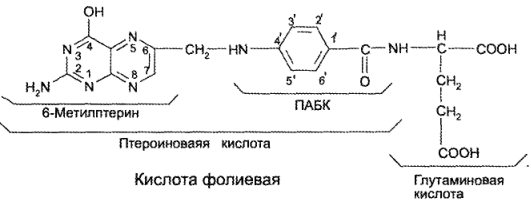
Кислота фолиевая — N-{n-[(2-амино-4-гидроксиокси-6-птериди- нил)метил)-амино}бензоил-L глутаминовая кислота — содержит фрагменты птеридина, n-аминобензойной кислоты и глутаминовой кислоты. К птероильной части молекулы может быть присоединено несколько остатков глутаминовой кислоты (до 7).
Наиболее активны коферментные формы:
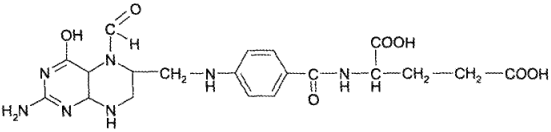
1) 5,6,7,8-тетрагидрофолиевая кислота;
2) фолиновая кислота — 5-формил-5,6,7,8-тетрагидрофолиевая кислота:
Недостаток фолиевой кислоты приводит к тяжелым нарушениям функций кроветворения, анемии.
Потребность организма взрослого человека в фолиевой кислоте составляет 500—700 мкг/сут. Основные естественные источники фолиевой кислоты такие же, как и других витаминов группы В (дрожжи, печень, капуста, морковь, шпинат и др.).
Физико-химические свойства и анализ качества
Физические свойства
Кислота фолиевая — кристаллический порошок желтого или желто-оранжевого цвета (за счет птеридиновой системы), без запаха. На свету разлагается, гигроскопична. Практически нерастворима в воде. Мало растворима в разведенной хлороводородной кислоте, легко растворима в растворах щелочей, аммиака, карбонатов. Разрушается под действием кислот, окислителей, восстановителей, света.
Имеет характерные спектры поглощения в УФ-, видимой и ИК- областях. В качестве одного из испытаний подлинности кислоты фолиевой ГФ регламентирует регистрацию спектра поглощения 0,001% раствора препарата в 0,1 М растворе натрия гидроксида в УФ-области (максимумы поглощения при 256, 283, 365 нм).
Плавится при температуре 360 °С с разложением.
Кислотно-основные свойства
Кислота фолиевая является амфолитом с преобладанием кислотных свойств. Обладая несколькими кислотными центрами, кислота фолиевая образует моно-, ди- и тризамещенные растворимые соли со щелочами, карбонатами, гидрокарбонатами и аммиаком, а также нерастворимые комплексные соединения с солями тяжелых металлов.
Гидролитическое расщепление и окисление
Кислота фолиевая легко гидролизуется и окисляется. Эти процессы могут идти одновременно. По методике ГФ, навеску препарата растворяют в 0,1 М растворе натрия гидроксида, добавляют эквивалентное количество 0,1 М раствора кислоты хлороводородной, определенное количество раствора калия перманганата и надевают. После охлаждения добавляют раствор водорода пероксида и фильтруют.
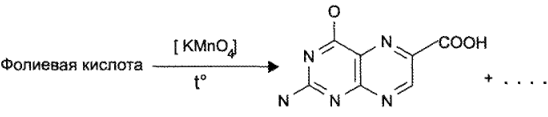
Образовавшаяся в результате гидролиза и окисления птерин-6- карбоновая кислота имеет голубую флюоресценцию в УФ-лучах.
Кислота фолиевая способна также в определенных условиях к реакции образования азокрасителя. Одна из методик лежит в основе ФЭК-количественного определения вещества.
Методы количественного определения
ГФ X приводит 2 методики количественного определения:
1) ФЭК;
2) полярографическую.
ФЭК-определение.
На 1-й стадии навеску лекарственного вешеетва в растворе аммиака концентрированного обрабатывают раствором калия перманганата для окислительного гидролиза с образованием птерин-6- карбоновой кислоты и n-аминобензоилглутаминовой кислоты:
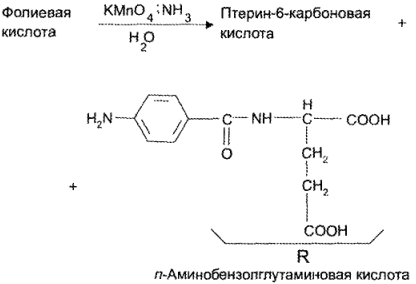
Затем добавляют 1% раствор натрия нитрита для образования соли диазония:
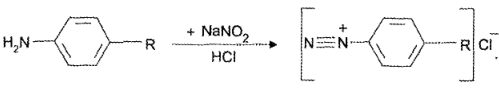
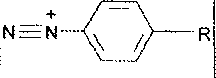
Образовавшийся избыток азотистой кислоты удаляют сульфаматом аммония:

Далее соль диазония сочетают N-(1-нафтил)-этилендиамином и измеряют оптическую плотность образовавшегося азокрасителя:
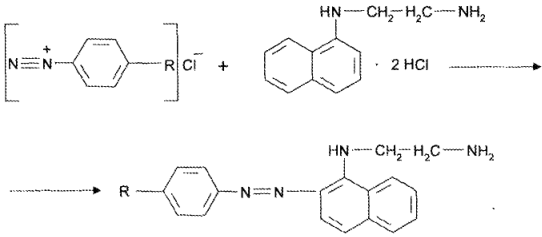
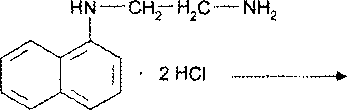
Для количественного определения применяют алкалиметрию, УФ-спектрофотометрию, флуориметрию.
Лекарственная форма кислоты фолиевой — таблетки по 0,001 г.
Антивитамины кислоты фолиевой
Химическая структура кислоты фолиевой специфична для проявления ангианемического биологического действия. Незначительные изменения в структуре приводят к исчезновению витаминной активности или приобретению антивитаминного эффекта.
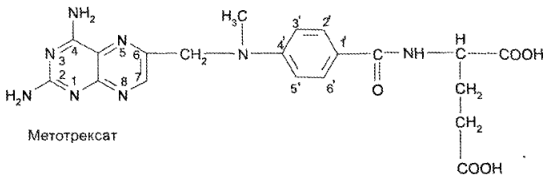
Один из метаболитов кислоты фолиевой — метотрексат — применяют в качестве противоопухолевого средства.
Препарат представляет собой смесь 4-дезокси-4-амино-N10-ме- тилфолиевой кислоты и простых птериновых соединений:
Физико-химические свойства и анализ качества
Метотрексат — желтый или желто-оранжевый порошок. Практически нерастворим в воде, 95% спирте, легко растворим в растворах щелочей и карбонатов щелочных металлов.
По химическим свойствам близок к кислоте фолиевой.
В качестве первого испытания подлинности регламентирована регистрация спектра поглощения в УФ-области 0,001% раствора препарата в 0,1 М растворе натрия гидроксида (1maх при 258; 303 и 370 нм).
Второе испытание подлинности проводят с помощью метода хроматографии на бумаге, используя в качестве вещества-свидетеля фолиевую кислоту (Rs метотрексата по отношению к фолиевой кислоте находится в пределах 1,8—2,1).
Количественное определение метотрексата проводят методом хро- матоспектрофотометрии. Сначала проводят хроматографию препарата на бумаге, используя в качестве подвижной фазы фосфатный буферный раствор. Затем зоны с метотрексатом и фолиевой кислотой, детектированные с помощью УФ-облучения хроматограммы, вырезают, экстрагируют 0,1М раствором натрия гидроксида и измеряют оптическую плотность фолиевой кислоты при 256 нм и метотрексата при 258 нм. Содержание метотрексата должно быть не менее 85%.
Лекарственные формы метотрексата: таблетки, покрытые оболочкой, по 0,0025 г, ампулы с лиофилизированным порошком по 0,005 г.
ПРОИЗВОДНЫЕ ИЗОАЛЛОКСАЗИНА
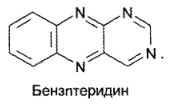
К данной группе относятся вещества природного происхождения с В2-витаминной активностью. В основе их химической структуры лежит конденсированная гетероциклическая система бензптеридина:
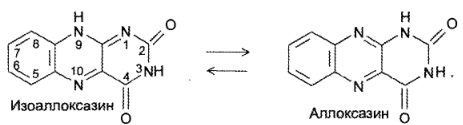
Аллоксазин и изоаллоксазин являются таутомерами кислородсодержащих производных бензптеридина:
Витамин В2 (рибофлавин) представляет собой 6,7-диметил-9-(D- I’-рибитил)-изоаллоксазин:
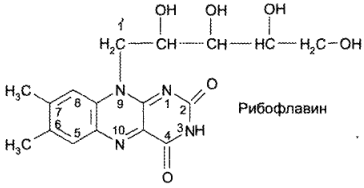
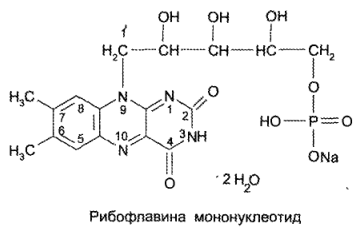
Кроме рибофлавина, в медицинской практике применяют его коферментную форму — рибофлавина мононуклеотид: 7,8-диметил- 10-(1-D-рибитил)-изоаллоксазин-5 -фосфат натрия, или рибофлавин-5 -монофосфат натрия:
Физические свойства
Рибофлавин и рибофлавина мононуклеотид — желто-оранжевые кристаллические порошки со слабым специфическим запахом. Мало
растворимы в воде, практически нерастворимы в спирте, эфире, хлороформе, растворимы в растворах щелочей. Водные растворы препаратов имеют желтовато-оранжевый цвет с интенсивной флюоресценцией в УФ-свете.
Являются лабильными химическими веществами, легко разлагаются на свету.
Рибофлавин и его производные обладают характерными спектрами поглощения в УФ-области и оптической активностью в щелочной или слабо щелочной среде (в кислой и нейтральной средах оптически неактивен). При определении оптической активности рибофлавина в присутствии 0,1 М спиртового раствора калия гидроксида величина удельного вращения регламентируется в пределах от -110 до -130°. В среде 0,1 М раствора натрия гидроксида величина удельного вращения составляет -170°. Если к щелочному раствору препарата добавить раствор кисло ты борной в количестве, необходимом для нейтрализации щелочи, поменяется направление оптической активности, а величина удельного вращения возрастет до +370°.
Химические свойства и анализ качества
Рибофлавин и его производные как полифункциональные вещества обладают определенными кислотно-основными и восстановительными свойствами, а также способностью к гидролитическому расщеплению.
Рибофлавин и его производные — амфотерные соединения. Кислотные свойства связаны главным образом с наличием имидной группы. Очень слабыми кислотными свойствами обладают и спиртовые гидроксильные группы рибитильного остатка. За счет амидного фрагмента молекулы рибофлавина образуют комплексные нерастворимые соединения с солями Ag+. . Со2+, Hg2+ и с солями других тяжелых металлов.
Основные свойства у рибофлавина выражены слабее кислотных, так как электронные пары у атомов N9 и N10 делокализованы. Как основание рибофлавин растворяется в ледяной уксусной кислоте и минеральных кислотах, образует осадки с общеалкалоидными осадительными реактивами.
Окислительно-восстановительные свойства рибофлавина и его производных связаны с наличием сопряженной изоаллоксазиновой системы. Восстановленис рибофлавина приводит к образованию бесцветного лейкорибофлавина, который может окисляться до характерно окрашенного рибофлавина:
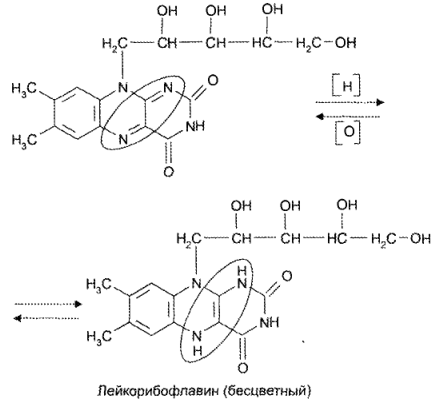
Химичекое строение рибофлавина обусловливает различные типы окисления в зависимости от условий проведения процесса. Рибофлавин окисляется при действии различных окислителей (калия перманганат, калия дихромат и др.).
При окислении препарата концентрированной Н2SО4 образуется продукт красного цвета.
При действии на препарат раствора перйодата натрия окисляется рибитильный фрагмент молекулы (реакция Малапрада). Данная реакция лежит в основе одной из методик количественного определения лекарственного вещества:
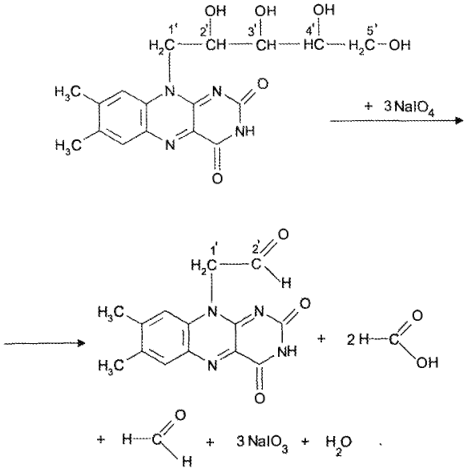
Выделившуюся в результате реакции кислоту муравьиную от- титровывают (потенциометрически или в присутствии индикатора) стандартным раствором натрия гидроксида.
По другой методике после действия перйодатом к раствору прибавляют натрия йодид и кислоту серную:
![]()
Выделившийся в результате реакции иод оттитровывают стандартным раствором натрия тиосульфата.
Другие свойства
Флюоресценция.
Разбавленный раствор рибофлавина в воде имеет яркую зеленую флюоресценцию при подсвечивании в УФ-свете, исчезающую при добавлении как раствора кислоты, так и раствора щелочи.
Добавление гидросульфита натрия приводит к исчезновению и флюоресценции, и окрашивания.
При действии кислоты и УФ-света образуется люмихром (производное изоаллоксазина), а при действии щелочи — люмифлавин (производное изоаллоксазина):
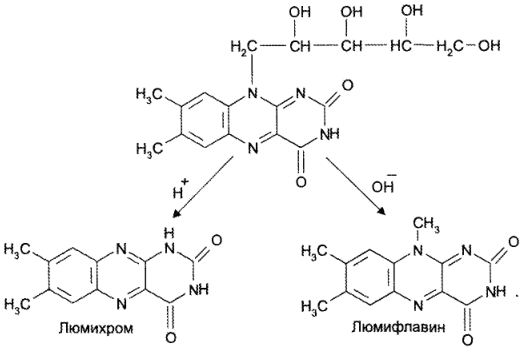
Количественное определение
Химическая структура рибофлавина позволяет применять для его количественного определения различные методики химического и физико-химического анализа:
- УФ-спектрофотометрию ( λтах = 267 нм);
- спектрофотометрию в видимой области (λтах — 444 нм);
- флуориметрические методики;
- перйодатное, окисление (реакция Малапрада);
- метод ацетилирования.
