Практические аспекты лечения хронической болезни почек
Назначая лечение в связи с хронической болезнью почек, следует помнить, что комплексный терапевтический подход позволяет остановить/затормозить прогрессирование потери функции почек.
Оптимальное лечение хронической болезни почек тормозит прогрессирование:
• ХБП может быть приостановлено в темпе своего развития
• Лечение на более ранних стадиях ХЗП/ХБП эффективнее
• Поэтому важно раннее выявление хронической болезни почек
Принимая во внимание, что сахарный диабет является самой частой причиной ХПН, антигипертензивные средства с диабетогенными свойствами не могут быть препаратами первого ряда в выборе лечения гипертензии у пациентов с ХБП. Уже на этапе развития инсулинорезистентности следует отдавать предпочтение ИАПФ и симпатолитикам (табл. 1.14). Не рекомендуется использование в стартовой терапии гипертензии у пациентов с диабетической нефропатией (3-блокаторов и тиазидных диуретиков. Через 4 года после начала исследования ALLHAT (Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial) у пациентов, которые получали тиазидоподобный диуретик, было документируемое повышение уровня глюкозы натощак на 0,17 ммоль/л, при приеме амлодипина — на 0,03 ммоль/л по сравнению с лечившимися лизиноприлом пациентами, у которых данный показатель снизился на 0,08 ммоль/л.
Таблица 1.14. Предпочтительные препараты при инсулинорезистентности (М.Б. Шестакова, 1999)

В последующем были получены убедительные данные об уменьшении риска развития диабета при назначении ИАПФ, БРА II, а карведилол и небиволол признаны безопасными препаратами в лечении метаболического синдрома, также моксонидин показан для лечения гиперактивности симпатической системы и метаболического синдрома. KDOQI, 2004, определены основные положения относительно лечения гипертензии у больных с ХБП с акцентом на применении ИАПФ и БРА II. Эти рекомендации предложены для пациентов с 1—4-й стадией ХБП, то есть со скоростью клубочковой фильтрации свыше 15 мл/мин (креатинин крови меньше 0,528 ммоль/л, согласно приказу МЗ Украины № 65/462 от 30.09.03 и креатинин крови меньше 0,44 ммоль/л для детей, согласно приказу МЗ Украины №365 от 20.07.05).
Для пациентов с любой стадией ХБП целевым уровнем АД является 130/80 мм рт.ст.
Все пациенты с ХБП должны рассматриваться как кандидаты для назначения фармакологической терапии с целью замедления прогрессирования почечной болезни.
Белок в моче в дополнение к повышенному АД является критерием оценки эффективности антигипертензивных препаратов. ИАПФ или БРАявляются препаратами, которым отдается предпочтение в лечении диабетической нефропатии и недиабетических поражений почек с протеинурией.
Диуретики должны применяться у большинства пациентов с ХБП (таким образом, большая часть таких больных нуждается в комбинированной терапии ИАПФ (БРА II) + диуретик). Подбор дополнительных препаратов, которые уменьшают кардиоваскулярный риск, для достижения целевого давления должен осуществляться согласно JNC-7 и существующим рекомендациям. Пациенты с ХБП относятся к группе высокого риска по частоте возникновения осложнений фармакологической терапии в сравнении с общей популяцией и, соответственно, должны чаще наблюдаться. Модификация образа жизни для уменьшения АД и риска кардиоваскулярной патологии должна рекомендоваться всем пациентам с ХБП.
Согласно этим рекомендациям, ХБП приравнивается к коронарной болезни сердца. Отмечено также, что побочные действия при применении препаратов, которые снижают холестерин, могут возникать из-за сниженной функции почек. Также определено, что лечение протеинурии может быть составляющей терапии дислипидемии, так как статины обладают антипротеинурическим эффектом.
К настоящему времени в нефрологии сформулирован ряд принципов, которых придерживаются в лечении пациентов с ХБП:
- Целевое АДприХБПменее 130/80 мм рт.ст. или САД < 98 мм рт.ст. (жесткий контроль — менее 125/75 мм рт.ст. и САД < 92 мм рт.ст.).
- Целевого уровня протеинурии нет, она должна быть минимально возможной или отсутствовать. Срок уменьшения протеинурии в два раза не должен, по возможности, превышать 6 месяцев (J. Redon, 2006).
- Достижение целевого уровня давления и ликвидация протеинурии являются независимыми задачами и предполагают использование всех возможных антигипертензивных средств при соблюдении определенной последовательности.
- Препараты выбора (как правило, в комбинации) в этой последовательности: ИАПФ, сартаны, диуретики/моксонидин, селективные антагонисты кальция, селективные р-блокаторы. При этом среди кальциевых блокаторов предпочтение отдается дилтиазему (верапамилу), фелодипину, лерканидипину, среди Р-блокаторов — карведилолу (блокатор а- и Р-рецепторов), бисопрололу и метопролола сукцинату и небивололу.
ИАПФ на сегодня признаны стартовым препаратом в лечении хронической болезни почек. Не получено убедительных данных о преимуществах БРА или прямых ингибиторов ренина, как и не признана целесообразной практика повсеместного назначения в нефрологии комбинации ИАПФ + БРА (см. раздел 4). Выбор конкретного ИАПФ определяется доказательной базой относительно снижения кардиоваскулярной смертности, ренопротекторной эффективности и возможности использования препарата в полной дозе согласно имеющейся у пациента СКФ.
Следует отметить, что различные ИАПФ неодинаково влияют на циркулирующее и тканевое содержание АПФ. При этом для длительной терапии наибольшее значение имеет органопротекторный эффект. Так, периндоприл имеет преимущества перед нифедипином (30—60 мг), амлодипином (5—10 мг), атенололом (50—100 мг), небивололом (5—10 мг) и телмисартаном (80— 160 мг) в реализации эндотелийзависимой вазодилатации. На примере трандолаприла (исследование PEACE, 2004) было показано, что возможности препарата в уменьшении смертности у больных с дисфункцией левого желудочка не свидетельствуют о таких же возможностях у больных без дисфункции левого желудочка (Н.Н. Безюк, 2004). Есть данные о том, что рамиприл и периндоприл имеют преимущества при ишемической болезни сердца без сердечной недостаточности и дисфункции левого желудочка. Механизмы действия ИАПФ определяются их плазменной и тканевой активностью. Так, в эксперименте показана более высокая ингибиция АПФ в сердце, легких, почках и грудной аорте, свойственная для моэксиприла, в сравнении с квинаприлом и эналаприлом (A. Torsello et al., 2003). Но проникновение моэксиприла в головной мозг, яички и почки является очень малым, что определяет его эффект в почках, аналогичный квинаприлу. В сердце моэксиприл и квинаприл снижают активность тканевого АПФ и повышают уровни простагландинов 12, то есть дополнительно еще и тормозят образование АПФ. Этот эффект нарушает адаптационную гипертрофию кардиомиоцитов, что в клинике приводит к гипертрофии желудочков сердца. Эти данные свидетельствуют о том, что индивидуальный подбор ИАПФ является важной составляющей лечения пациентов с хронической болезнью почек.
При назначении ИАПФ следует спросить пациента о предыдущем наличии ангиоэдемы, а в последующем динамично наблюдать за уровнем калия и креатинина сыворотки крови. Следует отметить, что дозу ИАПФ титруют до целевой или максимально переносимой. Чем выше переносимая доза ИАПФ, тем выше антипротеинурический и, вероятно, антисклеротический эффект. Следует помнить, что препараты с почечным путем выведения (периндоприл, лизиноприл, эналаприл) имеют более выраженный антигипертензивный (и, вероятно, антипротеинурический) эффект. Напротив, препараты с печеночным путем выведения (квадроприл, моэксиприл) более безопасны при значительном снижении СКФ.
Согласно данным доказательной медицины, ни один из ИАПФ не имеет преимуществ перед другими, однако более эффективны высокие дозы препаратов.
Другая группа препаратов — БРА II (сартаны) — также позиционируется для лечения хронической болезни почек (табл. 1.15). Данные ряда исследований свидетельствуют об эффективности сартанов в уменьшении левожелудочковой гипертрофии и снижении сердечно-сосудистой смерти, риска развития инфарктов и инсультов. При этом ренопротекторные свойства сартанов более характерны для высоких доз (см. раздел 4). Механизм действия БРА отличается от ИАПФ, и количество побочных эффектов у этой группы препаратов не отличается от плацебо (рис. 1.10). Однако кардиопротекторные свойства БРА уступают таковым ИАПФ, а стимуляция рецепторов 2-го типа не полностью изучена, что следует принимать во внимание в оценке рисков у пациентов с ХБП.
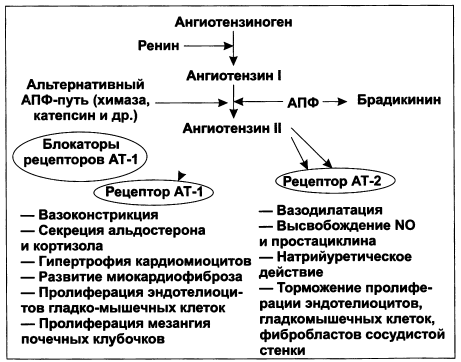
Рисунок 1.10
Таблица 1.15. Гипертензия при ХБП (антигипертензивное лечение пациентов с ХБП в Utrecht, 2004)
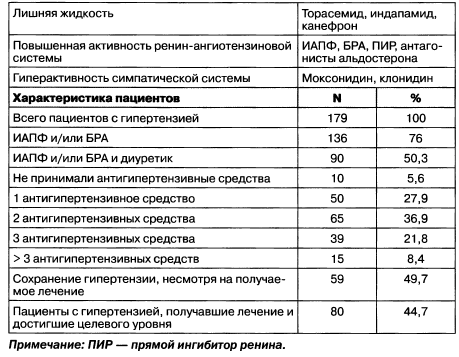
Необходимо отметить также, что эффективность БРА в снижении микроальбуминурии не зависит от полиморфизма ренин-ангаотензинового гена. Как и для ИАПФ, БРА свойственно внутригрупповое разнообразие, в первую очередь связанное с липофильностью/ водорастворимостью и степенью выведения почками. По мере прогрессирования ХБП доза сарганов с почечным вьшедением (кандесартан) и двойным вьшедением (ирбесартан, валсартан) уменьшается. Только доза телмисартана, на 98 % вьшодящегося печенью, и эпросартана (75 %) не корригируется в зависимости от стадии ХБП-ХПН.
Назначая препараты в лечении ХБП, следует помнить, что их взаимодействие может приводить к нежелательным побочным эффектам, например увеличению гиперурикемии и васкулитам (ИАПФ + БРА), а также принимать во внимание плейотропные свойства лекарственных средств, например антитромбоцитарные эффекты ИАПФ (эналаприл, квадроприл), синергизм в подавлении гиперактивности симпатической системы (теветен + моксонидин или БРА + спиронолактон/эплеренон).
Таким образом, основная комбинация препаратов при АД более 130/85 мм рт.ст. и ХБП сегодня выглядит так:
- антигипертензивная, антипролиферативная и антипротеинурическая терапия: ИАПФ (БРА и, возможно, прямые ингибиторы ренина), моксонидин, индапамид или ксипамид (или тиазидный диуретик 12,5—25 мг), или спиронолактон 25 мг (при отсутствии СД), или эплеренон, селективный (3-блокатор (небиволол, бисопролол), или карведилол (блокатор а-, Р-рецепторов), отдельные антагонисты кальция (фелодипин, лерканидипин);
- терапия анемии: железосодержащие препараты + эритропоэтинстимулирующий агент;
- снижение шлаков и фосфора (при необходимости), кальций-ОЗ, или фосфатбиндер, или цинакальцет, кетостерил, энтеросорбент;
- антитромбоцитарный препарат (аспирин, клопидогрель, тиклопедин);
- статины (при выраженной дислипидемии) или современные фенофибраты (при диабетической нефропатии).
При наличии терминальной ХПН, вероятно, целесообразным является применение препаратов с преимущественным выведением внепочечным путем, например, схема ЗМ: моэкс + микардис (теветен) + моксонидин.
Липидоснижающая терапия является составляющей защиты сосудов в коррекции АД и применяется для первичной и вторичной профилактики. В нефрологии доказательная база недостаточная; опираясь на кардиологические исследования возможно применение симвастатина, аторвастатина и розувастатина. Напомним, что исследование AURORA не показало каких-либо преимуществ розувастатина в дозе 10 мг в сравнении с плацебо в снижении комбинированной кардиоваскулярной точки, инфаркта и инсульта в течение 3,8 года применения у 396 пациентов с ХПН на диализе.
Среди диуретиков предпочтение отдается тиазидоподобным (индапамид, ксипамид) или петлевым (торасемид). Следует помнить, что торасемид имеет лучший в сравнении с фуросемидом профиль по кардиоваскулярным рискам (рис. 1.11). Однако при терминальной стадии ХПН мочегонный эффект фуросемида более выраженный. Доза индапамида 0,625 или 1,25 мг/сутки для длительного приема, ксипамида — от 10 до 80 мг/сутки (выше при меньшей СКФ!), торасемида — от 5 до 200 мг/сутки (при диабетической болезни почек), фуросемида—от Юдо 500 мг/сутки (при диабете). Большие дозы торасемида и фуросемида назначаются по 1—2 дня, затем 1—2 дня перерыв.
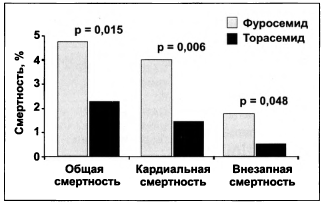
Рисунок 1.11. Уровень смертности при приеме торасемида и фуросемида (исследование TORIC)
В современной медицине антигипертензивную терапию проводят с учетом факторов риска, обеспечивая защиту конечного органа-мишени. В нефрологии это ренопротекция (для сохранения функции почек) и защита сердечно-сосудистой системы (для предотвращения преждевременной смерти).

Рисунок 1.12. Основные положения
Мероприятия по предотвращению поражения конечного органа предполагают (адаптировано по В. Dahlof, 2003; рис. 1.12—1.14):
— снижение АД;
— нормализацию АД;
— круглосуточный контроль АД, включая подъем АД утром;
— независимые от АД эффекты: синдром-специфические (например, альбуминурия), орган-специфические (например, гипертрофия левого желудочка, ХПН);
— уменьшение других факторов риска (например, снижение уровня холестерина или глюкозы); синергичные эффекты (например, прием комбинации «ИАПФ + моксонидин» в подавлении гиперактивности симпатической системы);
— комплексный подход (например, ИАПФ + БРА II + статин + аспирин + витамин D);
— назначение ИАПФ или БРА при ХБП даже без наличия гипертензии.


