Патофизиология печени. Функция печени, метаболизм лекарств и билирубина
Глава 7. Желтуха и нарушение функции печени
- Структура и функция печени
- Метаболизм лекарств
- Метаболизм билирубина
- Образование желчи и синдром холестаза
- Образование желчных камней
Структура и функция печени
Для правильного понимания гепатобилиарной патологии необходимо знание анатомии и ультраструктуры билиарного тракта печени (рис. 7.1). Гепатоциты расположены в один ряд, образуя плотную клеточную пластинку. Гепатоциты отделены от желчных капилляров базолатеральной мембраной, а от синусоидов — синусоидальной. Из-за разницы в строении синусоидальной мембраны и мембраны, обращенной к желчному капилляру, гепатоцит является полярной клеткой. Смежные пластинки гепатоцитов отделены друг от друга синусоидами, которые выстланы эндотелиальными клетками. Отростки эндотелиальных клеток образуют поры (фенестры), служащие для прямого контакта плазмы и гепатоцита с синусоидальной мембраной. В отличие от других типов эндотелия, синусоидальный эндотелий не имеет базальной мембраны. Это способствует переносу белковосвязанных веществ (билирубина и желчных кислот) из синусоидов в пространство Диссе и, в дальнейшем, в гепатоцит, а также ускоряет экскрецию липопротеинов из гепатоцита в синусоиды. В печени алкоголика в синусоидах снижается число фенестр, что приводит к нарушению обмена веществами между гепатоцитом и кровью синусоидов.
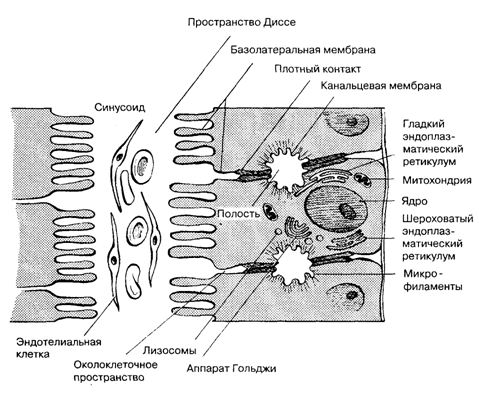
Рис. 7.1. Особенности структуры желчного секреторного аппарата.
Таким образом, функционально синусоидальная мембрана вовлечена в процесс двухстороннего переноса веществ. Транспортные процессы включают захват аминокислот, глюкозы, органических анионов, таких как желчные и жирные кислоты билирубина, для последующих рецептор-опосредованных внутриклеточных реакций. На синусоидальной мембране гепатоцита находятся специфичные транспортеры, в частности Na,K-АТФаза, и происходят процессы выделения альбумина, липопротеидов и факторов свертывания крови. В отличие от нее, основной функцией мембраны, обращенной в желчные капилляры, является секреция желчи, но всасывающая способность этой мембраны ограничена. На этой же части мембраны гепатоцитов расположены специфические ферменты: щелочная фосфатаза, лейцинаминопептидаза, гамма-глютамилтранспептидаза.
Из капилляров желчь попадает в терминальные желчные протоки, каналы Геринга, выстланные полигональными клетками «закрытой» связи с расположенными рядом гепатоцитами. Эти короткие протоки постепенно соединяются в более крупные протоки, затем в интралобулярные протоки, выстланные кубическим эпителием и имеющие диаметр 30—40 мкм. Из них желчь поступает в общий желчный проток и далее в желчный пузырь и двенадцатиперстную кишку.
Основные функции желчного пузыря:
- (1) концентрация и депонирование желчи между приемами пищи;
- (2) эвакуация желчи посредством сокращения гладкомышечной стенки желчного пузыря в ответ на стимуляцию холецистокинином;
- (3) поддержание гидростатического давления в желчных путях. Желчный пузырь обладает способностью десятикратно концентрировать желчь.
В результате этого образуется пузырная, изотоничная плазме желчь, но содержащая более высокие концентрации натрия, калия, желчных кислот, кальция и более низкие — хлоридов и бикарбонатов, чем печеночная желчь.
Особенностью архитектоники печени является образование гепатоцитами ацинусов, которые разделены на три функциональные зоны (рис. 7.2). В первой зоне гепатоциты прилежат к портальному тракту, следовательно, соприкасаются с синусоидами и содержат более высокие концентрации кислорода и питательных веществ. Наоборот, клетки третьей зоны, расположенные в околоцентральной области вокруг терминальной печеночной вены, содержат меньшее количество кислорода. Как следствие, ишемия может привести к некрозу гепатоцитов, расположенных в центральной зоне. Клетки третьей зоны активно участвуют в метаболизме и выведении лекарств, и, следовательно, гепатотоксичные препараты приводят к некрозу гепатоцитов этой зоны.
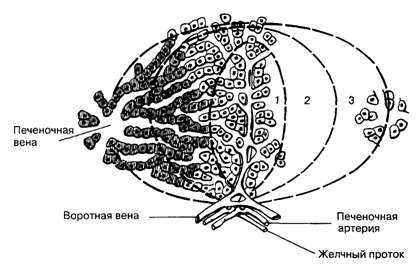
Рис. 7.2. Печеночный ацинус. Его ось формируется терминальной веточкой воротной вены, печеночной артерией, желчным протоком. Кровь вначале поступает в синусоиды в зону 1, далее — в зону 2, затем — в зону 3, после чего покидает ацинус через печеночную вену.
Метаболизм лекарств
Считается, что примерно 2 % всех случаев желтух у госпитализированных больных — лекарственного происхождения. Выделяют две фазы метаболизма лекарственных препаратов в печени. Первая представляет собой связанные с цитохромом Р450 окислительно-восстановительные реакции, которые модифицируют лекарства. Вторая фаза включает конъюгацию лекарств водорастворимыми веществами, такими как глюкуроновая кислота, сульфаты и глутатион. Препараты могут метаболизироваться последовательно в фазах 1 и 2 или только в фазе 2. При заболеваниях печени реакции фазы 1 почти целиком вытесняются реакциями фазы 2.
Цитохром Р450 принадлежит к семейству гемопротеинов и локализован в эндоплазматическом ретикулуме гепатоцитов в мембраносвязанной форме. Несмотря на обычно детоксицирующее действие цитохрома Р450, в процессе метаболизма лекарств в результате микросомального окисления образуются токсические компоненты, такие как свободные радикалы. Если они не подвергаются дальнейшему метаболизму, то могут связываться с клеточными белками, а также стимулировать перекисное окисление липидов мембран. Конъюгация с глутатионом ускоряется ферментами цитоплазмы, глутатион-S-трансферазами, которые играют важную роль в детоксикации электрофильных компонентов, образующихся при участии системы цитохрома Р450. Чаще всего к процессам биотрансформации в печени относятся глюкуронидация и сульфатация при помощи ферментов микросомальной уридиндифосфатглюкуронилтрансферазы и цитозольной сульфотрансферазы соответственно.
Воздействие лекарственных препаратов на ферменты, участвующие в метаболизме лекарств, стимулирует активность этих ферментов. Такая активация может быть клинически значимой, если в результате реакции ферменты индуцируют образование токсических метаболитов. Например, хроническое воздействие алкоголя приводит к активации цитохрома Р450, который окисляет ацетаминофен до токсических продуктов, чем объясняется повышенная чувствительность алкоголиков к токсическому воздействию ацетаминофена.
Метаболизм билирубина
Желтуха проявляется желтой окраской кожи, слизистых оболочек, мочи и полостных жидкостей при участии билирубина. Для правильной дифференциальной диагностики желтух необходимо знать фундаментальные физиологические основы образования и экскреции билирубина.
Билирубин образуется при разрушении гема (рис. 7.3): примерно 80 % — при разрушении гема эритроцитов, 20 % — при разрушении других гемопротеинов, таких как миоглобин, тканевые цитохромы. Микросомальный фермент — гемоксигеназа — превращает гем в биливердин, который под действием биливердинредуктазы превращается в билирубин. Образовавшийся в результате этих реакций неконъюгированный билирубин транспортируется кровью при помощи альбумина. Вытеснение лекарственными препаратами билирубина из связей с альбумином у новорожденных приводит к диффузии неконъюгированного билирубина через гематоэнцефалический барьер и к билирубиновой энцефалопатии или к истинной желтухе. Неконъюгированный билирубин поступает в печень, где из него образуется конъюгированный водорастворимый билирубиндиглюкуронид. Этот процесс облегчает экскрецию конъюгированного билирубина в желчь и катализируется микросомальным ферментом UDP-глюкуронилтрансферазой.

Рис. 7.3. Метаболизм билирубина. Превращение гема в биливердин под действием микросомальных оксидаз происходит преимущественно в ретикулоэндотелиальных клетках селезенки. В дальнейшем биливердин подвергается окислению цитозольной биливердинредуктазой с образованием билирубина. Неконъюгированный билирубин циркулирует в плазме, связанный, в основном, с альбумином. После диссоциации билирубин захватывается печенью, где он связывается с цитозольными белками, глутатион-S-трапсферазами. Глюкуронидизация билирубина катализируется микросомальной UDP-глюкуронилтрансферазой, что приводит к образованию моно- (БМГУ) и диглюкуронида билирубина (БДГУ). Конъюгированный билирубин экскретируется в желчь.
Таблица 7.1. Патофизиологическая классификация желтух
Повышение содержания несвязанного билирубина
- Повышенная выработка билирубина
- Гемолиз
- Неэффективный гемопоэз
- Нарушенный захват билирубина
- Синдром Жильбера
- Лекарства (рифампин, рентгеноконтрастное вещество, флависпидиновая кислота)
- Застойная сердечная недостаточность
- Хирургические или спонтанные портосистемные шунты
- Желтуха новорожденных
- Нарушение конъюгации билирубина
- Синдром Жильбера
- Синдром Криглера-Найяра
- Желтуха новорожденных
Повышение содержания связанного билирубина
- Нарушенная канальцевая экскреция
- Повреждение гепатоцитов (вирусный и алкогольный гепатит, цирроз печени)
- Внутрипеченочный холестаз (внутрипеченочный холестаз при беременности, TPN-индуцированная желтуха) Наследственные нарушения транспорта связанного билирубина (синдромы Дабина-Джонсона, Ротора)
- Повреждения внутрипеченочных желчных протоков
- Первичный билиарный цирроз
- Первичный склерозирующий холангит
- Отторжение печеночного трансплантата
- Реакция «трансплантат против хозяина»
- Опухоли
- Повреждения внепеченочных желчных протоков
- Холедохолитиаз
- Опухоли
- Первичный склерозирующий холангит
- Стриктуры желчных протоков
С точки зрения патофизиологии, желтуха классифицируется в зависимости от типа гипербилирубинемии: неконъюгированной или конъюгированной (табл. 7.1). Неконъюгированная гипербилирубинемия обусловлена общим увеличением образования билирубина, нарушением захвата его печенью и нарушением процесса конъюгации. При ускоренном разрушении эритроцитов, при неэффективном эритропоэзе, различных гемолитических состояниях усиливается процесс образования билирубина и происходит увеличение концентрации неконъюгированного билирубина в крови. Нарушение внутрипеченочного кровотока при сердечной недостаточности или при портокавальном шунтировании также нарушает доставку билирубина к гепатоцитам и приводит к небольшой неконъюгированной гипербилирубинемии. Нарушение захвата билирубина гепатоцитами в синусоидах может наблюдаться при синдроме Жильбера и в ответ на прием некоторых препаратов, например рифампицина. Снижение функции UDP-глюкуронилтрансферазы также может быть причиной нарушения конъюгации билирубина у новорожденных при синдроме Жильбера и синдроме Криглера-Найяра I и II типов. Активность UDP-глюкуронилтрансферазы может быть индуцирована фенобарбиталом, эффективно снижающим выраженность желтухи при синдроме Криглера-Найяра II типа.
Не только нарушение захвата билирубина, активность его конъюгации, но и нарушение экскреции в желчь служат важнейшими элементами изменений круговорота билирубина при «больших» заболеваниях печени. Поэтому конъюгированная гипербилирубинемия встречается при многих заболеваниях печени, включая заболевания, протекающие с острым и/или хроническим гепатоцеллюлярным и холестатическим процессом с обструкцией внепеченочных желчных путей; наследственными нарушениями экскреции билирубина при синдромах Дабина-Джонсона, Ротора.
Образование желчи и синдром холестаза
Желчь представляет собой изоосмотичную плазме жидкость, состоящую из воды, электролитов и органических веществ (желчных кислот, фосфолипидов, холестерина, билирубина). Желчные кислоты (или их соли) являются основным органическим компонентом желчи. Желчные кислоты поступают в желчь из двух источников: (1) первичные желчные кислоты (холевая и хенодезоксихолевая), которые синтезируются из холестерина в печени; (2) вторичные желчные кислоты (дезоксихолевая, литохолевая и урсодезоксихолевая) образуются под действием бактерий кишечника из первичных желчных кислот. Сами желчные кислоты состоят из двух важных компонентов, которые и определяют их физиологические и физико-химические свойства: (1) стероидного ядра с гидроксильными заместителями; (2) алифатической боковой цепи (рис. 7.4).
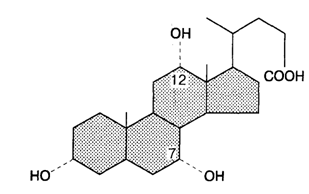
Рис. 7.4. Структура желчной кислоты. Желчные кислоты состоят из двух компонентов — ядра с гидроксильными окончаниями и алифатической боковой цепочкой. На рисунке холевая кислота показана как пример трехгидроксильной кислоты (3-, 7-, 12-ОН ). Другими примерами являются желчные кислоты, содержащие дезоксихолат, хенодезоксихолат и литохолат
У большинства млекопитающих первичные желчные кислоты содержат от трех до семи гидроксильных заместителей, число которых влияет на их водорастворимость (гидрофильность). Вскоре после образования первичные желчные кислоты подвергаются модификации в области терминальной карбоксильной группы. Это происходит во время печеночной фазы кишечно-печеночной циркуляции вторичных желчных кислот и конъюгации их с глицином или таурином. Наличие гидрофильного (гидроксильные компоненты и амидные связи алифатической боковой цепи) и гидрофобного (стероидное ядро) компонентов позволяет конъюгированным молекулам желчных кислот выступать в роли амфотерного соединения. Это дает им возможность формировать мицеллы (полимолекулярные агрегаты) выше критической мицеллярной концентрации. В свою очередь, молекулы желчных кислот способны растворять другие амфотерные вещества (холестерин, фосфолипиды) с образованием смешанных мицелл. Эта детергентоподобная роль желчных кислот важна для стабилизации физико-химического состояния желчи, переваривания и всасывания жиров.
Синтез желчных кислот из холестерина регулируется по механизму отрицательной обратной связи, хотя природа регуляции на молекулярном и биохимическом уровнях еще до конца не выяснена. Микросомальное 7-гидроксилирование холестерина является критическим этапом в синтезе желчных кислот. Хенодезоксихолиевая кислота, используемая для растворения камней желчного пузыря, подавляет синтез желчных кислот и тем самым способствует повышению уровня холестерина крови. При использовании же урсодезоксихолевой кислоты таких изменений не наблюдается даже при длительном лечении.
Образование желчи проходит как на синусоидальной, так и на канальцевой поверхности мембраны гепатоцитов и является как интрацеллюлярным, так и парацеллюлярным процессом. В отличие от гломерулярной фильтрации в почках, которая протекает пассивно под действием гидростатических сил, в процессе образования желчи происходит активный перенос органических и неорганических компонентов в просвет канальцев и пассивный транспорт воды. Таким образом, процессы секреции желчи сходны с процессами секреции в ацинусах поджелудочной железы, эпителии почечных канальцев. Образование канальцевой желчи можно разделить на два типа (рис. 7.5): (1) желчеобразование, зависимое от секреции желчных кислот, определяемое как отношение количества выделившейся в канальцы желчи к количеству секретируемых солей желчных кислот; (2) желчеобразование, независимое от секреции желчных кислот, которое может быть представлено как активная секреция неорганических электролитов и других веществ и отражено на графике в виде y-пересечения этой линии. Другими словами, связанное с секрецией кислот желчеобразование представляет собой скорость потока желчи, зависящей от наличия в желчных канальцах осмотически активных желчных солей, а несвязанное с секрецией кислот желчеобразование — при отсутствии солей желчных кислот. Отношение скорости образования желчи и образования солей желчных кислот имеет нелинейный характер при небольших количествах выделяемой желчи и не может соответствовать линейной зависимости, показанной на Рис. 7.5. Поэтому оба вида желчеобразования должны рассматриваться как взаимосвязанные показатели образования желчи.
Нарушение образования желчи называется холестазом. Последовательность возникающих патологических, физиологических и клинических проявлений холестаза зависит от вызвавшей его причины. При морфологическом исследовании материала гепатобиопсий желчь выявляется в канальцах перицентральных гепатоцитов, отмечается дилатация канальцев, а при исследовании ультраструктуры выявляется снижение количества микроворсинок. Холестаз можно определить как функциональный дефект образования желчи на уровне гепатоцита (внутрипеченочный холестаз), а также как органические или механические нарушения секреции и оттока желчи (внепеченочный холестаз). Наиболее частые причины внутри-и внепеченочного холестаза приведены в табл. 7.2. Существует несколько механизмов, играющих важную роль в патогенезе внутрипеченочного холестаза: нарушение и повреждение функции синусоидальной мембраны; нарушение функций внутриклеточных органелл гепатоцитов; повреждение и нарушение функций канальцевой мембраны. Таким образом, не существует единого механизма холестаза в различных клинических ситуациях, а многочисленность механизмов может приводить к различным расстройствам. Клинически холестаз характеризуется повышением в крови уровня многих веществ, включая билирубин, соли желчных кислот, холестерин, которые в норме секретируются в желчь. При биохимическом анализе крови при холестазе наблюдается непропорциональное повышение активности щелочной фосфатазы и концентрации билирубина параллельно с изменениями уровня аминотрансфераз, о которых речь пойдет ниже.
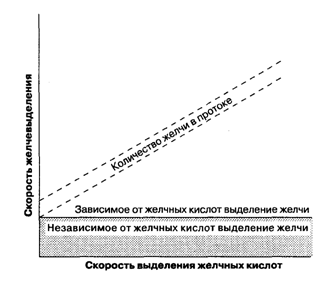
Рис. 7.5. Схематичное представление компонентов выделения желчи. Желчеобразование, связанное с секрецией желчных кислот, желчеобразование, независимое от секреции желчных кислот.
Таблица 7 — 2. Дифференциальная диагностика при холестатическом синдроме
| Внутрипеченочный | Внепеченочный |
| Острое повреждение печеночных клеток | Холедохолитиаз |
| Вирусный гепатит | Стриктуры желчных протоков |
| Алкогольная жировая дистрофия печени/гепатит | Склерозирующий холангит |
| Холангиокарцинома | |
| Лекарства | Карцинома поджелудочной железы |
| Хронические повреждения печеночных клеток | Панкреатит (острый, хронический) |
| Преампулярная карцинома | |
| Первичный билиарный цирроз | Атрезия желчных протоков |
| Склерозирующий холангит | Кисты холедоха |
| Лекарства | Другие нарушения |
| Парентеральное питание | |
| Системная инфекция | |
| Состояние после операции | |
| Доброкачественные обратимые состояния | |
| Другие нарушения |
Образование желчных камней
Существует два главных вида желчных камней: холестериновые (в США около 80 % всех случаев) и пигментные (табл. 7.3). Пигментные камни, в свою очередь, подразделяются на два подтипа: черные и коричневые. Черные, или похожие на ягоды шелковицы, камни состоят в основном из билирубината кальция, их обычно находят в желчном пузыре. Коричневые, или землистого оттенка, камни преимущественно образуются в желчном протоке и содержат, помимо билирубината кальция, жирные кислоты, формирующиеся под действием бактериальных фосфолипаз из лецитинов желчи, что отражает их этиологию.
Нарушение состава желчи, образование агрегатов холестерина, дисфункция желчного пузыря служат факторами, способствующими формированию холестериновых камней. Нерастворимый в воде холестерин секретируется в просвет канальцев в виде фосфолипидных микровезикул, которые под действием желчных кислот превращаются в смешанные липидные мицеллы. В желчи, насыщенной холестерином, либо при снижении концентрации в ней желчных кислот происходит агрегация холестерина с образованием крупных многослойных структур, в которых моногидраты холестерина кристаллизуются и образуют ядро. Несмотря на то, что высокое содержание холестерина в желчи предрасполагает к образованию камней, все-таки важную роль играют факторы ингибирования агрегации и нуклеации холестерина. Примером тому могут служить больные с высоким содержанием холестерина, но без холестериновых камней в желчи.
Таблица 7.3. Классификация желчных камней
| Холестериновые | Пигментные | ||
| Черные | Коричневые | ||
| Локализация | Желчный пузырь, протоки | Желчный пузырь, протоки | Протоки |
| Состав | Холестерин | Билирубинат Са2+ | Билирубинат Са2+ и свободные жирные кислоты |
| Этиологические факторы | Возраст | Возраст | Возраст |
| Раса | Хронический гепатит | Хроническая билиарная инфекция | |
| Чаще у женщин | |||
| Ожирение | Цирроз | ||
| Быстрое либо длительное похудание | Стаз (застой) желчи | ||
| Заболевание терминальной части подвздошной кишки | |||
| Лекарства (оральные контрацептивы, клофибрат) | |||
С возрастом у больных увеличивается фактор риска образования холестериновых камней. Коренные жители Америки (индейцы) более склонны к образованию холестериновых камней, чем жители Кавказа, и в то же время у последних холестериновые камни встречаются чаще, чем у чернокожих и выходцев из Азии. Отношение числа женщин к числу мужчин, у которых обнаружены холестериновые камни, составляет 2:1, причем много рожавшие женщины имеют больший риск этого заболевания, чем нерожавшие. Ожирение сопровождается избыточной секрецией холестерина печенью, что может привести к образованию камней. При болезни Крона и резекции терминальной части подвздошной кишки снижается абсорбция и пул желчных кислот, что также предрасполагает к формированию холестериновых камней. Клофибрат, используемый при лечении гиперхолестеринемии, повышает выделение холестерина в желчь и, тем самым, увеличивает риск образования холестериновых камней. Кроме того, риск образования холестериновых камней повышается при лечебном применении эстрогенов и гормональных контрацептивов.
Существуют некоторые предполагаемые факторы риска образования пигментных камней. К ним относят: гемолитические состояния с образованием большого количества билирубина, поступающего в печень и выделяющегося в желчь; цирроз печени; пожилой возраст больного; паразитарные заболевания желчных путей; аномалии развития желчных путей, сопровождающиеся стазом желчи.
