Оценки риска при проведении эпидемиологических исследований
В последние годы в медицинской науке сформировалось качественно новое научно-практическое направление — доказательная медицина и приобрели дальнейшее развитие общегигиенические методы, которые связаны с выявлением и оценкой влияния факторов риска на возникновение и дальнейшее прогрессирование отрицательных изменений в состоянии здоровья человека как на индивидуальном так и на популяционном уровне. Формирование понятия “риск» в медицине связано с необходимостью отображения относительных и вероятных закономерностей жизнедеятельности организма при его взаимодействии с окружающим миром. Вероятность — это мера, которая дает количественную характеристику возможности возникновения явлений или получения результата. Вероятность колеблется от 0, если событие никогда не наступит в пределах конкретной системы, до 1, если оно наступит неизбежно. Эти крайние варианты развития событий жестко детерминированы.
Термин «риск» семантически происходит от греческих слов risikon, ridsa – круча, скала. В итальянском языке risiko – опасность, угроза; risikarе – маневрировать между скал. В французском языке risdоrе – угроза, рисковать (дословно: объезжать кручу, скалу).
С целью сравнения разных вероятностей возникновения любого состояния человека (заболевание и др.) используется метод оценки риска. Он основывается на сравнении шанса возникновения события за определенный период времени при определенных условиях с шансом его возникновения за тот же интервал времени при других условиях. По мнению ряда отечественных (Е.И. Гончарук, А.М. Сердюк, Ю.В. Вороненко и др.) и зарубежных (Гундаров И.А., Лисицин В.Ю.) ученых под фактором риска (риск-фактором, риском для здоровья) нужно понимать любой фактор, который повышает достоверность возникновения неблагоприятных последствий для здоровья.
Известно, что человек ежедневно сталкивается с огромным количеством разного вида потенциальных факторов риска. Главной задачей общей гигиены является их выявление, оценка и научно обоснованная разработка наиболее эффективных мероприятий с целью частичного или полного устранения определенных факторов риска, для которых это возможно, и осуществление комплекса мероприятий по минимизации до безопасно приемлемого уровня тех факторов риска, которыми общество способно управлять.
При проведении классификации риска в системе здравоохранения исходя из социально-гигиенической позиции целесообразно базироваться на классификациях “риска» или “факторов риска» (на индивидуальном и групповом уровнях) Г.И. Стегунина, 1975, Robbins, 1980, и С. Varkevisser, 1995.
При этом социально-гигиеническую классификацию рисков (опасности) целесообразно продолжить и поделить на два вида — естественные и неестественные. По видам естественные риски делятся на эндогенные (возраст, пол и т.п.) и экзогенные (флора, фауна и т.п.). По локализации риски (опасности) делятся на связанные с литосферой, атмосферой, гидросферой или космосом. Соответственно официальному стандарту риски ухудшения состояния здоровья (опасности) делятся на физические, химические, биологические и психофизиологические. По источникам возникновения они делятся на явления, объекты и процессы. По последствиям влияния риск-факторов на здоровье: утомление, заболевание, травма или смерть.
При изучении здоровья человека (группы людей) с позиции риска (опасности) выделяют следующие виды риска: индивидуальный, социальный, относительный и привнесенный, кумулятивный и дополнительный.
При оценке ухудшения состояния здоровья человека выделяют следующие виды риска: относительный, атрибутивный, атрибутивный популяционный и популяционная фракция атрибутивного риска.
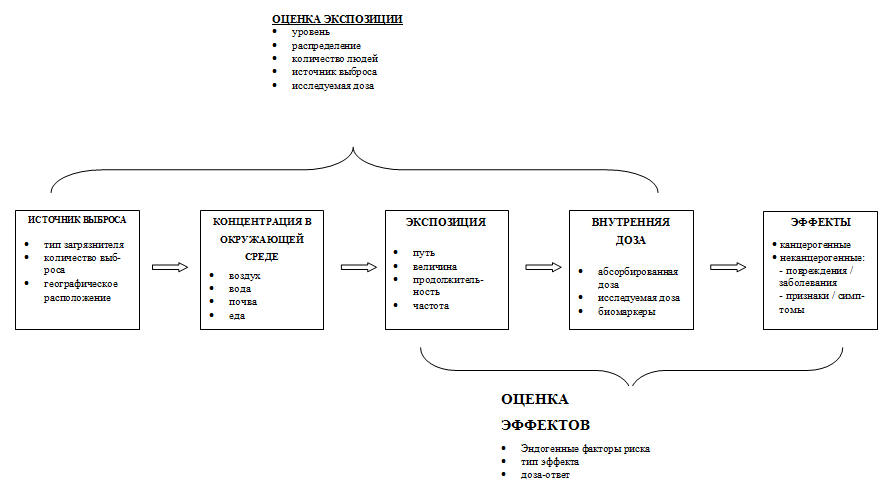
На сегодняшний день проведено иерархическое деление факторов риска в зависимости от характера влияния на индивидуум и группу людей, по продолжительности и др. Обобщенные данные этого исследования приведены на рис. 1.

Рис. 1. Иерархическое деление факторов риска
Для удобства использования и унификации нами создана классификация риска (опасности) в системе военного здравоохранения и организации медицинского обеспечения войск. В основу классификации было положено шесть наиболее важных характеристик рисков: 1) родовидовые (род, вид, происхождение, объект); 2) место реализации (периодичность, среда, сфера и очередность возникновения); 3) убытки от реализации (степень влияния на человека); 4) влияние на риск фактора времени (структура возникновения, характер влияния, учет фактора времени, продолжительность действия, частота влияния); 5) прогнозированность (степень прогнозированности, спектр действия, уровень потерь (убытков), степень устранения, степень компенсации, управляемость); 6) вид управленческого решения (уровень, время и тип принятия решений).
Основываясь на определении “риска» и “опасности», которые приведены выше, а также на опыте построения системных классификаций, можно предложить обобщающую классификацию риска и опасностей в системе здравоохранения вообще (табл. 1).
Таблица 1. Обобщающая классификация риска (опасностей) в системе здравоохранения
| Признаки классификации | Факторы |
|---|---|
| По роду | Естественные, техногенные, смешанные |
| По виду опасности | Физические, химические, биологические, информационно-семантические, комплексные |
| По происхождению | Космические, абиогенные, биогенные, биологические, биотические, природно-антропогенные, антропогенные, антропические |
| В зависимости от объекта | Индивидуальный, групповой (социальный, коллективный, этологический, социально-экономический, социально-психологический), видовой |
| По очередности возникновения | Первичный, вторичный |
| По периодичности возникновения | Периодический, непериодический |
| По среде возникновения | Атмосферный, водный, геоморфологический, эдафический, физиологический, генетический, популяционный, биоценотический, экосистемный, биосферный |
| По месту возникновения | Внешние и внутренние (оба вида риска имеют собственную большую классификацию) |
| По степени влияния на человека | Летальный, экстремальный, лимитирующий, беспокоящий, канцерогенный, мутагенный, тератогенный |
| По степени влияния на организацию медицинского обеспечения войск | Приемлемый, критический, катастрофический |
| По структуре возникновения | Простые, производные |
| По характеру влияния | Активные, пассивные |
| С учетом фактора времени | Статические и динамические |
| По продолжительности действия | Краткосрочные, среднесрочные, долгосрочные |
| По частоте влияния | Разовый, периодический, постоянный |
| По степени прогнозированности | Прогнозируемый, не прогнозируемый |
| По спектру действия | Выборочного действия, общего действия |
| По уровню потерь (убытков) | Минимальные, средние, оптимальные, максимальные, критические, катастрофические |
| По степени устранения | Те что устраняются полностью, … частично, … не устраняются вообще |
| По степени компенсации | Компенсированные, частично-компенсированные и некомпенсированные |
| По управляемости | Управляемые, неуправляемые |
| По уровню принятия решений | Макроэкономические и микроэкономические |
| По времени принятия решений | Опережающие, своевременные и запоздалые |
| По типу принятия решений | Рациональные (обоснованные), нерациональные (необоснованные), авантюрные (азартные) |
| По вероятности возникновения ситуации | Стохастические (на условиях вероятности возникновения), неопределенности (на условиях неопределенности) и конкурентные (на условиях конфликта) |
| По объективности | С объективной вероятностью, с субъективной вероятностью и с субъективно-объективной вероятностью |
| По уровню приемлемости | Безусловно приемлемый, приемлемый, неприемлемый |
| По степени правомерности | Правомерные, неправомерные |
| По восприятию людьми | Добровольные, принудительные |
Использование методологии оценки риска оказывает существенное влияние на качество эпидемиологических исследований. Оценка риска в профилактической медицине — это многоступенчатый процесс, нацеленный на выявление или прогноз вероятности неблагоприятного для здоровья результата влияния на человека вредных веществ, которые загрязняют среду помещения или производственную среду. Она опирается на разнообразную информацию об уровне этого загрязнения, токсичных свойствах вещества, его миграции и преобразованию в среде, пути влияния на человека, особенности человеческой популяции, которая испытывает влияние. В более узком (специальном) значении подразумевают конкретную методологию «оценки риска» («risk assessment»), принятую правительственным Агентством США по охране окружающей среды (US EPA) и рекомендованную международными организациями (ВООЗ, UNЕР).
В Украине концепцией риска в оценке влияния факторов окружающей среды практически не пользуются. Исследования, в основном, ограничиваются констатацией факта ухудшения состояния здоровья, т.е. идентификацией угрозы, которая возникает под влиянием действия вредных факторов окружающей среды. Если попробовать взглянуть на различия в методологии нормирования вредных факторов, которые существуют между нашей страной и другими государствами, то можно сделать вывод, что прогресс науки на пути к познанию сдерживался определенными социальными условиями.
В России правовой основой применения оценки риска является Постановление Главного государственного санитарного врача РФ и Главного государственного инспектора РФ по охране природы от 10.11.97 «Об использовании методологии оценки риска для управления качеством окружающей среды и здоровьем населения в Российской Федерации». Этим Постановлением было санкционировано использование методологии оценки риска для управления качеством окружающей среды и здоровьем населения, но вместе с тем, одновременно указана необходимость определенной адаптации ее к условиям России и намечены основные направления такой адаптации.
Система гигиенического регламентирования, принятая сегодня для обеспечения эффективной профилактики вредного влияния и гармонизации с общепринятыми в мировом сообществе представлениями, требует использования методов оценки риска. Практика оценки состояния среды и здоровья человека, которая сложилась в нашей стране в предыдущий период доминирования государственной собственности на средства производства и плановой государственной экономики, а также жесткой системы государственного санитарного надзора, существенно отличается от зарубежной системы контроля за соблюдением законодательных норм и правил. Это обязывает нас с достаточной осторожностью оказывать содействие переходу на новые формы деятельности, особенно в связи с будущим вступлением в Мировую организацию торговли.
Оценка риска играет решающую роль в оптимизации отбора приоритетных факторов для мониторинга, определении источников загрязнения окружающей среды, выборе точек и средств для контроля экспозиций, обосновании выбора индикаторных показателей для влияющих сред и экспонирующихся популяций.
Основные понятия
Риск – это осознанная опасность возникновения события с определенными в пространстве и времени нежелательными последствиями для здоровья человека. Риск — величина количественная. Он характеризуется или величинами от нуля (означает уверенность в том, что вред не будет нанесен никому) до единицы (означает уверенность в том, что вред будет нанесен всем), или как ожидаемая частота неблагоприятных эффектов, которые возникают в популяции от определенного вредного влияния. Первый способ выражения риска иногда трактуется как индивидуальный, второй — как популяционный риск.
Опасность (угроза) – это естественное, техногенное или социальное явление с прогнозируемыми, но неконтролируемыми угрозами возникновения нежелательных событий в определенный момент времени и в пределах данной территории, которые способны нанести вред здоровью людей, материальные убытки и др. Опасность — величина качественная.
Такая форма определения риска является универсальной потому, что позволяет объединить в одном показателе разнородные данные об объекте и субъекте опасности, а это, в дальнейшем, дает возможность получить интегральные оценки риска от неограниченного числа процессов любого генеза.
Источник опасности, или вредный фактор (в американских и международных документах – hazard), – химическое вещество, физический, биологический или социальный агент в окружающей среде, создающий потенциальную возможность риска для здоровья населения, которая реализуется лишь при определенных условиях экспозиции.
Экспозиция (exposure) – термин, который может либо просто констатировать влияние вредного фактора, либо определять количественную меру этого влияния на индивидуальный организм или на группу, популяцию с учетом величины последней.
Доза – основная мера экспозиции, характеризующая то количество вещества, которое влияет на организм при вдыхании загрязненного им воздуха, поглощении загрязненной им воды или пищи, контакте кожи с ним. В американских документах этому отвечает термин potential dose (потенциальная доза), в некоторых международных — intake, а относительно токсикологических экспериментов на животных — administered dose (предназначенная, введенная доза).
Другие понятия дозы, принятые американской методологией: applied dose (количество вещества на наружной границе анатомического барьера между внешней и внутренней средой организма), internal dose (внутренняя доза — количество вещества, которое всосалось во внутреннюю среду организма) и biologically effective dose (биологически эффективная доза — количество вещества, которое поступает в орган, с поражением которого связано развитие основных вредных эффектов экспозиции) представляют несомненный научный интерес, но из-за значительной неопределенности их расчетов в реальных исследованиях по оценке риска используются довольно редко.
Переносимая доза (в американских документах – reference dose (RfD), в международных – tolerable intake – ТI) – это доза, при действии которой на человеческую популяцию, включая ее наиболее чувствительные подгруппы, риск развития любых вредных эффектов ожидается на протяжении всего периода жизни.
При оценке риска, создаваемого только содержанием вредного вещества в воздухе, доза не рассчитывается, а устанавливается допустимая концентрация (reference concentration — Rfс).
Коэффициент опасности (hazard quotient) – отношение действующей дозы (или концентрации) к допустимой.
Ответ (response) – неблагоприятная реакция на определенную дозу вредного фактора, возникающая у части человеческой популяции или популяции лабораторных животных.
Идентификация источника (источников) опасности (hazard identification) – этап оценки риска, заключающийся в качественной характеристике возможных неблагоприятных эффектов влияния на организм тех вредных факторов, которые загрязняют окружающую среду в контролируемой зоне, городе, регионе и могут быть потенциальным источником опасности для здоровья проживающего здесь населения или какой-то его части.
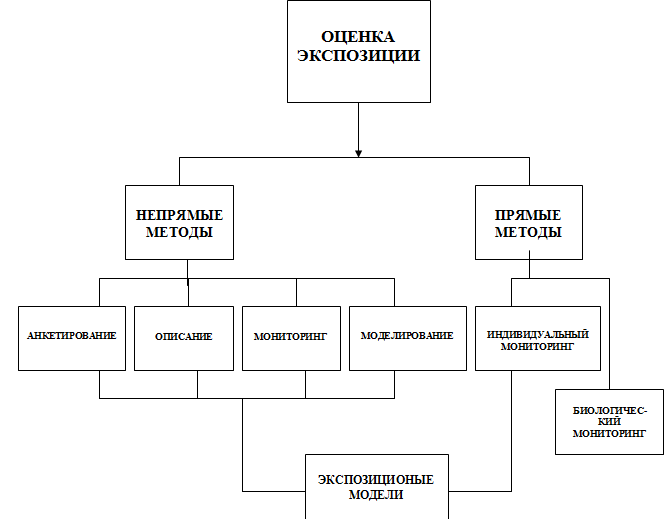
Оценка экспозиции – этап оценки риска, заключающийся в определении: какими путями, через какие компоненты окружающей среды, на каком количественном уровне (выраженном как концентрация в этом компоненте и/или как доза), в какое время, с какой периодичностью и общей продолжительностью происходит реальное или ожидаемое влияние конкретного вредного фактора на человеческую популяцию или ее часть с учетом ее численности.
Оценка зависимости «доза (концентрация) – ответ» – этап оценки риска, который состоит в установлении или прогнозировании связи между дозой или концентрацией вредного фактора и относительным числом индивидуумов с количественно определенным проявлением качественно определенного неблагоприятного эффекта.
Характеристика риска – завершающий этап оценки риска, на котором синтезируются данные предыдущих трех этапов с целью обоснования выводов в количественной, полуколичественной или описательной форме, которые должны быть переданы лицу или организации, принимающим решения в сфере экологической политики и управления здоровьем населения, или же субъекту хозяйственной деятельности, по заказу которого проводилась оценка риска.
Неопределенность – ориентировочная оценка границ, в пределах которых может находиться предвиденное истинное значение количественных параметров, использующихся на разных этапах оценки риска, а тем самым – и его завершающая характеристика. Однако часто указываются только причины неопределенности и ожидаемый уровень их влияния на итоговую оценку риска.
Управление риском (risk management) — система политических, технических, административных, законодательных и нормативных решений, направленных на ликвидацию или существенное уменьшение риска для здоровья населения, которые принимаются на основе результатов оценки риска с учетом ранжирования его источников, сравнительной опасности (для индивидуума и для населения в целом) возможных неблагоприятных эффектов, численности популяций, подвергающихся риску, а также всех тех факторов политики, экономики и общественного сознания, которые влияют на принятие решений в заданных условиях места и времени. Разработка разных сценариев управления риском допускает выбор тех, которые могут дать наибольший эффект при наименьших затратах и/или наибольшей реализованности.
Информация о риске (risk communication) заключается в ответственности эксперта или экспертного учреждения, проводящих оценку риска, за передачу развернутых результатов этой оценки лицам (органам), которые принимают решение, достоверном информировании о них общественных природоохранных движений и организаций, а также населения (через средства массовой информации), которым одновременно предлагаются те или другие варианты управления риском.
В эпидемиологических исследованиях по изучению здоровья чаще всего используются следующие понятия: относительный риск, атрибутивный риск, атрибутивный популяционный риск и популяционная фракция атрибутивного риска.
Относительный риск — отношение риска возникновения болезни или смерти среди тех, на кого действовали различные факторы к, риску среди неэкспонированных. Величина относительного риска позволяет измерить патогенную силу условий, с которыми ассоциируется фактор риска. Вместе с тем, она не дает представления относительно абсолютной величины распространенности заболеваний. С этой целью используется атрибутивный риск.
Атрибутивный риск – количество заболеваний или других патологических состояний, которые можно связать с действием фактора. Он рассчитывается путем вычитания количества патологических состояний, зафиксированных в контрольной группе от количества нарушений в опытной группе. В отличие от относительного риска, который измеряет силу отрицательного воздействия, атрибутивный риск измеряет его последствия, которые можно выразить количеством лиц, заболевших за определенный период в конкретной группе населения.
Относительный и атрибутивный риски разрешают сравнивать между собой вероятность заболевания в группах населения с наличием или отсутствием факторов риска. В то же время они не дают представления о патогенном значении фактора для популяции в целом. С этой целью используют показатель атрибутивного популяционного риска. Он рассчитывается путем произведения
(І2 — І1) ∙ р,
где (І2 — І1) — атрибутивный риск,
Р — количество лиц в популяции с конкретным фактором риска.
Популяционный атрибутивный риск (синонимы – популяционная фракция атрибутивного риска, атрибутивная популяционная фракция или этиологическая популяционная фракция) – это болезнь или другое патологическое состояние, ассоциирующиеся с действием фактора риска. Для оценки в популяции удельного веса заболеваний, связанных с конкретным фактором риска, используется популяционная фракция атрибутивного риска. Она рассчитывается как отношение популяционного атрибутивного риска к общему числу людей, заболевших данным заболеванием в конкретной популяции за аналогичный период времени. Его часто выражают в процентах и рассчитывают как:
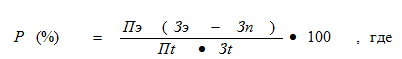
P – риск (в %),
Пэ — число экспонированных, т.е. испытавших влияние фактора риска;
Пt — число лиц в популяции;
Зэ — заболеваемость среди экспонированных;
Зn — заболеваемость среди неэкспонированных;
Зt — общая заболеваемость в популяции.
Общее описание методологии оценки риска
В развернутом виде она осуществляется в 4 этапа:
- идентификация источника опасности (вредного фактора);
- оценка экспозиции,
- оценка зависимости «доза — ответ»,
- характеристика риска.
Попытки игнорирования определенных этапов, как правило, приводят ко многим осложнениям. Поэтому считается, что методологической основой анализа риска в медико-экологических исследованиях является первый закон гигиены.
Связь между перечисленными этапами может быть как прямой, так и обратной, хотя каждый из них коротко описывается как определенная последовательность действий, выполняемых в соответствии с установленным алгоритмом. Следует отметить, что,
- во-первых, исходная методология US EPA по своей сути является рекомендательной, а не обязательной как в целом, так и в отдельных деталях;
- во-вторых, отличительной особенностью этой методологии является ее гибкость, возможность адаптации к конкретным задачам, к новой информации, возможность выбора между альтернативными подходами к оценке и т.п.;
- в-третьих, даже руководящие материалы US EPA по оценке риска периодически пересматриваются в связи с накопленным опытом и/или изменением взглядов специалистов этого Агентства.
Важнейшей задачей является овладение не только общей схемой оценки
риска, но и заложенными в этой методологии возможностями творческого
подхода.
Идентификация вредного фактора (факторов)
Первым шагом анализа риска является выявление наиболее серьезных источников опасности (факторов риска) и их ранжирование с целью определения реальной угрозы для человека и окружающей среды на основе построения карт риска; определение порогов устойчивости технических и экологических систем; использование методов математической статистики.
Как вытекает из приведенного выше определения, на этапе идентификации должна быть дана качественная оценка неблагоприятных для здоровья эффектов какого-то фактора (или факторов) у людей или животных.
Например, если установлено, что соединения свинца могут вызвать нарушение синтеза гемоглобина и поражение периферических нервов, вегетативной и центральной нервной системы, вызвать задержку психического развития у детей, подавлять женскую репродуктивную функцию и т.п., то свинец может быть идентифицирован как вредный для здоровья фактор. В этом примере идентификация опирается не только на экспериментальную, но и на большую клиническую и эпидемиологическую базу. Однако нередко идентификация вредного фактора основывается только на данных экспериментальной токсикологии. Если необходимой информации в доступных базах или в известной литературе нет, то такая идентификация требует проведения специальных токсикологических исследований. Как всякое такое исследование, оно связано с предшествующим изучением химических и физических свойств вещества и, в частности, его реакционной способности. Таким образом, этап идентификации опирается на теоретическую, экспериментальную и клиническую базу.
Важность этого этапа заключается в том, что только на его основе можно определить те эффекты вредного влияния на организм, в отношении к которым в дальнейшем будет оцениваться зависимость «доза — ответ» и формироваться окончательная характеристика риска. Вместе с тем, как правило, ставится задача выбрать из этих эффектов лимитирующие — тот или те, по которым оценка риска является наиболее актуальной, не только с учетом степени тяжести и/или индивидуальной и социальной значимости эффектов, но и того, который возможен при наиболее низких уровнях экспозиции. Другими словами, к решению этой важной задачи идентификации, которая требует учета как качественных, так и количественных характеристик, приходится возвращаться после анализа зависимостей «доза — ответ». Например, для того же свинца, исходя из этих критериев, критическим эффектом является снижение интеллектуального уровня и поведенческие отклонения от нормы у детей младшего возраста, для кадмия — поражение почечных канальцев.
С другой стороны, только при общем анализе токсикологической характеристики веществ и оцененных (на следующем этапе работы) уровней экспозиции может быть решена еще одна задача идентификации, а именно формирование короткого списка тех реальных для данной территории загрязнителей, для которых вообще имеет смысл переходить к этапу анализа зависимостей «доза — ответ» (самого сложного и требующего наиболее высокой квалификации эксперта). Обычная практика американских экспертов заключается в проведении полной оценки риска для всех зарегистрированных загрязнителей конкретной территории с их последующим ранжированием. Однако отечественные токсикологи считают, что эта практика не пригодна для условий России и Украины. Следует учитывать, что оценка риска необходима, прежде всего, в высоко индустриализованных зонах, где выбросы, стоки и отходы множества предприятий загрязняют окружающую среду десятками, а иногда и сотнями разных вредных веществ. В наших странах сегодня еще тяжело обеспечить адекватное качество оценки риска в широких масштабах. С другой стороны, для большей части этих загрязнителей существует система гигиенических нормативов (ПДК, ОБУВ). Поэтому в конкретных условиях те загрязнители, концентрации которых значительно ниже этих нормативов, могут быть исключены из дальнейшего рассмотрения, как не представляющие риска. В этой ситуации целесообразно сконцентрировать внимание, имеющиеся знания и возможные затраты на тех загрязнителях окружающей среды, которые представляют определенную опасность для здоровья населения и именно для них давать оценку риска (со следующим сравнением этих рисков).
Например, в России для оценки риска в промышленных городах Свердловской области были предложены следующие критерии отбора приоритетных загрязнителей («короткого списка»):
- Превышение средних концентраций вредного вещества соответствующей ПДК (а для веществ однонаправленного действия — отношение суммы их концентраций к соответствующим ПДК, превышающее 1,0) хотя бы в одном компоненте среды.
- Содержание вредного вещества на уровне, соизмеримом с соответствующими ПДК более чем в одном компоненте окружающей среды, если загрязнение почвы превышает фоновое и имеет место загрязнение продуктов питания местного производства. Как такие, что «не превышают», но «соизмеримы с ПДК» условно принимаются те концентрации, которые укладываются в диапазон 0,1-1,0 ПДК.
- Особенно неблагоприятный характер предвиденного вредного эффекта вещества (канцерогенность, влияние на репродуктивную функцию и/или на потомство, влияние на развитие нервной системы у детей).
К регионально приоритетным относятся те загрязнители окружающей среды, которые присутствуют в «коротких списках» не менее чем двух городов (территорий) региона. Внутри регионального «короткого списка» загрязнители ранжируются в зависимости от общей численности населения на этих территориях.
Представление о том, насколько сокращается объем работы на основе предложенного подхода, может дать пример города Верхняя Пишма (Свердловская область), в котором окружающая среда загрязняется 29 учтенными (за которыми осуществляется мониторинг) веществами. Как такие, что требуют оценки риска, здесь были отобраны только 9, из них: по критерию А — взвешенные частички, сернистый ангидрид, диоксид азота, аммиак; по критерию В — бенз(а)пирен; по критериям А и Б — медь; по критериям А, Б и В — свинец, мышьяк, кадмий.
Оценка экспозиций
На этом этапе должна быть дана оценка того, какими путями и через какую среду, на каком количественном уровне, в какое время и какой продолжительности будет реальное или ожидаемое вредное воздействие, а также оценка численности популяции, которая испытает или может испытать такое влияние.
Если по материалам мониторинга получены данные для оценки так называемого многосредового риска, связанного с загрязнением разных компонентов среды одним веществом и с разными путями экспозиции (например, ингаляционным, пероральным, через кожу), то для его оценки нужно определить суммарную дозу этого вещества, получаемую всеми путями (как минимум теми, о которых есть достаточная информация). Для этого необходимо произвести расчет дозы, полученной каждым путем отдельно. Кроме того, в некоторых случаях разные пути экспозиции ведут к поражению разных органов-мишеней, и полученные таким способом дозы должны рассматриваться отдельно. Если же возможна оценка риска от загрязнения только одного компонента среды (чаще всего воздуха), то расчет дозы вносит лишь дополнительные неопределенности в оценку уровня экспозиции, которая вполне может быть выражена в единицах концентрации загрязнителя в этом компоненте.
На рассмотренном этапе оценивается не только уровень экспозиции (т.е. концентрации вещества в среде), но и фактор времени. Именно это дает возможность опосредованно получить представление о получаемой дозе, даже если она не может быть определена непосредственно (например, с помощью химического анализа крови или других биосред). Для оценки риска, не связанного с профессией, доза рассчитывается на период жизни продолжительностью 70 лет (или для конкретного отрезка времени, например, для периода детства) как среднесуточная на 1 кг массы тела. Например, для среднесуточной дозы (ССД), получаемой ингаляционным или пероральным путем, расчет осуществляется по формуле:
ССД = (Кср х ОП х ПЭ] : (МТ х ПУ], где:
Кср – средняя (арифметическая) концентрация токсичного вещества в соответствующем компоненте среды;
ОП – объем потребления этого компонента (в тех же единицах объема или массы, к которым отнесена концентрация);
МТ – масса тела;
ПЭ и ПУ – соответственно суммарный период экспозиции и период усреднения (в днях).
Для расчета среднесуточной дозы за жизнь период усреднения равняется продолжительности жизни. Для этого показателя и многих других параметров экспозиции, которые учитываются при расчете дозы (в частности, для объема вдыхаемого воздуха, потребления воды, пищевых продуктов), методология US EPA предусматривает определение двух оценочных величин, одна из которых называется «центральная тенденция», а другая — «верхняя оценка».
«центральная тенденция» рассчитывается на основе средних или медианных интенсивностей экспозиции и усредненных оценок ее частоты, продолжительности, некоторых физиологических параметров (например, объема дыхания или потребления воды).
«верхняя оценка» (точнее «верхняя граница» — the upper bound) отвечает верхней границе 95% доверительного интервала интенсивности экспозиции (например, концентрации токсичного вещества в воздухе), а для используемых физиологических параметров и продолжительности экспозиции — значением 90-го или 95-го перцентиля. При наличии достаточной информации распределение экспозиции может быть оценено и с помощью других математических моделей (например, так называемой статистики Монте-Карло).
Экспозиция, которая отвечает «центральной тенденции», используется для оценки усредненного риска, который испытает население, а экспозиция, отвечающая «верхней оценке», рассматривается как основа прогноза наиболее возможного риска для отдельных членов этой популяции. Вместе с тем, если есть основания ожидать существенных расхождений и по «центральной тенденции» экспозиции между отдельными группами населения (субпопуляциями), то она рассчитывается для таких групп отдельно. Наиболее типичный пример этого — раздельная оценка экспозиции для детей и взрослых, для которых расхождения доз могут быть связаны с более высоким потреблением воздуха, воды и пищи в расчете на единицу массы тела, с отличием рационов питания, и, особенно, с высоким значением для детей дошкольного и младшего школьного возраста перорального пути экспозиции через руки, загрязненные почвой, которая содержит осевшие из воздуха токсичные вещества, или в связи с извращенными пищевыми вкусами (поедание почвы, снега, выкрашенной штукатурки и т.п.).
Численность экспонированной популяции не входит в расчет дозы, но является одним из важнейших факторов для решения вопроса о приоритетности природоохранных мероприятий, который возникает при использовании результатов оценки риска с целью «управления риском». Важной и непростой проблемой оказывается правомерность отнесения экспозиции (рассчитанной по данным мониторинга загрязнения, как правило, ограниченного количества точек) к более или менее широкой зоне, а тем самым — к определенной популяции. Важным фактором неопределенности может оказаться миграция населения (в частности, то, что значительная часть молодежи оставляет малые города), что приводит к фактическому сокращению продолжительности экспозиции.
В идеальном варианте оценка экспозиции действительно опирается на фактические данные мониторинга загрязнения разных компонентов окружающей среды (атмосферный воздух, воздух помещений, почва, питьевая вода, продукты питания). Следует отметить, что часто этот подход нельзя применять в связи с большими затратами. Кроме того, он не позволяет оценить связь загрязнения с конкретным источником (необходимое условие, если в рассматриваемом городе один и тот же загрязнитель выбрасывается из разных источников, а ставится вопрос об оценке риска, создаваемом только одним из них) и является недостаточным для прогнозирования будущей экспозиции, если данные реального мониторинга еще не могут быть получены. Поэтому во многих случаях используются разные математические модели рассеивания атмосферных выбросов, их оседания на почве, диффузии и разведения загрязнителей в грунтовых водах и/или открытых водоемах. Серьезной проблемой является не только выбор наиболее адекватной модели, но и надежность инвентаризации промышленных выбросов в атмосферу и промышленных стоков, что является исходной информацией для модельных расчетов концентраций вредных веществ в воздухе и воде.
Сегодня наблюдается нехватка моделей для расчета вредной экспозиции из атмосферы через почву (или прямо через продукты растениеводства и животноводства), как и вообще универсальных и надежных для использования миграционных моделей. Вместе с тем, даже такая неполная оценка экспозиции (и тем самым риска) может принести пользу.
Иногда используют также биокинетические математические модели, которые дают возможность оценить накопление токсичного вещества в организме человека (например, концентрации свинца в крови детей разного возраста) с учетом всех путей поступления.
Оценка зависимости «доза — ответ»
На этом этапе оценки риска осуществляется поиск количественных закономерностей, которые связывают получаемую дозу вещества с распространенностью того или другого неблагоприятного для здоровья эффекта, т.е. с вероятностью его развития. Словарь US EPA по оценке риска определяет термин зависимость «доза — ответ» как «связь между дозой и относительным количеством (в процентах) индивидуумов с количественно определенным проявлением конкретного эффекта в группе индивидуумов». В тех случаях, когда проводится оценка риска, обусловленного только загрязнением атмосферы, данный этап сводится к оценке зависимости «концентрация — ответ». В принципе этот же подход целиком можно применить и к оценке риска только при загрязнении питьевой воды, хотя в этом случае принято переводить концентрацию загрязнителя в его дозу (с учетом питьевого водопотребления).
Закономерности «доза (концентрация) — ответ» чаще всего (особенно, когда речь идет о редко встречающихся или новых загрязнителях) наблюдаются в токсикологических экспериментах. Как известно, экстраполяция их из группы животных на человеческую популяцию связана с большим количеством неопределенностей. Зависимости «доза — ответ», обоснованные эпидемиологическими данными, могут быть более надежными, но и они имеют свои источники неопределенности. Например, при построении некоторой эпидемиологической зависимости ответа от высоких уровней экспозиции (в основном производственной) ее экстраполяция на диапазон менее высоких уровней может оказаться ошибочной и зависеть от произвольного выбора математической модели. Имеющиеся данные о вариабельности экспозиции внутри изученной популяции и/или о разности экспозиций сравниваемых популяций часто оказываются недостаточными. Другими словами, определенный ответ — например, частота случаев рака, связывающаяся с усредненной оценкой экспозиции данной популяции, может быть обусловлена в основном той ее частью, которая испытала более высокую экспозицию, оставшуюся неизвестной исследователю. Зависимость, найденная для одной человеческой популяции, не обязательно подходит для другой, имеющей какие-то генетические или другие отличия и испытывающей влияние другого комплекса факторов, которые сопровождают исследуемую экспозицию, и т.п.
Тем не менее эпидемиологическое обоснование зависимости «доза — ответ» (особенно с использованием результатов матанализа нескольких эпидемиологических исследований) обоснованно признается более надежным, чем экспериментальное. Кроме того, для системных токсикантов только оно позволяет выражать «ответ» как явный вероятностный показатель риска для человека.
Эпидемиологические исследования, которые разрешают количественно соотнести «ответ» с экспозицией, даже в последнее десятилетие, характеризующееся интенсивным развитием так называемой экологической эпидемиологии (environmental epidemiology), проводятся не слишком часто в связи с организационными и финансовыми трудностями. Кроме того, во многих случаях такое исследование невозможно из-за недостаточно продолжительного периода экспозиции, малой численности экспонированной популяции, наличия слишком большого количества сопутствующих факторов риска, которые мешают эпидемиологическому анализу. Поэтому, как и в отечественной практике установления ПДК, в большинстве случаев рассмотренный этап оценки риска базируется на экспериментальных данных.
На этом этапе возникают проблемы с определением поглощенной дозы и ее индикаторов, т.е. биологических маркеров. В 1987 году Комитет по биологическим маркерам Национального научно-исследовательского Совета США определил биологические маркеры как индикаторы явлений или условий в биологических системах. Определение таких индикаторов входит в задачи специалистов занимающихся биомониторингом. Биологические маркеры могут быть индикаторами действия, эффекта или чувствительности.
Маркеры действия — это ксенобиотики или их метаболиты, большинство из которых концентрируются в моче, крови и других тканях, включая волосы и зубы.
Маркеры эффекта измеряют повреждение на уровне клеток или молекулы. Например, показатели нарушения функций мембран. Маркеры эффекта, в первую очередь, следует искать в органах и системах в зависимости от механизма действия ксенобиотика. Так, маркеры нефротоксичности используются для выявления групп риска при действии тяжелых металлов.
Маркеры чувствительности или склонности могут действовать на всех этапах развития повреждения после влияния фактора. Они связаны с генетически детерминированными особенностями метаболизма химических веществ.
Этап оценки зависимости «доза — ответ» в методологии US EPA разный для неканцерогенов и канцерогенов.
Для неканцерогенных токсичных веществ US EPA выходит из концепции пороговости действия и признает возможным установить так называемую референтную дозу (RfD) или референтную концентрацию (RfС), при действии которых на человеческую популяцию, включая ее чувствительные подгруппы, не создается риска развития любых вредных эффектов на протяжении всего периода жизни.
Термин «reference dose» означает «доза для ориентирования», «информационная доза» и прямо не подтверждает безопасность этой дозы. В русском и украинском языках повседневное употребление слова «референт» никак не соотносится с термином «референтная доза». Хотя «референтная доза» уже успела войти в профессиональный лексикон узкого круга лиц, которые занимаются оценкой риска в России, и даже в некоторые документы. Не следует также употреблять в этом контексте термин «допустимая доза или концентрация», поскольку в России и Украине они имеют вполне определенное юридическое содержание. Наиболее адекватный термин «tolerable intake» («переносимая доза»), используемый в документах ВООЗ, излагающих эту же методологию оценки риска.
RfD обычно выражается в мг/кг/день, RfС — в мг/м3.
Анализ имеющейся экспериментально-токсикологической информации о зависимости ответа от дозы сводится к определению наивысшего уровня дозы (экспозиции), при котором еще может быть довольно убедительно, с точки зрения эксперта по оценке риска, показано отсутствие статистически и биологически значимых вредных эффектов. Этот уровень называется NOAEL (no observed adverse effect level — уровень, при котором не наблюдаются неблагоприятные эффекты). В качестве критического (т.е. лимитирующего) эффекта принимается тот, по которому найдено наименьшее значение NOAEL. При отсутствии надежных данных для оценки этой величины может быть использован LOAEL (lowest observed adverse effect level) — минимальный уровень экспериментальной экспозиции, при которой еще наблюдался биологически и статистически значимый неблагоприятный эффект. Необходимо отметить, что в некоторых случаях LOAEL определяется на основе не экспериментальных, а «человеческих» данных (чаще всего относительно профессиональных экспозиций).
Очевидно принципиальное сходство этих понятий с понятиями «недействующей» и «пороговой» дозы или концентрации, принятыми в отечественной системе установления ПДК. Общим для обеих методологий недостатком является вероятностная неопределенность принятых величин. Стремясь преодолеть этот недостаток, специалисты US EPA в последние годы разрабатывают альтернативный подход: вероятностный анализ экспериментальных зависимостей «доза — ответ» с целью определения величин, которые обозначаются как benchmark dose (BMD) при пероральной экспозиции животных или benchmark concentration (ВМС) при ингаляционной экспозиции. (Benchmark — репер, отправная точка отсчета.) BMD/C определяется как нижняя доверительная граница дозы (концентрации), вызывающая избранный уровень ответа. Например, BMD может быть нижняя граница 95% доверительного интервала дозы, которая соответствует повышению на 1% частоты выявления определенного неблагоприятного показателя в сравнении с контрольной группой. Линейная модель принимается как основная для экстраполяции экспериментальных зависимостей на низкие уровни, но возможен выбор и другой модели. Выбор же предельного уровня ответа (benchmark response level), например 1%, довольно произвольный, но рекомендуется устанавливать его таким, чтобы BMD оказалась не намного ниже, чем LOAEL (иногда рекомендуется даже, чтобы она находилась между LOAEL и NOAEL). В принципе этот подход близкий к тому, который используется иногда в отечественной практике установления ПДК и называется нахождением вероятностного порогу.
Наиболее существенное расхождение между отечественной методологией и практикой обоснования ПДК, и наиболее распространенными случаями оценки риска неканцерогенных эффектов американскими экспертами, обнаруживается при ознакомлении с той фактической информацией, которая имеется в базе данных US EPA для обоснования NOAEL или BMD/C. Очень часто при этом не используются ( или не принимаются во внимание как неблагоприятные) те тонкие функциональные и биохимические сдвиги, на которых обычно основывается определение «порогов» отечественными токсикологами и гигиенистами. Поэтому вполне реально, что доза, установленная как NOAEL, рассматривалась бы для одного и того же вещества как действующая (надпороговая) или пороговая, с позиций отечественной методологии обоснования ПДК.
При переходе от NOAEL (или BMD/C) к RfD или RfC вводится целый ряд понижающих коэффициентов (которые по своей сути имеют то же назначение, что и принятые в отечественной гигиенической токсикологии так называемые коэффициенты запаса). Максимальные значения этих факторов неопределенности составляют:
10 — с учетом экстраполяции с животных на человека (для ингаляционной RfС — 3, если учтены так называемые дозиметрические межвидовые расхождения, т.е. расхождения кинетики отложения и резорбции в респираторных органах);
10 — с учетом особенно чувствительных людей;
10 или меньше — при наличии только кратковременных экспериментов;
10 — при неполной базе данных;
10 — если используется не NOAEL, a LOAEL.
При наличии информации о токсикокинетических и/или токсикодинамических свойствах вещества, делающей экстраполяцию с животных на человека более обоснованной, значения первых двух факторов может снижаться. При этом рекомендуется исходить из того, что фактор неопределенности межвидовых расхождений — это произведение фактора неопределенности расхождений токсикокинетики (равного 4,0) и фактора неопределенности расхождений токсикодинамики (равного 2,5). Например, если установлено отсутствие значимых расхождений токсикодинамики рассмотренного вещества у человека и у того вида лабораторных животных, в эксперименте на которых установлена зависимость «доза — ответ», но не могут быть исключены межвидовые расхождения токсикокинетики, при переходе к RfD соответствующий фактор неопределенности принимается равным не 10, а 2,5. Все эти предположения являются условными.
Если же эксперт усматривает в полученной информации любые дополнительные неопределенности, он может ввести еще так называемый модифицирующий фактор, который не превышает 10. Если произведение всех этих факторов превышает 10 000, то база данных признается непригодной для использования. Следует отметить, что и при величине этого суммарного делителя от 1000 до 10 000, оценка NOAEL или LOAEL с точностью превышающей десятые доли величин, становится невозможной. Всю эту процедуру установления предельных (для животных), а потом — переносимых (для человека) доз и концентраций, как и поиск токсикологической информации, на которой она основывается, может осуществлять самостоятельно каждый специалист по оценке риска, и именно так работают наиболее квалифицированные специалисты по такой оценке в США. Наряду этим, она часто основывается не только на использовании созданной и периодически возобновляемой в US EPA базы данных IRIS (и ряда других баз данных), но и на рекомендованных этим Агентством для многих веществ (приведенных в той же IRIS) величинах NOAEL и Rf/C.
В связи с отмеченным выше расхождением принципов экспериментально-токсикологической оценки предельных доз (концентраций) в США и в Украине, прямое использование «референтных» доз и концентраций, применяемых в США, возможно для решения задач оценки риска в Украине лишь как временное мероприятие. Следует также иметь в виду, что полным такой список обоснованных переносимых доз никогда не будет, и всегда возможно появление загрязнителя окружающей среды, для которого потребуется специальное обоснование переносимой дозы.
Зависимости «доза — ответ», найденные на основе анализа, а иногда и метанализа результатов эпидемиологических исследований, могут не ограничиваться упомянутым выше нахождением LOAEL. В идеале они выражаются как уравнения регрессии, которые связывают дозу (концентрацию) токсичного вещества с ожидаемой частотой того или другого нарушения здоровья, характерного для действия этого вещества, или с частотой госпитализации по поводу определенного заболевания, или со смертностью и т.п.. Подобный подход к этому этапу оценки риска наиболее адекватен для таких загрязнителей окружающей среды, как свинец, пыль (paniculate matters — РМ), сернистый ангидрид, но вполне возможно его распространение на другие факторы, если эксперт находит в литературе соответствующие эпидемиологические материалы и предлагает адекватный способ их использования.
При оценке зависимости «доза — ответ» для канцерогенов US EPA чаще всего (хотя и не всегда) рассматривает их действие как беспороговое. Такое размежевание между канцерогенными и неканцерогенными токсикантами не свойственно для отечественной методологии обоснования ПДК, которая исходит из того, что неопровержимый довод концепции беспороговости (как и концепции пороговости) канцерогенного действия в принципе невозможен. Можно определить только такой низкий уровень экспозиции, при котором установить статистически значимое повышение частоты возникновения опухолей, по сравнению со спонтанным уровнем, не удается ни эпидемиологу, ни экспериментатору, хотя всегда остается какая-то гипотетическая вероятность того, что на более многочисленных (практически невозможных) когортах людей или группах лабораторных животных такой ответ был бы установлен и на этом низком уровне. Этот уровень полностью отвечает американским определениям понятий NOAEL (для экспериментальных животных) или RfD (для людей), тем самым подчеркивается, что речь идет о дозах, не вызывающих заметного или статистически значимого эффекта. Таким образом, препятствием к определению указанных параметров для канцерогенных веществ является приближенность к парадигме беспороговости их действия. Кроме того, в современной науке даже приверженцами этой парадигмы она принимается только для тех веществ, канцерогенность которых является следствием их генотоксичности, а не для довольно большого количества негенотоксичних канцерогенов.
Именно поэтому проект нового Пособия US EPA по оценке риска канцерогенных веществ признает возможность пороговости для тех из них, канцерогенность которых не связана с мутагенностью (например, является вторичным следствием токсического действия, имеющего собственный порог).
По отношению к раку наибольшим доверием, естественно, пользуются зависимости «доза – ответ», обоснованные на эпидемиологических данных. Следует отметить, что количество таких зависимостей, используемых при оценке риска, крайне небольшое. Наилучшим примером является мышьяк, для которого обоснованы коэффициенты регрессии (факторы склонности) в (мг/кг/день)-1, которые отличаются в зависимости от локализации: 1,0 – для рака печени, 2,5 – для рака легких и мочевого пузыря, 0,86 – для рака почек, 1,5 – для рака кожи.
Оценка зависимости «доза — ответ» для канцерогенов, при отсутствии эпидемиологических материалов, сводится к использованию экспериментальных данных, которые рекомендуется получать на животных наиболее чувствительных видов или такого вида, о котором известно, что его реагирование на данный канцероген наиболее идентично реакции человеческого организма. При этом преимущество предоставляется тем путям влияния на животных, которые более всего отвечают условиям человеческой экспозиции. Однако, положительные результаты такого эксперимента, проводимого чаще всего на ограниченных группах лабораторных животных, реально могут быть получены только при действии высоких доз, которые дают высокую вероятность выхода опухолей, а система оценки риска предусматривает определение тех доз, при действии которых эта вероятность очень низкая. Поэтому проводится экстраполяция найденной зависимости «доза — ответ» на диапазон доз, которые значительно ниже реально использованных в эксперименте. Для такой экстраполяции используются разные математические модели (многоступенчатая, логистическая, модель одного удара, модель Вейбулла), которые дают неодинаковую оценку ответа в диапазоне низких доз. Каждая модель базируется на той или другой общей теории канцерогенеза, а не на данных, полученных при изучении действия конкретных химических веществ, и ни одна из них не может быть ни точно доказанная, ни убедительно опровергнута.
Раньше US EPA предоставляло преимущество так называемой линеаризованной многоступенчатой модели (linearized multistage model) как основе унифицированного подхода к экстраполяции из высоких доз на низкие:
P(d) = 1-exp{-[q(0) + q(1)d + q(2)d**2 + … + q(k)d**k]}, где
P(d) — вероятность развития рака при постоянном уровне дозы;
d, q(i) – константы;
k — число групп, которые получали разные дозы (d**) или число стадий, которые может проходить процесс канцерогенеза.
Основным параметром расчета риска для человека при этом служит так называемый фактор предрасположенности (slope factor), в качестве которого используется верхняя 95% доверительная граница уклона линейного участка кривой «доза – ответ». Фактор предрасположенности выражается в (мг/кг/день)-1 и является мерой риска от разовой дозы канцерогена. Например, если кто-то каждый день на протяжении всей жизни испытывал влияние канцерогена дозой 0,002 мг/кг, а фактор предрасположенности установлен на уровне 0,02 (мг/кг/день)-1, то дополнительный риск, получаемый умножением дозы на фактор предрасположенности, будет равен 4∙10-5. Другими словами, признается возможным развитие 4 дополнительных случаев рака на 100000 человек, которые испытывали экспозицию такого уровня.
При этом принимаются следующие принципиальные предположения:
- процессы канцерогенеза у человека и лабораторных животных фундаментально однообразные;
- вероятность развития рака от влияния какого-то канцерогена, действующего на протяжении жизни животных, такая же, как и у человека;
- возможны межвидовые расхождения токсикокинетики канцерогенных веществ, обуславливающие неодинаковое содержание их в органах-мишенях при эквивалентном дозировании, а также возможны межвидовые расхождения токсикодинамики, а именно: чувствительность этих органов к действию того же количества данного канцерогена может не приниматься во внимание, если только нет конкретной токсикокинетической и токсикодинамической информации для количественного учета этих расхождений.
Остается сложной проблема эквивалентности дозировки, связанная с необходимостью учета существенных расхождений массы и поверхности тела животных и человека. Рассмотрев теоретические и экспериментальные предпосылки к разным способам пересчета доз, используемых в эксперименте, на дозы для расчета канцерогенного риска у человека, специальная межведомственная группа американских специалистов остановилась на единой рекомендации — считать эквивалентными дозы, отнесенные к единице массы тела, возведенной в степень3/4, т.е. выраженные как мг/кг3/4/день.
Вместе с тем предложенные в 1996 г. новые подходы к анализу зависимости «доза — ответ» существенным образом отличаются от бывшей методологии US EPA:
- Как исходная точка для экстраполяции на кривой, описывающей экспериментальную зависимость «доза – ответ», выбирается нижняя 95% доверительная граница дозы, которая отвечает 10% вероятности развития рака – нижняя эффективная доза (НЭД), дающая 10% ответов (НЭД10).
- При достаточных теоретических основаниях возможности использования линейной зависимости в диапазоне малых доз (например, когда предполагается, что канцерогенность связана с действием данного вещества на ДНК), соответствующая НЭД10, точка на кривой, соединяется прямой с началом координат. Точка пересечения этой прямой с перпендикуляром, опущенным с точки на оси абсцисс, соответствующей оцениваемой человеческой дозе, имеет ординату, которая равняется искомому дополонительному риску рака у человека.
- Если возможность существования линейной зависимости недостаточна обоснована и имеются веские основания считать ее нелинейной (тем более тогда, когда может быть предположен порог канцерогенного действия), US EPA отказывается от применения любой нелинейной математической модели, признавая, что различные модели дают слишком отличающиеся оценки риска. В этих случаях экстраполяция вообще не проводится и риск для человека не может быть оценен как вероятность развития рака или как прогнозируемое количество дополнительных случаев рака в популяции. Вместо этого используется косвенный критерий величины риска: отношение НЭД10 к изученной для человека дозе — МОЭ (Margin of exposure – приблизительный перевод: «запас экспозиции»). Этот критерий аналогичен отношению NOAEL к изученной для человека дозе неканцерогенного токсичного вещества.
Таким образом, в целом новый методический документ US EPA по ряду позиций сближает подходы к оценке риска канцерогенов и «системных токсикантов», хотя бывшая методология еще довольно широко применяется как в самих США, так и в странах, которые позаимствовали ее.
Сближение подходов US EPA к анализу экспериментально устанавливаемых зависимостей «доза — ответ» для канцерогенов и неканцерогенов облегчает восприятие методологии оценки риска отечественными гигиенистами и токсикологами, которые при установлении ПДК как канцерогенных, так и неканцерогенных химических веществ выходят из наличия порога дозы, ниже которого доказательный неблагоприятный эффект отсутствует или, по крайней мере, практически не может быть выявлен.
Вместе с тем, чисто умозрительная парадигма беспороговости канцерогенного действия как теоретическая основа оценки риска сохраняется большинством западных экспертов для веществ, канцерогенность которых связывается с генотоксичностью. На ней и основана предлагаемая экстраполяция зависимости «доза — ответ» к нулевой точке, дающая возможность определить хоть какой-то конечный риск при любой малой экспозиции. Неминуемым следствием при этом является необходимость принятия решения: какая степень риска может быть принята как допустимая — решение, для принятия которого, пока что не существует научно обоснованных и общественно приемлемых критериев.
Для большинства практически значимых канцерогенных загрязнителей окружающей среды представляет интерес также оценка риска их неканцерогенных вредных эффектов. Поэтому для таких веществ, как никель, хром, мышьяк, кадмий и др., оценка зависимости «доза — ответ» дается как в отношении рака, так и в отношении неонкологических вредных эффектов. С другой стороны, западные эксперты часто прогнозируют (на основании экспериментальных данных) канцерогенный риск для населения в вероятностном выражении и для тех веществ, которые не являются четко установленными «человеческими» канцерогенами, что не одобряется отечественными токсикологами.
Характеристика риска («risk characterization»)
Характеристика риска — завершающий этап, целью которого является синтез всех результатов оценки риска и формулирование выводов, передаваемых лицу или организации, принимающей решение в сфере экологической политики.
На этом этапе оригинальная методология US EPA требует также подытожить и дать характеристики всех неопределенностей каждого из предыдущих этапов оценки риска, сообщив о них лицу, которое принимает управленческие решения, и общественность. Именно множество таких неопределенностей и недостаточная обоснованность предположений, принятых для их учета, вызывают наибольшую критику всей системы оценки риска, в том числе и в самих США. Как известно, практически те же неопределенности присущи и принятым отечественным величинам ПДК. Однако, после обсуждения узким кругом экспертов, эти величины устанавливаются как обязательные нормативы, а информация о неопределенностях не доводится к сведению пользователей этими нормативами. Очевидно, необходимо обобщить опыт реального использования оценок риска в наших условиях, прежде чем установить действительную необходимость, возможность, объем и порядок предоставления пользователю информации о неопределенностях таких оценок.
Форма характеристики риска может быть разной: от описательной до полуколичественной и даже количественной, но чаще всего используется комбинация этих подходов. Одним из количественных показателей, использующихся для косвенной характеристики неканцерогенного риска, является отношение оцененной суточной дозы вещества к RfD, которое называется коэффициентом опасности (hazard quotient — HQ). Только HQ > 1,0 рассматривается как свидетельство потенциального риска для здоровья. Другим показателем потенциальной вредности экспозиции является запас ее безопасности (МОЭ — margin of exposure), выражающийся отношением NOAEL к оцененной в тех же единицах дозе для человека. Если эта величина соизмерима с произведением всех факторов неопределенности или даже превышает его, необходимость управления риском считается неубедительной.
Если речь идет об оценке риска от загрязнения какого-то одного компонента среды, т.е. в случаях, когда нет необходимости расчета дозы и уровень экспозиции адекватно оценивается концентрацией, коэффициент опасности HQ = С : Rfс, причем вместо «референтной концентрации» может быть использована величина ПДК. Этот способ оценки экологической ситуации с гигиенических позиций давно известный в России и Украине. Расчет HQ для оценки «многосредового» риска допускает суммирование доз, полученных из разных сред разными путями, и сравнение такой суммарной дозы с переносимой.
При оценке риска, создаваемого несколькими химическими веществами, владеющими системной токсичностью, если есть основания допустить адитивность их действия (особенно, когда они вызывают тот же эффект, обусловленный сходными механизмами), US EPA рекомендует суммировать величины HQ, отвечающие каждому такому токсиканту (если нет расхождений эффекта при разных путях влияния). Этот способ оценки опасности комбинированного загрязнения также давно применяется отечественными гигиенистами, как сумма отношений фактических концентраций веществ к их ПДК. Следует иметь в виду, что адитивность доз является далеко не преобладающим типом комбинированного действия, особенно на низких уровнях экспозиции, в частности, для комбинированной токсичности металлов характерный более или менее выраженный антагонизм. Безусловно, могут встретиться и комбинации, обладающие действием выше адитивного (синергизм, потенциирование). Тем не менее во всех случаях, когда подобная информация о конкретных токсикантах отсутствует, оправданно рассчитывать «коэффициент опасности» как суммарный.
Вместе с тем, в любом случае коэффициентом опасности собственно риск для здоровья характеризуется не как вероятностный параметр соответственно его официальному определению, а лишь как косвенный критерий, который с многими предостережениями можно использовать для ранжирования рисков, но не для их абсолютной оценки.
Только зависимости «доза — ответ», основанные на эпидемиологических данных, позволяют дать такую оценку веществам, которые не обладают канцерогенностью для человека. В этом случае, путем умножения единичного риска (оценивающего на этапе анализа зависимости «доза — ответ» вероятность развития того или другого вредного эффекта на единицу экспозиции) на дозу, найденную на этапе оценки экспозиции, получают величину «индивидуального риска», т.е. вероятность развития этого эффекта у жителя исследуемой территории, а умножением этой вероятности на численность населения — величину «популяционного риска».
Например, единичный риск кадмиевой нефропатии равняется 55,9% на 1мг/кг/день, а среднесуточная доза кадмия для населения города Верхняя Пишма за счет всех путей экспозиции — 0,353057 мг/кг/день. Таким образом, индивидуальный риск 55,9 ∙ 0,353057=19,74 %. При численности населения 53 тыс. человек это означает, что сохранение того же уровня экспозиции на протяжении всей жизни приведет к развитию 10,5 тыс. случаев нефропатии.
Характеристика риска развития рака может осуществляться либо путем прогнозирования вероятного числа дополнительных случаев этого заболевания за весь период жизни, получаемого путем умножения дозы на фактор предрасположенности, либо путем линейной экстраполяции, либо же через критерий МОЕ. Такой количественный прогноз в условиях Украины возможен только для веществ, официально признанных канцерогенными для человека. Вместе с тем, целесообразно сообщать и о наличии тех веществ, канцерогенность которых для человека предполагается только при определенных условиях экспозиции (группа В). Допуская независимость механизмов канцерогенного действия разных веществ и линейность зависимости «доза — ответ», можно суммировать дополнительные риски развития злокачественных новообразований, создаваемые отдельными канцерогенами при комбинированной экспозиции.
Связь между оценкой риска и управлением им
Характеристика риска является основой для принятия решений по управлению риском (risk management), т.е. обоснования организационных, политических, правовых и других мероприятий, направленных на его предупреждение, ликвидацию или хотя бы снижение. В любой стране это управление зависит не только от установленной или предполагаемой величины риска, но и от многих других факторов, которые учитываются при формировании как решения в каждом конкретном случае, так и в целом позиции государства и общественного менталитета в сфере вопросов охраны природы и защиты здоровья населения. Эти факторы относятся к числу социальных, социально-психологических, экономических, политических, технологических и т.п..
Вместе с тем, сравнительная оценка риска, создаваемого здоровью населения разных территорий или для разных групп населения (профессиональных, возрастных, половых), или риска, создаваемого разными источниками загрязнения окружающей среды и/или разными его загрязнителями, или риска, связанного с загрязнением одним веществом разных компонентов окружающей среды и т.п., должна играть важную роль в ранжировании приоритетов природоохранной политики и требований государственного санитарного надзора на разных уровнях (местном, региональном, государственном). Так, в России Общее Постановление Главного государственного санитарного врача РФ и Главного государственного инспектора РФ по охране природы от 10.11.97 г. определяет, что методология оценки риска должна использоваться при проведении «государственного санитарного надзора и государственного экологического надзора, экологической и гигиенической экспертизы, экологического аудита, экологической и гигиенической паспортизации, социально-гигиенического мониторинга в части оценки влияния окружающей среды на здоровье населения, определении зон экологического бедствия и чрезвычайной экологической ситуации». Все эти виды деятельности либо содержат в себе непосредственные элементы управления риском (особенно предупредительного управления, например, в результате государственной экспертизы проектов), либо создают важные предпосылки для ранжирования приоритетов и финансового обеспечения мероприятий управления риском (в частности, после предоставления любой территории статуса особой зоны).
Экономический анализ управления риском. Важным подспорьем для выбора оптимальных «сценариев управления риском» может стать экономический анализ типа «затраты — эффективность». Как лучший обычно рекомендуется тот сценарий (другими словами, та система мероприятий управления), для которого прогнозируется наибольший эффект снижения риска на единицу будущих затрат. Вместе с тем такое же значение необходимо уделять и абсолютной величине ожидаемого эффекта.
Следует обратить особое внимание на объективность и полноту учета затрат на сравниваемые сценарии управления. Так, при сравнении разных подходов к снижению риска от загрязнения окружающей среды автомобильными выбросами, довольно распространенной ошибкой является утверждение, о том, что полный переход на неэтилированный бензин не только наиболее эффективный (что не подлежит сомнению), но и экономически чрезвычайно выгодный, так как, якобы не связан вообще с любыми затратами и экономическими потерями. На самом деле эта проблема гораздо сложнее.
С большой осторожностью следует воспринимать широко используемый на западе экономический анализ типа «затраты — выгоды». В этом случае для прогнозирования эффективности разных сценариев управления сравнивают затраты на соответствующие мероприятия не просто с эффектом снижения риска для здоровья населения, а с возможным снижением экономических потерь, обусловленных этим риском. Прежде всего следует подчеркнуть, что такое сопоставление может быть лишь одним из критериев выбора политических и других решений по управлению риском, но никак не решающим, поскольку ценность здоровья и человеческой жизни для общества не эквивалентна экономическим потерям, связанным с болезнью и смертью. Кроме того, оценка этих потерь западными экспертами обычно базируется на двух параметрах, которые не могут быть прямо перенесены в расчеты для отечественных условий. Одно из них — «стоимость болезни», т.е. усредненная сумма затрат и денежных потерь, связанных с тем или другим заболеванием. Этот параметр должен быть установлен на основе конкретных исследований для Украины в целом, а лучше всего — для каждого исследуемого региона. В условиях экономической нестабильности дать оценку «стоимости болезни» тяжело. Другой параметр, так называемая «готовность платить», т.е. сумма, которую обычный представитель населения психологически готов израсходовать на предупреждение конкретного риска. Эта величина определяется при социологических исследованиях, которые еще не проводились в Украине, а из-за границы безусловно не может быть перенесена, так как социально-экономические условия, и общественный менталитет в других странах существенным образом отличаются от наших.
Следует отметить, что в практике US EPA есть случаи привлечения значительных средств (в частности, затрат так называемого суперфонда на очищение территорий, загрязненных производственными отходами или в результате аварий) даже тогда, когда оценить риск для здоровья необходимо в небольшой группе жителей, т.е. при невозможности «окупить» эти затраты любыми финансовыми «выгодами», как бы они не рассчитывались.
Управление риском и гигиеническое нормирование. Важнейшим элементом оперативного и долгосрочного управления риском в сфере системы государственного санитарного надзора было и остается научное обоснование, установление и, главное, контроль за соблюдением нормированных уровней загрязнения окружающей среды (ПДК, ОБУВ). При условии продуманной адаптации методологии US EPA к принципам и практике упомянутого обоснования (в частности, в результате включения в эту методологию принятых в Украине критериев безвредности и соответствующего пересмотра американских рекомендаций в отношении переносимых доз) можно будет избежать принципиальных противоречий между рекомендациями по управлению риском, обоснованными, с одной стороны, на его оценке по новой для Украины методике, и с другой стороны, базирующихся на необходимости соблюдения действующих величин ПДК.
Еще одна потенциальная возможность таких противоречий связана с тем, что в отличие от унитарной системы гигиенических стандартов допустимого загрязнения, оценка риска в значительной степени определяется позицией эксперта, информацией, которой он владеет, избранными математическими моделями и т.п.. Вместе с тем, необходимо решить сложный вопрос о рациональной степени открытости информации относительно неопределенностей характеристики риска, переданной пользователю, от которого органы надзора требуют придерживаться ПДК как вполне детерминированной величины. Учитывая особое значение системы государственных гигиенических стандартов загрязнения среды в условиях Украины, не имеющее аналогов ни в одной стране мира за пределами СНГ, подрыв к ней доверия является опасным и недопустимым.
Вместе с тем хорошо известным, но все еще не устраненным недостатком отечественной системы разработки ПДК является то, что для одного и того же загрязнителя в разных компонентах окружающей среды они, как правило, обосновываются независимо, чаще всего разными исследователями на базе не совсем совпадающих критериев безвредности. Определение переносимой дозы («референтной дозы») для системных токсикантов на этапе оценки зависимости «доза — ответ» создает возможность расчета соответствующих ей переносимых концентраций в каждом компоненте среды при том или другом соотношении путей экспозиции. Именно с этих позиций излагает использование методологии оценки риска один из критериев — документов Международной программы химической безопасности. В данном случае решение этой задачи рассматривается с учетом не только «сценариев экспозиции» человека, но и того, насколько надежно и при каких путях экспериментальной экспозиции определена переносимая доза, насколько идентичны эффекты, по которым она оценивалась при разных путях экспозиции. Вот два примера такого подхода из числа рассмотренных в этом документе.
Пример 1. По оцененной экспозиции, 50% суммарной дозы получены с пищей, 20% – с водой и 30% – с воздухом. Имеющиеся данные адекватны для обоснования как пероральной (СДор), так и ингаляционной (СДинг) переносимых доз, которые основаны на подобных эффектах и лежат в одном порядке величин. За основу расчета может быть принята любая из них, но, учитывая то, что основным путем экспозиции человека является пероральный — принята СДор. Таким образом, допустимые дозы, которые поступают с пищей, водой и воздухом, соответственно равняются 0,5 СДор, 0,2 СДор и 0,3 СДор. Эти дозы могут быть пересчитаны в соответствующие ПДК на базе принятых норм потребления воды, воздуха и пищевых продуктов (с учетом состава пищевого рациона).
Пример 2. По сценарию экспозиции, 70% суммарной дозы получены с воздухом, 20% – с водой, 10% – с пищей. Это вещество присутствует также в отдельных потребительских товарах, но количественная оценка связанной с этим экспозиции невозможна. Данных о концентрации его в почве нет, но, исходя из физико-химических свойств вещества, эти концентрации, вероятно, низкие.
Имеющиеся данные адекватны для обоснования как СДор, так и СДинг, которые основаны на подобных эффектах и лежат в одном порядке величин. За основу расчета может быть принята любая из них, но, учитывая то, что основным путем экспозиции человека был ингаляционный — принятая СДинг. Учитывая, что в данном случае на основе экспериментальных данных устанавливалась переносимая концентрация (RfС в интерпретации US EPA), ее необходимо пересчитать в мг/кг/сутки на основе информации об объеме дыхания, массе тела и токсико-кинетических параметров, если они доступны. 10 % СД резервируются на поступление из потребительских товаров и почвы. Другие 90% распределяются так: 0,63 СДинг – с воздухом, 0,18 СДинг – с питьевой водой, 0,09 СДинг – с пищей. Эти дозы могут быть пересчитаны в соответствующие ПДК на базе принятых норм потребления воды, воздуха и пищевых продуктов (с учетом состава пищевого рациона).
Взаимосвязь оценки экспозиции и оценки эффектов