Основы биологического действия излучений,
применяемых в лучевой диагностике. Глава 2
Лучевая диагностика – Сапранов Б. Н. (ред.) — 2010
- 1. Механизм биологического действия ионизирующих излучений.
- 2. Молекулярный биологического действия ионизирующих излучений.
- 3. Клеточный этап биологического действия ионизирующих излучений.
- 4. Соматический этап биологического действия ионизирующих излучений.
- 5. Биологическое действие ультразвуковых волн
- 6. Тест-вопросы.
1. Механизм биологического действия ионизирующих излучений.
Все виды ионизирующих излучений (как корпускулярные, так и квантовые) обладают биологическим действием, т.е. вызывают функциональные или морфологические изменения в живых клетках, органах и организме в целом. Речь идет о повреждающем действии ионизирующих излучений, которое возникает под влиянием доз, превышающих естественный (природный) радиационный фон. Природный радиационный фон существует на протяжении всего эволюционного развития животного мира и человека и является обязательным условием существования всего живого — теория «гормезиса» – благоприятного действия малых доз радиации. Теория гормезиса согласуется с правилом Арндта-Шульца в фармакологии, согласно которому малые дозы фармакологических препаратов оказывают стимулирующее действие, средние – угнетающее, а большие – разрушающее.
Природный радиационный фон в среднем равен 0,1-0,2 р/год (100-200 мбэр/год, или 20-30 мкр/час), хотя колебания его в разных точках Земного шара составляют от 50 до 1000 мр/год. Он складывается из космического излучения (измеряется на уровне моря и равно — 30 мбэр/год, 68% всего природного фона), излучения из земной коры (грунт, вода, строительные материалы — 50-130 мбэр/год, 15%), излучения от самого человека (40К, 14С — 30 мбэр/год, 15%), и от других источников (2 мбэр/год, 1%). За 70 лет жизни человек в общей сумме получает примерно 16 р при вдыхании атмосферного воздуха, а при длительном пребывании в помещении эта доза вырастает до 160 р.
Однако ежедневно на человека, помимо природного ионизирующего излучения, действует еще и искусственное ионизирующее излучение (дополнительный фон), величина которого равна дозе естественного – 0,15-0,2 р/год. Дополнительный фон складывается из следующих компонентов: медицина (100-150 мбэр/год – 50-75% всего дополнительного фона), самолет (расстояние 2000 км, высота 12 км, 5 раз в год, — 2,5-5 мбэр/год – 1-2,5%), телевидение (4 часа в день, — 1 мбэр/год – 0,5%), АЭС (0,1 мбэр/год – 0,05%), ТЭЦ (уголь, до 20 км расстояния, — 0,6-6 мбэр/год – 0,3-3%), глобальные осадки от испытаний ядерного оружия (2,5 мбэр/год –1-2,5%), другие источники (промышленность, сельское хозяйство, флот, — 40 мбэр/год – 20%). Всякое дополнительное облучение с точки зрения радиационной гигиены является нежелательным, так как может привести к патологическим реакциям и заболеваниям вплоть до гибели живого организма. Характер повреждений зависит от многих факторов, но прежде всего имеет значение количество поглощенной энергии проникающего излучения.
Единой теории, объясняющей механизм повреждающего действия ионизирующих излучений на человеческий организм, нет. Тем не менее, учитывая установленные факты, можно представить его следующим образом, выделив при этом следующие этапы: молекулярный этап, клеточный этап, соматический этап (уровень целого организма), в котором выделяют соматические и наследственные эффекты.
2. Молекулярный этап БДИИ.
На первом, молекулярном этапе выделяют физическую, физико-химическую и химическую фазы. В первую, физическую, фазу, которая чрезвычайно коротка (около 10–12 сек), происходит процесс поглощения энергии излучения, который расходуется на возбуждение и ионизацию атомов и молекул облучаемых тканей. Возбужденные атомы и молекулы обладают повышенной биохимической активностью, однако считается, что процесс возбуждения играет очень незначительную роль в повреждающем действии ионизирующих излучений. Другое дело процесс ионизации. Для разрушения одной молекулы достаточно одного акта ионизации, но это не значит, что каждый акт ионизации сопровождается повреждением молекулы. И тем не менее, чем больше актов ионизации происходит по ходу пробега ионизирующих частиц, тем большая вероятность повреждения молекул биосубстрата.
В связи с тем, что вода составляет более 70% массы тела человека, важное биологическое значение приобретает ионизация молекул воды, так как большая часть поглощенной энергии расходуется на взаимодействие с молекулами воды, и лишь меньшая часть будет поглощена органическими соединениями. Процесс ионизации молекул воды можно записать следующим уравнением:
![]()
Естественно, что аналогичные акты ионизации происходят и с органическими молекулами.
Во второй, физико-химической фазе, продолжительностью около 10-6 сек., положительно заряженный ион молекулы воды диссоциирует на ион водорода (Н+) и свободный гидроксильный радикал (ОН), а отрицательно заряженный ион молекулы воды — на ион гидроксила (ОН—) и радикал водорода (Н.):
![]()
Свобоные радикалы формируются и из ионов органических молекул, если исходной энергии излучения достаточно, чтобы разрушить внутривалентные их связи. Свободные радикалы содержат свободные валентные связи, поэтому обладают высокой реактивной способностью, а потому могут претерпевать многочисленные превращения. Например, два радикала ОН могут образовать перекись водорода (Н2О2), радикал Н, соединяясь с растворенным в воде кислородом, которого всегда много в биосубстрате, образует гидропероксид (НО2), а две молекулы гидропероксида могут трансформироваться в высшую перекись водорода (Н2О4):
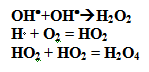
Пероксидные соединения могут сформироваться и из радикалов органических молекул, образуя еще одну фракцию пероксидных соединений. Таким образом, во второй фазе молекулярного этапа в тканях образуется ряд пероксидных веществ, которые, как известно, обладают токсичностью и выраженными окислительными свойствами. Взаимодействуя с органическими молекулами внутри клеток (нуклеопротеидами, липопротеиды, гюкопротеидами), пероксидные соединения приводят к фрагментации (деполимеризации) молекул или к их перестройке. Это уже будет третья, химическая фаза, молекулярного этапа, более продолжительная нежели первые две, в которой происходит перестройка и поражение биологически важных макромолекул, образование гистаминоподобных веществ, подавление активности ферментных систем клеток, изменение структур молекулярных поверхностей многофазной среды клеток. Это, в свою очередь, ведет к повышению проницаемости мембран клеток, денатурации внутриклеточных белков, дегидратации внутриклеточной среды и нарушение ее химизма.
Важно отметить, что хотя все реаккции молекулярного этапа идут в зоне облучения, и это может быть очень ограниченный участок облучения, пероксидные соединения молекул воды и органических веществ разносятся по всему организму, оказывая воздействие на радиочувствительные клетки в других органах и структурах человеческого организма. Они же включают в ответные реакции и центральную нервную систему, ибо нервные рецепторы в клеточных структурах чутко реагируют на изменение биохимизма клеток и межклеточных пространствах.
3. Клеточный этап БДИИ.
Обозначенные выше процессы начинают сказываться на жизнеспособности клеток -наступает клеточный этап биологического действия ионизирующих излучений, самый продолжительный и наиболее вариабельный по масштабу времени. Некоторые повреждающие эффекты в клетках могут развиваться в течение нескольких часов, в то время как другие, например трансформация нормальной клетки в злокачественную, требуют много лет.
Повреждающее действие ионизирующего излучения на клетку осуществляется в двух вариантах. Первый – это механизм непрямого действия ионизирующего излучения. Он заключается в том, что повреждающими агентами на клетку (клетки) являются продукты химической фазы молекулярного этапа радиобиологии. Второй вариант – механизм прямого действия, или теория мишени. Теория мишени заключается в том, что в клетке имеется некое чувствительное объёмное образование (например, ДНК), попадание в которое ионизирующей частицы и ведет к вредным последствиям для клетки. Учитывая несоразмерность, например, той же молекулы ДНК и ионизирующей частицы, вероятность их столкновения невелика, что и объясняет, с точки зрения сторонников этой теории, разный эффект от воздействия одних и тех же доз. Тем не менее, чтобы разрушить любую молекулу, достаточно одного акта ионизации или одного попадания ионизирующей частицы. Учитывая высокое содержание молекул воды в биосубтрате, основным механизмом в повреждающем действии ионизирующего излучения всё же считается непрямой.
Необходимо различать понятия «радиочувствительность» и «радиопоражаемость». Радиочувствительность это ответная, функциональная реакция клетки на облучение, не ведущая к её гибели. Радиопоражаемость это реакция клетки на облучение, ведущая к резкому изменению генома клетки вплоть до её гибели. Для одних клеток эти реакции очень разнятся: например, нервная клетка в человеческом организме самая радиочувствительная, то есть она реагирует уже на малые дозы, но в то же время, она самая радиоустойчивая, то есть гибель её наступает при очень больших дозах, в несколько раз превышающих дозы для гибели других клеток человеческого организма. Для других клеток радиочувствительность и радиопоражаемость означает практически одно и то же, то есть уже при малых дозах наступает повреждающее действие ионизирующего излучения, например клетки красного костного мозга. Так, гемопоэтические клетки реагируют уже на небольшие дозы – 10-15 р, и эти же дозы приводят к их гибели, в то время как нервные клетки, реагируя на эти же дозы, погибают лишь при дозах 500-700 р. На практике чаще пользуются термином радиочувствительности, вкладывая в него и понятие радиопоражаемости, однако необходимо помнить это существенное различие.
Радиочувствительность протоплазмы и ядра клетки одинакова, однако повреждение ядра клетки имеет больший эффект, что определяется его биологической значимостью. И, в первую очередь, в ядре клетки на повреждающее воздействие излучения реагирует хромосомный аппарат в виде структурных повреждений — хромосомных перестроек (аберраций). Это, в свою очередь, проявляется в торможении митотического процесса по трём вариантам.
В первом варианте после торможения или остановки митоза клетка восстанавливает его в обычном направлении, без каких-либо отклонений. Это благоприятный вариант воздействия ионизирующего излучения, и процентный вклад его тем больше, чем меньше доза воздействующего излучения. То есть, в данном случае о вредном воздействии ионизирующего излучения речь не идет.
Во втором варианте после торможения или остановки митоз восстанавливается, но в дочерних клетках появляются новые структурные или функциаональные характеристики, вследствие чего они приобретают новые, не свойственные материнской клетке свойства – мутации. Радиационные мутации развиваются в тех случаях, когда энергия излучения поглощается в хромосомах (носители дезоксирибонуклеиновых кислот – ДНК). Они могут возникнуть в любых клетках человеческого организма, и если они возникают в клетках, составляющих тело (сому) человека, речь идет о соматических мутациях, если же они возникают в половых клетках, говорят о генетических мутациях. Соматические мутации могут быть как полезные, то есть усиливают радиоустойчивость клеток, согласно теории гормезиса, но, как правило, ведут к патологическим изменениям, клеток, что проявляется или сокращением срока существования данной клеточной популяции, или к формированию заболевания, могущего, в конечном итоге, также привести к гибели клеток или самого организма, а в случае наступления патологических отклонений в половых клеток, к нежелательным проявлениям в последующих поколениях. Имеются данные, что клетки с соматическими мутациями представляют собой благоприятную основу для развития лейкоза и злокачественных опухолей в отдаленном (спустя многие годы) периоде. Генетические мутации проявляются в виде наследственных заболеваний, причем это может происходить как по доминантному, так и по рецессивному типу. Так, например, оценки, проведенные специалистами, показали, что облучение 1 миллиона человек дозой в 1 р приводит, в среднем, к развитию в трёх случаях злокачественных новообразований в год (естественная частота появления злокачественных новообразований – 2000 случаев). Среди 1 миллиона новорожденных в первом поколении популяции, облученной дозой в 1 р, будет насчитываться 60 детей с генетическими дефектами (естественная частота таких дефектов – 30 тысяч). Необходимо отметить, что число радиационных мутаций возрастает с увеличением дозы облучения, но далеко не пропорционально. И здесь основную роль играет механизм непрямого действия ионизирующего излучения. Однако мутации могут возникать и при воздействии очень малых доз, о чем говорят выше приведенные цифры, но здесь уже проявляется, в основном, механизм прямого действия ионизирующего излучения.
Третий вариант заключается в полной остановке митоза без его восстановления, что быстро ведет к гибели облученной клетки (клеток).
Второй и третий варианты реакций клеток на облучение и составляют суть радиопоражаемости клетки. Утрату клеткой способности к пролиферации в радиобиологии называют летальной дозой. В зависимости от связи летального эффекта с фазами митотического цикла, различают две формы радиационной гибели клеток: интерфазную (гибель клетки наступают в фазу покоя) и репродуктивную (гибель наступает после одного или нескольких актов деления). Для большинства клеток человеческого организма характерна репродуктивная форма лучевой гибели клеток.
Поражаемость клетки (клеток) зависит от ряда факторов, но основными являются интенсивность митоза, степень дифференциации и уровень их обменных процессов. Согласно основному закону радиобиологии – закону Бергонье-Трибондо, радиопоражаемость клеток прямо пропорциональна митотической активности и интенсивности обменных процессов, но обратно пропорциональна степени их дифференциации. Согласно этому закону все клетки (ткани) по радиопоражаемости делят на три группы:
- ткани с высокой степенью радиопоражаемости – гемопоэтические клетки (эритробласты миелоциты, мегакариоциты), лимфоидная ткань (лимфоузлы, селезенка, зобная железа, ретикулоэндотелиальная система), половые клетки (сперматогонии, яйцеклетки (в незрелом фолликуле), цилиндрический эпителий тонкой кишки;
2) ткани со средней степенью радиопоражаемости – эпителий хрусталика, клетки герментативного слоя кожи и слизистых, клетки сальных и потовых желез, клетки волосяных мешочков, хрящевые клетки и остеобласты растущих костей, эндотелий сосудов;
- ткани с низкой степенью радиопоражаемости – нервная ткань и клетки глии ЦНС, эпителий желез внутренней секреции, гепатоциты, эпителий почечных канальцев, альвеолярный эпителий легких, мышечные клетки скелетной и гладкой мускулатуры, миокард.
4. Соматический этап БДИИ.
Радиочувствительность (радиопражаемость) целого организма, вследствие сложности протекающих в нём физиологических процессов, не может быть суммарным результатом клеточных повреждений. Это сложный патофизиологический процесс, который зависит от характера облучения, физиологических особенностей организма, особенностей окружающей среды. Поэтому, прежде чем разбирать варианты радиобиологических соматических и наследственных эффектов, необходимо заострить внимание на этих факторах, знание которых позволяет предполагать вероятность и степень биологических реакций и повреждений с одной стороны, а с другой стороны рационально выбирать способы снижения этих возможных реакций и повреждений при диагностических и лечебных лучевых процедурах. Вот наиболее значимые факторы.
1. Вид излучения. Качественных различий биологических эффектов при воздействии ионизирующих излучений нет, имеются существенные различия лишь в количестве этих эффектов, так как плотность ионизации (количество пар ионов на единицу пути пробега фотона или корпускулярной частицы) неодинакова для разных видов излучений. Так, плотность ионизации альфа-лучей в сотни раз выше, чем плотность ионизации рентгеновских лучей. То есть, при одинаковом количестве поглощенной энергии биологический эффект от разных видов ионизирующих излучений будет разным. Если взять коэффициент биологической эффективности рентгеновских лучей за 1, то такой же коэффициент будет у гамма- и бэта-лучей, то уже у альфа-лучей и нейтронов (до 20 Мэв) этот коэффициент составляет 10, а у быстрых нейтронов (свыше 20 Мэв) – 20.
2. Расположение источника излучения. Эффективность биологических проявлений помимо вида лучей зависит и от локализации источника этих лучей. Так, в случае расположения источника альфа-излучения внутри организма, учитывая высокую плотность ионизации альфа лучей, возникает очень высокий биологический эффект. При наружном же облучении альфа-лучами о биологической активности говорить не приходится, так как, во-первых, они пробегают в воздухе 16-20 см, а, во-вторых, они полностью поглощаются уже роговым слоем кожи. Другое дело рентгеновские и гамма-лучи – они обладают высокой биологической активностью уже при наружном облучении, так как обладают высокой проникающей способностью, и число биологических реакций будет зависеть уже от того, на какую глубину проникают рентгеновские лучи и какие ткани будут на их пути.
3). Величина дозы. Очень важный фактор, влияющий на качество и количество биологических эффектов, и чем больше величина дозы, тем, естественно, больше их число, которое нарастает уже не в арифметической, а почти в геометрической прогрессии. В радиобиологии для оценки этого показателя применяют летальную дозу (DL) — дозовую величину, приводящую к гибели организма в течение 30-60 дней при однократном наружном облучении всего тела. Выделяют минимальную летальную дозу (DLМ) – погибают 10% облученных, половинную летальную дозу (DL50) – погибает 50% облученных, и абсолютную смертельную дозу – погибает 100% облученных (DL100). Для рентгеновских лучей эти дозы соответсвенно равны 100-200р, 200-400р и 400-600р.
4) Мощность дозы, то есть время, за которое организм получил ту или иную дозу. Как видно из приведенных летальных доз, они рассчитаны на однократное облучение. Если, например, DL100 человек получит не однократно, а в течение 10 дней, мощность дозы, упадет в 10 раз, и биологический эффект будет иным, и, прежде всего, будет касаться поверхностных тканей.
5). Площадь облучения. Возвращаясь к летальным дозам необходимо напомнить, что они определяют свой эффект не только при однократном облучении, но и при облучении всего тела. При локальном облучении какого-то участка тела биологический эффект, также будет абсолютно иным. Так, при облучении дозой в 300-400р, которая является DL50, участка кожи размером 10х10 см, кроме местной реакции в виде стойкого покраснения и выпадения волос, других проявлений обычно не наблюдается (эритемная и эпиляционная доза при местном облучении).
Из физиологических особенностей организма прежде всего имеет значение возраст, пол и состояние иммунной системы. Наиболее радиочувствительными являются молодой и старческий организмы, зрелый возраст и период новорожденности являются более радиоустойчивыми. А так как ионизирующее излучение является одним из повреждающих факторов внешней среды, ясно, что выход организма после воздействия больших доз ионизирующего излучения будет зависеть и от состояния иммунной системы. Если же защитные иммунные реакции организма в целом ослаблены (экологические факторы, плохие условия жизни, хронические заболевания и т.д.), то он, при прочих равных условиях, будет более подвержен воздействию ионизирующего излучения, как и любого другого агента, способных изменить биологизм данного организма.
В природе, как правило, более сильным биологическим существом является женская особь. Как было выяснено в экспериментальных условиях, самки являются и более радиоустойчивыми, нежели самцы, и, по всей вероятности, это положение можно распространить и на человека.
Из других биологических факторов необходимо обратить внимание на уровень меланина в коже. Меланин обладает защитными функциями в отношении ультрафиолетовых лучей и ионизирующего излучения, поэтому лица с выраженной пигментацией кожи являются более устойчивыми как к солнечным, так и к ионизирующим лучам. Также важна температура организма в момент облучения – пониженная, а особенно повышенная температура в момент воздействия ионизирующего излучения, усиливает его повреждающий эффект. Необходимо обратить внимание и на тип нервной системы – сильные типы (флегматики, холерики) при прочих равных условиях считаются более радиоустойчивыми.
5. Лучевые реакции организма.
Лучевые реакции организма подразделяются на общие, которые складываются из поражения кроветворной системы, органов пищеварительного тракта и центральной нервной системы, и местные – в зоне облучения. В свою очередь общие и местные реакции делятся на лёгкие и тяжелые, а по времени проявления на острые, которые наблюдаются в течение нескольких дней или недель после облучения сравнительно большими дозами, и отдалённые, которые возникают или могут возникнуть через годы после облучения значительно меньшими дозами.. Выделяют четыре типа лучевых реакций организма:
- — собственные лучевые поражения,
- — отдаленные соматические эффекты,
- — генетические эффекты,
- — тератогенные эффекты.
К лёгким общим реакциям относятся синдром лучевого похмелья и сокращение сроков жизни, к тяжелым общим относится острая лучевая болезнь (поглощённая доза > 1 Гр (100 р), хроническая лучевая болезнь (длительное облучение дозами выше ПДД — предельно допустимая доза), лейкемия.
Острые эффекты при общем облучении организма возникают после общего облучения человека дозой более 0,25 Гр (25 р) и заключаются в падении числа лимфоцитов, тромбоцитов и эритроцитов в периферической крови Если полученная доза облучения не превышает 1 Гр (100 р),то пациент обычно начинает выздоравливать, и количество лимфоцитов в крови через несколько дней начинает повышаться, хотя полное выздоровление может затянуться на несколько месяцев. Количество лейкоцитов – полезный критерий оценки полученной субъектом дозы облучения всего тела в диапазоне 0,25-4 Гр. При дозах выше 4 Гр тщательный подсчет позволяет обнаружить лишь единичные выжившие клетки. Тромбоциты и эритроциты снижаются не в такой степени, как лимфоциты, также с последующим их восстановлением, и поэтому контроль количества красных и белых клеток крови позволяет получить информацию о тяжести поражения или признаках выздоровления после облучения человеческого организма. В связи с этим исследования крови широко используют для контроля за состоянием здоровья людей, которые по своей профессии подвергаются риску лучевого повреждения, или пациентов, получающих лучевую терапию (хотя здесь речь идет о местном облучении, разовые и суммарные дозы здесь могут достигать больших величин).
К лёгким местным реакциям относят эритему , сухой дерматит, мокнущий дерматит, лучевой пневмосклероз, лучевую катаракту и др.
Лёгкие кожные реакции не требуют специального лечения и подвергаются обратному развитию самостоятельно. Эритема – стойкое покраснение, умеренная отечность и болезненность кожи. Развивается в зависимости от энергии рентгеновских лучей в дозе 500-900 р, исчезает самостоятельно, оставляя пигментацию кожи, которая держится длительное время. Сухой эпидермит характеризуется теми же клиническими симптомами, что и эритема, но выраженными в большей степени, и сопровождается выраженным шелушением кожи. Мокнущий эпидермит характеризуется появлением на коже на фоне отека и гиперемии пузырьков, наполненных серозной жидкостью. Пузырьки вскрываются, обнажая мокнущую ярко-розовую поверхность. После эпителизации развивается атрофия и депигментация кожи.
К тяжёлым местным реакциям (их называют еще лучевыми повреждениями) относят лучевую язву, лучевой рак, стерильность организм и др.
Местные лучевые повреждения возникают при облучении массивными дозами излучений, чаще всего как осложнения лучевой терапии злокачественных опухолей при нарушении методики и техники облучения. Типичным лучевым повреждением является лучевая язва, которая может развиться спустя 1-3 недели после облучения (острый лучевой некроз), 1-6 мес. после облучения (ранний лучевой некроз) и через много месяцев или лет (поздний лучевой некроз). По шкале оценки RTOG/EORTC выделяют пять степеней поздних местных лучевых повреждений.
В отличие от лучевых реакций, лучевые повреждения самостоятельно не проходят. Как правило, они требуют длительного лечения.
Генетические эффекты возникают при мутациях лучевого происхождения, протекающих в яйцеклетках яичников женщин или в сперматозоидах мужчин. По степени проявления мутаций выделяют доминантные — проявляются в первом поколении облученного организма, и рецессивные, проявляющиеся спустя несколько поколений после первичного облучения. Вероятно, большинство генетических повреждений приводит к эмбриональной смерти, однако некоторые из них могут быть не смертельными и возможно рождение живого ребенка, страдающего уродствами того или иного рода. По этой причине при всех медицинских исследованиях, связанных с облучением, стремятся избежать облучения гонад пациентов и персонала.
Тератогенные эффекты развиваются у плода при облучении беременной женщины, что может быть причиной серьезных повреждений развивающегося эмбриона и плода. Большое число наблюдений за детьми, родившимися у женщин, подвергавшихся облучению с диагностической или терапевтической целью во время беременности, показало, что облучение in utero может вести к серьезным аномалиям у потомства. В этих случаях наблюдались самые разнообразные дефекты, включающие в себя болезнь Дауна (монголизм), гидроцефалию, микроцефалию, пороки развития конечностей, костей лицевого черепа и др.
Наибольший риск повреждения эмбриона приходится на первые три месяца беременности и постепенно уменьшается в более поздние сроки. Риск внутриутробной смерти или серьезных пороков развития с наибольшей вероятностью происходит в течение первых 38 дней беременности, т.е. в период предимплантационной стадии (до 11-го дня) и в период органогенеза. Поэтому любое облучение беременной женщины в этих периодах должно быть исключено. В непредвиденных случаях, когда плод подвергался облучению в дозе более чем 0,2 Гр, необходимо рекомендовать прерывание беременности.
3.5. Биологическое действие ультразвуковых волн.
Хорошо известно, что только маленькая доля приложенной энергии ультразвука возвращается к датчику. Большая же часть теряется за счет поглощения. Ультразвуковые волны вызывают колебания частиц среды вокруг положения равновесия. Кинетическая энергия частиц освобождается в окружающую среду в виде тепла. Наиболее подвержена нагреванию костная ткань, обладающая наибольшим акустическим сопротивлением. Наибольшее повышение температуры происходит на границе входа ультразвука в ткани, в фокусной зоне и в пробном объеме. Таким образом, ультразвук обладает рядом биологических эффектов. К ним относятся кавитация и термальный эффект.
Кавитация представляет собой процесс формирования газовых пузырей из растворенных в жидкости газов, возникающий при определенном отрицательном давлении. Этот переход носит изотермальный характер, то есть не связан с изменением температуры. При разрушении такого газового пузыря вся освобожденная энергия взывает местное разрушение окружающих тканей.
В современных диагностических аппаратах выходная акустическая мощность в В-режиме увеличилась в 6 раз за последние 5 лет, и имеет тенденцию к дальнейшему росту.
На экране УЗИ-аппарата должны указываться величины теплового (термического) — ТI и механического МI индексов. ТI – тепловой – или термический – индекс предупреждает пользователя о потенциальном нагревании тканей во время исследования при использовании определенных параметров настройки прибора. Тепловой индекс, хотя и определен преднамеренно без каких-либо единиц, математически определяется как отношение реально испускаемой мощности ультразвукового поля к теоретической, требуемой для нагрева участка ткани на 10. Принято считать, что в «худшем варианте нагревания» ТI более 1 указывает на появление потенциального риска. Механический индекс или МI предложен для оценки нетермических процессов, в частности, кавитации. МI указывает на величину амплитуды ультразвуковых импульсов, воздействующих в данный момент на ткани. Увеличение этой амплитуды приводит к пропорциональному увеличению индекса.
Следует отметить, что даже после повсеместного внедрения этих индексов в широкую практику остается определенное количество нерешенных проблем. Многие факторы, такие как время экспозиции, толщина передней стенки, глубина исследуемого объекта, степень перфузии исследуемых органов и тканей и некоторые другие до сих пор остаются неучтенными.
В современных диагностических аппаратах выходная акустическая мощность в В-режиме значительно увеличилась и имеет отчетливую тенденцию к росту. Кроме того, вместе с допплерографией в клиническую практику так же пришли высокие мощности акустического излучения. Общая акустическая мощность представляет энергию, которая испускается датчиком в единицу времени. Единицей мощности является 1 Ватт или Джоуль/сек.
Согласно решению международной электротехнической комиссии «Требования к предоставлению акустических выходных характеристик медицинских диагностических приборов» все характеристики должны обязательно приводиться в сопроводительной документации для каждого датчики и каждого режима работы (В-, М-, Д- и проч.) в том случае, если они превышают нормативные значения выходной интенсивности излучения в луче – Iob> 20 мВт/см3, средней выходной интенсивности за импульс Ispta> 100мВт/см3, акустического давления P>1 МРа.
Становится очевидным, что современный специалист ультразвуковой диагностики должен уметь контролировать такие функции сканера как выходная мощность, знать интенсивность и давление создаваемого датчиком акустического поля, учитывать время экспозиции и научиться использовать в повседневной практике принцип ALARA (As Low As Reasonably Achievable – Так Низко Как Разумно Достижимо – т.е. использовать самую благоразумно низкую выходную мощность).
6. Тест-вопросы.
1. При увеличении количества кислорода в облучаемых тканях степень биологического воздействия на ткани
а) увеличивается,
б) уменьшается,
в) не меняется1
2. При увеличении количества воды в облучаемых тканях степень биологического воздействия на ткани
а) увеличивается,
б) уменьшается,1
в) не меняется.
3. Основной механизм биологического действия ионизирующего излучения на клетки
а) прямой,
б) непрямой,
в) оба играют одинаковую роль.1
4. Самая радиочувствительная клетка организма
а) эмриональная,
б) нервная,1
в) половая.
5. Самая радиопоражаемая клетка организма
а) эмбриональная,1
б) нервная,
в) половая.
6. Прежде всего, в клетке от воздействия ионизирующего излучения страдает
а) защитная функция,
б) митоз,1
в) обменные процессы.
7. Минимальная смертельная доза для рентгеновских лучей при однократном общем облучении составляет
а) 50-100 р,
б) 100-200 р,
в) 200-400 р.
8. Наиболее радиопоражаемый возраст
а) детский1
б) средний,
в) старческий1
9. Радиационные мутации бывают
а) только положительные,
б) только отрицательные,
в) те и другие.1
10. Наиболее сильный мутаген для человека это
а) алкоголь,
б) радиационное облучение,
в) ванилин,1
11. Критический орган это орган,
а) обладающий высокой радиочувствительностью,
б) обладающий высокой радиопоражаемостью,1
в) обладающий радиорезистентностью.
12. Теория полезного действия малых доз радиации называется
а) горметония,
б) гормезис,1
в) гистерезис.
13.. К биологическим эффектам ультразвука относятся
а) кавитация и термический эффект,
б) только термический эффект,
в) электризация тканей.
14. Принцип ALARA призывает специалиста уменьшить
а) мощность сигнала,
б) время исследования,
в) количество используемого геля.
15. Высокие – больше 1 – значения термического индекса говорят о
а) нагревании тканей на соответственное количество градусов,
б) имеющемся высоком потенциальном риске нагревания тканей,
