Осадительное титрование
Метод осадительного тирования основан на применении титрантов, которые образуют малорастворимые соединения с анализируемым веществом. В осадительном титровании используют реакции образования труднорастворимых соединений. К реакциям осаждения в титриметрическом методе предъявляются следующие требования:
- ● достаточно малая растворимость осадка;
- ● быстрое образование осадка при добавлении титранта;
- ● наличие индикаторов, позволяющих установить точку эквивалентности;
- ● минимальное соосаждение примесей.
К осадительному титрованию относят аргентометрию, меркурометрию, меркуриметрию и сульфатометрию.
Аргентометрия применяется главным образом для определения галогенидов:
![]()
Основным рабочим раствором является нитрат серебра. Этим методом можно определить любые элементы, входящие в состав анионов, образующих с серебром нерастворимые осадки. Хранят растворы соли нитрата серебра в темной склянке.
Большинство веществ обладают ограниченной растворимостью, т. е. в системе имеется осадок и насыщенный раствор.
![]()
Процесс обратимый, гетерогенный, протекает на поверхности раздела двух фаз. Константа равновесия
![]()
Эта величина называется произведением растворимости (ПР). ПР — произведение концентраций ионов электролита, содержащихся в его насыщенном растворе при данной температуре. Эта величина постоянная, используется на практике для малорастворимых электролитов. Например:

Наряду с раствором AgNO 3 используют растворы тиоционатов KCNS и NH 4 CNS. К анализируемому раствору галогенидов добавляют избыток титованного раствора:
AgNO 3 и непрореагировавшее серебро оттитровывают тиоционатом в присутствии ионов Fe +3 .
![]()
Как только все ионы серебра будут связаны, начнут вступать в реакцию ионы железа:
![]()
Образуется раствор красного цвета — это и есть индикатор. Так определяют содержание серебра в сплавах. Это метод Фольгарда. В методе Мора раствор поваренной соли титруют раствором нитрата серебра в присутствии нескольких капель индикатора — хромата калия K2СrO4. Вначале пойдет реакция:
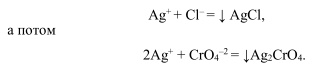
Образуется осадок темно-красного цвета. Хромат серебра начнет выпадать в осадок после того, как выпадет в осадок весь хлорид серебра, потому что растворимость хромата серебра больше растворимости хлорида серебра. Визуально наблюдаем побурение белого осадка.
Меркурометрический метод титриметрического анализа основан на применении титрованных растворов солей ртути(I) (меркуроионов). При взаимодействии [Hg2]+2 -ионов с хлоридами, бромидами, иодидами и т. д. образуются осадки малорастворимых галогенидов Hg2Cl2, Hg2 Br2, Hg2I2, например
![]()
Меркуриметрия — метод, основанный на применении в качестве титранта раствора солей ртути (II). При взаимодействии Hg +2 с хлорид ионами образуется слабодиссоциированное соединение:
![]()
После достижения точки эквивалентности в титруемом растворе появляются избыточные Нg+2 -ионы, которые обнаруживают при помощи соответствующего индикатора, образующего с Hg+2 окрашенные соединения.
Этот метод гораздо дешевле метода аргентометрии, но соли ртути ядовиты, это является недостатком метода. В качестве индикатора используют дифенилкарбазон, дающий изменение цвета на фиолетовый в точке эквивалентности.
Сульфатометрия — титрование растворами серной кислоты и хлоридом бария. Используется метод для определения ионов сульфата и бария.
![]()
Индикатор — ортаниловый А. Изменение окраски розовая — фиолетовая.
