Опухоли. Патогенез, морфология, классификация
Опухоли. Опухолевый рост
Опухолевый рост относится к разряду таких общепатологических процессов, понимание которых требует объединения усилий Ученых-медиков и биологов различных специальностей. В последние годы благодаря успехам молекулярной биологии и генетики получены новые данные о молекулярно-генетических перестройках в опухолях. Однако по-прежнему вопросы этиологии, патогенеза, морфогенеза и прогрессии опухолей остаются нерешенными. Как и раньше, здесь больше вопросов, чем ответов.
Для удобства дальнейшего изложения материала необходимо привести греческие и латинские термины, которые используются в литературе в качестве синонима для понятия опухоль — неоплазма (neoplasm), бластома (blastoma), тумор (tumor), онкос (oncos); а также для обозначения злокачественных опухолей — рак, или карцинома (cancer, carcinoma), и саркома (sarcoma).
Несмотря на длительную историю изучения проблемы опухолевого роста, до сих пор не достигнуто единого понимания, что же такое злокачественная опухоль. R.A.Willis (1967) определял злокачественную опухоль как «патологическую массу ткани с чрезмерным, некоординированным ростом, который сохраняется даже после прекращения действия факторов, его вызывающих». J.A.Ewing (1940) и H.C.Pilot (1986) в дефиниции злокачественной опухоли подчеркивали, что ее основным отличительным свойством является «наследственно обусловленный автономный рост». А.И.Струков и В.В.Серов (1985) дают определение злокачественной опухоли как «патологический процесс, характеризующийся безудержным размножением (ростом) клеток… Автономный, или бесконтрольный, рост — первое основное свойство опухоли».
Опухоли. ЭПИДЕМИОЛОГИЯ
Злокачественные опухоли представляют серьезную проблему для человечества, являясь одной из главных причин смерти в современном обществе. Число случаев злокачественных опухолей, регистрируемых каждый год, составляет около 5,9 млн; из них 2 млн больных погибают ежегодно и 2 млн регистрируются вновь.
Уровень заболеваемости и смертности от неоплазмы варьирует в разных странах мира, что объясняется различиями в экологической обстановке, этнических привычках и наследственности. Так, уровень смертности от рака желудка в Японии в 8 раз выше по сравнению с США, в то время как смертность от рака молочной железы и предстательной железы в Японии составляет V4 и V5 от соответствующих показателей в США.
Злокачественные новообразования встречаются с различной частотой среди разных этнических групп, проживающих на одной территории. В США заболеваемость раком легкого среди чернокожего населения в 2 раза выше, чем среди белого, что связывают с различиями в наследственной предрасположенности. Большая группа опухолей у детей имеет явное наследственное происхождение: ретинобластома, опухоль Вильмса и гепатобластома. В семьях больных данными опухолями обнаруживают специфические хромосомные аномалии. Так, развитие ретинобла-стомы коррелирует с обнаружением делеции хромосомы 13 с потерей гена р53, являющегося антионкогеном. Другим примером может служить наследственное заболевание пигментная ксеродерма с известным генетическим дефектом репарации ДНК, при котором риск развития рака кожи возрастает в 1000 раз.
С наследственными факторами связывают возникновение опухолей при синдроме атаксии-телеангиэктазии (высокая частота лейкозов и лимфом), анемии Фанкони (лейкозы), синдроме Блума (лейкозы и другие опухоли), множественных эндокринных неоплазиях I и II типов. Установлено, что рак молочной железы, толстой кишки и почек нередко регистрируется чаще в определенных семьях, хотя наследственных факторов, которые могли бы участвовать в передаче этих заболеваний, в семьях не найдено.
Различия в частоте развития той или иной опухоли часто могут быть обусловлены не только генетическими особенностями определенных групп населения, но и различиями в их социальном статусе. Известно, что раком легкого болеют чаще люди, работающие и живущие вблизи вредных производств, перенесшие туберкулез. Различия могут нивелироваться при изменении условий жизни людей. Так, американцы японского происхождения болеют раком желудка с той же частотой, что и местное население.
В последние годы в эпидемиологической ситуации по заболеваемости и смертности от опухолей обнаруживается ряд тенденций.
- Во-первых, наметился рост заболеваемости и смертности от рака во всех странах мира; 50 % погибших от онкологических заболеваний проживали в развитых странах. Онкологические заболевания многие годы уверенно занимают 2-е место в структуре причин смерти после сердечно-сосудистой патологии. Поскольку сейчас имеется тенденция к снижению смертности от последних, то опухоли имеют явный шанс стать лидером среди причин смерти в XXI веке.
- Во-вторых, рост заболеваемости опухолями регистрируется во всех возрастных группах, но наибольшее число больных раком составляют люди старше 50 лет. В этой связи опухоли превратились в геронтологическую проблему.
- В-третьих, установлены половые различия по частоте и структуре заболеваемости злокачественными опухолями между мужчинами и женщинами. В среднем заболеваемость неоплазиями Феди мужчин в 1,5 раза выше, чем среди женщин, а в старших возрастных группах — более чем в 2 раза. В структуре заболеваемости мужчин с 1981 г. лидирующие места занимают рак легкого, рак желудка и толстой кишки. Отмечается некоторая стабилизация уровня заболеваемости раком легкого и значительный Рост заболеваемости раком толстой кишки. В структуре заболеваемости женщин первые три места делят между собой рак молочной железы, матки и толстой кишки. В России ситуация несколько иная. У мужчин наиболее частыми являются рак легкого, желудка, кожи; у женщин — рак молочной железы, опухоли кожи и рак желудка.
- В-четвертых, структура заболеваемости и смертности от онкологических заболеваний постоянно меняется в связи с учащением одних опухолей и снижением заболеваемости другими опухолями. В ряде случаев такое снижение заболеваемости связано с использованием эффективных профилактических мероприятий. Например, в США в связи с запретом на курение и строгим контролем за выбросом бензапирена и других канцерогенных веществ в атмосферу показатели заболеваемости раком легкого стабилизировались.
Опухоли. ПРИЧИНЫ РАЗВИТИЯ И ПАТОГЕНЕЗ
Различные этиологические факторы, способные вызвать развитие опухолей, называются канцерогенными факторами, или канцерогенами. Выделяют три основные группы канцерогенных агентов: химические, физические (радиационные) и вирусные. Полагают, что 80—90 % злокачественных опухолей являются результатом неблагоприятного воздействия окружающей среды. Таким образом, проблема рака может считаться экологической проблемой.
Процесс развития опухолей под влиянием канцерогенных факторов носит название канцерогенеза. Среди причин развития опухолей человека и животных называются различные канцерогенные агенты, что легло в основу построения множества теорий канцерогенеза.
Основные теории канцерогенеза:
- теория химических канцерогенов,
- физических канцерогенов,
- вирусно-генетическая
- полиэтиологическая теории.
Исторический интерес представляет дизонтогенетическая теория Ю.Конгейма, или теория «эмбриональных зачатков».
Теория химических канцерогенов.
Химический канцерогенез у человека был впервые описан J.Hill, наблюдавшим развитие полипоза слизистой оболочки носа у людей, вдыхавших чрезмерные количества лекарств, и Sir Percival Patt (1775), описавшим рак мошонки трубочистов. С тех пор описано более 1000 химических канцерогенных веществ, из которых только 20, как было доказано, инициируют опухоли человека. Хотя основные исследования в области химического канцерогенеза проводятся на лабораторных животных и в клеточных культурах, тем не менее есть наблюдения опухолей человека, развитие которых обусловлено воздействием химических канцерогенов. Яркими примерами могут служить профессиональные опухоли — рак мочевого пузыря у работающих с анилиновыми красителями, рак легкого у людей, контактирующих с асбестом, рак печени работников поливинил-хлоридного производства и др.
Канцерогенные агенты подразделяются на две большие группы: генотоксические и эпигенетические в зависимости от их способности взаимодействовать с ДНК.
К генотоксическим канцерогенам относятся полициклические ароматические углеводороды, ароматические амины, нитрозосоединения и др.
Часть генотоксических канцерогенов может напрямую взаимодействовать с ДНК, поэтому они называются прямыми. Другие же должны претерпеть химические превращения в клетках, в результате которых они становятся активными, приобретают электрофильность, могут концентрироваться в ядрах клеток и взаимодействовать с ДНК. Эти генотоксические канцерогены называются непрямыми. Активация непрямых генотоксических канцерогенов происходит с участием ряда ферментных систем клетки, таких как монооксигеназная ферментная система, основным действующим компонентом которой являются цитохром Р-450-гемопротеид, эпоксидгидратазы, а также трансферазы, катализирующие реакции конъюгации канцерогенных веществ. Активированные метаболиты реагируют с различными участками ДНК, вызывая алкилирование ее оснований — аденина, гуанина, цитидина и тимидина. Образование алкилгуанина может приводить к точечным мутациям в геноме клетки. Названные ферментные системы обнаружены в клетках печени, бронхиального, желудочного, кишечного и почечного эпителия и других клетках.
Эпигенетические канцерогены представлены хлорорганическими соединениями, иммунодепрессантами и др. Они не дают положительных результатов в тестах на мутагенность, однако их введение вызывает развитие опухолей.
Происхождение химических канцерогенов может быть экзо- и эндогенным. Известными эндогенными канцерогенами считаются холестерин, желчные кислоты, аминокислота, триптофан, некоторые стероидные гормоны, пероксиды липидов. Накоплению эндогенных канцерогенов в организме могут способствовать некоторые заболевания, а также хронические гипоксические состояния.
Химический канцерогенез имеет многоступенчатый характер и протекает в несколько стадий: инициации, промоции и прогрессии опухоли. Каждая из стадий требует специальных этиологических факторов и отличается морфологическими проявлениями. В стадию инициации происходит взаимодействие генотоксического канцерогена с геномом клетки, что вЬ1зывает его перестройку. Однако для злокачественной трансформации этого бывает недостаточно. Последняя обеспечивается действием еще одного повреждающего агента, вызывающего дополнительные перестройки в геноме. Клетка малигнизируется начинает бесконтрольно делиться. Вещество, определяющее начало стадии промоции, называется промотором. В качестве промоторов нередко применяются эпигенетические канцерогены, а также вещества, не являющиеся сами по себе канцерогенами. Эффект химических канцерогенов зависит от длительности введения и дозы, хотя нет той пороговой минимальной дозы, при которой канцерогенный агент может считаться безопасным. Кроме того, эффект от действия различных химических канцерогенов может суммироваться.
Об опухолевой прогрессии говорят при наличии безудержного роста опухоли.
Обобщая данные по химическому канцерогенезу, следует подчеркнуть, что для реализации своего действия химические канцерогены должны воздействовать на ядерную ДНК и вызвать ее повреждения.
Теория физических канцерогенов.
К физическим канцерогенам относятся три группы факторов: солнечная, космическая и ультрафиолетовая радиация; ионизирующая радиация и радиоактивные вещества.
1. Космическая, солнечная (в том числе ультрафиолетовая) радиация, пожалуй, является самым распространенным канцерогенным фактором, с которым приходится контактировать человеку. Имеются убедительные экспериментальные доказательства и клинические наблюдения канцерогенного эффекта солнечной радиации. Известны факты о предрасположенности к развитию меланом жителей околоэкваториальных регионов, особенно обладающих белой кожей с низким уровнем синтеза меланина, который является экраном, защищающим клетки кожи от мутагенного воздействия ультрафиолетовых лучей. Мутагенное действие этих лучей подтверждается также наблюдениями за больными пигментной ксеродермой, имеющими генетический дефект ферментов, которые осуществляют репарацию ДНК. В результате удаления мутированных участков ДНК не происходит, что приводит к появлению малигнизированных клеток и частому развитию у этих больных рака кожи.
Особого внимания заслуживает вопрос о развитии опухолей под действием как ионизирующей, так и неионизирующей радиации. Актуальность этой проблемы стала особенно высока во второй половине XX века в связи с атомной бомбардировкой Хиросимы и Нагасаки, ядерными испытаниями и авариями на атомных электростанциях (АЭС).
Эпидемиологические данные, подтверждающие канцерогенное воздействие ионизирующей радиации, касаются использования рентгеновских лучей в медицине, работы с радиоактивными источниками в промышленности и наблюдения за лицами, пережившими атомную бомбардировку и аварии на АЭС.
Использование рентгеновских лучей в медицине имело не только положительные последствия. В самом начале применения рентгеновских лучей врачи не использовали защитные средства, а пациентам назначали необоснованно высокие дозы облучения. Тогда-то и была зарегистрирована высокая частота развития злокачественных опухолей рук у рентгенологов, а затем лейкозов у пациентов, получавших облучение позвоночника и костей таза по поводу анкилозирующего спондилита. В последние годы описано учащение развития злокачественных опухолей у детей, матери которых проходили рентгеновское исследование таза во время беременности. Хотя эти результаты и вызывают споры, однако хорошо известно, что ткани плода обладают особо высокой чувствительностью к рентгеновскому облучению.
Профессиональный рак легкого, вызванный вдыханием радиоактивного газа радона, был впервые описан у шахтеров урановых рудников. Саркома костей у рабочих, разрисовывающих цифербласты часов люминесцирующими красителями, также связана с накоплением в костях радиоактивных частиц. Имеются противоречивые данные о более высокой частоте развития лейкозов у людей, живущих вблизи предприятий, обрабатывающих отходы ядерного топлива.
Радиационные катастрофы, такие как атомная бомбардировка японских городов во время второй мировой войны, ядерные испытания на полигонах в области Семипалатинска и Маршалловых островов, а также авария 1986 г. на Чернобыльской АЭС, привели к резкому росту числа онкологических заболеваний среди пострадавшего населения. В несколько раз увеличилась частота развития лейкозов и солидных опухолей, в первую очередь щитовидной железы, особенно среди детей. Поражение щитовидной железы связывается с избирательным накоплением в ее ткани радиоактивного йода, образующегося в ходе ядерных цепных реакций.
Становится ясным, что канцерогенное действие радиации может суммироваться с действием других канцерогенных агентов — химическими и вирусными. Кроме того, как было показано в экспериментах, радиация может активировать вирусы (например, вирус миелоидной лейкемии мышей).Следует подчеркнуть, что как и химические канцерогены, физические канцерогенные агенты реализуют канцерогенное действие через повреждение ДНК генома клеток.
Вирусно-генетическая теория.
Основоположником теории по Праву считается Л.А.Зильбер (1968). Согласно данной теории, Ряд опухолей может развиться под действием особых вирусов, которые называются онкогенными вирусами. Первые эксперименты по доказательству роли вирусов в развитии опухолей ставились с использованием бесклеточных фильтратов из ткани неоплазмы, которые вызывали развитие опухолей у животных-реципиентов. Таким способом V.Ellerman и O.Bang (1908) впервые удалось вызвать лейкоз у кур. Первый онкогенный вирус был описан в 1911 г. экспериментатором-патологом Рокфеллеровского института Pyeton Rous как фильтрующийся агент способный вызывать развитие саркомы у кур. За данное открытие P.Rous через 55 лет в 1968 г. был удостоен Нобелевской премии. В 30-е годы G.Bittner открыл вирус рака молочной железы мышей, a R.E.Shope — вирус папилломы кролика. После этих основополагающих исследований количество работ по идентификации онкогенных вирусов стало лавинообразно возрастать. До недавнего времени вирусный канцерогенез считался присущим только животным. В последние десятилетия получены данные о значении вирусов и в развитии некоторых опухолей человека: африканской лимфомы Беркитта, или лимфомы Беркитта (ДНК-содержащий вирус Эпштейна — Барра), назофарингеальная карцинома (вирус ДНК-содержащий Эпштейна — Барра), папилломы и рака кожи половых органов (ДНК-содержащий папиллома-вирус), некоторые виды Т-клеточных лейкозов и лимфом (РНК-содержащий вирус HLTV I) и др. Онкогенные вирусы относятся к семействам ДНК- и РНК-содержащих вирусов.
ДНК-содержащие онковирусы содержат две группы генов: первая группа — гены, необходимые для репликации вируса, вторая группа — гены структурных белков вируса. ДНК-содержащие онковирусы встраиваются либо полностью, либо частично в геном клетки-хозяина и в подавляющем большинстве случаев вызывают гибель этой клетки. Основной механизм смерти инфицированной клетки обусловлен разрушением ее мембраны в момент выхода вирусных частиц. Высказывается предположение, что при попадании ДНК-содержащего онковируса в чувствительные клетки только в одном из миллиона случаев возникает злокачественная трансформация клетки. К ДНК-содержащим онковирусам относятся аденовирус, вирусы группы герпеса, паповавирусы, вирус ветряной оспы и вирус гепатита В. Вирусы данной группы значительно чаще вызывают различные инфекционные болезни, чем опухолевый рост.
РНК-содержащие онковирусы относятся к ретровирусам и за исключением вирусов иммунодефицита человека и гепатита С, не приводят к развитию инфекционных заболеваний. Многие из ретровирусов существуют в организме хозяина годами, не вызывая при этом в нем никаких патологических явлений. Все РНК-содержащие онковирусы подразделяют на быстро- и медленно-трансформирующиеся.
Геном РНК-содержащих вирусов имеет обязательно три группы генов:
- gag — кодирующие белки вируса,
- рО1 — кодирующие обратную транскриптазу, необходимую для синтеза на РНК вирусной ДНК, которая полностью или частично встраивается в геном клетки-хозяина,
- env — кодирующие белки вирусного капсида.
Инфицированная вирусом клетка не погибает, так как РНК-содержащие вирусы покидают ее в основном путем отпочковывания без разрушения клеточной мембраны, и это делает РНК-содержащие вирусы весьма эффективными в отношении трансформации клеток. В настоящее время известно множество онкогенных ретровирусов, вызывающих развитие сарком, лейкозов и солидных опухолей у животных и людей.
В 1976 г. в ретровирусе саркомы Рауса был обнаружен первый ген, ответственный за злокачественную трансформацию клетки. Это был src-онкоген. Экспериментально было установлено, что вирусы саркомы Рауса, лишенные src-онкогена, не способны вызывать развитие опухоли. В настоящее время уже известно более 100 генов вирусов, ответственных за развитие опухолей, которые называются вирусными онкогенами. Трансфекция вирусных онкогенов в клетки приводит к их злокачественной трансформации.
Полиэтиологическая теория канцерогенеза.
Эта теория объединяет все другие, поскольку опухоли — это множество разных болезней, в развитии каждой из которой могут участвовать разные этиологические факторы. Кроме того, эффект всех известных канцерогенов может суммироваться и усиливаться.
Достижения экспериментальной и клинической онкологии XX века позволили установить, что развитие опухолей является результатом возникновения мутаций в соматических клетках, происходящих при повреждении молекул ДНК.
Это заключение подтверждается тремя группами фактов:
- 1) наличием корреляций определенных хромосомных мутаций с некоторыми типами опухолей;
- 2) развитием опухолевого фенотипа в клетках при трансфекции в них онкогенных вирусов;
- 3) обнаружением мутагенных свойств у большинства известных канцерогенных агентов.
КЛЕТОЧНЫЕ ОНКОГЕНЫ, АНТИОНКОГЕНЫ
И СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О КАНЦЕРОГЕНЕЗЕ
Схема 33. Механизмы активации протоонкогенов

Рассматривая различные теории этиологии опухолей, поражаешься тому факту, что разнообразные канцерогенные агенты, отличающиеся по механизмам своего действия, приводят к одному и тому же результату — развитию опухолей, основными свойствами которых является нерегулируемый рост с нарушенной Дифференцировкой клеток. Объяснение этому феномену было дано лишь в последние десятилетия благодаря открытию клеточных онкогенов и антионкогенов. Современное представление о канцерогенезе связывается с возможностью различных канцерогенных агентов вызывать такие повреждения генома клеток, которые сопровождаются активацией клеточных онкогенов и/или инактивацией антионкогенов (схема 33). Связь канцерогенеза с данными генами клеток не случайна, так как именно эти гены могут запускать деление клеток, участвуют в контроле их пролиферации и дифференцировки.
В 1976 г. Stechellen и соавт. у птиц, а в 1978 г. Spector и соавт. у млекопитающих обнаружили участок ДНК, гомологичный вирусным онкогенам. В активном состоянии такие участки получили название клеточных онкогенов, в неактивном — протоонкогенов. Протоонкогены — это нормальные гены клеток. В зрелых тканях они, как правило, неактивны. Активация протоонкогенов и превращение их в клеточные онкогены происходит при опухолевом росте, а также в процессе эмбриогенеза. Некоторые из клеточных онкогенов активируются также при пролиферации и дифференцировке клеток в очагах репаративной регенерации.
Клеточные онкогены кодируют синтез белков, которые называются онкобелками, или онкопротеинами. Следует отметить, что все известные в настоящее время онкобелки принимают участие в передаче митогенетических сигналов от клеточной мембраны до ядра к определенным генам клеток. Это значит, что большинство факторов роста и других цитокинов в той или иной степени могут взаимодействовать с онкобелками.
По функциональной активности и структурному сходству с элементами сигнальной митогенетической цепочки все онкобелки могут быть подразделены на следующие группы:
- онкобелки — гомологи факторов роста (c-sis, int-r, k-fgt и др.);
- онкобелки — голомоги рецепторов к факторам роста (с-erB, с-егbА и др.);
- онкобелки, связанные с работой рецепторов, — аналоги G-белка (c-ras) и протеинкиназные белки (c-src, c-fps, c-fes, c-abl, c-met);
- онкобелки, передающие ростовые сигналы на ДНК (c-fos, c-jun, c-myc и др.).
Для того чтобы стимулировать пролиферацию клеток, протоонкогены должны превратиться в клеточные онкогены. Известны четыре основных механизма активации протоонкогенов:
- инсерционная активация — активация под действием встроенных в геном генов (вирусных);
- активация при транслокации участка хромосомы с встроенным в него протоонкогеном;
- активация путем амплификации (умножении копий) протоонкогена;
- активация при точечных мутациях протоонкогенов (см. схему 33).
Инсерционная активация происходит при участии РНК- и реже ДНК-содержащих вирусов, которые могут встраиваться в геном клетки и своими генами модулировать активность близлежащих клеточных генов, среди которых могут оказаться протоонкогены. Ретровирусы могут быть носителями вирусного онкогена, или энхансера, выполняющего роль активатора онкогенов.
Транслокация участков хромосом в клетках может приводить к контакту протоонкогенов с сильными энхансерами, как это происходит при лимфоме Беркитта и хроническом миелолейкозе человека.
При лимфоме Беркитта наблюдается реципрокная транслокация участков хромосом 8 и 14. В результате участок хромосомы °q24, содержащий c-mic, транслоцируется на участок хромосом 14 14q32, в зону действия гена тяжелых цепей иммуноглобулинов. В Ю % случаев происходит другой вариант реципрокной транслокации с встраиванием участка 8q24, несущего c-myc в хромосому 2, вблизи генов легких цепей иммуноглобулинов. Активные гены иммуноглобулинов выступают в роли энхансеров по отношению к клеточному онкогену с-тус.
Хронический миелоидный лейкоз человека характеризуется специфическим генетическим дефектом — наличием филадельфийской хромосомы, которая образуется в результате реципрокной транслокации между хромосомами 9 и 22. Участок хромосомы 9, несущий протоонкоген c-abl, оказывается на фрагменте хромосомы 22, где формируется новый ген-гибрид c-abl-bcr, белковый продукт которого обладает тирозиназной активностью.
Амплификация клеточного онкогена проявляется в увеличении числа его копий и может захватывать как отдельные гены, так и целые участки хромосом. При этом могут появляться добавочные мелкие хромосомы. Амплификация описана для с-mус и c-ras семейств клеточных онкогенов при раке легкого, мочевого пузыря, толстой кишки, поджелудочной железы.
Амплификация N-myc найдена в человеческой нейробластоме в 38 % случаев и коррелирует с плохим прогнозом жизни больных. Амплификация c-neu, онкобелок которого гомологичен рецепторам к эпидермоидному фактору роста, является плохим прогностическим фактором при раке молочной железы. Накопление в клетках карциномы онкобелка c-neu приводит к усиленному связыванию ростовых факторов, которые синтезируются самими же опухолевыми клетками (ФНО-а), что стимулирует рост опухоли по аутокринному механизму.
Антионкогены, или гены — супрессоры рака. В геноме клеток обнаруживаются гены, которые, напротив, тормозят пролиферацию клеток и оказывают антионкогенное действие. Потеря клеткой таких генов может приводить к развитию рака. Наиболее изученными антионкогенами являются р53 и Rb (retinoblastoma gene). Потеря Rb обнаруживается в редко встречаемой детской опухоли ретинобластоме (частота ретинобластомы 1 на 20 000 детей). 60 % ретинобластом развиваются спорадически, а 40 % описываются как наследственные опухоли с аутосомно-до-минантным типом наследования. В случаях наследственного дефекта Rb нормальный ген отсутствует только на одной аллеле. Вторая аллель остается сохранной, поэтому опухоль может развиться только при одновременном повреждении второго сохранного гена Rb. В случае спонтанно развившейся ретинобластомы потеря Rb затрагивает сразу оба аллеля.
Молекулой 1995 года назван ген-супрессор р53. Существуют две формы антионкогена р53: «дикая» (неизмененная) и мутированная. В опухолевых клетках при многих типах рака обнаруживается накопление мутированной или «дикой» формы р53 в избыточном количестве, что оказывает отрицательное действие на регуляцию клеточного цикла, в связи с чем клетка приобретает способность к усиленной пролиферации.
Регуляция пролиферативной активности клетки с помощью п53 осуществляется через усиление или ослабление им апоптоза (см. лекцию 8 «Некроз» общего курса). Активация р53 на фоне активации клеточных онкогенов c-fos и с-mус приводит к смерти опухолевых клеток, что и наблюдается при действии на опухоль химиопрепаратов и радиации. Мутации р53 или инактивация его другими способами на фоне усиления экспрессии c-fos, c-myc и bcl-2, наоборот, заканчиваются усилением пролиферации клеток и злокачественной трансформацией.
ПАТОГЕНЕЗ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Патогенез злокачественных опухолей в общих чертах может быть представлен как стадийный процесс, состоящий из следующих этапов:
- 1. Изменения в геноме соматической клетки под действием различных канцерогенных агентов и в ряде случаев при наличии определенных наследственных изменений генома.
- 2. Активация клеточных онкогенов и супрессия антионкогенов.
- 3. Экспрессия клеточных онкогенов, нарушения продукции регуляторных генов.
- 4. Злокачественная трансформация клеток с приобретением способности к автономному росту.
ОСНОВНЫЕ СВОЙСТВА ОПУХОЛЕЙ
В зависимости от степени зрелости, темпов роста, характера роста, способности давать метастазы и рецидивировать различают два типа опухолей: доброкачественные и злокачественные.
Доброкачественные опухоли построены из зрелых, дифференцированных клеток, обладают медленным экспансивным ростом с формированием капсулы из соединительной ткани на границе с окружающей нормальной тканью (рост опухоли самой в себе), не рецидивируют после удаления, не дают метастазов. Названия доброкачественных опухолей образуются из корня названия исходной ткани с прибавлением окончания «ома».
Злокачественные опухоли построены из частично или вовсе недифференцированных клеток, растут быстро, прорастая окружающие ткани (инфильтрирующий рост) и тканевые структуры (инвазивный рост), могут рецидивировать и метастазировать. Злокачественные опухоли из эпителия называются Раком, или карциномой, из производных мезенхимной ткани — саркомы. При разборе закономерности опухолевого роста нам Придется постоянно сравнивать эти два типа неоплазм.
Основными свойствами опухолей являются автономный рост, наличие атипизма, способность к прогрессии и метастазированию.
Автономный рост опухоли. Характеризуется отсутствием контроля за пролиферацией и дифференцировкой клеток со стороны организма-опухоленосителя. Это вовсе не означает, что опухолевые клетки находятся в каком-то пролиферативном хаосе. В действительности клетки опухолей переходят на аутокринный или паракринный механизм регулирования своего роста. При аутокринной стимуляции роста опухолевая клетка сама продуцирует факторы роста или онкобелки, — аналоги факторов роста, а также рецепторы, или онкобелки, — аналоги рецепторов факторов роста. Так происходит, например, в мелкоклеточном раке легкого, клетки которого продуцируют ростовой гормон бомбезин и одновременно рецепторы к нему. При этом происходит и паракринная стимуляция, поскольку бомбезин может взаимодействовать и с соседними клетками. Ярким примером паракринной стимуляции опухоли может быть продукция инсулиноподобного фактора роста-2 фибробластами стромы рака легкого. При этом фактор роста взаимодействует с рецепторами на раковых клетках и стимулирует их пролиферацию.
Автономный рост опухоли выражается в утрате контактного торможения и иммортализации (приобретение бессмертия) опухолевых клеток, что может быть объяснено переходом клеток на аутокринный и паракринный пути регулирования своего роста.
Автономность опухоли носит относительный характер, поскольку опухолевая ткань постоянно получает от организма различные питательные вещества, кислород, гормоны, цитокины, приносимые с током крови. Кроме того, она испытывает воздействия иммунной системы и прилежащей окружающей неопухолевой ткани.
Таким образом, автономность опухоли следует понимать не как полную независимость опухолевых клеток от организма, а как приобретение опухолевыми клетками способности к самоуправлению.
В злокачественных опухолях автономный рост выражен в значительной степени, и они растут быстро, прорастая прилежащие нормальные ткани. В доброкачественных опухолях автономный рост выражен крайне слабо, некоторые из них поддаются регуляторным воздействием, растут медленно, не прорастая соседние ткани.
Атипизм опухоли. Термин «атипизм» происходит от греч. atypicus — отклонение от нормы. Помимо термина «атипизм», используются также такие понятия, как «анаплазия» (возврат к эмбриональному этапу развития) и «катаплазия» (уподобление эмбриональной ткани). Последний термин более корректен, так как при опухолевом росте никакого возврата к эмбриональной ткани „е происходит, хотя многие свойства опухолевой ткани сближает ее с эмбриональной.
В опухолях выделяют 4 вида атипизма:
- морфологический,
- биохимический,
- антигенный
- функциональный
Морфологический атипизм. Он также носит название атипизм структуры опухоли» и выражается в том, что ткань опухоли не повторяет строение аналогичной зрелой ткани, и клетки опухоли могут быть не похожи на зрелые клетки того же происхождения.
Морфологический атипизм представлен двумя вариантами: тканевым и клеточным. Тканевый атипизм выражается в изменении соотношения между паренхимой и стромой опухоли, чаще с преобладанием паренхимы; изменением величины и формы тканевых структур с появлением уродливых тканевых образований различной величины. Клеточный атипизм заключается в появлении полиморфизма клеток как по форме, так и по величине, укрупнении в клетках ядер, имеющих часто изрезанные контуры, увеличении ядерно-цитоплазматического соотношения в пользу ядра, появлении крупных ядрышек. В результате патологических митозов в опухолевых клетках обнаруживаются клетки с гиперхромными ядрами, гигантскими ядрами, многоядерные клетки и фигуры патологических митозов.
При электронно-микроскопическом исследовании клеточный атипизм опухолевой клетки проявляется также изменениями структуры ядра с маргинацией хроматина и наличием гетерохроматина, уменьшением количества ядерных пор, что может способствовать разобщению ядра и цитоплазмы опухолевой клетки. Кроме того, на ультраструктурном уровне становится отчетливо видна степень утраты специфической дифференцировки опухолевой клеткой.
Злокачественным опухолям присущи оба типа морфологического атипизма. Имеется определенная положительная корреляция между степенью их выраженности и злокачественностью опухоли. Доброкачественным опухолям свойствен только тканевый атипизм, поскольку они построены из зрелых, дифференцированных клеточных элементов.
Биохимический атипизм. Проявляется в метаболических изменениях в опухолевой ткани. Все перестройки метаболизма в опухоли направлены на обеспечение ее роста и приспособление к относительному дефициту кислорода, который возникает при быстром росте неоплазмы. В опухолевых клетках регистрируется усиленный синтез онкобелков, факторов роста и их рецепторов, уменьшение синтеза и содержания гистонов, синтез эмбриональных белков и рецепторов к ним, превращение опухолевых клеток в факультативные анаэробы, снижение содержания цАМФ. Биохимический атипизм может изучаться с помощью морфологических методов — гисто- и иммуногистохимических поэтому его еще называют гистохимическим атипизмом.
Антигенный атипизм. Г.И.Абелев (1963—1978) выделяет в опухолях 5 типов антигенов:
- антигены вирусных опухолей, которые идентичны для любых опухолей, вызванных данным вирусом;
- антигены опухолей, вызванных канцерогенами;
- изоантигены трансплантационного типа — опухолеспецифичные антигены;
- онкофетальные антигены — эмбриональные антигены (а-фетопротеин, раковоэмбриональный антиген и др.);
- гетероорганные антигены.
Наличие опухолеспецифических антигенов доказывается как экспериментальными, так и клиническими данными. Экспериментально показана возможность отторжения опухолевого трансплантата организмом животного-реципиента имбредных линий мышей, что исключает возможность отторжения за счет конфликта в антигенах гистосовместимости. Другим доказательством является обнаружение среди клеток воспалительного инфильтрата в опухолях цитотоксических Т-лимфоцитов, которые способны взаимодействовать с клеткой-мишенью только при наличии комплементарности по системе главного комплекса гистосовместимости. Аналогичные Т-клеточные инфильтраты были обнаружены в меланомах. В опухолях человека опухолеспецифические антигены обнаружены лишь в единичных неоплазмах — меланоме, нейробластоме, лимфоме Беркитта, остеогенной саркоме, раке толстой кишки, лейкозах. Идентификация этих антигенов иммунологическими и иммуногистохимическими методами широко используется в диагностике данных опухолей.
Таким образом, можно заключить, что антигенный атипизм опухолей проявляется в образовании опухолеспецифических антигенов, онкофетальных антигенов, а также в утрате некоторыми опухолями антигенов гистосовместимости, тканеспецифических антигенов, что приводит к развитию антигенонегативных опухолей и формированию к ним толерантности.
Функциональный атипизм. Характеризуется утратой опухолевыми клетками специализированных функций, присущих аналогичным зрелым клеткам, и/или появлением новой функции, не свойственной клеткам данного типа. Например, клетки низко-дифференцированного скиррозного рака желудка прекращают продуцировать секрет и начинают усиленно синтезировать коллаген стромы опухоли.
Прогрессия опухоли. Теория прогрессии опухолей разработана L.Foulds (1969) на основе данных экспериментальной онкологии. Согласно теории об опухолевой прогрессии, происходит постоянный стадийный прогрессирующий рост опухоли с прохождением опухолью ряда качественно отличных стадий. При этом проявляется автономность не только роста, но и всех других признаков опухоли, как полагал сам автор теории. С последней точкой зрения трудно согласиться, поскольку злокачественность опухоли всегда имеет материальную базу в виде существования активного синтеза определенных онкобелков, факторов роста, их рецепторов, что накладывает отпечаток на проявления морфологического атипизма опухоли и используется в прогнозировании жизни онкологических больных.
МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА, МОРФОГЕНЕЗ И ГИСТОГЕНЕЗ ОПУХОЛЕЙ.
МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ОПУХОЛЕЙ
Опухоли построены из паренхимы и стромы. Паренхима опухоли — это собственно опухолевые клетки, образовавшиеся в результате злокачественной трансформации клетки-предшественницы и ее клональной пролиферации.
Структура опухолевой клетки
Структурные изменения затрагивают все компоненты опухолевой клетки — ядро, цитоплазму, мембраны, органеллы и цитоскелет. Это называется морфологическим атипизмом опухоли и в общих чертах было разобрано в предыдущей лекции.
Ядра опухолевых клеток. Как правило, ядра опухолевых клеток увеличены, полиморфны, их контуры изрезаны, структура Изменена. Ядро имеет неупорядоченно расположенный хроматин с конденсацией его в виде глыбок под кариолеммой. При этом увеличивается относительное содержание гетерохроматина, содержащего неактивную ДНК, по сравнению с эухроматином, построенным из активно работающей ДНК. Уменьшение содержания активно работающей ДНК, а следовательно, и активно работающих генов в опухолевой клетке отражает тот факт, что в
функциональном отношении опухолевая клетка очень примитивна, требует генетического и метаболического обеспечения в основном процессов роста и размножения. Размеры ядра увеличиваются за счет нарушения процессов эндоредупликации ДНК, полиплоидии, эндомитозов, увеличения хромосом в ряде новообразований. В ядрах могут обнаруживаться разнообразные включения: вирусные частицы, внутриядерные тельца, тубулярные структуры, пузырьки, выросты, карманы ядерной мембраны.
Наблюдаются также изменения ядрышек — увеличение их размеров, количества, появление «персистирующих» ядрышек не исчезающих во время митозов, увеличение размеров ядрышкового организатора, в котором сконцентрирована ядрышковая ДНК, кодирующая рибосомальную РНК. Поэтому изменения данной ультраструктуры происходят параллельно с изменениями белоксинтетической функции клетки.
Ядерная мембрана опухолевых клеток бедна ядерными порами, что затрудняет транспортные связи между ядром и цитоплазмой.
Описанные структурные изменения ядер опухолевых клеток сочетаются с хромосомными и генными перестройками: хромосомными аберрациями (количественными и качественными изменениями хромосом), генными мутациями с нарушением процессов репарации ДНК, активацией протоонкогенов и супрессией или потерей генов-супрессоров опухолевого роста. Хромосомные аберрации представлены потерей или избытком каких-либо хромосом, появлением кольцевидных хромосом, транслокацией, делецией и редупликацией хромосом.
Классическим примером реципрокной транслокации хромосом с активацией при этом протоонкогенов являются лимфома Беркитта и хронический миелолейкоз. Делеция, или нетранскрипционная перестройка, характеризуется потерей генетического материала. Примером служит делеция в хромосоме 11, при опухоли почек Вильмса и в хромосоме 13 при ретинобластоме. В ретинобластоме при этом происходит потеря антионкогена Rb. При лейкозах описаны делеции хромосом, опережающие на несколько лет развитие лейкоза. Редупликация хромосом часто сочетается с процессами транслокации и делеции. При хроническом миелолейкозе, помимо маркерного признака в виде филадельфийской хромосомы, например в стадии обострения, нередко наблюдается также полисомия по хромосомам 8, 17 и 19.
Увеличение частоты неоплазм с возрастом связывают с накоплением в соматических клетках мутаций и с возрастной дерепрессией репарации ДНК.
Цитоплазма, органеллы и цитоплазматическая мембрана опухолевых клеток. Поверхность опухолевых клеток отличается увеличенной складчатостью, появлением микровыростов, пузырьков, а в ряде опухолей и микроворсинок различной конфигурации и плотности. Полагают, что в области микроворсинок обычно концентрируются рецепторы, способны воспринимать канцерогенные агенты. Эндоплазматическая сеть в опухолевых клетках может быть развита в разной степени, что отражает белоксинтетическую функцию. Усиление анаэробного гликолиза сопровождается уменьшением в опухолевых клетках количества митохондрий, а также появлением крупных и гигантских митохондрий с нарушенной ориентацией крист. В то же время имеется небольшое количество типов опухолей с высоким содержанием митохондрий в цитоплазме (онкоцитомы, зернисто-клеточный, почечно-клеточный рак).
Особенности цитоскелетона опухолевой клетки обусловлены неупорядоченностью расположения его компонентов. Микротрубочки образуют перинуклеарную сеть, а микрофиламенты в виде пучков обычно локализуются под цитолеммой. Перестройки в цитоскелетоне нарушают работу интегриновых рецепторов и адгезивных молекул, что отражается на изменениях в межклеточных взаимодействиях, обеспечивает процессы инвазивного роста и метастазирования.
Строма опухоли. Второй важный структурный компонент опухоли — ее строма. Строма в опухоли, так же как и строма в нормальной ткани, в основном выполняет трофическую, модулирующую и опорную функции. Стромальные элементы опухоли представлены клетками и экстрацеллюлярным матриксом соединительной ткани, сосудами и нервными окончаниями. Экстрацеллюлярный матрикс опухолей представлен двумя структурными компонентами: ба-зальными мембранами и интерстициальной соединительной тканью. В состав базальных мембран входят коллагены IV, VI и VII типов, гликопротеиды (ламинин, фибронектин, витронектин), протеогликаны (гепаран-сульфат и др.). Интерстициальная соединительная ткань опухоли содержит коллагены I и III типов, фибронектин, протеогликаны и гликозаминогликаны.
Происхождение стромы опухоли. В настоящее время получены убедительные экспериментальные данные о возникновении клеточных элементов стромы опухолей из предсуществующих Нормальных соединительнотканных предшественников окружающей опухоль ткани. J.Folkman (1971) показал, что клетки злокачественных опухолей продуцируют некий фактор, стимулирую-^й пролиферацию элементов соосудистой стенки и рост сосудов. Это сложное вещество белковой природы впоследствии было названо фактором Фолькмана. Как затем было установлено, фактор Фолькмана представляет собой группу факторов роста фибробластов, которых уже известно более 7. Фолькман первым доказал, что стромообразование в опухоли является результатом сложных взаимодействий опухолевой клетки и клеток соединительной ткани.
Важную роль в стромообразовании в неоплазме выполняют соединительнотканные клетки как местного, гистиогенного, так и гематогенного происхождения. Стромальные клетки продуцируют разнообразные факторы роста, стимулирующие пролиферацию клеток мезенхимного происхождения (факторы роста фибробластов, фактор роста тромбоцитов, ФНО-а, фибронектин инсулиноподобные факторы роста и др.), некоторые онкобелки (c-sic, c-myc), одновременно экспрессируют рецепторы, связывающие факторы роста и онкобелки, что позволяет стимулировать их пролиферацию как по аутокринному, так и по паракринному пути. Кроме того, сами клетки стромы способны выделять разнообразные протеолитические ферменты, приводящие к деградации экстрацеллюлярный матрикс.
Опухолевые клетки активно участвуют в образовании стромы. Во-первых, трансформированные клетки стимулируют пролиферацию соединительнотканных клеток по паракринному регуляторному механизму, продуцируют факторы роста и онкобелки. Во-вторых, они способны стимулировать синтез и секрецию соединительнотканными клетками компонентов экстрацеллюлярного матрикса. В-третьих, сами опухолевые клетки способны секретировать определенные компоненты экстрацеллюлярного матрикса. Причем определенный тип таких компонентов имеет характерный состав в некоторых опухолях, что можно использовать при их дифференциальной диагностике. В-четвертых, опухолевые клетки продуцируют ферменты (коллагеназы и др.), их ингибиторы и активаторы, способствующие или, напротив, препятствующие инфильтрирующему и инвазивному росту злокачественных опухолей. Динамическое равновесие между коллагеназами, их активаторами и ингибиторами обеспечивает стабильное состояние опухоли и препятствует прорастанию ее в прилежащие ткани. В момент роста опухолевые клетки активно синтезируют коллагеназы, эластазы и их ингибиторы.
Таким образом, образование стромы в опухоли является сложным многостадийным процессом, основными ступенями которого можно считать следующие:
- секреция опухолевыми клетками митогенных цитокинов -— различных факторов роста и онкобелков, стимулирующих пролиферацию соединительнотканных клеток, прежде всего эндотелия, фибробластов, миофибробластов и гладких мышечных клеток;
- синтез опухолевыми клетками некоторых компонентов экстрацеллюлярного матрикса — коллагенов, ламинина фибронектина и др.;
- пролиферация и дифференцировка клеток-предшественниц Соединительнотканного происхождения, секреция ими компонентов экстрацеллюлярного матрикса и формирование тонкостенных сосудов капиллярного типа, что в совокупности и составляет строму опухоли;
- миграция в строму опухоли клеток гематогенного происхождения — моноцитов, плазмоцитов, лимфоидных элементов, тучных клеток и др.
Злокачественные опухоли часто формируют строму, в которой доминирует тип коллагена стромы соответствующего органа на стадии эмбрионального развития. Так, в строме рака легкого преобладающим типом коллагена является коллаген III, характерный для эмбрионального легкого. Разные опухоли могут отличаться по составу коллагенов стромы. В карциномах, как правило, доминируют коллагены III типа (рак легкого), IV типа (почечноклеточный рак и нефробластомы). В саркомах — интерстициальные коллагены, но в хондросаркоме — коллаген II типа, в синовиальной саркоме — достаточно много коллагена IV типа. Описанные различия в композиции стромы особенно важно учитывать при дифференциальной диагностике сарком.
Ангиогенез в опухоли. Рост опухолей зависит от степени развитости в них сосудистой сети. В новообразованиях диаметром менее 1—2 мм питательные вещества и кислород поступают из тканевой жидкости окружающих тканей путем диффузии. Для питания же более крупных новообразований необходима васкуляризация их ткани.
Ангиогенез в опухоли обеспечивается группой ангиогенных факторов роста, некоторые из которых могут генерироваться также активированными эпителиальными клетками в очагах хронического воспаления и регенерации. Группа ангиогенных факторов опухоли включает в себя факторы роста фибробластов, эндотелия, ангиогенин, фактор роста кератиноцитов, эпидермоидный фактор роста, фактор роста сосудов глиомы, некоторые колониестимулирующие костномозговые факторы и др.
Наряду с факторами роста в ангиогенезе имеет большое значение состав экстрацеллюлярного матрикса стромы опухоли. Благоприятным является содержание в нем компонентов базальных мембран — ламинина, фибронектина и коллагена IV типа. Формирование сосудов в опухолях происходит на фоне извращенной митогенетической стимуляции в измененном экстрацел-люлярном матриксе. Это приводит к развитию неполноценных сосудов преимущественно капиллярного типа, имеющих нередко прерывистую базальную мембрану и нарушенную эндотелиальную выстилку. Эндотелий может замещаться опухолевыми клетями, а иногда и вовсе отсутствовать.
Роль стромы. Для опухоли роль стромы не ограничивается только трофическими и опорными функциями. Строма оказывает модифицирующее влияние на поведение опухолевых клеток т.е. регулирует пролиферацию, дифференцировку опухолевых клеток, возможность инвазивного роста и метастазирования. Модифицирующее воздействие стромы на опухоль осуществляется благодаря наличию на клеточных мембранах опухолевых клеток интегриновых рецепторов и адгезивных молекул, способных передавать сигналы на элементы цитоскелета и дальше в ядро опухолевой клетки.
Интегриновые рецепторы — класс гликопротеидов, расположенных трансмембранно, внутренние концы которых связаны с элементами цитоскелета, а наружный, внеклеточный, способен взаимодействовать с трипептидом субстрата Arg — Gly — Asp. Каждый рецептор состоит из двух субъединиц — альфа и бета, имеющих множество разновидностей. Разнообразие сочетаний субъединиц обеспечивает разнообразие и специфичность интегриновых рецепторов. Интегриновые рецепторы в опухолях подразделяются на межклеточные и интегриновые рецепторы между опухолевыми клетками и компонентами экстрацеллюлярного матрикса — ламининовые, фибронектиновые, витронектиновые, к различным типам коллагенов, гиалуронатовые (к адгезивным молекулам семейства CD44). Интегриновые рецепторы обеспечивают межклеточные взаимодействия между опухолевыми клетками, а также с клетками и экстра-целлюлярным матриксом стромы. В конечном итоге интегриновые рецепторы определяют способность опухоли к инвазивному росту и метастазированию.
Адгезивные молекулы САМ (от англ. cell adhesiv molecules) — другой важный компонент клеточных мембран опухолевых клеток, обеспечивающий их взаимодействие между собой и со стромальными компонентами. Они представлены семействами NCAM, LCAM, N-кадгерином, CD44. При опухолевой трансформации происходит изменение структуры и экспрессии адгезивных молекул, входящих в состав клеточных мембран, что приводит к нарушению взаимосвязи опухолевых клеток, а следовательно, инвазивному росту и метастазированию.
В зависимости от развитости стромы опухоли подразделяют на органоидные и гистиоидные.
В органоидных опухолях имеются паренхима и развитая строма. Примером органоидных опухолей могут служить различные опухоли из эпителия. При этом степень развитости стромы может также варьировать от узких редких фиброзных прослоек и сосудов капиллярного типа в медуллярном раке до мощных полей фиброзной ткани, в которой эпителиальные опухолевые цепочки едва бывают различимыми, в фиброзном раке, или скирре.
В гистиоидных опухолях доминирует паренхима, строма практически отсутствует, так как представлена лишь тонкостенными сосудами капиллярного типа, необходимыми для питания. По гистиоидному типу построены опухоли из собственной соединительной ткани и некоторые другие неоплазмы.
Характер роста опухолей по отношению к окружающим тканям бывает экспансивным с формированием соединительнотканной капсулы и оттеснением прилежащих сохранных тканей, а также инфильтрирующим и инвазивным с прорастанием прилежащих тканей.
В полых органах выделяют также два типа роста в зависимости от отношения опухоли к их просвету: экзофитный при росте опухоли в просвет, и эндофитный — при росте опухоли в стенку органа.
В зависимости от количества узлов первичной опухоли неоплазмы могут обладать уницентрическим или мулътицентрическим характером роста.
МОРФОГЕНЕЗ ОПУХОЛЕЙ
Разбирая морфогенез опухолей, необходимо остановиться на четырех вопросах:
- 1) возникает ли опухоль без каких-либо предшествующих изменений сразу, «с места в карьер» — de novo — или же стадийно
- 2) в случае стадийного развития опухоли, какова сущность этих стадий, в том числе и процесса метастазирования
- 3) развивается ли неоплазма из одной трансформированной клетки, и тогда все опухолевые клетки относятся к одному клону, или же опухолевому росту предшествует трансформация многих клеток
- 4) каково взаимодействие опухоли и организма-опухоленосителя
Стадийность морфогенеза опухолей
На первые два вопроса о развитии опухолей de novo или стадийно отвечают две теории — скачкообразной и стадийной трансформации.
- Теория скачкообразной трансформации. В соответствии с этой теорией H.Ribbert, M.Borst, B.Fischer (1914) опухоль может развиться без предшествующих изменений тканей, о чем свидетельствуют данные экспериментального вирусного канцерогенеза, а также разнообразные клинические наблюдения. Теоретически возможность скачкообразного развития опухоли подтверждается существованием одноступенчатой модели вирусного канцерогенеза. В подавляющем же большинстве экспериментальных моделей опухолей речь идет о многоступенчатом развитии опухолей (см. лекцию 20 «Опухолевый рост»).
- Теория стадийной трансформации при опухолевом росте была разработана отечественным онкологом-экспериментатором Л.М.Шабадом (1968), который одним из первых высказывался о решающем значении мутации соматических клеток в происхождении злокачественных опухолей. В 60-х годах, изучая экспериментальный канцерогенез в различных органах, он предложил выделять четыре стадии в морфогенезе злокачественных опухолей, три из которых относятся к предопухолевым процессам: 1) очаговая гиперплазия; 2) диффузная гиперплазия; 3) доброкачественная опухоль; 4) злокачественная опухоль.
В настоящее время расшифрованы и уточнены следующие стадии морфогенеза злокачественных опухолей:
- стадия предопухоли — гиперплазии и предопухолевой дисплазии;
- стадия неинвазивной опухоли (рак на месте); а стадия инвазивного роста опухоли;
- стадия метастазирования.
Вопрос о взаимоотношении доброкачественных и злокачественных опухолей решается неоднозначно. Бесспорно, существуют доброкачественные опухоли, которые могут трансформироваться в злокачественные. Примером могут служить аденоматозные полипы, аденомы и папилломы, в которых развиваются фокусы малигнизации и рак. Но есть также доброкачественные опухоли, практически никогда не трансформирующиеся в злокачественные аналоги.
Предопухолевая дисплазия. Развитию большинства злокачественных опухолей предшествуют предопухолевые процессы, что наиболее детально изучено в группе эпителиальных опухолей и опухолей системы крови и лимфоидной ткани. В первом случае речь идет о предраке, во втором — о предлейкозе и предлимфоме. К предопухолевым процессам в настоящее время относят диспластические процессы, которые характеризуются развитием изменений как в паренхиматозных, так и стромальных элементах. Основными морфологическими критериями диспластических процессов считают появление признаков клеточного атипизма в паренхиме органа при сохранной структуре ткани. В строме очагов дисплазии регистрируются изменения состава экстрацеллюлярного матрикса, появление клеточного инфильтрата, фибробластическая реакция и др. При дисплазии эпителия обнаруживаются полиморфные эпителиальные клетки с гиперхромными ядрами и фигурами митозов не только в базальных отделах, утолщается базальная мембрана, накапливаются коллагены определенных типов и появляются лимфоидные инфильтраты. В случае предлейкоза увеличивается процент бластных клеток до 9. Помимо стереотипных проявлений дисплазии как пред опухолевого процесса, в разных органах и тканях имеются и свои специфические черты, о чем будет сказано в соответствующих лекциях в частном курсе патологической анатомии.
В большинстве органов диспластический процесс развивается при наличии пролиферации клеточных элементов на фоне предшествующей гиперплазии в связи с хроническим воспалением и дисрегенерацией. Однако в ряде случаев дисплазия сочетается с атрофией ткани, как это бывает при атрофическом гастрите с перестройкой эпителия, а также при циррозе печени. Сочетание дисплазии и атрофии не случайно, так как и тот, и другой процессы имеют общие генетические механизмы, в которых участвует ряд клеточных онкогенов, ген-супрессор р53 и др. В одних ситуациях активация данных генов приводит к апоптозу и атрофии без или в сочетании с дисплазией, в других — к пролиферации также без или в сочетании с дисплазией.
На стадии дисплазии методами иммуногистохимии и молекулярной биологии регистрируются перестройки в работе онкопро-теинов, факторов роста, интегриновых рецепторов и адгезивных молекул. Причем генетические перестройки могут значительно опережать морфологические изменения и служить ранними признаками предопухолевых изменений.
Стадия неинвазивной опухоли. Прогрессирование дисплазии связывают с дополнительными воздействиями, ведущими к последующим генетическим перестройкам и злокачественной трансформации. В результате возникает малигнизированная клетка, которая некоторое время делится, формируя узел (клон) из себе подобных клеток, питаясь за счет диффузии питательных веществ из тканевой жидкости прилежащих нормальных тканей и не прорастая в них. На данной стадии опухолевый узел не имеет еще своих сосудов. Причина этого неизвестна. Вероятно, малая масса опухоли обусловливает недостаточную продукцию факторов, стимулирующих ангиогенез и стромообразо-вание в опухоли. Однако, по нашему мнению, представляется более верной точка зрения об отсутствии в неинвазивной опухоли определенных генных перестроек, которые необходимы для осуществления инвазивного роста.
В случае рака стадия роста опухоли «самой в себе» без разрушения базальной мембраны и без образования стромы и сосудов называется стадией рака на месте — cancer in situ, и выделяется в самостоятельную морфогенетическую стадию. Длительность течения данной стадии может достигать 10 лет и более.
Стадия инвазивной опухоли. Она характеризуйся появлением инфильтрирующего роста. В опухоли появляется развитая сосудистая сеть, строма, выраженная в различной степени, границы с прилежащей неопухолевой тканью отсутству-1От за счет прорастания в нее опухолевых клеток.
Инвазия опухоли протекает в три фазы и обеспечивается определенными генетическими перестройками. Первая фаза инвазии опухоли характеризуется ослаблением контактов между клетками, о чем свидетельствуют уменьшение количества меж. клеточных контактов, снижение концентрации некоторых адгезивных молекул из семейства CD44 и др. и, наоборот, усиления экспрессии других, обеспечивающих мобильность опухолевых клеток и их контакт с экстрацеллюлярным матриксом. На клеточной поверхности снижается концентрация ионов кальция, что приводит к повышению отрицательного заряда опухолевых клеток. Усиливается экспрессия интегриновых рецепторов, обеспечивающих прикрепление клетки к компонентам экстрацеллюлярного матрикса — ламинину, фибронектину, коллагенам. Во второй фазе опухолевая клетка секретирует протеолитические ферменты и их активаторы, которые обеспечивают деградацию экстрацеллюлярного матрикса, освобождая тем самым опухоли путь для инвазии. В то же время продукты деградации фибронектина и ламинина являются хемоаттрактантами для опухолевых клеток, которые мигрируют в зону деградации в третьей фазе инвазии, а затем процесс повторяется снова.
Стадия метастазирования. Это заключительная стадия морфогенеза опухоли, сопровождающаяся определенными гено- и фенотипическими перестройками опухоли. Процесс метастазирования связан с распространением опухолевых клеток из первичной опухоли в другие органы по лимфатическим, кровеносным сосудам, периневрально, имплантационно, что легло в основу выделения видов метастазирования.
Процесс метастазирования объясняется с помощью теории метастатического каскада, в соответствии с которой опухолевая клетка претерпевает цепь (каскад) перестроек, обеспечивающих распространение в отдаленные органы. В процессе метастазирования опухолевая клетка должна обладать определенными качествами, позволяющими ей проникать в прилежащие ткани и просветы сосудов (мелких вен и лимфатических сосудов); отделяться от опухолевого пласта в ток крови (лимфы) в виде отдельных клеток или небольших групп клеток; сохранять жизнеспособность после контакта в токе крови (лимфы) со специфическими и неспецифическими факторами иммунной защиты; мигрировать в венулы (лимфатические сосуды) и прекрепляться к их эндотелию в определенных органах; осуществлять инвазию микрососудов и расти на новом месте в новом окружении.
Метастатический каскад условно может быть разделен на четыре этапа:
- формирование метастатического опухолевого субклона;
- инвазия в просвет сосуда;
- циркуляция опухолевого эмбола в кровотоке (лимфотоке);
- оседание на новом месте с формированием вторичной опухоли (рис. 5).
Рис. 5. Метастатический каскад [Cotran R.S., Robins L.S., 1989]. БМ — базальная мембрана; ЭЦМ — экстрацеллюлярный матрикс.
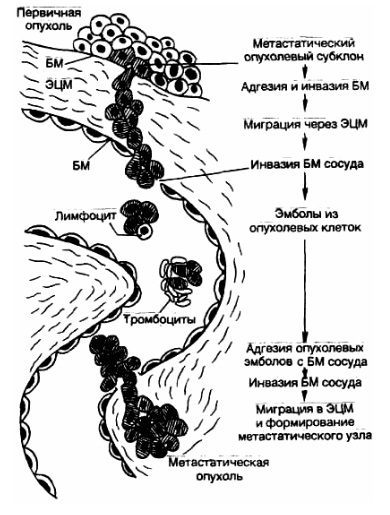
Процесс метастазирования начинается с появления метастатического субклона опухолевых клеток с измененной плазмолеммой, в результате чего клетки теряют межклеточные контакты и приобретают способность к передвижению. Затем опухолевые клетки мигрируют через экстрацеллюлярный матрикс, прикрепляясь интегриновыми рецепторами к ламинину, фибронектину, коллагеновым молекулам базальной мембраны сосуда, осуществляют ее протеолиз за счет выделения коллагеназ, катепсина, эластазы, гликозаминогидролазы, плазмина и др. Это позволяет опухолевым клеткам инвазировать базальную мембрану сосуда, прикрепляться к его эндотелию, а затем, изменяя свои адгезивные свойства (супрессия адгезивных молекул семейства САМ), отделяться как от опухолевого пласта, так и от эндотелия сосуда, «а следующем этапе формируются опухолевые эмболы, которые могут состоять только из опухолевых клеток или же из опухолевых клеток в сочетании с тромбоцитами и лимфоцитами. Фибриновое покрытие таких эмболов может защищать опухолевые клетки от элиминации клетками иммунной системы и действия неспецифических факторов защиты. На заключительном этапе опухолевые клетки взаимодействуют с эндотелием венул за счет «homing»-рецепторов и молекул семейства CD44, происходит прикрепление и протеолиз базальной мембраны, инвазия в периваскулярную ткань и рост вторичной опухоли.
Клональные теории происхождения и эволюции опухоли
Важнейшим в онкогенезе является вопрос о том, развивается ли злокачественная опухоль при малигнизации одной клетки или нескольких. Ответ на этот вопрос неоднозначен, так как, хотя большинство опухолей и имеет моноклоновое происхождение, существует небольшое число опухолей, формирующихся из нескольких клеток.
- Теория моноклонового происхождения опухолей. У большинства опухолей такое происхождение доказывается наблюдениями неоплазм у женщин, гетерозиготных по изоформе глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ). Известно, что ген Г-6-ФДГ локализуется в Х-хромосомах, одна из которых получена от матери, а другая от отца. Одна из двух Х-хромосом, содержащихся в каждой клетке, инактивируется на стадии бластоцисты, и в клетке остается единственная Х-хромо-сома, кодирующая ту или иную изоформу Г-6-ФДГ. Это приводит к тому, что все клетки женского организма подразделяются на две группы в зависимости от изоформы Г-6-ФДГ. Описанная гетерогенность по Г-6-ФДГ свойственна многим женщинам негритянского происхождения. При этом установлено, что развивающиеся у них опухоли состоят из клеток только одного вида по изоформе Г-6-ФДГ, т.е. имеют моноклоновое происхождение. Методом инактивации Х-хромосомы доказано моноклоновое происхождение аденом и карцином толстой кишки, аденом околощитовидной железы. При хроническом миелолейкозе имеется другой маркер моноклонового происхождения опухолевых клеток — филадельфийская хромосома, при Т- и В-клеточных лимфомах и лейкозах — специфические перестройки генов Т- и В-рецепторов, выявляемые с помощью блот-анализа ДНК. Моноклоновое происхождение сопровождается ростом опухоли на начальной стадии развития в виде одного узла — т.е. имеет место уницентрической характер роста. Однако моноклоновость уже развившейся опухоли может быть результатом не моноклонового ее происхождения, а возникать в итоге селекции наиболее злокачественного клона опухолевых клеток и вытеснения им менее злокачественных клонов-
- Теория поликлонового происхождения опухолей. Поликлоновое происхождение опухолей встречается значительно реже, чем моноклоновое, и характерно для опухолей с мультицентричным характером роста, таких как полипоз толстой кишки, мультицентрический рак молочной железы и печени и др.
Мультицентрический характер роста может обусловливать и формирование единого узла опухоли при близком расположении и слиянии нескольких очагов роста. Это положение впервые обосновал Willis в своей теории опухолевого поля (1967). Согласно данной теории, возможно образование одновременно нескольких очагов пролиферации клеток с их последующей трансформацией. По мере роста опухолевые очаги сливаются. При этом опухолевые клетки принадлежат к разным клонам.
В ходе прогрессии опухоли может происходить ее клональная эволюция [Nowell P., 1988], т.е. могут появляться новые клоны опухолевых клеток, возникающие в результате вторичных мутаций, что приводит к поликлоновости опухоли и доминированию наиболее агрессивных клонов как итог клональной селекции. Доброкачественные опухоли характеризуются доминированием опухолевых клеток одного клона на протяжении всего существования, в то время как в злокачественных опухолях постоянно прогрессирует поликлоновость, особенно при низкодифференцированных высокозлокачественных вариантах. Теория клональной эволюции может помочь в объяснении не только прогрессии злокачественной опухоли и метастазирования, но также дать ответы на следующие вопросы: почему в опухолях может возникать феномен «метаплазии» — изменения дифференцировки клеток на отдельных участках? Как может усиливаться злокачественность опухоли со временем или особенно после проведения противоопухолевой терапии? Почему возникают устойчивые к противоопухолевым воздействиям опухоли спонтанно и после терапевтических воздействий (феномен множественной лекарственной устойчивости опухоли).
Взаимодействие опухоли и организма-опухоленосителя
Взаимодействие опухоли и организма-опухоленосителя складывается из действия опухоли на организм и защиты организма-опухоленосителя от опухоли.
Действие опухоли на организм хозяина. Проявляется в локальном и общем воздействии.
Локальное воздействие включает в себя нарушения метаболизма, сдавление прилежащих и разрушение растущей опухолью сохранных тканей, прорастание стенок сосудов, что может приводить к местному венозному застою. Некроз и изъязвление опухоли могут сопровождаться кровотечением, присоединением вторичных инфекций.
Общее воздействие опухоли на организм хозяина может приводить к развитию различных анемий, раковой интоксикации, раковой кахексии и паранеопластических синдромов. Остановимся на двух последних проявлениях.
Раковая кахексия. Характеризуется истощением больного с развитием бурой атрофии миокарда, печени и скелетной мускулатуры. Возникновение раковой кахексии связывают с увеличением уровня белкового обмена в ткани опухоли, которая становится ловушкой всех питательных веществ и обрекает организм на «голодание». В последние годы развитие раковой кахексии связывают также с усиленной продукцией α-ФНО макрофагами и другими клетками в организме-опухоленосителе. а-ФНО называется кахектином, и его патогенетическая роль в возникновении кахексии доказана пока только в экспериментах на животных.
Паранеопластические синдромы. Это синдромы, обусловленные наличием опухоли в организме. Патогенез их различен, но всегда ключевое событие обусловлено воздействием неоплазмы. При гормонально-активных опухолях могут возникнуть различные эндокринопатии, как, например, синдром Иценко — Кушинга при аденомах передней доли гипофиза или нейроэндокринных опухолях легких; гиперкальциемия и остеопороз при аденомах околощитовидных желез и раке легкого. Опухоль, особенно на стадии метастазирования, воздействует на свертывающую и противосвертывающую систему крови, сама продуцирует факторы, усиливающие коагуляцию крови, и способствует развитию различных тромбопатий (мигрирующие тромбофлебиты, небактериальный тромбоэндокардит) и афибриногенемии. При опухолевом росте описан широкий спектр иммунопатологических процессов с иммунокомплексными, анти-тельными и цитотоксическими механизмами развития. Эти процессы приводят к возникновению у онкологических больных нейропатий, миопатий и дерматопатий.
Механизмы противоопухолевой защиты организма. Они разнообразны и складываются из защитных реакций с участием процессов репарации мутированного участка ДНК, сбалансирован’ ной работы генов-супрессоров и клеточных онкогенов, а также из факторов неспецифической и специфической, иммунной и неиммунной защиты.
Рис. 6. Противоопухолевая иммунная реакция.
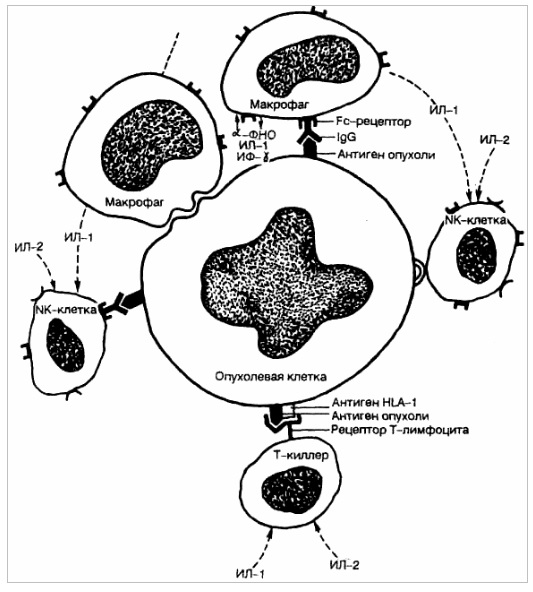
В защите от опухоли имеют значение реакции клеточного и гуморального иммунитета (рис. 6). Основными клетками, участвующими в противоопухолевой иммунной защите, являются специфические цитотоксические Т-лимфоциты, способные распознать мембраносвязанные опухолевые антигены (см. лекцию 20), а также антигены, относящиеся к антигенам I класса основного комплекса гистосовместимости; натуральные Т-киллеры (NK-клетки), вызывающие деструкцию опухолевых клеток предварительной сенсибилизации. Лизис осуществляется за счет непосредственного связывания с опухолевыми клетками или через Fc-фрагменты противоопухолевых антител; макрофаги осуществляют как неспецифическое повреждение опухолевых клеток через выделение а-ФНО и других факторов, так и специфическое иммунное повреждение путем присоединения к Fc. фрагментам противоопухолевых антител и через активацию Т-лимфоцитов, выделяющих 7-интерферон и другие цитокины.
Антительный механизм противоопухолевого иммунитета может осуществляться связыванием противоопухолевыми антителами комплемента с формированием литического комплекса, который взаимодействует с опухолевой клеткой, присоединением к опухолевой клетке через Fc-фрагмент противоопухолевых антител NK-клеток и макрофагов.
Интересным является вопрос о неэффективности иммунных реакций в защите от опухоли. Эту неэффективность, вероятно, можно объяснить развитием иммуносупрессии у онкологических больных, наличием феномена антигенного ускользания опухоли в связи с антигенной лабильностью, антигенным упрощением ее клеток, а также усилением роста опухоли под влиянием противоопухолевых антител.
ГИСТОГЕНЕЗ ОПУХОЛЕЙ
Термин «гистогенез опухолей» означает тканевое происхождение опухоли, что не совсем точно, так как в настоящее время мы можем нередко определять не только тканевое, но и клеточное происхождение неоплазмы, т.е. ее цитогенез. Особенно хорошо изучен цитогенез опухолей кроветворной и лимфоидной ткани — гемобластозов. В основе теории цитогенеза гемобластозов положено учение о стволовых и полустволовых клетках-предшественницах кроветворения.
Многие вопросы происхождения солидных опухолей остаются пока еще спорными, поскольку имеется мало данных о клетках-предшественницах многих тканей. Предлагаются гипотетические схемы цитогенеза рака легкого, желудка, молочной железы и др.
В теории гисто- и цитогенеза опухолей следует выделить несколько основных аспектов.
- 1. Трансформации может подвергаться только пролиферирующая соматическая клетка, т.е. поли- или унипотентные клетки-предшественницы.
- 2. Опухолевая клетка способна повторять в извращенной форме признаки дифференцировки (т.е. фенотип), заложенные в клетке-предшественнице, из которой она возникла.
- 3. В опухолевых клетках извращение дифференцировки связано с наличием блока дифференцировки. При наличии такого блока дифференцировки на уровне унипотентных клеток-предшестественниц опухолевые клетки обладают минимальной фенотипической гетерогенностью. При наличии блока дифференцировки на уровне полипотентных клеток-предшественниц в неоплазме выражена фенотипическая гетерогенность опухолевых клеток и появляются клетки-химеры с множественной дифференцировкой.
- 4. Дифференцировка опухолевых клеток зависит как от уровня малигнизации клетки-предшественницы, так и от уровня блока дифференцировки. Доброкачественные опухоли развиваются при трансформации унипотентных клеток-предшественниц с низким блоком дифференцировки, поэтому они построены из зрелых клеточных элементов.
Злокачественные опухоли характеризуются меньшим уровнем дифференцировки их клеток по сравнению с доброкачественными, что связывается с их развитием из полипотентных клеток-предшественниц и наличием высокого блока дифференцировки. Чем выше уровень малигнизации и уровень блока дифференцировки, тем менее дифференцированна возникающая злокачественная опухоль.
В качестве гисто- и цитогенетических маркеров опухолевых клеток могут использоваться ультраструктурная организация опухолевой клетки, а также генные, хромосомные, антигенные и биомолекулярные маркеры, получившие название «опухолевые маркеры». В группу биомолекулярных опухолевых маркеров относят различные молекулы (факторы роста, рецепторы, онкобелки, адгезивные молекулы, интегриновые рецепторы), ферменты, белки промежуточных филаментов, рецепторов и адгезивных молекул.
МОРФОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ ОПУХОЛЕЙ
В настоящее время всеобъемлющей классификации опухолей не существует, так как имеется ряд спорных нерешенных проблем, таких как гистогенез опухолей, происхождение ряда нормальных клеток, тканевых структур, которые могут быть источником опухоли. До сих пор спорно, например, происхождение некоторых элементов кроветворной системы, ряда структур, обладающих способностью продуцировать биологически активные вещества (APUD-система, гломусные клетки, перициты сосудов, пигментные клетки, интерстициальные клетки поперечно исчерченных мышц, мозгового вещества почек и др.).
Изданная ВОЗ в 1959 г. Всеобщая номенклатура опухолей человека имела ориентировочный характер. В основу ее были положены гистогенетический и локализационный принципы с учетом клинического течения заболевания. В дальнейшем в качестве приложения к МКБ-9 была создана расширенная номенклатура опухолей, которая легла в основу классификаций опухолей ВОЗ. Международная классификация опухолей позволяет сравнивать материалы, полученные в различных странах; она удовлетворяет запросы клинико-анатомического анализа опухолей и дифференциальной диагностики.
Клиницисты в рамках классификаций ВОЗ используют дополнительную классификацию по системе TNM (Т — опухоль, N — метастазы в лимфатические узлы, М — гематогенные метастазы). Эта классификация дает четкое представление о местном распространении опухоли, а также о фазе опухолевого процесса, что имеет большое значение для прогноза и лечебных назначений.
ПРИНЦИПЫ МОРФОЛОГИЧЕСКОЙ КЛАССИФИКАЦИИ
На основании гистогенетического принципа с учетом морфологического строения, локализации, особенностей структуры в отдельных органах, доброкачественности и злокачественности выделено 7 групп опухолей.
- 1. Эпителиальные опухоли без специфической локализации (органонеспецифические).
- 2. Опухоли экзо- и эндокринных желез, а также эпителиальных покровов (органоспецифические).
- 3. Мезенхимальные опухоли.
- 4. Опухоли меланинобразующей ткани.
- 5. Опухоли нервной системы и оболочек мозга.
- 6. Опухоли системы крови.
- 7. Тератомы.
Следует отметить, что деление эпителиальных опухолей на органонеспецифические и органоспецифические не оправдано, так как для большинства опухолей найдены тканевые органоспецифические маркеры, что имеет решающее значение в морфологической диагностике опухолей. В последующем изложении мы рассмотрим наиболее часто встречающиеся группы.
Эпителиальные опухоли без специфической локализации
Эти опухоли, развивающиеся из плоского или железистого эпителия, не выполняющего специфической функции, делят на доброкачественные и злокачественные. Их разновидности приведены в табл. 1.
Таблица 1. Эпителиальные опухоли без специфической локализации
| Источник | Опухоли | |
| доброкачественные | злокачественные | |
| Эпителий: плоский и переходный | Папиллома | Рак на месте, аденокарцинома; плоскоклеточный рак с ороговением, без ороговения |
| призматический и железистый | Аденома: ацинарная, тубулярная, трабекулярная, сосочковая, фиброаденома, аденоматозный полип | Рак на месте, аденокарцинома; слизистый (коллоидный) рак |
| Стволовые клетки и клетки-предшественники эпителия | Рак: солидный, мелкоклеточный, фиброзный, медуллярный | |
Доброкачественные опухоли
К этой группе эпителиальных опухолей относят папиллому и аденому.
Папиллома. Опухоль из плоского или переходного эпителия Обычно имеет сосочковый вид (напоминает цветную капусту) построена из клеток разрастающегося покровного эпителия, число слоев увеличено. Строма выражена хорошо и растет вместе с эпителием. В папилломе сохраняются свойства эпителиальных опухолей: полярность, комплексность и наличие базальной мембраны. Чаще всего папиллома наблюдается на коже, слизистых оболочках полости рта, пищевода, голосовых связок, лоханок почек, мочеточников мочевого пузыря.
Аденома. Опухоль из призматического и железистого эпителия. Встречается на слизистых оболочках, выстланных призматическим эпителием, и в железистых органах. Аденомы слизистых оболочек, выступающие над поверхностью в виде полипа, называют аденоматозными (железистыми) полипами. Если в аденоме сильно развита строма, то говорят о фиброаденоме. В опухоли эпителий сохраняет комплексность. Полярность и базальную мембрану. Различают альвеолярную, трабекулярную, сосочковую аденому, если в аденоме образуются полости, то говорят о цистаденоме.
Злокачественные опухоли
Злокачественная опухоль, развивающаяся из низкодифференцированных клеток эпителия, — это рак. Различают следующие микроскопические формы рака.
«Рак на месте» (carcinoma in situ). Форма рака без инфильтрирующего роста, но с выраженным клеточным атипизмом. Опухоль растет в пределах эпителиального пласта.
- Плоскоклеточный (эпидермальный) рак. Развивается в коже и слизистых оболочках, покрытых плоским эпителием. Опухолевый эпителий теряет полярность, комплексность и базальную мембрану. В результате ороговения (ороговевающий рак) образуются раковые жемчужины. В эпителиальных клетках с низкой дифференцировкой ороговения не происходит. Развивается неороговевающий плоскоклеточный рак.
- Аденокарцинома (железистый рак). Развивается из призматического эпителия, выстилающего слизистые оболочки, и эпителия желез. В опухоли выражен клеточный атипизм, эпителий теряет комплексность, полярность, базальную мембрану. В зависимости от степени дифференцировки выделяют высокодифференцированную, умеренно дифференцированную и низкодифференцированную аденокарциному. В опухоли часто встречаются некрозы и кровоизлияния.
- Слизистый (коллоидный) рак. Клетки, из которых состоит опухоль, продуцируют большое количество слизи, имеют признаки выраженного клеточного атипизма. Слизистый рак — одна из форм низкодифференцированной аденокарциномы.
- Солидный рак. Форма низкодифференцированного рака. В клетках резко выражен клеточный атипизм. Имеет трабекулярное строение.
Мелкоклеточный рак. Форма низкодифференцированного рака. Построен из лимфоцитоподобных клеток. В нем часто отмечаются некрозы и кровоизлияния. - Фиброзный рак (скирр). Построен из атипичных клеток, замурованных в сильно развитой строме (грубоволокнистой соединительной ткани). Относится к низкодифференцированным ракам.
- Медуллярный (аденогенный) рак. Форма низкодифференцированного рака, построенного из атипичных эпителиальных клеток. Характеризуется преобладанием паренхимы над стромой. В нем часто встречаются некрозы и кровоизлияния.
Опухоли экзо- и эндокринных желез, а также эпителиальных покровов
Клетки этих опухолей, сохраняя функциональные и морфологические черты тех органов, из которых они развиваются, встречаются в эпителиальных покровах, экзо- и эндокринных железах.
Опухоли экзокринных желез и эпителиальных покровов
Разновидности экзокринных желез и эпителиальных покровов представлены в табл. 2.
Таблица 2. Опухоли экзокринных и эпителиальных покровов
| Источник | Опухоли | |
| доброкачественные | злокачественные | |
| Печень гепатоциты |
Печеночно-клеточная аденома (гепатома) | Печеночно-клеточный рак |
| Почки эпителий канальцев Метанефрогенная ткань |
Аденома | Почечно-клеточный рак Нефробластома |
| Молочная железа эпителий альвеол и выводных протоков эпителий крупных протоков (локализуется в области соска и ареолы) |
Фиброаденома
(периканаликулярная интраканаликулярная) |
«Рак на месте»:
дольковый, протоковый Болезнь Педжета (рак) |
| Матка оболочка хориона |
Пузырный занос | Деструирующий (злокачественный) пузырный занос;
хорионэпителиома (хорионкарцинома) |
Кожа
|
Сирингоаденома Гидраденома Трихоэпителиома |
Рак
Рак Базально-клеточный рак |
ПЕЧЕНЬ.
- Печеночно-клеточная аденома. Доброкачественная опухоль, возникающая из гепатоцитов, образует трабекулы.
- Печеночно-клеточный (гепатоцеллюлярный) рак. Построен из атипичных гепатоцитов. Может расти в виде одного или нескольких узлов. Обычно строит трабекулы, реже — тубулярные структуры. Строма опухоли выражена слабо, много тонкостенных сосудов.
ПОЧКИ. Аденома. Доброкачественная опухоль, имеет тубулуярное, иногда трабекулярное строение. В зависимости от состава клеток различают темноклеточную, светлоклеточную (гипернефроидную) и ацидофильную аденомы.
- Почечно-клеточный (гипернефроидный) рак. Злокачественная опухоль, построенная из атипичных клеток, часто сопровождается некрозами и кровоизлияниями. Характерны рост по венам и ранние гематогенные метастазы в легкие, кости, печень, противоположную почку. В зависимости от клеточного состава выделяют следующие микроскопические формы: светлоклеточный, зернисто-клеточный, железистый, саркомоподобный, смешанно-клеточный.
- Нефробластома (эмбриональный рак почки, опухоль Вильмса). Злокачественная опухоль смешанного строения, состоит из эпителиальных клеток, образующих солидные и тубулярные структуры, и поперечнополосатых мышц, жировой клетчатки, хряща, сосудов. Встречается у детей.
МОЛОЧНАЯ ЖЕЛЕЗА. Опухоли очень разнообразны и часто развиваются на фоне дисгормональной доброкачественной дисплазии.
- Фиброаденома. Доброкачественная опухоль из железистого эпителия с сильно развитой стромой. Различают перикана-ликулярную, интраканаликулярную фиброаденомы. Редко встречается листовидная (филлоидная) опухоль.
- Рак молочной железы. Представлен следующими формами: неинфильтрирующим дольковым и внутрипротоко-вым раком, болезнью Педжета.
- Неинфильтрирующий дольковый рак (дольковый «рак на месте»). Построен из атипичных клеток, растет в дольке, имеет железистый или солидный варианты.
- Неинфильтрующий внутрипротоковый рак (протоковый «рак на месте»). Может быть сосочковым, криброзным и угревидным. Растет в пределах протока, часто подвергается некрозу, возможны кальцинаты.
- Болезнь Педжета. Развивается из эпидермиса или эпителиальных клеток крупных протоков. Образуются крупные светлые клетки (клетки Педжета) в базальных и средних слоях эпидермиса. Опухоль локализуется в области соска и ареолы.
Все перечисленные формы рака молочной железы при прогрессировании превращаются в инфильтрирующий рак молочной железы.
МАТКА. Эпителиальные опухоли представлены деструирующим пузырным заносом и хорионэпителиомой.
- Деструирующий (злокачественный) пузырный занос. Представлен ворсинами хориона крупных размеров, врастающими в стенки вен матки и малого таза. В ворсинах преобладают синци-тиальные клетки. Иногда очень трудно отличить от хорионэпителиомы.
- Хорионэпителиома (хорионкарцинома). Злокачественна опухоль трофобласта, развивается из остатков последа. Описана М.Н.Никифоровым (1886) и Маршаном (1887). Состоит из элементов цито- и синцитиотрофобласта. Строма опухоли отсутствует, сосуды имеют вид полостей, в которых плавают опухолевые клетки. Характерны гематогенные метастазы. Опухоль гормонально активна, симулирует беременность. Иногда встречаются эктопические хорионэпителиомы: в средостении, яичках у мужчин, мочевом пузыре, яичнике у женщин.
КОЖА. Опухоли многочисленны. Рассмотрим наиболее важные.
- Сирингоаденома. Доброкачественная опухоль из эпителия протоков потовых желез. Характерны выстилка двухслойным эпителием, образование сосочков и тубул.
- Гидраденома. Доброкачественная опухоль из секреторного эпителия потовых желез, часто формирует сосочки.
- Трихоэпителиома. Доброкачественная опухоль из эпителия волосяного фолликула, типичны кисты, заполненные роговым веществом.
- Базально-клеточный рак (базалиома). Опухоль развивается из базальных клеток эпидермиса, клетки располагаются тяжами или гнездами. Опухоль растет радиально, разрушая прилежащую ткань, но метастазов не дает. Может рецидивировать.
- Злокачественные опухоли производных кожи представлены раком потовых, сальных желез и волосяных фолликулов. Встречаются редко.
Опухоли эндокринных желез
Разновидности этих опухолей представлены в табл. 3.
Таблица 3. Опухоли эндокринных желез
| Источник | Опухоли | |
| доброкачественные | злокачественные | |
| Яичники
трубно-маточный эпителий строма полового тяжа клетки зачатка мужской половой железы |
Серозная и муцинозная цистаденома
Текома Гранулезоклеточная опухоль |
Серозная цистаденокарцинома; псевдомуцинозная цисткарцинома Текома злокачественная Гранулезоклеточная опухоль злокачественная Дисгерминома |
| Яички
половые клетки гранулоциты (клетки Лейдига) |
Опухоль из клеток Лейдига
Опухоль из клеток Сертоли |
Семинома |
| герминогенные клетки и клетки стромы | Гонадобластома | |
| Щитовидная железа
клетки А и В |
Аденома фолликулярная | Фолликулярный, папиллярный, не-
дифференцированный рак (мелко- и гигантоклеточный) |
| клетки С | Аденома солидная | Солидный рак с амилоидозом стромы (медуллярный рак) |
| Околощитовидные железы главные клетки | Аденома | Рак |
| Надпочечники
клетки коркового слоя |
Аденомы адренокортикальные | Адренокортикальный рак |
| клетки мозгового слоя | Феохромоцитома | Злокачественная феохромоцитома |
| Вилочковая железа эпителиальные клетки | Тимома (кортикально-клеточная, медуллярно-клеточная, смешанно-клеточная, гранулематозная) | Рак |
| Гипофиз | Аденома хромофобная, эозинофильная, базофильная | Рак |
| Эпифиз | Пинеалома | |
| Поджелудочная железа | Злокачественные | |
| В-клетки
С-клетки А-клетки D1-клетки Ес-клетки D-клетки |
Инсулинома
Гастринома Глюкагонома Випома Серотонинома Соматостатинома |
инсулинома,
гастринома, глюкагонома, випома, серотонинома, соматостатинома |
| Желудочно-кишечный тракт
энтерохромаффинные клетки |
Карциноид | Злокачественный
карциноид |
ЯИЧНИКИ. Опухоли могут развиваться из эпителия, стромы, полового тяжа и герминогенной ткани, могут быть доброкачественными и злокачественными. Рассмотрены наиболее важные опухоли яичников.
- Серозная цистаденома. Доброкачественная эпителиальная опухоль, имеющая вид кисты, обычно заполнена серозной жидкостью. Иногда в кистах возможно сосочковое разрастание эпителия.
- Муцинозная цистаденома (псевдомуцинозная кистома). Доброкачественная эпителиальная опухоль. Кисты выстланы призматическим эпителием, в полости находится слизь. Иногда выстилающий эпителий образует сосочки. В случае разрыва кисты возможна также имплантация клеток кисты по брюшине.
- Серозная цистаденокарцинома. Злокачественная эпителиальная опухоль, обычно имеет сосочковое строение. Характерны имплантационные метастазы по брюшине.
- Псевдомуцинозная цисткарцинома (рак из псевдомуцинозной кисты). Злокачественная эпителиальная опухоль, построенная из атипичных клеток, образующих солидные, железистые и криб-розные структуры. Часто встречается некроз.
- Текома. Доброкачественная опухоль из стромы полового тяжа. По строению может напоминать фиброму. Этот вариант опухоли обычно гормонально-неактивный. Если опухоль построена из светлых, напоминающих эпителий клеток, то она обычно гормонально-активная и продуцирует эстрогены.
- Злокачественная текома. Характеризуется выраженным полиморфизмом и атипией клеток, напоминает саркому, гормонально-неактивна.
- Гранулезоклеточная опухоль (фолликулома). Доброкачественная опухоль полового тяжа. Растет из гранулезы. Клетки образуют трабекулярные и тубулярные структуры. Опухоль гормонально-активная, вырабатывает эстрогены.
- Злокачественная гранулезоклеточная опухоль (рак). Отличается большим полиморфизмом клеток, быстрым ростом и метастазами.
- Дисгерминома. Злокачественная опухоль, образующаяся из клеток зачатка мужской половой железы, напоминает семиному, в строме встречаются лимфоциты.
ЯИЧКИ. Опухоли весьма разнообразны.
Различают:
- 1) герминогенные опухоли;
- 2) опухоли из клеток гонадной стромы;
- 3) опухоли, возникающие из оболочек яичка и придатков;
- 4) опухоли, развивающиеся из герминогенных элементов и клеток гонадной стромы.
- Семинома (дисгерминома). Злокачественная опухоль, построенная из герминогенного атипичного эпителия. Наиболее часто тречающаяся опухоль. Довольно рано дает метастазы. Нередко сопровождается некрозами.
- Опухоль из клеток Лейдига (лейдигома). Развивается из гландулоцитов — клеток гонадной стромы, доброкачественная, гормонально-активная.
- Опухоль из клеток Сертоли. Доброкачественная опухоль из сустентоцитов, гормонально-активная, вызывает преждевременное половое созревание у детей.
- Опухоли из герминогенных клеток и клеток гонадной стромы (гонадобластомы). Развиваются из клеток типа семиномы и клеток, напоминающих сустентоциты и гранулезоклеточные элементы. Обычно метастазирует герминогенный компонент.
ЩИТОВИДНАЯ ЖЕЛЕЗА. Опухоли могут возникать из клеток А, В, С, бывают доброкачественными и злокачественными.
- Фолликулярная аденома. Возникает из клеток А и В, по строению напоминает щитовидную железу.
- Солидная аденома. Развивается из клеток С, которые вырабатывают кальцитонин. Иногда образует сосочки. Наличие последних является неблагоприятным признаком в отношении малигнизации.
- Рак щитовидной железы. Чаще развивается из предшествующей аденомы.
- Фолликулярный рак. Злокачественный аналог фолликулярной аденомы. Построен из атипичных клеток. Дает преимущественно гематогенные метастазы в легкие и кости.
- Папиллярный рак. Самая частая злокачественная опухоль щитовидной железы. Построен из атипичных клеток, образующих сосочки.
- Солидный (медуллярный) рак. Развивается из клеток С, которые вырабатывают кальцитонин. Характерно, что при этом раке в строме часто выявляют амилоид, который образуется опухолевыми клетками, относящимися к APUD-системе. Такой амилоид называют APUD-амилоидом.
- Недифференцированный рак. Построен из атипичных полиморфных клеток, различают два варианта: мелко- и гигантокле-точный.
ОКОЛОЩИТОВИДНЫЕ ЖЕЛЕЗЫ.
- Аденома. Имеет обычно трабекулярное строение, гормонально-активная. Сопровождается гиперпаратиреозом, который обусловливает развитие фиброзной остеодистрофии.
- Рак околощитовидных желез. Не имеет специфических черт, встречается редко.
НАДПОЧЕЧНИКИ. Опухоли возникают из коркового и мозгового слоев. Могут быть доброкачественными и злокачественными.
- Доброкачественные опухоли коркового слоя. Светлоклеточная адренокортикальная аденома. Вырабатывает альдостерон и вызывает синдром Кона. Эту аденому называют также альдостеромой.
- Темноклеточная адренокортикальная аденома. Вырабатывает андрогены (андростерома), поэтому возникают признаки вирилизма, реже синдрома Кушинга.
- Смешанная адренокортикальная аденома. Проявляется ги-перкортицизмом (синдром Кушинга), называется кортикотеромой.
- Гломерулезоклеточная аденома. Проявляется повышенной выработкой минералокортикоидов.
- Злокачественная опухоль коркового слоя надпочечников. Адренокортикальный рак. Построен из атипичных полиморфных клеток, дает преимущественно гематогенное метастазирование.
- Доброкачественная опухоль мозгового вещества. Феохромоцитома. Это гормонально-активная опухоль выделяет большое количество катехоламинов, что приводит к повышению артериального давления.
- Злокачественная опухоль мозгового слоя надпочечников. Злокачественная феохромоцитома (феохромобластома). Характеризуется выраженным клеточным атипизмом, обычно гормонально-неактивная.
ВИЛОЧКОВАЯ ЖЕЛЕЗА. Опухоли, возникающие из кортикальных и медуллярных клеток, бывают доброкачественными и злокачественными. Клинически протекают бессимптомно либо вызывают миастению, иммунодефицитные синдромы и аутоиммунные заболевания (системная красная волчанка).
Различают 4 вида тимом.
- Кортикально-клеточная тимома. Возникает из кортикального эпителия, обладает инфильтрирующим ростом, имеет умеренный клеточный атипизм.
- Медуллярно-клеточная тимома. Происходит из эпителия мозгового вещества, опухоль обычно доброкачественная.
- Смешанно-клеточная тимома. Обладает признаками описанных ранее тимом.
- Гранулематозная тимома. Построена из атипичных многоядерных эпителиальных клеток, формирующих гранулематозные образования.
ГИПОФИЗ. Аденома.
Гистологически различают аденомы:
- хромофобную
- эозинофильную
- базофильную.
Обычно эти опухоли обладают гормональной активностью. В зависимости от гормональной активности аденом выделяют:
- соматотропную,
- пролактиновую аденому;
- аденому из клеток, секретирующих АКТГ;
- аденому, секретирующую тиреотропный гормон;
- аденому из клеток, секретирующих фолликулостимулирующий гормон.
Рак. Злокачественный аналог аденом гипофиза.
ЭПИФИЗ. Пинеалома. Доброкачественная опухоль из железистого эпителия и нейроглии; вызывает обменные и гормональные нарушения.
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА. Опухоли островкового аппарата поджелудочной железы относятся к опухолям APUD-системы (апудомам). Различают следующие опухоли.
- Инсулинома. Развивается из В-клеток островкового аппарата. По строению напоминает трабекулярную или тубулярную аденому. Гормонально-активна, клетки вырабатывают большое количество инсулина, что приводит к развитию гипогликемического синдрома.
- Гастринома. Развивается из G-клеток. Бывает множественной. По строению напоминает трабекулярную аденому. Гормонально-активна, клетки вырабатывают большое количество га-стрина, что приводит к развитию синдрома Золлингера — Элли-сона.
- Глюкагонома. Появляется из А-клеток, которые синтезируют глюкагон. По строению имеет вид трабекулярной аденомы. Вызывает гипергликемическое состояние и развитие сахарного диабета.
- Випома. Развивается из D{ -клеток, продуцирующих гормон, аналогичный вазоактивному интестинальному полипептидному гормону (ВИП). По строению плиднотрабекулярная, вызывает гипокалиемию и дегидратацию.
- Серотонинома. Возникает из Ес-клеток, вырабатывающих 5-гидрокситриптамин. Имеет солидно-трабекулярное строение, вызывает карциноидный синдром.
- Соматостатинома. Аденома из D-клеток. По строению напоминает солидно-трабекулярную аденому; характерны гипоинсулинемия, гипоглюкагонемия, стеаторея, ахлоргидрия.
Все эти опухоли имеют злокачественные аналоги, которые могут быть гормонально-активными, их называют злокачественными инсулиномами, гастриномами и т.д.
ЖЕЛУДОЧНО-КИШЕЧНЫЙ ТРАКТ. Карциноид. Развивается в слизистой оболочке желудочно-кишечного тракта из энтерохромаффинных клеток, вырабатывающих различные биогенные амины (чаще всего серотонин). Опухоль по строению напоминает солидно-трабекулярную аденому, дает аргентаффинную и хромаффинную реакцию. Клетки этой опухоли относятся к APUD-системе. У больных вызывают карциноидный синдром.
Злокачественный карциноид. Злокачественный аналог карциноида.
Мезенхимальные опухоли
Из мезенхимы развиваются соединительная ткань, сосуды, мышцы, кости, хрящ, серозные оболочки, кроветворная система, gee эти ткани являются источником как доброкачественных, так и злокачественных опухолей (табл. 4).
Таблица 4. Мезенхимальные опухоли
| Источник | Опухоли | |
| доброкачественные | злокачественные | |
| Соединительная (фиброзная) ткань | Фиброма: плотная, мягкая, десмоид | Фибросаркома: дифференцированная, недифференцированная |
| Дерматофиброма (гистиоцитома) | Выбухающая дерматофиброма (злокачественная гистиоцитома) | |
| Жировая ткань | Липома | Липосаркома |
| Гибернома | Злокачественная гибернома | |
| Мышечная ткань | Лейомиома | Лейомиосаркома |
| Рабдомиома | Рабдомиосаркома | |
| Зернисто-клеточная опухоль | Злокачественная зернисто-клеточная опухоль | |
| Кровеносные сосуды | Гемангиома: капиллярная, венозная, кавернозная; доброкачественная гемангиоперицитома | Ангиосаркома: злокачественная гемангиоэндотелиома, злокачественная гемангиоперицитома |
| Гломусная опухоль (гломус-ангиома) | ||
| Лимфатические сосуды | Лимфангиома | Лимфангиосаркома (злокачественная лимфангиоэндотелиома) |
| Синовиальные оболочки | Доброкачественная синовиома | Синовиальная саркома (злокачественная синовиома) |
| Мезотелиальная ткань | Доброкачественная мезотелиома | Злокачественная мезотелиома |
| Костная ткань | Остеома, доброкачественная остеобластома | Остеосаркома |
| Хондрома, доброкачественная хондро-5ластома Гигантоклеточная опухоль | Хондросаркома | |
Доброкачественные опухоли
Фиброма. Опухоль соединительной ткани построена из клеток типа фибробластов, фиброцитов и пучков коллагеновых волокон. Выделяют два вида фибром: плотную с преобладанием пучков коллагеновых волокон и мягкую, построенную из большого количества клеток и рыхлой соединительной ткани. Десмоид — особая разновидность фибромы, характеризующаяся инфильтрирующим ростом. После удаления рецидивирует. Встречается преимущественно у женщин.
Дерматофиброма (гистиоцитома). Построена из клеток типа фибробластов, гистиоцитов, макрофагов, фиброцитов. Характерны крупные многоядерные клетки, содержащие гемосидерин и липиды (клетки Тутона). Встречается чаще всего на коже конечностей.
Липома. Построена из липоцитов жировой клетчатки, бывает одиночной или множественной. Иногда растет, инифильтрируя мышцы (внутримышечная, или инфильтрирующая, липома).
Гибернома. Развивается из клеток бурого жира, обычно одиночная. Чаще всего локализуется в межлопаточной области спины.
Лейомиома. Возникает из гладких мышц, пучки мышечных волокон хаотично переплетаются. Для отличия от фибромы ткань окрашивают по методу Ван-Гизона. Если строма развита сильно, то говорят о фибромиоме.
Рабдомиома. Развивается из клеток поперечнополосатых мышц, напоминающих эмбриональные мышечные волокна.
Зернисто-клеточная опухоль (опухоль Абрикосова). Имеет нейрогенное происхождение, развивается из клеток шванновской оболочки нервов. Наиболее часто локализуется в языке.
Гемангиома. Собирательное понятие. Различают следующие виды:
- капиллярная гемангиома — построена из ветвящихся сосудов капиллярного типа, чаще локализуется в коже;
- венозная гемангиома — построена из сосудов, образующих полости, напоминающие вены;
- кавернозная гемангиома — состоит из крупных тонкостенных сосудистых полостей, заполненных кровью (встречается в печени, коже);
- доброкачественная гемангиоперицитома — построена из хаотично переплетающихся капилляров, окруженных муфтами из пролиферирующих перицитов.
Гломусная опухоль (гломус-ангиома). Построена из сосудов, окруженных гломусными клетками, богата нервными волокнами.
Лимфангиома. Построена из лимфатических сосудов различной формы и размеров, заполненных лимфой.
Доброкачественная синовиома. Развивается из синовиоцитов сухожильных влагалищ и сухожилий. Строит альвеолярные структуры. Часто образует гигантские клетки. Иногда в опухоли встречаются ксантомные клетки.
Доброкачественная мезотелиома. Возникает из мезотелия, напоминает фиброму.
Остеома. Построена из костных балочек, разделенных волокнистой тканью, различают губчатую и компактную остеомы.
Доброкачественная остеобластома. Состоит из мелких остеоидных, частично обызвествленных костных балочек, разделенных волокнистой тканью с остеокластами.
Хондрома. Построена из беспорядочно расположенных клеток гиалинового хряща (если опухоль локализуется в периферических отделах кости, то ее называют экхондромой, если в центральных — энхондромой).
Доброкачественная хондробластома. Отличается от хондромы лишь тем, что в ней обнаруживают хондробласты.
Гигантоклеточная опухоль. Построена из гигантских клеток и фиброзной ткани, в ней встречаются и ксантомные клетки. Гистогенез этой опухоли неясен, она дает рецидивы, иногда метастазирует гематогенным путем.
Злокачественные опухоли
Злокачественные опухоли из мезенхимы обладают выраженным клеточным атипизмом, их называют саркомой. Характерно метастазирование гематогенным путем.
Фибросаркома. Злокачественная опухоль соединительной ткани. Построена из атипичных фибробластоподобных клеток. В зависимости от степени дифференцировки выделяют дифференцированную фибросаркому, которая поздно дает метастазы, и низкодифференцированную фибросаркому, для которой характерны и ранние метастазы.
Выбухающая дерматофиброма (злокачественная гистиоцитома). Отличается от доброкачественного аналога наличием атипичных клеток с митозами. Растет медленно, метастазы дает Редко.
Липосаркома (липобластическая липома). Злокачественная опухоль из жировой ткани. Различают несколько ее типов: преимущественно высокодифференцированную, преимущественно Миксоидную, преимущественно круглоклеточную, преимущественно полиморфно-клеточную. Липосаркомы растут медленно, поздно дают метастазы.
Злокачественная гибернома. Отличается от доброкачественного аналога выраженным клеточным полиморфизмом. Иногда встречаются гигантские клетки.
Лейомиосаркома. Злокачественная опухоль из гладких мыщц. Характеризуется выраженным полиморфизмом клеток и большим количеством митозов.
Рабдомиосаркома. Редкая злокачественная опухоль из поперечнополосатых мышц. Имеет полиморфное строение, что часто затрудняет дифференциальную диагностику.
Злокачественная зернисто-клеточная опухоль. Отличается от доброкачественного аналога выраженным полиморфизмом клеток, митозами.
Ангиосаркома. Злокачественная опухоль из сосудов. Отличается выраженным клеточным атипизмом, происходит из эндотелиальных клеток (злокачественная гемангиоэндотелиома) или перицитов (злокачественная гемангиоперицитома). Для опухоли характерны быстрый рост и ранние метастазы.
Лимфангиосаркома. Злокачественная опухоль лимфатических сосудов.
Синовиальная саркома (злокачественная синовиома). Имеет монофазное или двухфазное строение из клеток, образующих псевдоэпителиальные железистые образования, и атипичных фибробластоподобных клеток. Растет быстро, рано метастазирует.
Злокачественная мезотелиома. Развивается в брюшине, плевре. Построена из атипичных клеток, образующих сосочковые или тубулярные структуры.
Остеосаркома (остеогенная саркома). Построена из атипичных клеток типа остеобластов с множеством митозом и примитивной кости. В зависимости от особенностей образования кости различают остеобластическую и остеолитическую формы.
Хондросаркома. Характеризуется выраженным полиморфизмом атипичных клеток хондроидного типа, образованием хондроидного межклеточного вещества. Могут быть очаги остеогенеза, ослизнения. Растет медленно, дает поздние метастазы.
Экспертами ВОЗ (1969) выделена группа мягкотканных опухолей. В нее включены опухоли всех неэпителиальных внескелетных тканей, за исключением лимфоретикулярной системы, а также нейроэктодермальные опухоли периферической нервной системы и нервных ганглиев.
Опухоли меланинобразующей ткани
Меланинобразующие клетки (меланоциты) возникают из шванновской оболочки периферических нервов. Опухолеподобные образования представлены невусами, истинные опухоли — меланомой.
Невусы. Наиболее часто встречаются в коже. В зависимости от расположения различают: 1) пограничный невус, растущий на границе эпидермиса и дермы; внутридермальный, расположенный только в дерме; сложный (смешанный), характеризующийся чертами пограничного и интрадермального невусов; эпителиоидный (веретеноклеточный), встречающийся у детей (ювенильный невус), в нем иногда выявляют многоядерные гигантские клетки.
Меланома (меланосаркома, злокачественная меланома). Одна яз самых злокачественных опухолей человека. Быстро растет, очень рано метастазирует как гематогенно, так и лимфогенно. Локализуется везде, где есть пигментные клетки. Строение опухоли полиморфно, клетки с выраженным клеточным атипизмом. По классификации Кларка выделяют следующие формы: поверхностно распространяющаяся, типа злокачественного лентиго, узловая. Решающее значение для прогноза опухоли имеет глубина прорастания опухоли в дерму и подкожную основу (жировую клетчатку) — выделяют 5 стадий. Меланома может быть пигментной и беспигментной.
Опухоли нервной системы и оболочек мозга
Опухоли могут происходить из центральной, автономной (вегетативной), периферической нервной системы и входящих в состав этой системы мезенхимальных элементов (табл. 5). Опухоли могут быть доброкачественными и злокачественными. Следует отметить, что при локализации опухолей в ЦНС вне зависимости от строения течение всех опухолей злокачественное. Еще одной особенностью опухолей ЦНС является то, что они метастазируют в пределах головного и спинного мозга.
Таблица 5. Опухоли нервной системы и оболочек мозга
| Исходная клетка | Опухоли | |||
| доброкачественные | злокачественные | |||
|
Опухоли центральной нервной системы |
||||
|
Нейроэктодермальные опухоли |
||||
|
Глиальные (астроцитарные) опухоли |
||||
| Астроцит, астробласт | Астроцитома | Астробластома | ||
|
Глиальные (олигодендроглиальные) опухоли |
||||
| Олигодендроглиоцит, олигодендроглиобласт | Олигодендроглиома | Олигодендроглиобластома | ||
|
Эпендимальные опухоли и опухоли хориоидного эпителия |
||||
| Эпендимоцит, эпендимобласт хориоидэпителий | Эпендимома
Хориоидная папиллома |
Эпендимобластома
Хориоидкарцинома |
||
|
Нейрональные опухоли |
||||
| Ганглионейроцит | Ганглионеврома (ганглиоцитома) | Ганглионейробластома | ||
| Ганглионейробласт | Нейробластома | |||
|
Низкодифференцированные и эмбриональные опухоли |
||||
| Медуллобласт | Медуллобластома | |||
| Глиобласт | Глиобластома | |||
|
Менингососудистые опухоли |
||||
| Менинготелий | Менингиома | Менингеальная саркома | ||
|
Опухоли автономной (вегетативной) нервной системы |
||||
| Симпатогонии | Симпатобластома (симпатогониома) | |||
| Ганглионейробласт | Ганглионейробластома | |||
| Ганглионейроцит | Ганглионеврома | |||
| Клетки нехромаффинных параганглиев | Доброкачественная нехромаффинная параганглиома (гломусная опухоль, хемодектома) | Злокачественная нехромаффинная параганглиома (хемодектома) | ||
|
Опухоли периферической нервной системы |
||||
| Леммоцит
(шванновская клетка) |
Неврилеммома (шваннома), нейрофиброматоз (болезнь Реклингхаузена) | Злокачественная неврилеммома (нейрогенная саркома) | ||
Опухоли центральной нервной системы
Опухоли ЦНС разделяются на нейроэктодермальные и менингососудистые.
Нейроэктодермальные опухоли
Нейроэктодермальные опухоли развиваются наиболее часто из элементов глии и представлены различными доброкачественными и злокачественными глиомами.
Глиальные опухоли
Астроцитома. Доброкачественная опухоль, одна из частых опухолей нейроэктодермальной природы. Развивается из клеток астроцитарной глии. В зависимости от строения выделяют фибриллярную, протоплазматическую, фибриллярно-протоплазматическую астроцитому.
Астробластома. Злокачественный аналог астроцитомы. Отличается клеточным атипизмом, быстрым ростом, некрозами и метастазами в пределах ЦНС.
Олигодендроглиома. Доброкачественная опухоль из олигодендроглии. В ней встречаются иногда кальцинаты, кисты.
Олигодендроглиобластома. Злокачественная опухоль с выраженным клеточным атипизмом, наличием очагов некроза. Быстро растет.
Эпендимальные опухоли и опухоли хориоидного эпителия
Эпендимома. Доброкачественная опухоль глиальной природы, развивающаяся из эпендимы желудочков мозга; образует псевдорозетки вокруг сосудов.
Эпендимобластома. Злокачественная опухоль. Характеризуется выраженным клеточным полиморфизмом, напоминает глиобластому. Растет быстро, дает метастазы в пределах ЦНС.
Хориоидная папиллома (хориоидпапиллома). Доброкачественная опухоль, развивается из эпителия сосудистого сплетения мозга, состоит из ворсинчатых разрастаний эпителия.
Хориоидкарцинома (злокачественная хориоидная папиллома). Расположена в желудочках мозга, построена из атипичных клеток хориоидэпителия (папиллярный рак). Встречается редко.
Нейрональные опухоли
Ганглионеврома (ганглиоцитома). Доброкачественная опухоль, построенная из зрелых ганглиозных клеток. Встречается Редко.
Ганглионейробластома. Очень редкая опухоль, злокачественный аналог ганглионевромы.
Нейробластома. Построена из нейробластов, включает много митозов, клетки растут, образуя синцитий. Встречается редко.
Низкодифференцированные и эмбриональные опухоли
Медуллобластома. Очень злокачественная опухоль, построенная из медуллобластов. Встречается у детей, расположена обычно в черве мозжечка.
Глиобластома. Одна из самых частых злокачественных опухолей головного мозга. Для нее характерны выраженный клеточный атипизм, некрозы и кровоизлияния. Опухоль быстро растет и рано дает метастазы.
Менингососудистые опухоли
Опухоли возникают из оболочек мозга и родственных им тканей.
Менингиома (арахноидэндотелиома). Доброкачественная опухоль, исходящая из мягких мозговых оболочек, построена из эндотелиоподобных клеток, в которых часто откладывается известь и образуются псаммомные тельца. В зависимости от строения выделяют несколько вариантов менингиом.
Менингеальная саркома. Злокачественный аналог менингиомы. По строению напоминает фибросаркому.
Опухоли автономной (вегетативной) нервной системы
Опухоли автономной (вегетативной) нервной системы, развивающиеся из симпатических ганглиев, а также клеток нехромаф-финных параганглиев, могут быть доброкачественными и злокачественными.
Доброкачественная нехромаффинная иараганглиома (хемодектома). Развивается из клеток, относящихся к APUD-системе, способных синтезировать серотонин, реже АКТГ, поэтому эту опухоль называют апудомой. Она имеет трабекулярное строение и содержит большое количество сосудов синусоидного типа.
Злокачественная нехромаффинная параганглиома. Имеет выраженный клеточный полиморфизм. Характеризуется инфильтрирующим ростом и лимфогенными метастазами.
Симпатобластома (симпатогониома). Злокачественная опухоль по строению напоминает нейробластому. Клетки с выраженным клеточным атипизмом, много митозов. Опухоль растет быстро, рано дает метастазы. Встречается в детском возрасте.
Опухоли периферической нервной системы
Опухоли периферической нервной системы, развивающиеся из оболочек нервов, могут быть доброкачественными и злокачественными.
Неврилеммома (шваниома). Построена из веретенообразных клеток, образующих ритмические структуры (палисады), называемые «тельца Верокаи».
Нейрофиброма. Состоит из нервных волокон и соединительной ткани. Если у больного имеется системный нейрофиброма-тоз, то речь идет о болезни Реклингхаузена.
Злокачественная неврилеммома (нейрогенная саркома). Характеризуется выраженным клеточным атипизмом и полиморфизмом, в ней можно найти ритмические структуры и ядерные симпласты.
Опухоли системы крови
См. лекцию «Гемобластозы«.
Тератомы
Тератомы. Развиваются при отщеплении одной из бластомер яйца. Состоят из одного или нескольких видов тканей. Могут иметь организмоидное и органоидное строение. Нередко достигают больших размеров. Наиболее часто встречаются тератомы крестцово-копчиковые, яичников, яичек, забрюшинные и мезентериальные, зева, легких.
Тератобластома. Злокачественная опухоль, характеризующаяся выраженным клеточным атипизмом и полиморфизмом, быстро растет и метастазирует.
