Определение галогенидов при совместном их присутствии
Глава 18. Анализ лекарственных смесей в условиях аптек
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ В СМЕСЯХ
Для определения йодидов в присутствии хлоридов (если хлориды находятся в виде соли с двухвалентным металлом, например кальция хлорид) можно использовать 3 способа титрования в различных комбинациях. Это комплексонометрия, методы осаждения и окислительно-восстановительного титрования. На схеме 3 представлены различные варианты количественного определения йодидов в присутствии хлоридов кальция или других двухвалентных металлов.

Расчет содержания лекарственных веществ проводят по разности (в случае суммарного титрования йодидов и хлоридов) или по формуле прямого титрования (если йодиды и хлориды определяют отдельно).
В экспресс-анализе для количественного определения йодидов и хлоридов часто используют сочетание приведенных титриметрических методов с рефрактометрией.
Рассмотрим приведенную схему титрования на примере прописи 19.
Пропись 19.
Кальция хлорида 3,0
Калия йодида 2,0
Воды очищенной 100,0 мл.
Вариант I. Кальция хлорид определяют тригонометрически, а калия йодид — по методу Фаянса с индикатором натрия эозинатом (хлорид-ионы не мешают титрованию с индикатором натрия эозинатом).
Методика. Кальция хлорид. К 2 мл микстуры прибавляют 4—5 мл аммиачного буферного раствора, 0,1 г индикаторной смеси или 5—7 капель раствора кислотного хром-темно-синего и титруют 0,05 М раствором трилона Б до сине-фиолетового окрашивания.
1 мл 0,05 М раствора трилона Б соответствует 0,01095 г СаС12*6Н2О:
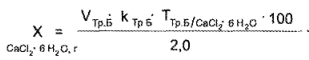
Калия йодид. К 2 мл микстуры прибавляют 1 мл разведенной кислоты уксусной, 3-5 капель раствора натрия эозината и титруют 0,1 н. раствором серебра нитрата до ярко-розового окрашивания осадка.
1мл 0,1 н. раствора серебра нитрата соответствует 0,01660 г Kl.
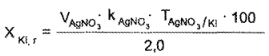
Аргентометрическое титрование йодидов можно проводить с применением внешнего индикатора — нитрозо-крахмальной бумаги.
Вариант П.
Кальция хлорид определяют трилонометрически, а калия йодид — методом аргетометрии с применением внешнего индикатора. Определение конечной точки титрования основано на реакции йодидов с нитритом натрия в кислой среде:
![]()
Титрование стандартным 0,1 я. раствором серебра ни трата проводят до тех пор, пока капля реакционной среды, нанесенная на нитрозо-крахмальную бумагу, не будет вызывать ее посинения вследствие выделения йода.
Для получения более точных результатов необходимо предварительно рассчитать объем 0,1 н. титрованного раствора серебра нитрата, который должен пойти на титрование взятой навески. Можно также провести вначале ориентировочное титрование.
В данном случае V 0,1 н. раствора серебра нитрата, необходимый для титрования 1 мл микстуры с содержанием 0,02 г калия йодида, рассчитывают по формуле:
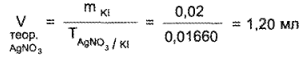
Следует отметить, что определению йодидов по реакции с натрия нитритом не мешают хлориды и бромиды.
Кроме приведенных вариантов аргентометрического титрования, возможно определять сумму калия йодида и кальция хлорида по методу Фольгарда или Фаянса (с индикатором бромфеноловым синим), а затем содержание калия йодида рассчитывать по разности между объемом титрованного раствора, израсходованным на титрование суммы галогенидов, и объемом трилона Б, пошедшим на титрование кальция хлорида:

Определение СаС12 * 6 Н2О проводят трилонометрически (расчет — см, вариант I).
Вариант III.
Йодкрахмальный метод Кольтгофа используют для определения йодидов в присутствии хлоридов и бромидов. В реакционную смесь, содержащую йодиды, прибавляют 1 каплю 0,1 я. раствора калия йодата, раствор крахмала и раствор серной кислоты разведенной. В результате реакции образуется йод, окрашивающий крахмал в синий цвет:
![]()
Окрашивание йодкрахмального комплекса устойчиво лишь в присутствии йодид-ионов. Если их связать серебра нитратом, синяя окраска раствора исчезает. На резкость изменения окраски влияет количество прибавленной воды. В экспреес-анализе объем раствора должен быть около 15 мл. Метод дает хорошие результаты при титровании йодидов в присутствии хлоридов, если концентрация последних не превышает концентрацию йодидов более чем в 3 раза.
Метод также удобен при определении йодидов в присутствии алкалоидов пуринового ряда и других оснований, барбитуратов. Однако его нельзя применять для анализа лекарственных веществ, с которыми может взаимодействовать йод (кислота аскорбиновая, натрия салицилат и др.).
В присутствии бромидов титрование затруднено, а переход окраски от синей через серую до желтой наступает не резко. Поэтому до прибавления раствора кислоты серной к реакционной смеси приливают 5 мл 10% раствора аммония карбоната.
Методика. Калия йодид. К 2 мл микстуры прибавляют 10—15 мл воды, 1 каплю 0,1 и. раствора калия йодата, 2 мл свежеприготовленного раствора крахмала и по каплям серную кислоту, разведенную до появления синего окрашивания жидкости. Далее титруют 0,1 н. раствором серебра нитрата до перехода синего окрашивания в желтое.
1 мл 0,1 н. раствора серебра нитрата соответствует 0,0166 г К1.
Расчеты содержания калия йодида и кальция хлорида шестиводного — см. вариант 1.
Вариант IV.
Количественное определение обоих компонентов можно провести методом меркуриметрии в одной навеске.
Калия йодид определяют безындикаторным методом Кольтгофа, основанным на растворении оранжевого осадка ртути дийодида в избытке калия йодида е образованием бесцветного комплекса:
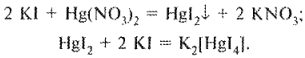
После того как все свободные йодиды перейдут в комплекс тет- райодмеркурата калия, избыточная капля титрованного раствора ртути (II) нитрата, вступая во взаимодействие с частью комплексного иона, вновь образует нерастворимый оранжевый осадок ртути дийодида, свидетельствующий о конце титрования:
![]()
При определении без индикатора йодид-ионы взаимодействуют фактически до комплексного соединения К2[Нg14], поэтому в данном случае z = 2.
Для определения кальция хлорида к оттитрованной жидкости прибавляют в качестве индикатора раствор дифенилкарбазона и титруют стандартным раствором ртути (II) нитрата до фиолетового окрашивания. При этом ртути (II) нитрат сначала разрушает полученное ранее комплексное соединение:
![]()
Затем взаимодействует с кальция хлоридом:
![]()
Избыточная капля ртути (II) нитрата реагирует с дифенилкарбазоном, образуя комплекс фиолетового цвета:

Методика. Калия йодид. 2 мл микстуры титруют 0,1 н. раствором ртути (II) нитрата до появления не исчезающей красно-оранжевой мути.
1 мл 0,1 н. раствора ртути (II) нитрата соответствует 0,03320 г К1.
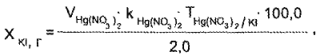
где — объем 0,1 н. раствора ртути (II) нитрата, пошедший на титрование калия йодида, в мл.
Кальция хлорид. К оттитрованной жидкости прибавляют 5—7 капель раствора дифенилкарбазона, 1—2 капли раствора кислоты азотной разведенной и титруют 0,1 н. раствором ртути (II) нитрата до фиолетового окрашивания.
1 мл 0,1 н. раствора ртути (II) нитрата соответствует 0,01095 г СаС12-6 Н2О:
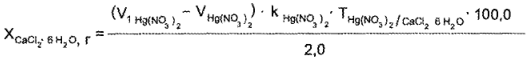
Где VHg(NO3)2— объем 0,1 н. раствора ртути (II) нитрата, пошедший на титрование калия йодида, мл;
V1 Hg(NO3)2 — объем 0,1 н. раствора ртути (II) нитрата, пошедший на титрование суммы калия йодида и кальция хлорида, мл.
Титрование указанных галогенидов солями Нg2+ протекает легко, но если в состав смеси входят соли алкалоидов или других азотистых оснований, содержащих третичный или четвертичный атом азота, образующийся при титровании комплекс К2[Нg14] действует по типу обшеалкалоидного реактива Майера и, следовательно, может давать осадки.
Барбитураты и сульфаниламиды также образуют осадки с солями Нg2+, но при подкислении раствором кислоты азотной (по бромфеноловому синему) титрование возможно в их присутствии (лучше с добавлением эфира).
![]()
Соли Нg2+ способны восстанавливаться до металлической ртути, если в лекарственную смесь входят сильные восстановители (кислота аскорбиновая, натрия тиосульфат и др.), поэтому меркуриметрическое титрование в их присутствии общепринятыми методиками невозможно. Влияние кислоты аскорбиновой можно исключить прибавлением эквивалентного количества титрованного раствора церия (IV) сульфата до появления неисчезающего желтого окрашивания.
Вариант V. Кальция хлорид определяют трилонометрически, а калия йодид — йодкрахмальным методом (с применением в качестве титрованного раствора ртуги (II) нитрата).
Механизм реакции аналогичен титрованию йодидов по методу Кольтгофа с применением в качестве титранта раствора серебра нитрата. Точку эквивалентности устанавливают по исчезновению окраски йодкрахмального комплекса, синяя окраска которого изменяется через буроватую до чистой розовато-оранжевой:
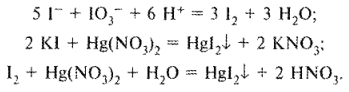
Титрованию калия йодида не мешают кислота борная, рибофлавин, эуфиллин, натрия бензоат, натрия гидрокарбонат, прозерин.
Методика. Калия йодид. К 2 мл микстуры прибавляют 2 мл воды, 1 каплю 0,1 н. раствора калия йодата, 0,5 мл раствора крахмала растворимого, по каплям серную кислоту разведенную до появления устойчивого синего окрашивания и титруют 0,1 н. раствором ртути (II) нитрата до перехода синего окрашивания (через бурое) в яркое розово-оранжевое.
1 мл 0,1 н. раствора ртути (II) нитрата соответствует 0,01660 г К1.
Расчет содержания СаС12 * 6 Н2О — см. вариант I.
Расчет содержания К1 см. — вариант IV.
Помимо приведенных методик определения калия йодида методами осадительного титрования в экспресс-анализе широко применяются окислительно-восстановительные способы титрования.
Вариант VI, Кальция хлорид определяют трилономстрически, а калия Йодид — методом йодатометрии.
Йодид-ионы окисляются калия йодатом в среде кислоты хлороводородной сначала до йода:
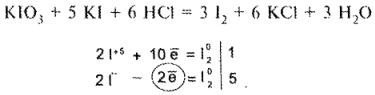
Затем выделившийся йод титруют до йодмонохлорида:
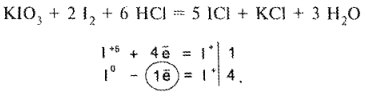
При расчете М (1/z): z = 3.
Методика. К 1 мл смеси добавляют 5 мл раствора кислоты хлороводородной 1 : 1 (готовится из 37% раствора кислоты хлороводородной), 1 мл раствора крахмала растворимого и быстро титруют 0,1 н. раствором калия йодата до появления светло-бурой окраски. Затем титрование проводят медленно, по каплям, до перехода окраски в лимонно-желтую.
1 мл 0,1 н. раствора калия йодата соответствует 0,005533 г К1.
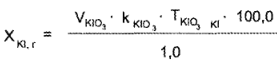
Расчет содержания СаС12 * 6 Н2О — см. вариант I.
Вариант VII. Кальция хлорид определяют тригонометрически, калия йодид — броматометрически. Йодид-ионы окисляются калия броматом в среде кислоты хлороводородной до йодмонохлорида:
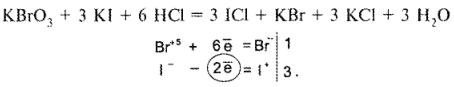
При расчете М (1/z): z = 2.
Методика. К 1 мл микстуры прибавляют 5 мл раствора кислоты хлороводородной 1:1 (готовится из 37% раствора кислоты хлороводородной), 1 мл раствора крахмала и титруют 0,1 н. раствором калия бромата до перехода бурой окраски раствора в лимонно-желтую.
1мл 0,1 н. раствора калия бромата соответствует 0,0083005 г К1.
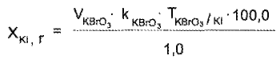
Расчет содержания СаС12 * 6 Н2О — см. вариант 1.
Вариант VIII.
Кальция хлорид определяют трилонометрически, калия йодид — методом перманганатометрии.
Йодид-ионы окисляются калия перманганатом в среде кислоты хлороводородной разведенной:
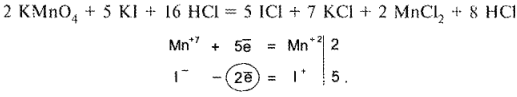
При расчете М (1/z): z — 2.
Определению йодидов не мешает присутствие в лекарственных смесях других галогенидов, сульфатов, фосфатов, рибофлавина, тиамина бромида, глутаминовой кислоты, теофиллина, эуфиллина, кофеин-бензоата натрия, эфедрина гидрохлорида.
Мешают титрованию сильные восстановители: кислота аскорбиновая, натрия тиосульфат, цистеин, ароматические амины, фенолы и их производные и другие лекарственные вещества, которые могут реагировать с калия перманганатом или образующимся при титровании йодмонохлоридом.
Методика. К 1 мл микстуры прибавляют 5 мл раствора кислоты хлороводородной 1:1 (готовится из 37% раствора хлороводорода) и титруют 0,1 н. раствором калия перманганата до появления светлобурой окраски раствора. Затем прибавляют 1 мл раствора крахмала растворимого и снова титруют по каплям до перехода окраски в лимонно-желтую.
1 .мл 0,1 н. раствора калия перманганата соответствует 0,0083005 г К1.
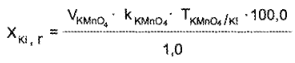
Расчет содержания СаС12 * 6 Н,0 — см. вариант I.
Вариант IX.
Кальция хлорид определяют трмлонометрически, калия йодид — методом йодхлорметрии.
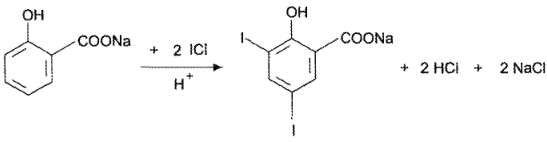
Сущность метода заключается в следующем: к аликвотной части микстуры, содержащей калия йодид, прибавляют избыток 0,1 н. раствора йодмонохлорида. При этом протекает реакция:
Кl + IС1 — 12 + КС1.
Количество выделившегося йода эквивалентно вступившим в реакцию йодид-ионам, поэтому при расчете М (1/z), значение 2-1.
Для связывания избытка йодмонохлорида в реакционную среду прибавляют натрия салицилат:
Через несколько минут выделившийся йод оттитровывают 0,1 н. стандартным раствором натрия тиосульфата:
![]()
Йодхлорметрическому определению йодидов не мешают хлориды, но мешают бромиды.
Методика. К 1 мл смеси прибавляют избыток (10-20 мл) 0,1 н. раствора йодмонохлорида и взбалтывают. Затем прибавляют 100 мл воды и 5 — 10 мл 1% раствора натрия салицилата, Через 3-5 мин выделившийся йод титруют 0,1 н. раствором натрия тиосульфата.
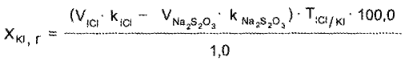
Расчет содержания СаС12 * 6 Н,0 — см. вариант 1.
Вариант X.
Анализ можно осуществить с использованием метола рефрактометрии. Вначале проводят трилонометрическое определение кальция хлорида шестиводного, а затем определяют показатель преломления лекарственной смеси относительно воды.
Для количественного определения хлоридов в сочетании с бромидами в виде солей одновалентных металлов бромид-ионы окисляют калия перманганатом до свободного брома и далее удаляют образовавшийся бром путем его превращения в пентабромацетон:
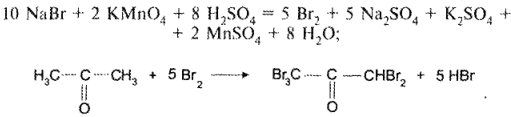
После этого в растворе остаются только хлоридионы, которые определяют по методу Фольгарда.
Для определения бромидов сумму галогенидов титруют по методу Мора или определяют меркуриметрическим методом.
Примером служит анализ прописи 20.
Пропись 20.
Натрия бромида
Натрия хлорида по 3,0
Воды очищенной до 100,0 мл.
Определение натрия хлорида проводят после окисления бромид- ионов калия перманганатом и переведения образовавшегося брома в связанное состояние в виде пентабромацетона. Избыток калия перманганата удаляют водорода пероксидом и проводят определение натрия хлорида по методу Фольгарда.
В другой навеске определяют сумму галогенидов аргентометрическим или меркуриметрическим методами и расчет натрия бромида осуществляют по разности количеств титрантов 1-го и 2-го титрования.
Методика. Натрия хлорид. К 1 мл микстуры прибавляют 3~5 мл воды, по 3 мл серной кислоты разведенной и ацетона и по каплям 5% раствор калия перманганата до устойчивого в течение 10 мин розового окрашивания. Через 10 мин избыток калия перманганата удаляют осторожным прибавлением по каплям 3% раствора водорода пероксида. К обесцвеченному раствору прибавляют 10 мл 0,1 н. серебра нитрата, 15—20 капель раствора квасцов железоаммониевых и титруют 0,1 н. раствором аммония роданида до буроватооранжевого окрашивания раствора над осадком.
1 мл 0,1 н. раствора серебра нитрата соответствует 0,005844 г NaCl.
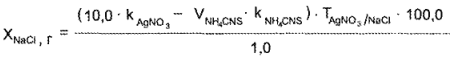
Натрия бромид.
1) К 1 мл микстуры прибавляют 5—7 капель раствора калия хромата и титруют 0.1 н. раствором серебра нитрата до оранжево-желтого окрашивания.
1мл 0,1 н. раствора серебра нитрата соответствует 0,01029 г NaBr.
2) К 1 мл микстуры прибавляют 5-8 капель раствора дифенилкарбазона, 1-2 капли кислоты азотной разведенной и титруют 0,1 н. раствором ртути (II) нитрата до фиолетового окрашивания.
1мл 0,1 н. раствора ртути (II) нитрата соответствует 0,01029 г NaBr.
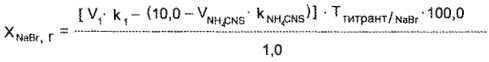
где V1 — объем 0,1 н. раствора серебра нитрата или 0,1 н, раствора ртути (II) нитрата, пошедший на титрование суммы галогенидов, мл; к, — поправочный коэффициент к титрованным растворам серебра нитрата или ртути (II) нитрата.
Более сложной задачей является анализ лекарственных смесей, содержащих одновременно йодид-, бромид- и хлорид-ионы. Некоторые из подобных смесей содержат йоды и бромиды в виде солей одновалентных металлов, а хлориды — в виде солей с двухвалентными металлами. Схемы анализа подобных смесей могут быть различными. Особый интерес при этом представляет сочетание методов осаждения и окислительно-восстановительных методов (схема 4).

Более простой вариант титрования основан на различии окислительно-восстановительных свойств йодидов и бромидов. Йодид как более сильный восстановитель окисляется стандартным раствором натрия нитрита (добавляют избыток титранта) до свободного йода. Затем избыток натрия нитрита удаляют с помощью мочевины. Выделившийся в эквивалентном йодиду количестве йод оттитровывают стандартным раствором натрия тиосульфата:
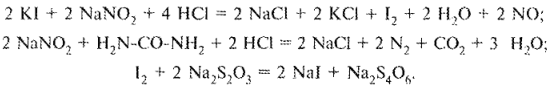
Предложенную схему иллюстрирует анализ прописи 21.
Пропись 21.
Калия йодида
Калия бромида по 4,0
Раствора кальция хлорида из 10,0 ~ 200,0мл.
Кальция хлорид определяют методом трилонометрии.
Калия бромид определяют методом рефрактометрии.
Калия йодид определяют методом йодометрии (заместительное титрование).
Методика.
Калия йодид. К 1 мл микстуры прибавляют 5—6 капель кислоты серной разведенной, 0,04 г мочевины и медленно по каплям при частом взбалтывании 2 мл 0,1 М раствора натрия нитрита и оставляют на 5-10 мин в темном месте в закрытой колбе. Затем прибавляют 0,1 г калия йодида для растворения выделившегося йода и титруют 0,1 М раствором натрия тиосульфата до обесцвечивания. В конце титрования прибавляют 2-3 капли крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 0,01660 г Кl.
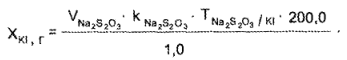
Кальция хлорид. 1 мл раствора помещают в мерный цилиндр емкостью 10 мл и объем доводят водой до метки, К 2 мл полученного раствора прибавляют 2 мл аммиачного буферного раствора, 0,02 г индикатора кислотного хром-темно-синего и титруют 0,05 М раствором трилона Б до сине-фиолетового окрашивания.
I мл 0,05 М раствора трилона Б соответствует 0,01095 г СаС12 * 6Н2О.
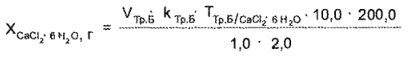
Калия бромид определяют рефрактометрически.
