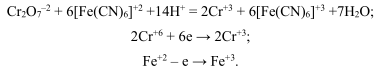Оксидиметрия
- Основные понятия методов оксидиметрии
- Перманганатометрия
- Йодометрия
- Хроматометрия
Основные понятия методов оксидиметрии
К методам окислительно-восстановительного титрования (оксидиметрия) относятся все титриметрические методы, в основе которых лежат окислительно-восстановительные реакции. Рабочим раствором является либо раствор окислителя, либо раствор восстановителя, а анализируемым раствором в первом случае — восстановитель, во втором — окислитель.
В зависимости от рабочего раствора в оксидиметрии применяют следующие основные методы:
- ● перманганатометрия, рабочим является раствор перманганата калия KMnO 4 ;
- ● йодометрия, используется окислительно-восстановительные свойства пары I 2 (2I – );
- ● хроматометрия, рабочий раствор — бихромат калия K2Cr2O7;
Эквивалентная молярная масса Mэ окислителя и восстановителя зависит от числа принимаемых или отдаваемых электронов Mэ = Мм / n,
где Мм — молярная масса окислителя или восстановителя;
n — число электронов.
Проведение оксидиметрии возможно только в том случае, если:
ЭДС (электродвижущая сила) реакции значительно больше нуля ЭДС = Еок – Ев , где Е ок и Ев — табличные данные (нормальные окислительно-восстановительные потенциалы);
1) скорость реакции достаточно велика;
2) можно определить точку эквивалентности.
В зависимости от условий реакции ЕО/В рассчитывается по уравнению Нернста:

В оксидиметрии существуют два типа индикаторов.
Первый тип индикаторов — интенсивно окрашенные растворы титрантов, например раствор перманганата калия. Конец титрования — появление или исчезновение малинового окрашивания раствора KMnO 4 . В йодометрии используют появление или исчезновение синего окрашивания йодокрахмала.
Второй тип индикаторов. Происходит изменение окрашивания раствора при изменении потенциала редокс-индикато. Дифениламин ↔ дифенилбензидин. При значении потенциала Е ≥ 0,79 В цвет раствора меняется с бесцветного на синий.
Перманганатометрия
Перманганатометрическим методом объемного анализа называют метод, основанный на окислении различных веществ перманганатом калия (KMnO 4 ). В зависимости от условий, в которых протекает реакция окисления-восстановления, ионы MnO 4 – могут принимать различное число электронов. В кислой среде:

То есть здесь более низкое значение потенциала. Но титрование в этой среде используют гораздо реже, чем в кислой среде. Изменение окрашивания малиновый — коричневый (трудно определить переход в окрашивании раствора). Перманганатометрию используют для определения:
- ● нитрит-ионов;
- ● сульфит-ионов;
- ● оксалатов;
- ● ионов металлов [Fe (II), Sn (II)] восстановителей;
- ● редуцирующих сахаров.
Для метода применяют 0,02–0,05 н растворы перманганата калия (более концентрированные растворы окрашены более интенсивно, менее концентрированные — менее устойчивы при хранении). Необходимо устанавливать титр раствора перманганата через 10 ч после приготовления раствора. Титр устанавливают по оксалату натрия Na2C2O4. Раствор хранят в темных склянках в темном месте.

Молярная масса эквивалента нитрита равна половине его молярной массы. Ход анализа отработан десятилетиями и выполняется по методике, которая учитывает все нюансы.
Йодометрия
Йодометрия — титриметрический (объемный) метод определения веществ, основанный на окислительно-восстановительных реакциях с участием йода иили йодида калия. В основе всех йодометрических реакций лежит реакция:
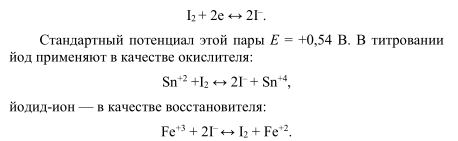
Проводят йодометрию с индикатором крахмалом, который добавляют перед началом титрования (интенсивное синее окрашивание). Если используют йодид, то титрование проводят непрямым методом. К анализируемому раствору добавляют избыток йодида, затем образующийся йод титруют раствором тиосульфата натрия с образованием тиотионат-иона:
![]()
Хроматометрия
Хроматометрией называется метод объемного анализа, основанный на использовании раствора бихромата калия в качестве стандартного. Бихромат калия способен окислять многие неорганические и органичские вещества сульфиты, дитионаты, гексацианоферрат (II), арсениты, иодиды, спирты, гидрохинон, глицерин, аскорбиновую кислоту, тиомочевину и др. В качестве примера ниже приведена используемая в объемном анализе реакция окисления — восстановления, протекающяя с участием бихромата и гексацианоферрата (II)