Неорганические ядохимикаты и органические препараты ртути
- 11.6.1. Гранозан (этилмеркурхлорид)
- 11.6.2. Фториды и кремнефториды
- 11.6.3. Фосфид цинка
Неорганические соединения, применяемые для борьбы с вредителями сельскохозяйственных культур, с грызунами, чаще называют ядохимикатами. Они отличаются высокой эффективностью, но при этом — достаточно высокой токсичностью. Характерной их особенностью является отсутствие избирательности. Неорганические ядохимикаты довольно стабильны и поэтому долго сохраняются в окружающей среде. Дождевая вода вымывает их из почвы и переносит в водоемы. Поэтому неорганические ядохимикаты наносят большой вред окружающей среде. Развитие пестицидов по этой причине идет по пути создания веществ эффективных, селективных и быстро разрушающихся в присутствии влаги и кислорода воздуха. Очевидно, что прогресс в создании таких пестицидов лежит на пути получения органических веществ. Это является главной причиной того, что многие неорганические ядохимикаты исключаются из числа современных пестицидов, а некоторые из них сегодня имеют историческое значение или используются как остатки старых запасов 20-30-летней давности. Некоторые ядохимикаты неорганической природы и в настоящее время находят применение при обработке садов, виноградников и др. Это препараты меди, цинка, бария, таллия, соли фтороводородной кислоты и др. Широко используются металлорганические соединения, одним из которых является гранозан (этилмеркурхлорид).
Доказательство отравления неорганическими пестицидами сводится к обнаружению и определению в объекте солей соответствующих металлов по методикам, описанным в разделе «группа металлических ядов». Этилмеркурхлорид, фториды, фосфид цинка требуют особых подходов к изолированию и анализу биологических объектов, поэтому остановимся на этих препаратах.
11.6.1. Гранозан (этилмеркурхлорид)
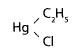
Этилмеркурхлорид — это белый кристаллический порошок, малорастворим в воде, растворим в растворах щелочей. Гранозан представляет собой смесь 2% этилмеркур- хлорида, 1% красителя, 1% минерального масла и сухих наполнителей. Применяется как фунгицид и бактерицид.
Отравления гранозаном наблюдаются чаще всего при употреблении в пищу обработанных гранозаном семечек подсолнечника, гороха, муки из протравленного зерна. Встречаются отравления в производственных условиях.
Симптомы отравления развиваются через 1-3 недели после попадания яда в организм. При попадании на кожу гранозан оказывает кожно-резорбтивное действие с образованием язв. Пары гранозана в 2 раза токсичнее паров ртути. Это объясняется тем, что органический радикал способствует растворению гранозана в липидах и проникновению в мозг, что вызывает тяжелое поражение ЦНС, приводит к блокированию сульф- гидрильных групп и нарушению обменных процессов. При отравлениях наблюдается потеря аппетита, неприятный вкус во рту, жажда, головная боль, бессонница. Позже появляются тошнота, рвота, боли в животе, понос, галлюцинации, парез конечностей.
На вскрытии отмечают белковую и жировую дистрофию печени.
В качестве объектов анализа могут быть внутренние органы, моча, кровь, зерно, мука, крупа и др.
Изолирование этилмеркурхлорида из печени и почек. Навеску объекта массой 25 г заливают 50 мл 3 М хлороводородной кислоты и оставляют на 30-60 мин, периодически помешивая. Смесь центрифугируют, заливают еще раз тем же растворителем на 30—60 мин и снова центрифугируют. Вытяжки объединяют и два раза взбалтывают по 5 мин с 10 мл хлороформа. Хлороформные экстракты объединяют, при необходимости центрифугируют.
Изолирование этилмеркурхлорида из крови. К 2 мл цельной крови прибавляют 5 мл 1 М раствора гидроксида натрия, нагревают на водяной бане 10 мин до получения однородной жидкости. Смесь охлаждают и добавляют 20 мл концентрированной хлороводородной кислоты. Через 15 мин этилмеркурхлорид экстрагируют дважды хлороформом по 10 мл.
Изолирование этилмеркурхлорида из мочи. К 20-50 мл мочи добавляют концентрированную хлороводородную кислоту с таким расчетом, чтобы получить в конечном разведении 1-3 М раствор. Из полученного раствора этилмеркурхлорид экстрагируют хлороформом 2 раза по 10 мл.
Обнаружение этилмеркурхлорида в полученных экстрактах. Хлороформные извлечения переносят в делительные воронки, прибавляют к ним 20 мл ацетатного буферного раствора с рН=4,5 и 0,1 мл 0,1% раствора дитизона в хлороформе. Смесь взбалтывают. Образуется этилмеркурдитизонат, который окрашивает слой хлороформа в желтый цвет.
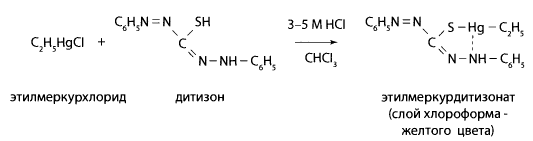
После этого хлороформный слой отделяют и выпаривают досуха. Сухой остаток растворяют в минимальном количестве хлороформа (не более 0,5 мл) и исследуют.
Метод хроматографии в тонком слое сорбента. На пластинку с тонким слоем силикагеля КСК наносят несколько капель хлороформного раствора остатка. Параллельно наносят каплю «стандарта», подсушивают на воздухе и хроматографируют в системе н-гексан — хлороформ (2:5) или н-гексан — ацетон (4:1). После хроматографирования и высушивания пластинки дитизонат этилмеркурхлорида обнаруживается в виде желтого пятна с Rf=0,56—0,60. Предел обнаружения — 0,1 мкг этилмеркурхлорида. Эту же пластинку можно обработать парами брома. При этом желтое пятно дитизоната этилмеркурхлорида обесцвечивается.
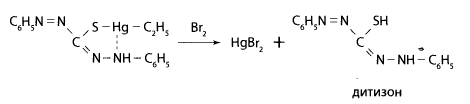
Образуется бромид ртути(П). На обесцвеченное пятно наносят каплю суспензии йодида меди(1). Пятно приобретает розовую или кроваво-красную окраску. При этом образуется тетрайодмеркуриат меди(1) — Cu2HgI4.
Обнаружение этилмеркурхлорида по реакции вытеснения ртути. Эта методика используется при анализе зерна, крупы, растительных объектов. К 100 г объекта добавляют 150 мл 12% хлороводородной кислоты и опускают зачищенные медные спиральки. Смесь нагревают и кипятят 10 мин, затем оставляют на сутки при комнатной температуре. После этого спиральки вынимают, промывают водой, этиловым спиртом и осушают эфиром. При наличии этилмеркурхлорида в исследуемых объектах ртуть восстанавливается на медных спиральках в виде серого налета. Далее спиральки помещают в узкие пробирочки, добавляют несколько кристалликов йода и исследование продолжают, как описано в разделе «Обнаружение и определение ртути в моче» (см. раздел 10.5.13).
Количественное определение этилмеркурхлорида
Определение содержания этилмеркурхлорида проводят фотометрическим методом. Для этого проводят хроматографирование этилмеркурдитизоната, который наносят в виде полосы на стартовую линию пластинки со слоем силикагеля КСК. Образовавшееся пятно желтого цвета соскабливают с пластинки, добавляют 4—10 мл хлороформа, перемешивают и центрифугируют. Полученный раствор доводят до определенного объема хлороформом и измеряют значение оптической плотности при длине волны 472 нм. Расчет проводят по калибровочному графику или по стандартному раствору этилмеркурдитизоната.
Данным методом возможно определение в 25 г печени 0,5-0,8 мкг, в 2 мл крови или в 25 мл мочи — 0,4—0,8 мкг этилмеркурхлорида.
11.6.2. Фториды и кремнефториды
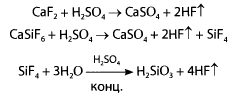
Фтор — элемент 7 группы периодической системы Д. И. Менделеева, в свободном виде в природе не встречается. Его основной минерал флюорит (плавиковый шпат) — CaF2 встречается в виде месторождений на всех континентах.
Фтор в небольших количествах входит в состав организма человека. Он участвует в образовании эмали зубов, костной ткани, в обмене веществ, в активации некоторых ферментов.
Основные соединения фтора — это фтороводородная (плавиковая) кислота, фториды, гидрофториды металлов, фторбораты и фторсиликаты, а также фторволокна (фторкаучу- ки, фторопласты), фтороуглероды.
Медицинское значение имеют фторид натрия и фторотан. Натрия фторид находит применение в стоматологии в виде 2% раствора, а также для профилактики кариеса в таблетках по 0,0005 г. Фторотан — это средство для ингаляционного наркоза. Он быстро выводится из организма и почти не вызывает раздражения слизистых оболочек.
Фтор и его соединения сильнотоксичны. Контакт с фтором вызывает раздражение кожи, слизистых оболочек носа и глаз, дерматиты, конъюнктивиты, отек легких. ПДК для фтора составляет 0,03 мг/м3, непереносимая концентрация — 77 мг/м3. Некоторые фторорганические соединения могут медленно выделять фтор или летучие соединения фтора и приводить к хроническим отравлениям. Из ЖКТ всасываются даже плохо растворимые соли. Кислая среда желудочного сока способствует их переходу в растворимое состояние. Выводятся соединения фтора почками.
Фторид натрия — это белый порошок, при действии сильных кислот разлагается с выделением фтороводородной кислоты — сильнейшего раздражающего средства, вызывающего раздражение слизистых оболочек и отек легких. Фторид натрия (технический) применяется в сельском хозяйстве в качестве инсектицида и зооцида.
При отравлении фторидом натрия наблюдаются слабость, головокружение, тошнота, боли под ложечкой, понос, слюнотечение, судороги.
При вскрытии обнаруживают венозное полнокровие внутренних органов, жидкую кровь в полостях сердца, почек, тяжелые дистрофические и некробиотические явления.
Кремнефторид натрия — это белый, иногда желтоватый или сероватый порошок без запаха, малорастворим в холодной воде. Технический кремнефторид применяется в сельском хозяйстве для борьбы с вредителями сахарной свеклы, хлопчатника, зерновых культур.
Кремнефторид обладает способностью всасываться через кожные покровы. При отравлении кремнефторидами наблюдается поражение нервной системы и нарушение обмена веществ. Явления отравления выражаются обильным слюнотечением, рвотой, болями в животе. Наблюдается сухость кожи, трещины, гнойная сыпь, учащенное дыхание, раздражение слизистых оболочек верхних дыхательных путей. При вдыхании большого количества пыли кремнефторидов может наступить смерть. При хронических отравлениях отмечаются заболевания зубов и некоторых костей.
Изолирование фторидов и кремнефторидов из технических препаратов и биологического материала (органы трупов, рвотные массы, содержимое желудка) проводится в присутствии суспензии оксида кальция для исключения потери исследуемых веществ. В фарфоровый тигель вносят 25 г измельченного объекта, прибавляют 13-14 мл суспензии оксида кальция (5 г оксида кальция и 15 мл воды очищенной). Смесь хорошо перемешивают, смачивают раствором нитрата аммония, высушивают и сжигают. Золу промывают водой и высушивают. В золе должен содержаться малорастворимый фторид или кремнефторид кальция.
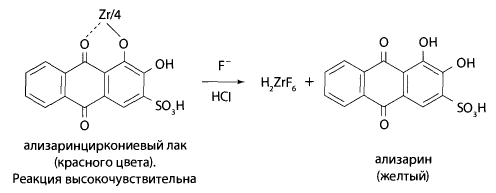
Обнаружение фторидов и кремнефторидов в полученной золе проводят с помощью химических реакций «травления» стекла, образования геля ортокремниевой кислоты и с ализаринциркониевым лаком.
Реакция «травления» стекла. Часть золы помещают в платиновый тигель, прибавляют небольшое количество концентрированной серной кислоты. Тигель накрывают часовым стеклом, нижнюю поверхность которого предварительно покрывают слоем воска или парафина и с помощью иглы делают надпись. Тигель оставляют на сутки при комнатной температуре. Затем часовое стекло снимают, освобождают от парафина (воска). Наличие на стекле нанесенной надписи свидетельствует о присутствии в исследуемом объекте фторидов или кремнефторидов.
Выделяющийся фтористый водород взаимодействует с оксидом кремния, содержащимся в стекле. Происходит «разъедание» стекла.
4HF + SiО2 → SiF4 + 2Н2О
Данная реакция малочувствительна. Предел обнаружения фторидов и скорость проведения реакции можно повысить, если тигель с золой и серной кислотой подогреть. Но в этом случае на стекло наносят слой лака, высушивают и также делают соответствующую надпись.
Реакция образования геля ортокремниевой кислоты. В пробирку вносят часть полученной золы и несколько капель концентрированной серной кислоты. К отверстию пробирки подносят платиновую проволоку (или стеклянную палочку), на конце которой имеется капля воды. Помутнение капли воды указывает на наличие фторидов или кремнефторидов в исследуемой пробе.
Эта реакция основана на том, что при действии серной кислоты на золу выделяется фтористый водород. Он реагирует со стенками пробирки, образуя газообразный тетрафторид кремния.
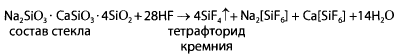
Тетрафторид кремния гидролизуется водой с образованием геля Si02 или H2Si03 и кремнефтористоводородной кислоты.
![]()
Наблюдается помутнение капли воды на стеклянной палочке или платиновой проволочке.
Реакция с алтаринциркониевым лаком. На полоску фильтровальной бумаг и наносят каплю смеси, состоящей из равных объемов 0,25% раствора ализаринового красного и 0,25% раствора нитрата циркония. После подсушивания на полученное пятно красного цвета наносят каплю исследуемого раствора. При наличии фторидов или кремнефторидов наблюдают изменение окраски пятна на желтую.
Реакции отличия фторидов и кремнефторидов. Чтобы отличить препараты фторида от кремнефторидов, используют реакции с раствором аммиака, гидроксидом натрия, солями калия и реакцию образования геля ортокремниевой кислоты.
Реакция с раствором аммиака. К водному раствору исследуемого вещества прибавляют несколько капель 10% водного раствора аммиака. При подогревании в присутствии кремнефторидов выпадает студенистый осадок (нерастворимая ортокремниевая кислота).
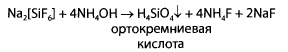
Реакция с раствором гидроксида натрия. К 5 мл водного раствора исследуемого вещества добавляют 3 мл 10% раствора гидроксида натрия. В присутствии кремнефторидов наблюдают образование белого студенистого осадка.
Реакция с солями калия. К 3 мл исследуемого раствора прибавляют 4 мл 5% раствора хлорида калия и 5 мл этилового спирта. В присутствии кремнефторидов выпадает белый осадок состава K2SiF6. Этиловый спирт ускоряет выпадение осадка.
Образование геля ортокремниевой кислоты. В отличие от фторидов, реакция проводится обязательно в платиновом или железном тигле с использованием ранее описанной методики. В этих условиях фториды не дают реакции образования ортокремниевой кислоты.
Количественное определение фторидов. Для количественного определения используют спекгрофотометрический метод, основанный на образовании тройного комплекса ализарин-комплексона, церия и фтора. В мерную колбу вместимостью 100 мл вносят 1-10 мл исследуемого раствора, 10 мл 0,0005 М раствора ализарин-комплексона, 2 мл ацетатного буферного раствора (рН=5,0) и прибавляют 10 мл 0,0005 М водного раствора нитрата церия. Содержимое колбы доводят водой до метки и через 10 мин измеряют оптическую плотность при длине волны 610 нм. Содержание фторидов рассчитывают по стандартному раствору фторида натрия.
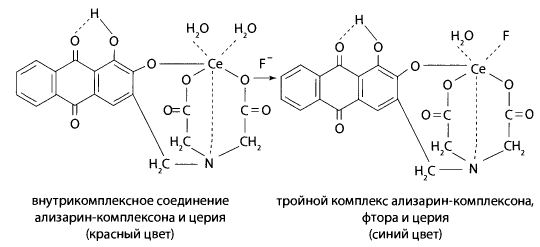
Метод позволяет определять содержание фторидов в объекте от 5 мг и более.
11.6.3. Фосфид цинка
Фосфид цинка — Zn3P2 — представляет собой темно-серый порошок с запахом чеснока, нерастворим в воде и органических растворителях. В кислотах растворяется с образованием фосфористого водорода (взрывоопасен) и хлорида цинка
Zn3P2 +6HCI → 2РН3↑ + 3ZnCI2
Применяется фосфид цинка в виде 21% смачивающегося порошка, таблеток и пасты для борьбы с грызунами. Для прилипания фосфида цинка к зерну-приманке добавляют 3-5% растительного масла.
Фосфид цинка ядовит. Тяжелое отравление наступает при принятии десятых долей грамма этого вещества. Признаки отравления проявляются через несколько минут. Возникают резкие боли в животе, слабость, головокружение, рвота с примесью крови и желчи. Состояние быстро ухудшается. Пострадавший теряет сознание, дыхание становится редким, кожа бледнеет, образуется липкий пот. Смерть наступает в первые часы после приема яда при явлениях асфиксии, тяжелого нарушения дыхания и кровообращения.
На вскрытии отмечают гемолиз крови, множественные кровоизлияния в различные органы и ткани, дистрофические изменения почек, печени, миокарда даже в случае быстрой смерти.
Объектами исследования при отравлении фосфидом цинка являются желудок и кишечник с содержимым, пищевые продукты, приманки для грызунов и другие.
При анализе приманок изолирование фосфида цинка проводить не требуется. Объект обрабатывают кислотой и обнаруживают выделяющийся фосфористый водород и соль цинка.
Изолирование фосфористого водорода из содержимого желудка и кишечника.
В круглодонную колбу помещают 20-100 г объекта и присоединяют к прибору для перегонки с водяным паром. Прибор имеет приемник, состоящий из пяти колб, последовательно соединенных друг с другом. В первый приемник наливают 25 мл бромной воды, во все последующие — по 10 мл бромной воды. В колбу с объектом добавляют воду до кашицеобразной массы, подкисляют 10% раствором серной кислоты и сразу отгоняют фосфористый водород. Скорость перегонки регулируют так, чтобы через приемник проходило 3-5 пузырьков газа в 1 с. В процессе перегонки над бромной водой в приемнике появляется белый туман. Это результат взаимодействия бромной воды с фосфористым водородом. Перегонка считается законченной, когда в колбах-приемниках перестанет образовываться белый дым над жидкостью. В первом приемнике объем жидкости должен в процессе перегонки увеличиться не менее, чем на 50 мл. После окончания перегонки содержимое всех приемников объединяют и упаривают. Остаток растворяют в 2-5 мл 2 М раствора атомной кислоты. Этот раствор содержит фосфорную кислоту.
![]()
Обнаружение фосфорной кислоты
Реакция с молибдатом аммония и бензидином. На фильтровальную бумагу наносят 1 каплю раствора молибдата аммония, 1-2 капли раствора остатка в азотной кислоте и через 1-2 мин прибавляют каплю раствора бензидина. Затем бумагу держат над парами аммиака — пятно окрашивается в синий цвет.
Реакция с магнезиальной смесью. Часть раствора из приемника нейтрализуют раствором аммиака и прибавляют магнезиальную смесь, перемешивают и добавляют 10% раствор аммиака. В присутствии фосфорной кислоты образуется белый кристаллический осадок.
![]()
Реакция образования аммонийной соли фосфорно-молибденовой кислоты.
Нагревают 1-2 мл раствора молибдата аммония в азотной кислоте и по каплям добавляют часть исследуемого раствора. При наличии фосфорной кислоты образуется осадок желтого цвета
![]()
Изолирование и обнаружение цинка. Остаток объекта в колбе после отгонки фосфористого водорода упаривают и проводят мокрую минерализацию с помощью серной и азотной кислот по методике, описанной в разделе 6.5.1. В полученном минерализате ионы цинка обнаруживают реакциями с дитизоном и, после выделения в виде диэтилди- тиокарбамата, с сульфидом натрия, с гексацианоферратом(П) калия и с тетрароданомер- куроатом аммония (см. раздел 10.5.9).
