Глава 12. Некоторые ядовитые газы
Токсикологическая химия Вергейчик Т.Х.
12.1. Оксид углерода (II)
12.2. Хлор
Токсические вещества, поступающие в организм ингаляционным путем, называют ядовитыми газами. Через легкие в организм могут проникать вещества в виде аэрозолей, паров, дыма и т.д. В данном разделе мы рассматриваем вещества, токсическое действие которых проявляется только при вдыхании воздуха, содержащего примесь газов — это хлор и оксид углерода. Другие летучие соединения рассмотрены в соответствующих разделах.
12.1. Оксид углерода (II)
Физико-химические свойства. Оксид углерода (II) — монооксид углерода, угарный газ. Это газ без цвета и запаха, горит синим пламенем с образованием СO2. В смеси с воздухом взрывается при зажигании. Он образуется при неполном сгорании топлива, в процессе выплавки и переработки черных и цветных металлов. Оксид углерода (II) содержится в выхлопных газах двигателей внутреннего сгорания, образуется при взрывных работах, при пожарах.
Токсикологическое значение. Отравления оксидом углерода составляют более 17% среди общего числа отравлений. Основными их видами являются:
- Отравления оксидом углерода (II), содержащимся в выхлопных газах автомобилей и других транспортных средств. Наблюдаются у лиц, длительно находящихся в закрытых гаражах и автомобилях с работающим двигателем (чаще всего в зимнее время).
- Отравления от угорания в быту в помещениях с неисправным отоплением, в котельных бытовых и производственных зданий.
- Отравления при пожарах лиц, находящихся в задымленных зданиях и помещениях (закрытые комнаты, квартиры), в вагонах транспорта и в лифтах.
Чувствительность людей разных возрастных групп к оксиду углерода различна. Новорожденные более выносливы и переносят такие концентрации оксида углерода (II) в воздухе, которые являются смертельными для взрослых.
Действие оксида углерода (II) на организм выражается в угнетении кислородопереносящей функции крови. Механизм основан на взаимодействии оксида углерода (II) с железом (II) гемоглобина и образовании карбоксигемоглобина.
HbO2 + СО ↔ O2 + HbСО
Сродство гемоглобина к окиду углерода (II) в 250-300 раз выше, чем к кислороду. Даже небольшое количество оксида углерода (II) во вдыхаемом воздухе приводит к образованию больших количеств HbСО. Например, наличие в воздухе 0,1% угарного газа ведет к превращению в карбоксигемоглобин 50% гемоглобина крови. Обратная реакция диссоциации карбоксигемоглобина происходит в 3600 раз медленнее, чем диссоциация оксигемопгобина, что приводит к выраженной гипоксии тканей. Симптомы отравления при различных концентрациях карбоксигемоглобина (HbСО) в крови приведены в таблице 57.
Оксид углерода (II) способен угнетать тканевое дыхание. Это происходит за счет его соединения с железосодержащим комплексом цитохромоксидазой, что снижает способность тканей утилизировать кислород. Оксид углерода (II) фиксируется и задерживается тканями достаточно длительное время (более 16 сут.). Это объясняется прочной связью с миоглобином, основным белком мышечной ткани.
МbO2 + СО ↔ МbСО + O2
Таблица 57. Содержание карбоксигемоглобина в гемоглобине и основные симптомы отравления
| Концентрация HbСО, % | Симптомы отравления |
| 0-10 | Симптомов не выявлено |
| 10-20 | Ощущаются сжатие лба, небольшая головная боль, покраснение кожных покровов |
| 20-30 | Легкая степень отравления: ощущение тяжести и давления в голове, пульсация в висках, туман в глазах, головокружение, сильная слабость, головная боль, тошнота, часто рвота, сонливость, сердцебиение, учащенное дыхание |
| 30-40 | Отравление средней тяжести: нарастающая слабость, одышка, кратковременная потеря сознания и памяти, заторможенность, судороги |
| 40-50 | К описанным симптомам добавляются учащение дыхания и пульса, часто наблюдается коллапс |
| 50 60 | Тяжелая форма отравления: длительная потеря сознания (часы, сутки), нарушение нервной и психической деятельности (галлюцинации, бред, клонические и тонические судороги, парезы, параличи). Резкое расстройство дыхания (частое, неправильного типа), кровообращения. Слизистые оболочки и цвет лица алые |
| 60-70 | К вышеописанным симптомам добавляются ослабление дыхательной н сердечной деятельности. Возможен смертельный исход |
| 70-80 | Замедление дыхания, ослабление пульса, остановка дыхания и смертельный исход |
На течение отравления оксидом угаерода (II) оказывают влияние следующие факторы:
- Этиловый спирт сдерживает насыщение крови оксидом углерода (II), и чем больше спирта в крови, тем меньше процент образования ньСО.
- Синильная кислота способна усилить токсическое действие оксида углерода (II). Синильная кислота выделяется при сгорании шерсти, полимеров, синтетических материалов (на пожарах).
- Оксиды азота (II и IV) усиливают токсическое действие оксида углерода (II).
При отравлении наибольшие количества оксида углерода (II) обнаруживаются в синусах мозговых оболочек, сосудах бедра и плеча. Оксид углерода (II) выводится из организма через дыхательные пути за 1 ч на 60-70%, за 4 ч — на 90-96%.
Объекты исследования: кровь, мышцы (редко).
Обнаружение и определение оксида углерода (II) проводится непосредственно в крови. С этой целью используются газохроматографический, химический, спектроскопический и спектрофотометрический методы анализа.
Газохроматографический метод основан на определении оксида угаерода (II) с помощью парофазного анализа. Обнаружение проводят непосредственно в газовой фазе или после восстановления до метана или окисления до оксида углерода (IV).
- й вариант метода. К крови добавляют карбонат или гидрокарбонат натрия. Оксид углерода (II) переходит в газовую фазу. Ее отбирают шприцом и вводят в хроматограф. Используют детектор по теплопроводности (катарометр). Обнаружение проводят по времени удерживания. Концентрацию оксида углерода (II) рассчитывают по калибровочному графику, выражающему зависимость площади пика от концентрации оксида угперода (II). В таком варианте определение оксида углерода (II) в крови возможно при его содержании 30-100%. Ошибка метода составляет 10%.
- й вариант метода. Выделение оксида углерода (II) из крови проводят, как и в первом варианте. Газовую фазу вводят в дозатор прибора. В качестве газа-носителя рекомендован гелий, который вытесняет СО из дозатора и переносит в хроматографическую колонку с никелевым катализатором на ИНЗ-600. Под действием водорода СО восстанавливается до метана (СНД, появление которого в системе регистрируется пламенноионизационным детектором (ПИД). Преимущество метода в высокой чувствительности и возможности проведения анализа с малыми навесками крови (0,1 мл).
- й вариант метода основан также на применении парофазного анализа. В парогазовой фазе содержится смесь СО и С02 эндогенного происхождения. Используется колонка с силикагелем, на которой разделяются оксид углерода (IV) и оксид углерода (II). Это разделение фиксируется детектором. Затем оксид углерода (II) в специальной ячейке окисляется оксидом йода (V) до оксида углерода (1V), и регистрируется общее количество С02, Концентрацию оксида углерода (II) определяют по разнице полученных пиков эндогенного С02 и суммарного количества СO2.
Метод микродиффузии. Описание метода и используемого прибора приведено ранее (см. раздел 6.6.2). Во внешнюю камеру прибора вносят 1 мл крови и 1 мл 10% раствора серной кислоты. Во внутреннюю камеру помещают 2 мл 0,1% раствора хлорида палладия в 0,1 М растворе хлороводородной кислоты. Прибор закрывают крышкой и оставляют на 1 ч при комнатной температуре. При наличии в крови оксида углерода (II) во внутренней камере появляется серебристая пленка металлического палладия.
PdCI2 + СО + Н2O → Pd + 2HCI + СO2
Химический метод основан на том, что оксид углерода (II) образует с гемоглобином довольно прочное химическое соединение, которое плохо реагирует с другими реактивами.
Обнаружение карбоксигемоглобина химическим методом при отравлениях проводят непосредственно в крови с использованием различных реактивов. Для сравнения используют кровь животных или доноров (контрольная проба), с которой проводят те же испытания (табл. 58).
Изменение окраски наблюдают путем сравнения контрольного и испытуемого образца после добавления различных реактивов. Кровь, содержащая карбоксигемоглобин, от прибавления химических реагентов не изменяет или незначительно изменяет окраску.
Заключение об обнаружении карбоксигемоглобина в крови дается, если с большинством реактивов будут получены указанные в таблице результаты.
Следует учитывать, что при легкой степени отравления и незначительном содержании карбоксигемоглобина возможно получение отрицательного результата.
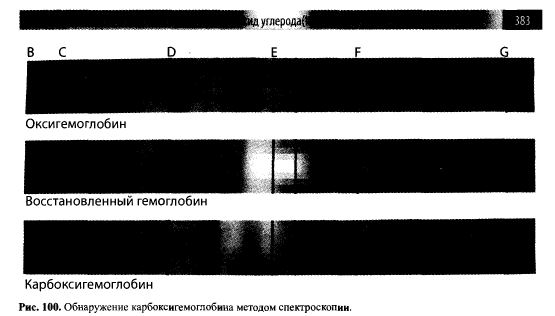
Спектроскопический метод используется для обнаружения в крови карбоксигемоглобина при отравлении оксидом углерода (II). В практике химико-токсикологического анализа для этих целей используют микроспектроскоп — это спектроскоп, соединенный с окуляром. В основе метода — способность гемоглобина и его производных поглощать световое излучение определенной дайны волны. Если луч света проходит через раствор, содержащий гемоглобин и его производные, в спектре появляются темные полосы поглощения.
Таблица 58. Химические реакции для обнаружения в крови карбоксигемоглобина
| Название пробы | Реактив | Окраска крови, содержащей HbСО | Окраска контрольного опыта крови |
| Гоппе-Зейлера | 30% раствор NaOH | Ярко-красная | Бурая |
| Сальковского-
Катаяма |
(NH4)2S + 30% раствор СН3СООН | Малиново-красная | Серо-зеленая |
| Хорошкевича-
Маркеа |
8% раствор хинина г/х → t° + (NH4)2S | Светло-красная | Красно-бурая |
| Бюркера | 1% раствор K3[Fe (CN)6] | Красная | Желтоватая |
| Сидорова | 20% р-р K3[Fe (CN)6] и 0,01% раствор К2Сr2O7 | Карминово-красная | Коричнево-зеленая |
| Ветцеля | 20% р-р K3[Fe(CN)6] + ледяная СН3СООН | Вишнево-красный осадок | Серовато-коричневый осадок |
| Лнбермана | Формалин | Красная | Коричнево-черная |
| Рубнера | 5% раствор основного ацетата свинца | Красная | Коричневая |
| Залесского | 10% раствор CuSO4 | Пурпурно-красная | Зеленая |
Разбавленная кровь, не содержащая карбоксигемоглобина, при наблюдении в спектроскопе обнаруживает две полосыпоглощения. Они располагаются между линиями Фраунгофера Д и Е в желтой и зеленой частях спектра, которые соответствуют оксигемоглобину. Если к крови добавить восстановитель (NH4)2S, оксигемоглобин восстанавливается в гемоглобин. При этом вместо 2 полос поглощения будет наблюдаться одна широкая полоса в той же области спектра. В разбавленной крови, направленной на химикотоксикологический анализ с подозрением на отравление оксидом углерода (II), также будут наблюдаться две темные полосы поглощения (рис. 100). При добавлении к этой крови (NH4)2S восстановления не происходит. Две полосы поглощения не исчезают. Это говорит о высокой химической стойкости карбоксигемоглобина. Однако между этими четко выраженными полосами часто появляется небольшое затемнение за счет того, что несвязанный с оксидом углерода (II) оксигемоглобин восстанавливается до гемоглобина.
Спектрофотометрическое определение карбоксигемоглобина. По своей сущности этот метод можно отнести к дифференциальной фотометрии.
В крови людей и животных гемоглобин содержится в виде дезоксигемоглобина (Hb) и оксигемоглобина (HbO2) — продукта взаимодействия гемоглобина с кислородом. В крови может содержаться также небольшое количество метгемоглобина (MtHb).
При поступлении в организм оксида углерода (II) происходит образование карбоксигемоглобина за счет оксигемоглобина и дезоксигемоглобина. Метгемоглобин с оксидом углерода (II) не связывается. Все указанные соединения имеют характерные спектры поглощения в области 450-620 нм.
Метод определения карбоксигемоглобина основан на том, что при взаимодействии с восстановителями (дитионатом натрия, сульфидом аммония) все соединения гемоглобина (MtHb, HbO2) за исключением карбоксигемоглобина (СОHb) восстанавливаются до дезоксигемоглобина.
Спектр поглощения дезоксигемоглобина имеет одну полосу поглощения с максимумом при 557 нм. Карбоксигемоглобин не восстанавливается, и его спектр поглощения сохраняется. Это видно из представленных спектров поглощения проб крови (см. рис. 101).
Методика определения карбоксигемоглобина (ВОЗ, Женева, 1998) заключается в следующем. Для анализа исследуемую кровь делят на 3 части. Одну часть (А) оставляют без изменения, вторую часть (В) насыщают оксидом углерода до 100% содержания СОHb и используют в качестве стандарта, третью часть (С) насыщают кислородом до полного вытеснения СО, т.е. получают 100% оксигемоглобина.
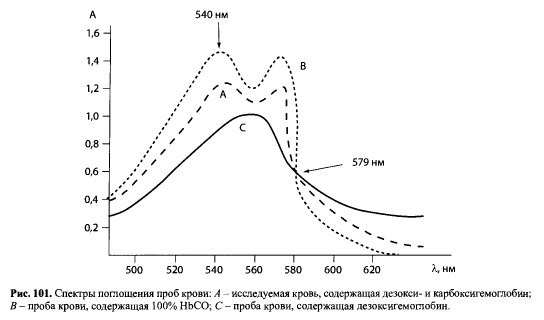
К каждой из трех проб добавляют восстановитель дитионат натрия — Na2S2O4 · 2Н2O. Регистрируют спектры поглощения всех трех растворов в области 500-620 нм и измеряют значение оптической плотности А при 540 и 579 нм (изобестическая точка).
Расчет содержания карбоксигемоглобина ведут по величине отношения оптической плотности А540/А579. Находят отношение А540/А579 для растворов А, В и С. Эти отношения подставляют в формулу:
![]()
Этот метод эффективен при исследовании крови, содержащей более 10% карбоксигемоглобина. Физиологическая норма содержания карбоксигемоглобина в крови составляет от 1,5 до 3,1%, для курильщиков — <10%. Смертельная концентрация карбоксигемоглобина в крови составляет в среднем -60% и может колебаться в зависимости от внешних условий и особенностей организма от 40 до 80%.
Определение оксида углерода (II) в воздухе
1-й способ. Для обнаружения оксида углерода (II) в воздухе используют его способность поглощаться кровью животного. С этой целью 20 л воздуха прокачивают при помощи аспиратора сначала через ряд склянок Тищенко с суспензией гидроксида железа (II) с целью связывания кислорода, а затем через 5 мл разведенной крови животного. Полученную кровь анализируют спектрофотометрическим методом.
2-й способ. Метод основан на окислении оксида углерода (II) оксидом йода (V) до оксида утлерода (IV). Исследуемый объем воздуха (20 л) прокачивают через раствор, содержащий оксид йода (V).
I2O5 + 5СО → 5СO2 + I2
Образовавшийся оксид углерода (IV) пропускают через раствор гидроксида бария.
Ва(ОН)2 + СO2 → ВаСO3 + Н2O
Избыток гидроксида бария оттитровывают (микротитрование) хлороводородной кислотой.
Ва(ОН)2 + 2HCI → ВаСI2 + 2Н2O
Симптомы отравления оксидом углерода (II) наблюдаются при его содержании в воздухе 0,20 мг/л. Смертельное отравление может наступить при 1,8-5,7 мг/л. При концентрации 5,7-14,8 г/л смерть наступает в течение нескольких минут, что соответствует 90% содержанию карбоксигемоглобина в крови.
12.2. Хлор
Хлор — желто-зеленый газ с резким удушающим запахом, растворим в неполярных растворителях, хуже — в воде. Хлор применяется для хлорирования воды, для получения пластмасс, инсектицидов, растворителей, дезинфицирующих, отбеливающих, моющих средств, в производстве глицерина, оксида этилена, в металлургии для хлорирующего обжига руд цветных металлов.
Хлор является высокотоксичным элементом, его использовали во время Первой мировой войны как боевое отравляющее вещество. Отравления хлором, в том числе массовые, могут наблюдаться в результате аварий на химических производствах, а также при транспортировке хлора или при избыточном хлорировании воды в бассейнах. Содержание хлора в воздухе 0,006 мг/л оказывает раздражающее действие на дыхательные пути. Хлор в организме реагирует с влагой на слизистых дыхательных путей и образует хлороводородную и хлорноватистую кислоты, что и обуславливает его раздражающее действие. Концентрация хлора в воздухе 0,1 мг/л опасна для жизни. Пострадавший задыхается, лицо синеет, он мечется, делает попытку бежать, но тотчас падает, движения становятся нескоординированными, сознание теряется, пульс делается частым, затем нитевидным. Остановка дыхания может наступить через 5-25 мин после вдыхания газа. Вдыхание более высокой концентрации может привести к мгновенной смерти в результате рефлекторного торможения дыхательного центра. Смертельный исход объясняется химическим ожогом легких.
При вскрытии легкие кажутся уменьшенными в размере и имеют характерный желтовато-бурый глинистый цвет, ткань легких теряет эластичность.
Обнаружить в организме свободный хлор невозможно. Чаще всего обнаружение хлора проводят в атмосфере или в производственных помещениях.
Для обнаружения хлора в воздухе около 20 л его прокачивают через два поглотителя. Первый поглотитель содержит растворы йодида калия и крахмала, второй раствор о-толидина. В первом случае при наличии хлора в воздухе наблюдается появление синего окрашивания за счет выделения свободного йода, который с крахмалом образует окрашивание.
Cl2 + 2KI → 2KCl + I2
Такое окрашивание могут давать оксиды азота, озон. Поэтому в качестве теста для проверки используют вторую реакцию с о-толидином. О-толидин подвергается окислению с образованием желто-оранжевого окрашивания.
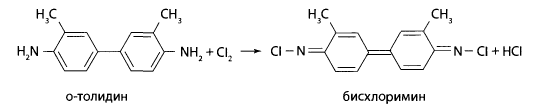
Для количественного определения хлора в воздухе применяют два метода. Фотоколориметрический метод основан на реакции с йодидом калия и крахмалом и спектрофотометрический метод по реакции с о-толидином.
