Нарушения сердечного ритма и проводимости
Осложнения острого инфаркта миокарда
- Этиология
- Классификация нарушений ритма и проводимости
- Электрофизиологические механизмы аритмий
- Методы диагностики нарушений сердечного ритм
- Диагностика отдельных нарушений ритма и проводимости
- Лечение нарушений сердечного ритма и проводимости
Нарушениями сердечного ритма, или аритмиями, называют:
- ЧСС > 100 или < 60 ударов в мин;
- неправильный ритм любого происхождения;
- любой несинусовый ритм;
- нарушение проводимости импульса по различным участкам проводящей системы сердца.
Таким образом, термин «нарушения сердечного ритма» («аритмии») объединяет различные по механизму, клиническим проявлениям и прогностическому значению нарушения образования и проведения электрического импульса.
Этиология
Нарушения ритма сердца — один из наиболее распространенных клинических синдромов, который выявляется не только при органических заболеваниях сердечной мышцы, но и при нарушениях нейрогуморальной регуляции, электролитных сдвигах, токсических воздействиях на сердце и даже у здоровых лиц..
Прогностическое значение многих нарушений ритма и проводимости различно в зависимости от причин, вызвавших аритмию. Тем не менее, существует группа нарушений сердечного ритма, прогноз которых всегда достаточно серьезен, независимо от того, выявляются или нет значительные органические изменения в сердце (желудочковая тахикардия, фибрилляция желудочков, АВ-блокада III степени и т.д.).
В таблице 1 перечислены наиболее частые причины возникновения нарушений ритма и проводимости.
Таблица 1. Наиболее частые причины нарушений сердечного ритма и проводимости
| Кардиальные причины | Токсические воздействия |
| ИБС, в том числе инфаркт миокарда и нестабильная стенокардия
Сердечная недостаточность Кардиомиопатии (ГКМП. ДКМП. РКМП) Приобретенные пороки сердца Врожденные порок сердца Миокардиты Пролапс митрального клапана и др. |
Курение
Алкоголь Тиреотоксикоз |
| Лекарственные воздействия | |
| Сердечные гликозиды
Антиаритмические средства (проаритмическое действие) Диуретики Симпатомиметики и др |
|
| Электролитные нарушения | Идиопатические аритмии |
| Гипокалиемия
Гиперкалиемия Гипомагниемия Гиперкальциемия и др |
Классификация нарушений ритма и проводимости
I. Нарушение образования импульса.
A.Нарушения автоматизма СА-узла (номотопные аритмии):
- Синусовая тахикардия.
- Синусовая брадикардия.
- Синусовая аритмия.
- Синдром слабости синусового узла.
Б. Эктопические (гетеротопные) ритмы, обусловленные преобладанием автоматизма эктопических центров:
1. Медленные (замещающие) выскальзывающие комплексы и ритмы:
а) предсердные;
б) из АВ-соединения;
в) желудочковые.
2. Ускоренные эктопические ритмы (непароксизмальные тахикардии):
а) предсердные;
б) из АВ-соединения;
в) желудочковые.
3. Миграция суправентрикулярного водителя ритма.
B. Эктопические (гетеротопные) ритмы, преимущественно обусловленные механизмом повторного входа волны возбуждения:
1. Экстрасистолия:
а) предсердная;
б) из АВ-соединения;
в) желудочковая.
2. Пароксизмальная тахикардия:
а) предсердная;
б) из АВ-соединения;
в) желудочковая.
- Трепетание предсердий.
- Мерцание (фибрилляция) предсердий.
- Трепетание и мерцание (фибрилляция) желудочков.
П. Нарушения проводимости.
- Синоатриальная блокада.
- Внутрипредсердная (межпредсердная) блокада.
- Атриовентрикулярная блокада:
а) I степени;
б) II степени;
в) III степени (полная).
4. Внутрижелудочковые блокады (блокады ветвей пучка Гиса):
а) одной ветви (однопучковые, или монофасцикулярные);
б) двух ветвей (двухпучковые, или бифасцикулярные);
в) трех ветвей (трехпучковые/ или трифасцикулярпые).
- Асистолия желудочков.
- Синдром преждевременного возбуждения желудочков:
а) синдром Вольфа-Паркинсона-Уайта (WPW);
б) синдром укороченного интервала P-Q(R) (CLC).
III. Комбинированные нарушения ритма.
- Парасистолия.
- Эктопические ритмы с блокадой выхода.
- Атриовентрикулярные диссоциации.
В практической работе удобно также использовать деление всех аритмий на суправентрикулярные (наджелудочковые) и желудочковые аритмии, а также нарушения проводимости.
Электрофизиологические механизмы аритмий
Возникновение нарушений ритма сердца всегда обусловлено изменениями электрофизиологических свойств сердечной мышцы, в частности, нарушениями формирования или/и проведения трансмембранного потенциала действия (ТМПД) в специализированных и сократительных клетках. По современным представлениям основными электрофизиологическими механизмами возникновения аритмий являются:
1. Нарушения образования импульса.
- Изменение нормального автоматизма СА-узла.
- Возникновение патологического автоматизма специализированных клеток проводящей системы и кардиомиоцитов (эктопическая активность).
- Триггерная (наведенная) активность специализированных и сократительных клеток (возникновение ранних и поздних деполяризаций).
2. Нарушения проведения импульса.
- Простая физиологическая рефрактерность или ее патологическое удлинение.
- Уменьшение максимального диастолического потенциала покоя и трансформация быстрого электрического ответа в медленный).
- Декрементное (затухающее) проведение импульса, в том числе неравномерное.
- Нарушение межклеточного электротонического взаимодействия.
- Повторный вход волны возбуждения (re-entry).
- Другие механизмы.
3. Комбинированные нарушения образования и проведения импульса.
- Парасистолическая активность.
- Гипополяризация мембраны + ускорение диастолической деполяризации.
- Гипополяризация мембраны + смещение порогового потенциала в сторону положительных значений.
- Другие механизмы.
НАРУШЕНИЯ ОБРАЗОВАНИЯ ИМПУЛЬСА
Изменения нормального автоматизма СА-узла
В специализированных и сократительных клетках сердца формируются, как известно, два основных типа ПД. Миокард предсердий и желудочков, а также специализированные волокна системы Гиса-Пуркинье, относятся к тканям с так называемым «быстрым ответом». Для них характерна очень высокая скорость начальной деполяризации (фазы О ПД), обусловленной быстрым натриевым током (рис.1, а).

Во время последующей длительной реполяризации клеточной мембраны (фазы 1, 2, 3 ПД) существуют два разнонаправленных ионных тока: внутрь клетки через медленные кальциевые каналы поступают ноны Са2+, а из клетки по калиевым каналам выходят ионы К+.
В фазу 2 ПД интенсивность этих разнонаправленных токов почти одинакова и трансмембраннын потенциал клетки изменяется мало (фаза «плато» ПД). Во время фазы конечной быстрой реполяризацин (фазы 3 ПД) интенсивность кальциевого тока значительно падает, а выходящий калиевый ток становится максимальным. В результате потери клеткой ионов К+ полностью восстанавливается исходная поляризация клеточной мембраны: ее наружная поверхность становится заряженной положительно, а внутренняя поверхность — отрицательно. Во время диастолической фазы 4 ПД такая поляризация клетки поддерживается действием K+-Na+— нacoca.
В клетках СА-узла и АВ-соединения быстрые натриевые каналы отсутствуют. Поэтому деполяризация мембран этих клеток почти полностью определяется медленным входящим током Са2+. Поскольку интенсивность этого тока невелика, а его продолжительность достигает 5-10 мс, фаза О ПД узловых клеток имеет относительно малую крутизну (клетки «медленного ответа») (рис. 1, б)
Другой особенностью клеток с «медленным ответом» является их способность к самопроизвольному (спонтанному) медленному увеличению ПП во время фазы 4 ПД. Процесс спонтанной диастолической деполяризации продолжается вплоть до достижения уровня порогового потенциала, после чего инициируется фаза О ПД, т.е. завершается полная спонтанная деполяризация клетки. Это свойство клеток с «медленным ответом» лежит в основе функции автоматизма.
Спонтанная диастолическая деполяризация обусловлена медленными ионными токами: выходящим калиевым и входящими натриевым и кальциевым токами.
Свойством автоматизма обладают не только клетки СА-узла и АВ-соединения, но и специализированные волокна системы Гиса-Пуркинье и некоторые специализированные волокна предсердий. Однако в обычных условиях скорость спонтанной диастолической деполяризации СА-узла существенно выше, чем центров автоматизма II и III порядка. Поэтому в норме доминирующим является автоматизм СА-узла, который как бы «подавляет» автоматизм всех нижележащих центров.
Частота спонтанного возникновения ПД в клетках СА-узла, которая при сохранении синусового ритма определяет ЧСС, зависит от действия трех механизмов:
- скорости спонтанной диастолической деполяризации (крутизны подъема фазы 4 ПД);
- уровня мембранного ПП клеток СА-узла;
- величины порогового потенциала возбуждения.
Чем выше скорость (крутизна) спонтанной диастолической деполяризации, тем быстрее мембранный ПП достигнет уровня порогового потенциала и инициирует очередной ПД, и тем выше будет частота синусового ритма. Наоборот, замедление спонтанной диастолической деполяризации (уменьшение крутизны подъема) ведет к урежению синусового ритма.
При увеличении максимальных отрицательных значений мембранного ПП (гиперполяризация мембраны), происходящего, например, под действием медиатора парасимпатической нераной системы — ацетилхолина, для достижения порогового потенциала необходимо большее время, и ЧСС уменьшается. Наоборот, при меньших отрицательных значениях ПП (гипополяризация мембраны) частота синусового ритма увеличивается при той же скорости спонтанной диастолической деполяризации (действие катехоламинов).
Наконец, при менее отрицательных значениях порогового потенциала в клетках СА-узла ПД инициируется позже, и синусовый ритм замедляется. Более высокие отрицательные значения порогового потенциала сопровождаются учащением сердечной деятельности.
Таким образом:
1. Учащение синусового ритма может быть обусловлено:
- ускорением спонтанной диастолической деполяризации клеток СА-узла (активация САС, высокая концентрация катехоломинов),
- уменьшением отрицательных значений ПП (гипополяризация мембраны клеток) или
- смещением порогового потенциала в сторону отрицательных значений (ишемия, гипоксия, ацидоз).
2. Замедление синусового ритма может быть обусловлено:
- уменьшением скорости спонтанной диастолической деполяризации клеток СА-узла (активация парасимпатической нервной системы, снижение активности САС),
- увеличением отрицательных значений ПП (гиперполяризация мембран клеток) или
- смещением порогового потенциала в сторону положительных значений.
Аномальный (патологический) автоматизм
Патологическое повышение автоматизма клеток АВ-соединения и волокон Пуркинье чаще всего выявляется при повреждении и ишемии миокарда, значительной активации САС, действии катехоламинов на сердце, а также при повышении концентрации ионов Са2+ в среде. Повышение автоматизма центров II и III порядка, которые на время становятся водителями ритма, возможно при возрастании скорости спонтанной диастолической деполяризации (действие катехоламинов) и уменьшении отрицательных значений мембранного потенциала покоя (при гипополяризации клеток).
Аномальный (патологический) автоматизм лежит в основе возникновения некоторых типов предсердной тахикардии, ускоренных ритмов желудочков и АВ-соедннения, желудочковой тахикардии.
Повышение автоматизма СА-узла или эктопических центров II и III порядка наиболее часто вызывается следующими причинами:
- высокой концентрацией катехоламинов (активацией САС);
- электролитными нарушениями (гипокалиемией, гиперкалъциемией};
- гипоксией и ишемией миокарда;
- механическим растяжением волокон миокарда (например, при дилатации камер сердца);
- интоксикацией сердечными гликоэидами.
Триггерная активность
Этот вид нарушения образования импульса связан с появлением дополнительных осцилляции мембранного потенциала, возникающих либо во время фазы реполяриза-ции (фазы 2 и 3) основного ПД («ранние» постдеполяризации), либо сразу после завершения ПД, т.е. в фазу 4 исходного ПД («поздние» постдеполяризации). Если амплитуда таких постдеполяризаций достигает порога возбуждения, происходит образование нового преждевременного ПД, который в свою очередь может инициировать следующие преждевременные ПД и т.д.
Такой механизм возникновения эктопического ритма получил название триггерного (наведенного), поскольку он вызывается осцилляциями мембранного потенциала, так или иначе связанными с основным исходным ПД, т.е. «наведением». К основным причинам появления добавочных осцилляции мембранного потенциала относятся все факторы, ведущие к накоплению в сердечной клетке ионов Са2+.
Механизм ранней триггерной активности может быть причиной некоторых вариантов желудочковой тахикардии типа «пируэт». Поздние (задержанные) постдеполяризации возникают, как правило, при избыточном влиянии на сердце катехоламинов, при ишемии миокарда и дигиталисной интоксикации.
НАРУШЕНИЯ ПРОВЕДЕНИЯ ИМПУЛЬСА
Различные механизмы нарушения распространения электрического импульса по проводящей системе сердца и сократительному миокарду лежат в основе не только многочисленных блокад проведения, но и многих эктопических аритмий (экстрасистолии, пароксизмальных тахиаритмий и др.).
Изменение скорости деполяризации клеточной мембраны (уменьшение максимального диастолического потенциала покоя и трансформация быстрого электрического ответа в медленный).
После того как ТМПД достиг своего пикового значения, становится возможной передача возбуждения на соседние клетки. Поскольку большинство из них, за исключением АВ-соединения, относятся к клеткам с «быстрым ответом», в норме волна возбуждения очень быстро распространяется по всем специализированным волокнам проводящей системы, а затем выходит на сократительный миокард. Скорость распространения возбуждения в системе Гиса-Пуркинье составляет от 1 до 3 м/с, а по мышечным волокнам — около 0,9-1,0 м/с.
В клетках АВ-соединения с «медленным ответом» скорость проведения примерно в 20 раз ниже, чем в системе Гиса-Пуркинье (0,05 м/с), что определяет нормальную физиологическую задержку проведения импульса по АВ-соединению. Важно подчеркнуть, что в патологических условиях клетки «быстрого ответа» иногда могут трансформироваться в клетки «медленного ответа», что приводит к замедлению проведения электрического импульса. Такая ситуация может возникать, например, при острой и хронической ишемии миокарда, остром ИМ и т.п.
Таким образом, первым фактором, определяющим распространение волны возбуждения по специализированным волокнам проводящей системы и сократительному миокарду, является скорость деполяризации клеточной мембраны (крутизна наклона фазы О ПД). Она зависит в первую очередь от количества открытых (функционирующих) быстрых натриевых каналов клеточной мембраны во время формирования фазы О ПД. Чем больше быстрых натриевых каналов мембраны открыто в этот период, тем больше крутизна фазы О ПД и, соответственно, выше скорость проведения электрического импульса.
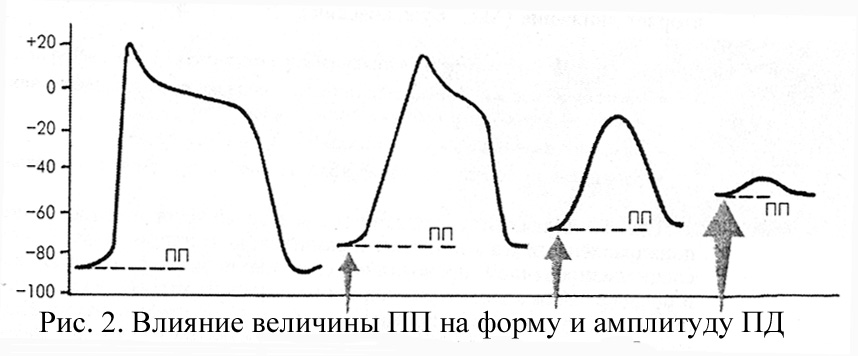
Важнейшим фактором, определяющим процент открытых (активированных) быстрых натриевых каналов, является максимальная отрицательная величина диастолического ПП. Если в патологических условиях (повышенная концентрация ионов К+ вне клетки, инфаркт или ишемия миокарда и др.) ПП снижается (уменьшается его отрицательная величина), часть быстрых натриевых каналов инактивируется, и крутизна формирования фазы 0 ПД падает. Тогда клетка «быстрого ответа» трансформируется в клетку «медленного ответа». Понятно, что проведение электрического импульса по участку сердечной мышцы с такими характеристиками ПД резко замедляется. При уменьшении ПП до -50 мВ инактивируется около 50% быстрых Ка+-каналов, и распространение возбуждения прекращается (рис. 2).
Декрементное (затухающее) проведение
Декрементное (затухающее) проведение — это второй механизм замедления проведения возбуждения. Декрементное проведение заключается в постепенном уменьшении амплитуды ПД по мере проведения возбуждения по поврежденному, но еще жизнеспособному сердечному волокну. Декрементное проведение возникает, как правило, при значительном повреждении сердечной мышцы, например, при остром ИМ в области, непосредственно примыкающей к зоне некроза (в периинфарктной зоне).
Если в участке повреждения находятся несколько параллельно расположенных сердечных волокон, то степень замедления декрементного проведения в каждом из них нередко оказывается неодинаковой. Деполяризация соседних волокон происходит не одновременно, что еще больше снижает эффективность электрического стимула и может также явиться причиной возникновения блокады проведения. Кроме того, при таком неравномерном декрементном проведении электрического импульса происходит расщепление единого фронта волны возбуждения на несколько более мелких волн, что создает картину электрически негомогенной среды и может способствовать возникновению разнообразных желудочковых и суправентрикулярных аритмий.
Нарушение электротонического взаимодействия
Нарушение электротонического взаимодействия между двумя возбудимыми участками, разделенными небольшой зоной высокого сопротивления — третий важнейший механизм замедления проведения возбуждения. Такая ситуация может возникнуть при локальной ишемии миокарда, ограниченном очаговом повреждении или некрозе сердечной мышцы, которые сопровождаются местным повышением внеклеточной концентрации ионов К+ или при развитии очагового фиброза сердечной мышцы. Появление даже небольшого ограниченного невозбудимого участка сократительного или специализированного волокна может сопровождаться ступенеобразным резким замедлением проведения возбуждения в дистальном участке этого волокна
Такое же значение для замедления проведения может иметь значительное увеличение электрического сопротивления межклеточных вставочных дисков — нексусов, которые в нормальных условиях обладают очень низким электрическим сопротивлением, что облегчает протекание тока между клетками. Известно, что ацидоз, гипоксия, ишемия и токсическое воздействие сердечных гликозидов существенно повышают сопротивление нексусов.
Нарушение электротонического взаимодействия между возбудимыми участками и повышение электрического сопротивления вставочных дисков, по-видимому, является основным механизмом возникновения частичных или полных блокад ножек и ветвей пучка Гиса.
Рефрактерность
Следует упомянуть еще об одном механизме нарушения проведения ПД, который имеет значение, в частности, при формировании так называемого повторного входа волны возбуждения (re-entry) — одного из наиболее частых механизмов возникновения сердечных аритмий.
Как известно, вслед за быстрой деполяризацией специализированного или сократительного волокна (фазой О ПД) следует длительный период невозбудимости волокна, в течение которого повторные надпороговые стимулы не сопровождаются возникновением нового ПД. Это абсолютный или эффективный рефрактерный период (ЭРП), который обычно несколько превышает длительность фазы 2 ПД (фазы плато). В течение всего ЭРП быстрые натриевые каналы остаются инактивированными.
В фазу 3 ПД их инактивация постепенно устраняется, и доля натриевых каналов, способных активироваться вновь, постепенно возрастает. Если в этот период нанести очередной стимул, возникнет новый ПД, но его амплитуда и скорость деполяризации будут снижены. Это относительный рефрактерный период (ОРП). Низкая скорость деполяризации новых ПД, вызванных в течение ОРП, обусловливает медленное дальнейшее распространение волны возбуждения по волокну. Если очередной стимул совпадает с ЭРП, новый ПД не возникает и дальнейшее распространение возбуждения блокируется полностью.
Повторный вход волны возбуждения (re-entry)
Повторный вход волны возбуждения (re-entry) является одним из наиболее важных механизмов возникновения многих аритмий. Это особый вид нарушения распространения волны возбуждения, при котором электрический импульс, совершая движение по замкнутому пути (петле, кругу), вновь возвращается к месту своего возникновеня и повторяет движение.
Для возникновения механизма повторного входа (re-entry) необходимы три условия:
- анатомическое или функциональное расщепление пути проведения электрического импульса и наличие замкнутого контура (петли проведения);
- однонаправленная блокада на одном из участков петли;
- замедленное распространение возбуждения на другом участке петли.
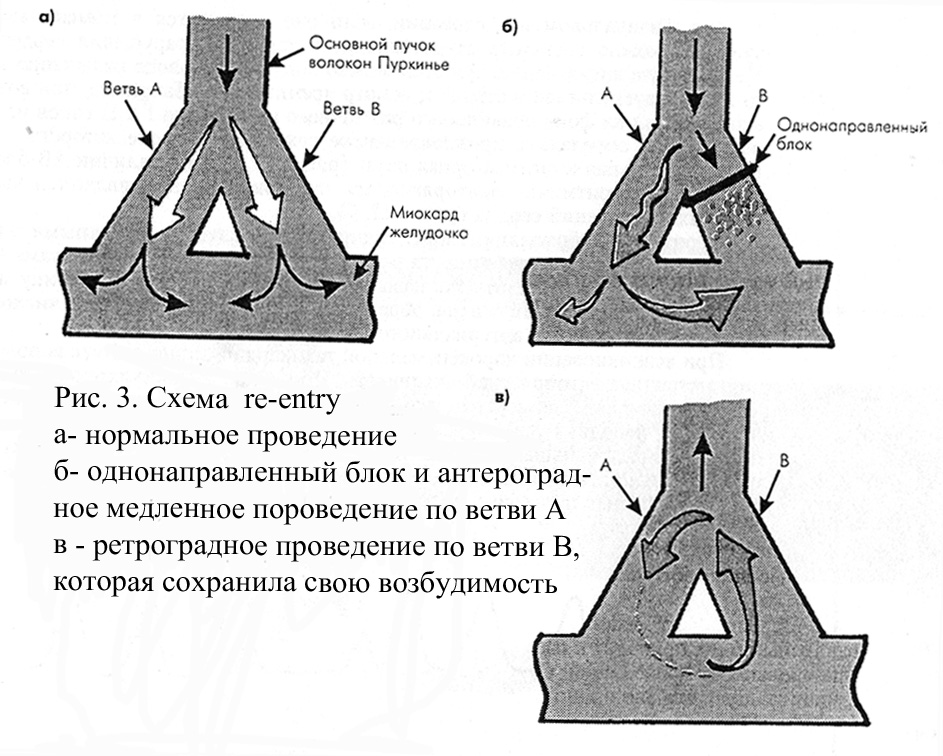
Рисунок 3 иллюстрирует механизм, с помощью которого замедленное проведение и однонаправленный блок приводят к развитию повторного входа. Анатомическое строение специализированной проводящей системы и миокардиальных волокон желудочков и предсердий таково, что оно и в норме содержит множество элементов, которые потенциально могут функционировать как петли замкнутого контура. В нормальных условиях быстро распространяющееся возбуждение почти одновременно охватывает все волокна Пуркипье (рис. 3, а) и достигает миокарда желудочков, в связи с чем механизм re-entry не реализуется. В патологических условиях область поражения миокарда (например, зона ишемии) может охватывать периферические участки проводящей системы, где располагаются замкнутые петли, образованные пучками волокон Пуркинье. Скорость проведения импульса в этих участках может быть значительно снижена, например, в результате уменьшения потенциала покоя и скорости деполяризации.
В связи с тем, что в пораженной области сердца угнетение проводимости, как правило, бывает неравномерным, в одном из сегментов замкнутой петли снижение проводимости может оказаться настолько выраженным, что здесь возникает однонаправленный блок: импульс не проводится в антероградном направлении (на рисунке — сверху вниз), по проводится в ретроградном направлении (на рисунке снизу вверх). Таким образом, формируются все три условия, необходимые для возникновения механизма re-entry.
В этих условиях, как показано на рисунке 3 б, в дистальной замкнутой петле, образованной пучками волокон Пуркинье и миокардом, импульс не может пройти через участок однонаправленной блокады (ветвь В) и медленно проводится в антероградном направлении (сверху вниз) только по ветви А, по которой он достигает миокарда желудочков. Поскольку ветвь В первоначально не возбуждалась и не находится в рефрактерном состоянии, импульс проводится по ней в ретроградном направлении (снизу вверх) и вновь достигает основного пучка волокон Пуркинье (рис. 3, в). Если к этому времени основной пучок волокон Пуркинье и его деблокированная ветвь А вышли из состояния рефрактерности, возможно повторное возбуждение петли А и миокарда желудочков, в результате чего возникает преждевременное сокращение — экстрасистола При «благоприятных» условиях такая циркуляция волны возбуждения по замкнутой петле может продолжаться достаточно долго, обусловливая повторные частые сокращения сердца — пароксизм так называемой реципрокной тахикардии.
Прервать циркуляцию re-entry можно также, нанося искусственные преждевременные импульсы и стараясь попасть в узкий «зазор» между передним фронтом волны возбуждения и «хвостом» рефрактерности.
В зависимости от размеров петли повторного входа различают macro- re-entry и micro-re-entry. Формирование macro-re-entry лежит в основе возникновения трепетания предсердий и некоторых форм реципрокной тахикардии. Петля macro-re-entry возникает:
- в функционирующих дополнительных проводящих путях при синдроме преждевременного возбуждения (синдроме WPW);
- в АВ-соединенини;
- в миокарде, окружающем крупный участок невозбудимой ткани сердца (постинфарктный рубец, аневризма ЛЖ);
- в миокарде предсердий.
При формировании петли micro-re-entry движение импульса происходит по малому замкнутому кольцу, не связанному с каким-либо анатомическим препятствием. Полагают, что формирование множества петель micro-re-entry в предсердиях или желудочках ведет к возникновению фибрилляции предсердий или желудочков. В этих случаях передние фронты циркулирующих воли возбуждения постоянно наталкиваются на ограниченные участки невозбудимой ткани, находящейся в рефрактерном периоде. В связи с этим волны micro-re-entry постоянно меняют свое направление, возникают завихрения и хаотическое случайное возбуждение отдельных участков предсердий или желудочков.
Методы диагностики нарушений сердечного ритм
Клиническое исследование
Несмотря на то, что окончательное суждение о характере, тяжести и прогнозе отдельных видов нарушения ритма и проводимости, их электрофизиологических механизмах и возможных способах лечения врач получает при анализе результатов современных методов инструментальной диагностики, клиническое исследование больных с аритмиями имеет важнейшее диагностическое значение. Оно позволяет:
- уточнить характер и тяжесть течения основного заболевания, на фоне которого развились нарушения сердечного ритма;
- составить ориентировочное суждение о характере имеющейся аритмии (экстрасистолия, пароксизмальная тахиаритмия, преходящие блокады проведения и т.п.);
- оценить условия, при которых возникают и купируются нарушения ритма;
- провести (в некоторых случаях) дифференциальный диагноз между наджелудочковыми и желудочковыми нарушениями ритма;
- оценить возможные последствия продолжающейся аритмии (например, аритмический шок при инфаркте миокарда, возможность возникновения ТЭЛА при пароксизмах фибрилляции предсердий и т.д.);
- составить план дополнительного инструментального обследования больного;
- выбрать наиболее эффективные способы лечения больных и т.п.
Жалобы
При анализе жалоб больного обращают внимание на субъективные признаки тех или иных нарушений ритма и проводимости. Больных часто беспокоят сердцебиения, перебои в работе сердца, чувство «замирания» сердца, и «остановки» сердечной деятельности. В одних случаях речь идет о преждевременных сокращениях сердца (экстрасистолах), в других — о серьезных нарушениях проводимости, например, об АВ-блокадах II степени с выпадениями отдельных желудочковых комплексов. Очень важно оценить, какие клинические симптомы обычно сопутствуют возникновению аритмий у данного больного: внезапная слабость, головокружение, одышка, боли в области сердца, полиурия. Нередко преходящие АВ-блокады, тяжелые приступы тахиаритмий, проявления синдрома слабости синусового узла сопровождаются кратковременным обмороком, эпизодами эпилептиформных припадков, необъяснимыми случаями травматизма и т.д.
Физикальное исследование
При физикальном исследовании, если оно проводится в момент возникновения аритмии, можно составить представление о характере нарушения сердечного ритма. Наибольшую информацию при этом можно получить, приводя пальпацию артериального пульса, аускультацию сердца и осмотр яремных вен. Например, при возникновении экстрасистол на фоне правильного ритмичного повторения I и II тонов или пульсовых волн можно определить преждевременное сокращение, после которого следует более продолжительная компенсаторная пауза. При наличии АВ-блокады II степени на фоне ритмично повторяющихся пульсовых волн выявляются выпадения отдельных сокращений сердца.
Мерцание (фибрилляция) предсердий характеризуется хаотичными сокращениями сердца, отделенными друг от друга различными временными интервалами. При этом важно определить так называемый дефицит пульса — разницу между истинным числом сокращений сердца, определяемым при аускультации, и числом пульсовых волн периферического артериального пульса.
При возникновении пароксизмальной тахикардии важно решить вопрос о локализации источника эктопической активности. При суправентрикулярной тахикардии пульсация югулярных вен соответствует числу волн артериального пульса. При желудочковой пароксизмальной тахикардии количество югулярных пульсаций значительно меньше числа артериальных пульсовых волн.
В некоторых случаях во время физикального исследования больных с аритмиями врач использует некоторые специальные приемы для рефлектороного раздражения вагусных центров: массаж синокаротидной зоны, проба Вальсальвы и др.
Характерные клинические признаки, выявляемые при конкретных нарушениях сердечного ритма, подробно описаны ниже.
Электрокардиография
Регистрация ЭКГ в большинстве случаев позволяет уточнить характер аритмии. Исключение составляют случаи, когда нарушения ритма и проводимости носят преходящий характер (короткие пароксизмы суправентрикулярной или желудочковой тахикардии, фибрилляция или трепетание предсердий и т.п.). В этих случаях предпочтительно длительное мониторировапие ЭКГ по Холтеру (см. ниже).
Запись стандартной ЭКГ в 12 отведениях у больных с аритмиями также имеет свои особенности. Нередко бывает необходима более продолжительная регистрация ЭКГ (в течение 10-20 с). При этом обычно используется более медленная запись, например, со скоростью 25 мм/с или меньше. Необходимость в более протяженных записях ЭКГ возникает при преходящих СА-блокадах и АВ-блокадах, при политопных экстрасистолах и др.
Анализ зарегистрированной ЭКГ в 12 отведениях проводят по общепринятому плану расшифровки ЭКГ, приведенному ниже.
Общая схема (план) расшифровки ЭКГ.
1. Анализ сердечного ритма и проводимости:
- оценка регулярности сердечных сокращений;
- подсчет числа сердечных сокращений;
- определение источника возбуждения;
- оценка функции проводимости.
- Определение электрической оси сердца во фронтальной плоскости, поворотов сердца вокруг продольной и поперечной осей:
- Анализ предсердного зубца Р.
- Анализ желудочкового комплекса QRST:
- анализ комплекса QRS;
- анализ сегмента S-T;
- анализ зубца Т;
- анализ интервала Q-T.
5. Электрокардиографическое заключение.
Напомним лишь некоторые приемы анализа ЭКГ, необходимые для диагностики нарушений ритма и проводимости.
Регулярность сердечных сокращений оценивается при сравнении продолжительности интервалов R-R между последовательно зарегистрированными сердечными циклами. Регулярный, или правильный, ритм сердца диагностируется в том случае, если продолжительность измеренных интервалов R-R одинакова и разброс полученных величин не превышает ± 10% от средней продолжительности интервалов R-R. В остальных случаях диагностируется неправильный (нерегулярный) сердечный ритм.
Число сердечных сокращений (ЧСС) при правильном ритме подсчитывают чаще по формуле: ЧСС=60/RR. При неправильном ритме подсчитывают число комплексов QRS, зарегистрированных за какой-то определенный отрезок времени (например, за 3 с). Умножая этот результат в данном случае на 20 (60 с / 3 с = 20), подсчитывают ЧСС. При неправильном ритме можно ограничиться также определением минимального и максимального ЧСС. Минимальное ЧСС определяется по продолжительности наибольшего интервала R-R, а максимальное — по наименьшему интервалу R-R.
Для определения источника возбуждения, или так называемого водителя ритма, необходимо оценить ход возбуждения по предсердиям и установить отношение зубцов Р к желудочковым комплексам QRS.
Синусовый ритм: зубцы РΙΙ положительны и предшествуют каждому желудочковому комплексу QRS; форма всех зубцов Р в одном и том же отведении одинакова.
Для предварительной оценки функции проводимости необходимо измерить:
• длительность зубца Р, которая характеризует скорость проведения электрического импульса по предсердиям (в норме не более 0,1 с);
- длительность интервалов P-Q(R) во II стандартном отведении, отражающую общую скорость проведения по предсердиям, АВ-соединению и системе Гиса (в норме от 0,12 до 0,2 с);
- длительность желудочковых комплексов QRS (проведение возбуждения по желудочкам), которая в норме составляет от 0,06 с до 0,10 с.
Увеличение длительности перечисленных зубцов и интервалов указывает на замедление проведения в соответствующем отделе проводящей системы сердца.
После этого измеряют интервал внутреннего отклонения в грудных отведениях V1 и V6, косвенно характеризующий скорость распространения волны возбуждения от эндокарда до эпикарда соответственно правого и левого желудочков. Интервал внутреннего отклонения измеряется от начала комплекса QRS в данном отведении до вершины зубца R.
Электрическая ось сердца (проекция среднего результирующего вектора QRS на фронтальную плоскость) определяется в шестиосевой системе Bayley и количественно выражается углом α, который образован электрической осью сердца и положительной половиной оси I стандартного отведения.
Различают следующие варианты положения электрической оси сердца (рис. 4):
- нормальное положение, когда угол α составляет от +30° до +69°;
- вертикальное положение — угол α от +70° до +90°;
- горизонтальное — угол α от 0° до +29°;
- отклонение оси вправо — угол α от +91° до +180°;
- отклонение оси влево — угол α от 0° до -90°.

Для определения положения электрической оси сердца можно воспользоваться известным визуальным способом и информацией, представленной в таблице 2.
Таблица 2. Зависимость алгебраической суммы зубцов в отведениях от конечностей от величины угла α
| Угол α | Максимальные значения алгебраической суммы зубцов R и S (Q) | Комплекс QRS типа RS (QR) (алгебраическая сумма зубцов равю нулю) | |
| Положительная | Отрицательная. | ||
| +30 | I и II | aVR | III |
| +60 | II | aVR | aVL |
| +90 | aVF | aVL и aVR | I |
| +120 | Ш | aVL | aVR |
| +150 | III | aVL | II |
| +180 | aVR | I | aVF |
| 0 | I | aVR | aVF |
| -30 | aVL | III | II |
| -60 | aVL | III | I и II |
| -90 | aVL и aVR | aVF | I |
Длительное мониторировамие ЭКГ по Холтеру
В последние годы широкое распространение в клинической практике получило длительное мониторировапие ЭКГ по Холтеру. Метод применяется в основном для диагностики преходящих нарушений ритма сердца, выявления ишемических изменений ЭКГ у больных ИБС, а также для оценки вариабельности сердечного ритма. Существенным преимуществом метода является возможность длительной (в течение 1-2 суток) регистрации ЭКГ в привычных для пациента условиях.
Использование длительного мониторирования ЭКГ по Холтеру является частью обязательной программы обследования больных с нарушениями ритма сердца или с подозрением на наличие таких нарушений.
Внутрисердечное электрофизиологическое исследование (ЭФИ)
Инвазивное внутрисердечное электрофизиологическое исследование (ЭФИ) относится к числу наиболее информативных методов изучения электрофизиологических свойств различных отделов сердца и его проводящей системы. Оно используется для уточнения локализации АВ-блокады, характера пароксизмальных тахиаритмий, источника и механизмов эктопических нарушений ритма, диагностики аномальных проводящих путей и т.п.
Чаще всего это исследование проводится с целью определения четких показаний к выработке индивидуальной тактики хирургического лечения рецидивирующих и прогностически неблагоприятных нарушений ритма и проводимости, а также для выбора типа имплантируемых искусственных водителей ритма — электрокардиостимуляторов (ЭКС). Кроме того, ЭФИ используют для купирования тяжелых аритмий, рефрактерных к обычным методам лечения.
Чреспищеводная электрическая стимуляция сердца (ЧПЭС)
Чреспищеводпая электрическая стимуляция сердца (ЧПЭС) — неинвазивный метод исследования, который используется для изучения характера и электрофизиологических механизмов нарушений ритма сердца, купирования пароксизмальных наджелудочковых тахиаритмии, а также для диагностики скрытой коронарной недостаточности у больных ИБС. Анатомическая близость пищевода и левого предсердия позволяет осуществлять программированную электрическую стимуляцию предсердий с помощью электрода, располагающегося в пищеводе.
Сущность метода заключается в регулируемом увеличении числа сердечных сокращений (ЧСС) путем навязывания искусственного ритма электрической стимуляцией предсердий. Для этого используется гибкий биполярный электрод-катетер, который вводится через нос или рот в пищевод на глубину примерно 45 см и устанавливается на уровне предсердий. Электрод позволяет регистрировать внутрипищеводную ЭКГ.
