МИНЕРАЛЬНЫЕ КИСЛОТЫ, ЕДКИЕ ЩЕЛОЧИ И НЕКОТОРЫЕ СОЛИ, ИЗВЛЕКАЕМЫЕ ИЗ ОБЪЕКТА ВОДОЙ
Токсикологическая химия Вергейчик Т.Х.
- 13.1. Общая характеристика и токсикологическое значение
- 13.2. Исследование диализата на минеральные кислоты
- 13.3. Исследование диализата на нитриты и нитраты
- 13.4. Исследование диализата на едкие щелочи и аммиак
13.1. Общая характеристика и токсикологическое значение
Химико-токсикологическое исследование биологических объектов на минеральные кислоты, щелочи и некоторые соли проводится по постановлению правовых органов, если материалы уголовного дела указывают на возможность отравления перечисленными веществами или при наличии явных признаков отравления этими веществами (см. раздел 6.1).
Токсикологическое значение минеральных солей, кислот, щелочей и некоторых солей. Минеральные кислоты широко применяются в различных отраслях промышленности и в быту, поэтому часто доступны для населения. Это является одной из причин как случайных, так и умышленных отравлений. Известны криминальные случаи использования серной кислоты для нанесения физических увечий. С такой же целью могут использоваться и остальные кислоты. Случайные бытовые отравления встречаются реже.
При отравлении кислотами чаще всего наблюдаются острые отравления.
Серная кислота выпускается промышленностью в виде так называемого моногидрата — 98% раствора серной кислоты, олеума — 20% раствор серного ангидрида в серной кислоте, неочищенной серной кислоты или купоросного масла — 93-97% раствор серной кислоты. Серная кислота смешивается с водой в любых отношениях, при этом выделяется большое количество тепла. Применяется серная кислота почти во всех областях химической промышленности.
Пар над водными растворами серной кислоты состоит из смеси паров воды, серной кислоты и серного ангидрида. При вдыхании таких паров наблюдается затрудненное дыхание, сопровождающееся кашлем, охриплостью, нередко развивается ларингит, трахеит, бронхит. При больших концентрациях паров развивается отек гортани, легких, иногда наступает смерть в результате асфиксии и шока. При попадании серной кислоты на кожу она быстро проникает в глубину тканей, образуется белый струп, приобретающий затем темно-красную окраску. Смертельные случаи встречаются при поражении больших участков поверхности тела или при приеме внутрь 5-10 мл серной кислоты.
При исследовании трупа на коже вокруг рта можно обнаружить следы химического ожога в виде бурых полос и пятен. Слизистые оболочки рта, глотки, пищевода имеют серо-бурый цвет, слизистая оболочка желудка — серовато-красный цвет.
Азотная кислота представляет собой бесцветную прозрачную жидкость. Она смешивается с водой во всех отношениях. Открытая емкость с азотной кислотой выделяет тяжелые пары, образующие белый дым. Азотная кислота выпускается промышленностью в виде 50-60% и 96-98% растворов. Азотная кислота применяется в химической промышленности при производстве удобрений, взрывчатых веществ, лекарственных препаратов и т.д. По сравнению с серной кислотой она менее доступна для населения.
При действии азотной кислоты на ткани они приобретают желтый цвет за счет продуктов разложения и нитрования. Отравления азотной кислотой могут быть ингаляционными и пероральными.
При ингаляционном отравлении азотной кислотой наблюдается синюшность слизистых оболочек век и губ, в трахее и бронхах — большое количество мелкопузырчатой пены, легкие увеличены в объеме, на разрезе синюшно-красные с большим количеством пены. Наблюдаются отек мягкой мозговой оболочки и головного мозга, полнокровие внутренних органов.
При приеме внутрь смертельная доза азотной кислоты составляет 8-10 мл. Отравление начинается с резких болей в области рта, глотки, пищевода, желудка. Возникает рвота бурыми массами, содержащими обрывки слизистой оболочки. Смерть наступает от шока или коллапса.
При вскрытии содержимое желудка имеет резкий запах оксидов азота, наблюдается желтоватая окраска кожи в окружности рта, слизистой оболочки рта и пищеварительного тракта. Сердечная мышца и печень дряблые, имеют серовато-красный цвет с бурым оттенком.
Хлороводородная кислота представляет собой раствор хлористого водорода в воде. Промышленностью выпускается несколько видов хлороводородной кислоты. Наиболее известны: «аккумуляторная», содержащая примерно 37% хлористого водорода, и концентрированная, содержащая примерно 25% хлористого водорода. Первая из них имеет довольно много примесей и применяется только для технических целей. Вторая является более очищенной, один из ее сортов используется в фармацевтической практике. Разведенная хлороводородная кислота (1:2) готовится из 25% раствора и является доступной для населения.
При вдыхании хлористого водорода наблюдают раздражение верхних дыхательных путей и легких. Смерть может наступить от асфиксии в результате отека гортани или спазма голосовой щели.
При приеме внутрь концентрированной хлороводородной кислоты смерть может наступить от 15-20 мл такого раствора. Симптомы отравления такие же, как при отравлении серной кислотой, но выражены в меньшей степени.
При вскрытии видно, что слизистые оболочки полости рта, пищевода, желудка и верхнего отдела кишечника имеют сероватый или черный цвет. Содержимое желудка представляет собой бурую массу. Почки, печень и сердце находятся в состоянии жировой дистрофии. Сердечная мышца дряблая, имеет желтоватый цвет.
Гидроксид натрия — это твердое кристаллическое вещество, растворимое в воде, спирте, глицерине. При попадании на кожу или слизистые оболочки образует мягкие струпья. Опасно попадание гидроксида натрия в глаза, так как при этом развивается вторичная глаукома, сморщивание глазного яблока. При попадании внутрь симптомы отравления подобны симптомам отравлений кислотами. Смертельная доза гидроксида натрия и других едких щелочей составляет 10-20 г.
Гидроксид калия — это белое кристаллическое вещество, очень легко растворимое в воде. При отравлении гидроксидом калия картина сходна с отравлением гидроксидом натрия, но многие реакции действия на организм выражены сильнее.
Аммиак. Насыщенный раствор аммиака содержит до 33% аммиака, 10% его раствор известен как нашатырный спирт. Аммиак имеет широкое применение в химических синтезах, в холодильной промышленности. В медицинской практике применяется при обморочных состояниях. Раствор аммиака — это слабая щелочь. Он вызывает болезненные воспалительные реакции с образованием сильного отека. При длительном воздействии на организм наблюдается отслоение слизистых оболочек, образование пузырей и некроза. При большой концентрации аммиака в воздухе наступает паралич ЦП С и быстрая смерть при явлениях асфиксии (цианоз, судороги, остановка дыхания). Клиническая картина сходна с действием других едких ядов: отек гортани, психомоторное возбуждение, судороги, бред, затем коллапс, парез нижних конечностей. Смерть наступает в течение 10-15 мин.
При вскрытии наблюдаются ярко красные оболочки рта, глотки, пищевода, желудка, отек легких, в почках — нефроз и некроз извитых канальцев, в головном мозге — мелкие кровоизлияния, аммиачный запах от полостей. Смертельная доза составляет 10-15 мл 33% раствора и 25-50 мл 10% раствора аммиака.
Нитрат и нитрит натрия — это бесцветные или слегка желтоватые кристаллы, имеют соленый вкус, похожий на вкус хлорида натрия, хорошо растворимы в воде.
Нитрит натрия используется в химической промышленности при производстве красителей, фотоэмульсий, иногда в строительстве как антифриз для бетона в зимнее время, в резинотехнической, текстильной и металлообрабатывающей промышленности. Как консерванты пищевых продуктов нитриты и нитраты в настоящее время не применяются.
Нитраты находят применение во многих отраслях промышленности. Нитраты (аммония, щелочных металлов и кальция) являются основными азотными удобрениями. Нитраты — компоненты ракетного топлива, пиротехнических составов, травильных растворов при крашении тканей, их используют для закалки металлов, как лекарственные средства и в других областях.
Нитриты и нитраты относятся к токсичным соединениям. Они быстро всасываются из ЖКТ. Отравления нитритами и нитратами могут быть производственными и бытовыми. Нитраты вызывают отек легких, кашель, рвоту, острую сердечно-сосудистую недостаточность. Смертельная доза нитратов находится в пределах 8-15 г. Установлено, что в организме нитраты могут восстанавливаться до нитритов. Нитриты вызывают головную боль, рвоту, угнетают дыхание, действуют на сосудистые стенки и угнетают сосудодвигательный центр. При отравлении нитритами в крови образуется метгемоглобин, повреждаются мембраны эритроцитов. Возможно образование из нитритов нитрозоами- нов и аминов непосредственно в ЖКТ. При отравлении характерна сине-черная окраска губ, носа, ушных раковин, ногтей, кровь приобретает шоколадный цвет.
Объектами исследования на наличие этой группы соединений являются содержимое желудка, рвотные массы, остатки пищи, части одежды. При подозрении на наличие солей на исследование дополнительно направляют печень.
Изолирование минеральных кислот, едких щелочей и солей проводят путем настаивания объекта с водой. Для очистки полученных извлечений используют диализ (см. раздел 6.4.6).
13.2. Исследование диализата на минеральные кислоты
При анализе диализата на минеральные кислоты положительную реакцию будут давать как естественно содержащиеся, так и экзогенные анионы (SO4 2-, NO3—, С1— ). Поэтому при положительных реакциях предварительных испытаний диализата проводят перегонку кислот в виде их оксидов.
Предварительное исследование диализата
Вначале проводят испытание диализата на отдельные ионы кислот:
- Испытание на сульфаты. К 1 мл диализата добавляют 0,1 мл 10% раствора хлороводородной кислоты и 1 мл 5% раствора хлорида бария. При наличии сульфат- ионов образуется белый осадок.
- Испытание на хлориды. К 1 мл диализата добавляют 0,1 мл 10% раствора азотной кислоты и 0,1 мл 1% раствора нитрата серебра. При наличии хлоридов образуется белый творожистый осадок, растворимый в растворе аммиака.
- Испытание на нитраты и нитриты. Каплю диализата добавляют к раствору дифениламина в концентрированной серной кислоте. При наличии нитратов или нитритов смесь окрашивается в синий цвет.
Основное исследование диализата
Серная кислота
Диализат помещают в колбу и вносят в него медные опилки. Колбу соединяют с холодильником, снабженным аллонжем, конец которого опускают в раствор йода в йодиде калия (рис. 102).
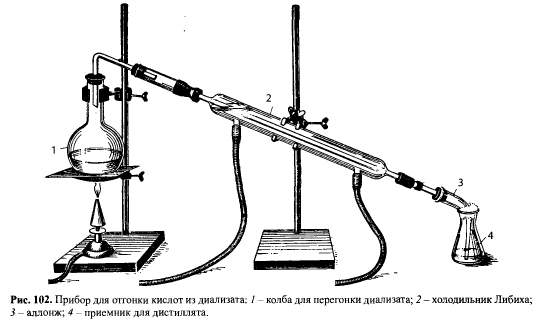
Колбу с диализатом и медными опилками нагревают. Если раствор йода в приемнике обесцветится, его необходимо добавить дополнительно.
В колбе с объектом происходит окислительно-восстановительная реакция с образованием сернистой кислоты, которая разлагается до оксида серы (IV).
H2SO4 + Сu → СuО + Н2SO3
H2SO3 → SO2 + Н2O
В приемнике также проходит окислительно-восстановительная реакция и наблюдается обесцвечивание йода.
I2 + SO2 + 2Н2O → 2HI + H2SO4
Обнаружение образовавшейся серной кислоты проводят с помощью следующих реакций.
Реакция образования сульфата бария. К 3-5 каплям раствора прибавляют 1-2 капли 5% раствора хлорида бария. Появляется белый осадок, указывающий на наличие серной кислоты.
Реакция получения сульфата свинца. К 3-5 каплям раствора прибавляют 2-3 капли 3% раствора ацетата свинца — выпадает белый осадок сульфата свинца, нерастворимый в азотной кислоте, но растворимый в растворах щелочей и в растворе ацетата аммония.
PbSO4 + 3NaOH → Na[Pb(OH)3] + Na2SO4
PbSO4 + 4NH4(CH3COO) → (NH4)2[Pb(CH3COO)4] + (NH4)2SO4
Последняя реакция основана на способности ионов свинца образовывать ацетатные ацидокомплексы.
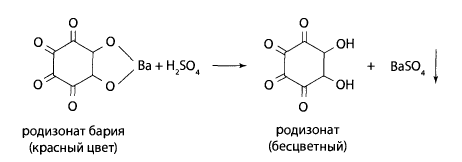
Реакция с родизонатом бария. К 1-2 мл раствора добавляют окрашенный в красный цвет 0,2% раствор родизоната бария. При наличии в растворе сульфат-ионов окраска исчезает, раствор обесцвечивается и образуется белый осадок сульфата бария.
Количественное определение серной кислоты проводят методом алкалиметрии. Определенный объем диализата или отгона оттитровывают 0,1 М раствором гидроксида натрия при индикаторе метилоранже.
Азотная кислота
Перегонку диализата проводят, гак в случае серной кислоты, в присутствии медных опилок. В приемник помещают очищенную воду. В реакционной колбе происходят реакции, приводящие к образованию оксидов азота.
ЗСu + 2HNO3 → ЗСuО + 2NO + Н2O
ЗСuО + 6HNO3 → ЗСu(NO3)2 + ЗН2O
2NO + O2 → 2NO2
В приемнике оксид азота связывается с водой.
2NO2 + Н2O → HNO2 + HNO3
Для обнаружения образовавшихся азотной и азотистой кислот используют следующие реакции.
Реакция с дифениламином. В углубление на предметном стекле наносят 3-4 капли раствора дифениламина в концентрированной серной кислоте и прибавляют 1 каплю полученного в результате перегонки раствора — появляется синее окрашивание.
Эта реакция неспецифична.
Реакция с бруцином. В углубление на предметном стекле помещают несколько капель исследуемого раствора и прибавляют 2-3 капли бруцина в концентрированной серной кислоте — появляется красное окрашивание при наличии в диализате азотной кислоты.
Реакция с белком на азотную кислоту (ксантопротеиновая проба). В часть исследуемого раствора помещают белые шелковые, хлопчатобумажные и шерстяные нити и раствор выпаривают. Затем нити промывают водой. Шерстяные и шелковые нити окрашиваются в желтый цвет. При добавлении раствора аммиака окраска нитей переходит в оранжевую. Хлопчатобумажные нити остаются белыми.
Реакция на азотистую кислоту. В пробирку вносят несколько капель исследуемого раствора, прибавляют 2-4 капли 10% раствора серной кислоты и 2-3 капли 1% водного раствора феназона — наблюдают образование зеленого окрашивания.
Количественное определение азотной кислоты проводят методом нейтрализации. Определенный объем диализата или отгона титруют 0,1 М раствором гидрокрида натрия при индикаторе фенолфталеине.
Хлороводородная кислота
Часть диализата помещают в колбу и нагревают на песчаной бане. Вначале из колбы отгоняется вода в приемник. Когда концентрация хлористого водорода в реакционной колбе достигнет 10%, он начинает перегоняться и поступать в приемник, где растворяется в воде.
Обнаружение хлороводородной кислоты проводят с помощью следующих реакций.
Реакция с нитратом серебра. В пробирку помещают 1-2 мл раствора, прибавляют
- 2 капли 5% раствора нитрата серебра и 1 мл 10% азотной кислоты — появляется белый осадок, растворимый в растворе аммиака и появляющийся вновь после подкисления раствора азотной кислотой.
HCI + АgNO3 → AgCl + HNO3
AgCl + NH4OH → Ag(NH3)2CI + H2O
Ag(NH3)2CI + HNO3 → AgCl + NH4NO3 + NH3
Реакция выделения йода. В пробирку помещают 1 мл раствора, прибавляют несколько кристалликов калия хлората и нагревают. В верхнюю часть пробирки помещают несколько йодкрахмальных бумажек. При наличии хлороводородной кислоты йодкрахмальные бумажки синеют.
6HCI + KClO3 → 3CI2 + KCl + 3H2O
Cl2 + 2KI → l2 + 2KCI
Количественное определение хлороводородной кислоты проводят по методу Фольгарда в определенном объеме диализата или отгона.
Если в исследуемом растворе присутствует сероводород, для количественного определения хлороводородной кислоты используют гравиметрический метод. С этой целью к раствору добавляют избыток нитрата серебра. При этом в осадке образуются хлорид серебра (AgCl) и сульфид серебра (Ag2S). Осадок отфильтровывают, обрабатывают 10% раствором аммиака для растворения хлорида серебра. Аммиачный раствор подкисляют азотной кислотой и полученный осадок хлорида серебра отфильтровывают, высушивают до постоянной массы и взвешивают.
13.3. Исследование диализата на нитриты и нитраты
Нитриты
Реакция с сульфаниловой кислотой и р-нафтолом. В углубление на предметном стекле помещают 2 капли предварительно нейтрализованного диализата, прибавляют 2-3 капли 0,5% раствора сульфаниловой кислоты в 2% растворе хлороводородной кислоты. Через 3-5 мин к смеси прибавляют 1 каплю щелочного раствора Р-нафтола — появляется интенсивная оранжево-красная окраска.
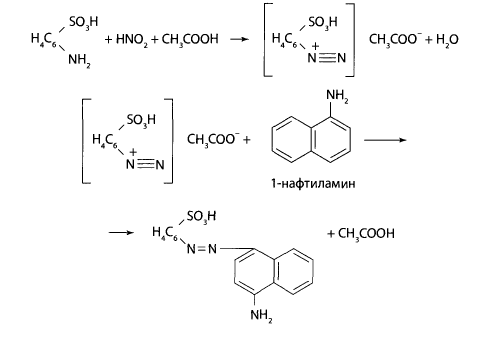
Реакция с реактивом Грисса (смесь сульфаниловой кислоты и 1 -нафтиламина). В углубление предметного стекла вносят несколько капель нейтрализованного уксусной кислотой диализата и прибавляют 3-4 капли реактива Грисса. Через несколько минут появляется интенсивная красная окраска.
Реакция с феназоном. К части диализата добавляют 10% раствор серной кислоты и несколько капель 1% раствора феназона — наблюдают появление зеленого окрашивания.
С помощью указанных реакций могут быть обнаружены эндогенные нитриты. Поэтому используют дополнительную перегонку диализата после подкисления уксусной кислотой. Дистиллят должен давать те же реакции на нитриты. Методика не позволяет обнаружить следовые количества естественно содержащихся нитритов.
Нитраты
Перед обнаружением в диализате нитратов нитриты должны быть удалены с помощью азида натрия — NaN3 или сульфаминовой кислоты — NH2SO3H. После этого проводят реакции:
- С дифениламином в серной кислоте с получением синего окрашивания.
- С сульфатом железа (II). В пробирку помещают часть исследуемого раствора (обычно 2-3 капли) и кристаллик сульфата железа (II). Затем по стенке пробирки медленно приливают каплю концентрированной серной кислоты. На месте соприкосновения двух жидкостей появляется бурое кольцо. Нитраты восстанавливаются до оксида азота (II), который с избытком сульфата железа (II) образует раствор бурого цвета.
6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2 (SO4) 3 + 4H2O + 2NO
FeSO4 + NO → [Fe(NO)]SO4 комплекс бурого цвета
13.4. Исследование диализата на едкие щелочи и аммиак
Анализ на едкие щелочи и аммиак проводится при сильно щелочной реакции водных вытяжек из биологического материала и отсутствии карбонатов по предварительным пробам (см. раздел 6.1).
Гидроксид натрия
Для обнаружения ионов натрия используют реакции с гидроксостибиатом калия и цинкуранилацетатом.
Реакция с гидроксостибиатом калия. К 3-5 каплям диализата, нейтрализованного уксусной кислотой, прибавляют 2-3 капли раствора гидроксостибиата кал ид. При потирании стенок пробирки стеклянной палочкой выпадает белый кристаллический осадок.
Наиболее вероятна формула гидроксостибиата калия — K[Sb(OH)6], который при взаимодействии с образовавшимся ацетатом натрия образует белый осадок.
CH3COONa + K[Sb(OH)6] → [Na[Sb(OH)6] + КОН
В кислой среде возможно переоткрытие гидроксида натрия за счет образования осадка метасурьмяной кислоты — HSb03.
Реакция с цинк-уранилацетатом. На предметное стекло наносят каплю диализата и выпаривают досуха. Затем добавляют 1-2 капли цинк-уранилацетата. При наличии ионов натрия с уранилацетатом в нейтральных и уксуснокислых растворах образуется зеленовато-желтый кристаллический осадок в виде октаэдров и тетраэдров.
Zn(UO3)2(CH3COO)8 + CH3COONa → NaZn(UO3)2(CH3COO)9
Гидроксид калия
Для обнаружения ионов калия применяют реакции с гидротартратом натрия и с кобаль- тинитритом натрия.
Реакция с гидротартратом натрия. В маленькую пробирку вносят 3-5 капель диализата, прибавляют 3-4 капли 1 М раствора гидротартрата натрия и такой же объем смеси равных количеств 2 М раствора винной кислоты и 2 М раствора ацетата натрия. Стенки пробирки потирают стеклянной палочкой. При наличии ионов калия выпадает белый осадок — КНС4Н4O6.
Реакция с кобальтипитритом натрия. 3-5 капель исследуемого диализата вносят в маленькую пробирку и прибавляют 2-3 капли раствора кобальтинитрита натрия — Na3[Co(NO2)6].
При наличии ионов калия выпадает желтый кристаллический осадок — K2Na[Co(NO2)6].
Аммиак
Анализ проводится с диализатом, если предварительные испытания указывают на возможное его наличие.
Реакция с реактивом Несслера. В пробирку вносят 1-2 капли исследуемого раствора, прибавляют 3-5 капель воды очищенной и 3-4 капли реактива Несслера. В присутствии аммиака выпадает желто-бурый или оранжево-коричневый осадок.
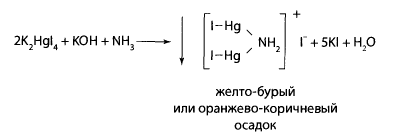
Реакция неспецифична, так как многие ионы могут давать осадки в присутствии щелочи или реагировать с йодид-ионами, образуя подобную окраску.
Количественное определение едких щелочей и аммиака. Определенный объем диализата титруют 0,1 М раствором хлороводородной кислоты в присутствии индикаторов — фенолфталеина (для гидроксидов калия и натрия) и метилового оранжевого (для аммиака).
