Лечение хронической почечной недостаточности
Лекции по нефрологии — Иванов Дмитрий Дмитриевич — 2010
Хроническая почечная недостаточность наиболее часто является следствием хронической болезни почек, редко — исходом ОПН. В зависимости от возраста пациентов сущесгаукгсразличиявсгруктуре дебютныхзаболеваний, приводящихкпочечной недостаточности. Причинами хронической почечной недостаточности у детей (в порядке уменьшения удельного веса) являются микробно-воспалительные заболевания почек на фоне аномалий развития мочевыводящей системы и обструктивных уропатий, гломерулопатии (иммунокомплексные, фокальный сегментарный гломерулосклероз, IgA-нефропатия, синдром Альпорта), тубулопатии. У взрослых наиболее частыми причинами хронической почечной недостаточности являются диабетическая нефропатия, гипертоническая болезнь, гломерулонефрит.
Развитие хронической почечной недостаточности характеризуется необратимой утратой гомеостатических функций почек, а именно снижением клубочковой фильтрации, относительной плотности (осмолярности) мочи, повышением концентрации креатинина, мочевины, калия, фосфора, магния, алюминия сыворотки крови, снижением уровня кальция крови, нарушением кислотно-основного состояния (метаболический ацидоз), развитием анемии и гипертензии.
Диагноз хроническая почечная недостаточности верифицируется на основании снижения СКФ менее 90 мл/мин или эквивалентного ей повышения креатинина крови. В детском возрасте используется еще один критерий — снижение относительной плотности мочи. Указанные изменения должны быть документированы на протяжении 3 и более месяцев и дифференцируются по стадиям согласно классификациям, утвержденным соответствующими приказами МЗ Украины и 2-м съездом нефрологов Украины (2005) (табл. 5.1, 5.2).


Хроническая почечная недостаточность характеризуется одновременным повышением мочевины и креатинина. Изолированное повышение мочевины может наблюдаться при наличии усиленного катаболизма, при кровотечениях гастроинтестинального тракта, приеме коргикостероидов и заболеваниях печени. Изолированное повышение креатинина может быть проявлением гиперактивности симпатической системы, а также наблюдается у пациентов, принимающих цефалоспорины или бисептол.
Основные клинические симптомы при хронической почечной недостаточности:
- со стороны сердечно-сосудистой системы: гипертензия, левожелудочковая гипертрофия, сердечная недостаточность, кальцификация сердца и сосудов, перикардит, дилатационная кардиомиопатия;
- со стороны нервной системы: полиневрит, мышечная слабость, инсомния, тремор, нарушение памяти, снижение внимания и как крайние проявления — ступор и кома;
- со стороны гастроинтестинального тракта: анорексия, тошнота, рвота, гастрит, язва, панкреатит;
- со стороны гематологической системы: дефицитная анемия, кровоточивость, метроррагия;
- со стороны эндокринной системы: задержка роста у детей, инсулинорезистентность, гипогликемия, импотенция, инфертильность, нарушенный эутиреоидный статус;
- со стороны иммунной системы: склонность к инфекциям, новообразованиям, снижение активности фагоцитоза;
- со стороны фосфорно-кальциевого обмена: вторичный гиперпаратиреоидизм, скелетные аномалии.
Все клинические проявления хронической почечной недостаточности можно классифицировать в четыре синдрома:
- а) кардиоваскулярный, включающий в себя гиперактивность симпатической системы, кардиоренальную анемию;
- б) синдром белково-энергетического дефицита, включающий М1А-симптомокомплекс;
- в) синдром костно-минеральных нарушений;
- г) синдром нарушения гомеостаза (рис. 5.1).
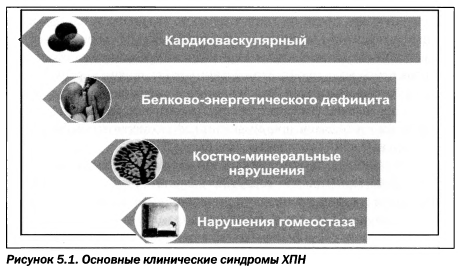
Обобщение всей клинической картины хронической почечной недостаточности в синдромы облегчает оценку прогноза почечной недостаточности и выбор приоритетов в тактике лечения. Так, в долговременном прогнозе ведущую роль играет кардиоваскулярный синдром, определяющий основную причину смертности пациентов от сердечно-сосудистых катастроф. Напротив, внезапная смерть при хронической почечной недостаточности чаще возникает при нарушениях гомеостаза.
Тактика лечения хронической почечной недостаточности определяется причинным заболеванием и синдромами, развивающимися у данного пациента (рис. 5.2). Диагностика синдромов и терапевтические мероприятия представлены на рис. 5.3—5.7.

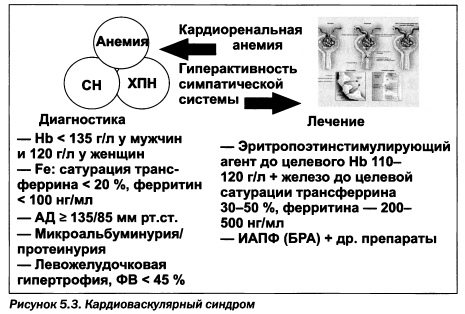
Пациенты со сниженной функцией почек имеют повышенный риск развития кардиоваскулярной патологии. Гипертензия и микропротеинурия, возникающие вследствие гиперактивности симпатической системы, как проявления кардиоваскулярного синдрома рассмотрены подробно в разделе 4. Принципиально важно повторить следующие положения.
Стабилизация кровяного давления при СКФ менее 60 мл/мин предусматривает применение ИАПФ с двойным механизмом выведения (фозиноприл, квадроприл, моэксиприл), БРА II1 (эпросартан, телмисартан), бета-блокаторов, рекомендованных для лечения сердечной недостаточности (бисопрол, метопролола сукцинат, небиволол, карведилол), антагонистов кальция, которые не ухудшают почечный кровоток (фелодипин, лерканидипин), блокаторов центральных имидазолиновых рецепторов (моксонидин), тиазидоподобных диуретиков (арифон, ксипамид) или петлевых диуретиков.
При наличии креатинина свыше 0,124 ммоль/л назначение ИАПФ может приводить к повышению креатининемии до 30 % и выше и гиперкалиемии, а при наличии креатинина 0,4—0,6 ммоль/л применение ИАПФ нередко сопровождается резким приростом азотистых шлаков. Пациентам с хронической почечной недостаточностью следует крайне осторожно относиться к использованию комбинации ИАПФ + БРА ввиду возможного прогрессивного снижения функции почек. Сердечные гликозиды и прямые вазодилататоры следует назначать при неэффективности терапии ИАПФ и бета-блокаторами.
В большинстве случаев монотерапия гипертензии не проводится. Целевым АД для больных хронической почечной недостаточностью в додиализном периоде, после трансплантации или на фоне диализа является < 130/80 мм рт.ст. В начале диализной процедуры больные должны иметь корригированное АД < 140/90 мм рт.ст., во время гемодиализа (но не перитонеального диализа) и после него > 110/80 мм рт.ст. для предупреждения коронарной ишемии. Следует заметить, что пациентам с хронической почечной недостаточностью следует выбирать среднее давление после трех измерений. Контроль за состоянием сердечно-сосудистой системы целесообразно проводить совместно с кардиологом, регулярно выполняя ЭКГ и УЗИ сердца. Восстановление реологических параметров крови осуществляется под контролем фибриногенемии за счет назначения аспирина, клопидогреля, тиклопидина или, реже, низкомолекулярных гепаринов.
Пациентам, не получающим диализ, рекомендуются все мероприятия для понижения давления, что и пациентам без хронической почечной недостаточности: снижение лишнего веса, уменьшение соли в пищевом рационе до 3 г/сутки, отказ от курения, умеренные физические нагрузки. У больных, которые получают диализ, необходимы контроль сухого веса и эффективности диализных процедур для профилактики гипертензии.
Анемия является важной составляющей кардиоваскулярного синдрома и входит в триаду кардиоренального синдрома. Известно, что у больных с хронической почечной недостаточностью в разные сроки развивается анемия, обусловленная недостаточной выработкой эритропоэтина пораженными почками. Анемия возникает у 70—90 % пациентов с терминальной стадией хронической почечной недостаточности. Снижение синтеза эндогенного эритропоэтина происходит в результате гибели перитубулярных клеток интерстиция почек. Этот процесс коррелирует с уровнем клубочковой фильтрации, демонстрируя более низкие значения при снижении функции почек. Кроме того, анемия считается независимым кардиоваскулярным фактором, осложняющим прогноз заболевания (Silverberg, 2003).
Выделяют следующие наиболее значимые причины анемии при хронической почечной недостаточности:
- — недостаточная выработка эндогенного эритропоэтина;
- — угнетение эритропоэза гемотрансфузиями;
- — уменьшение времени жизни эритроцитов (гемолиз);
- — дефицит железа в результате его мальабсорбции, недостатка фолиевой кислоты и витамина В12;
- — хронические и острые кровопотери.
Накоплены доказательные данные, свидетельствующие о снижении частоты сердечно-сосудистых событий у пациентов с хронической почечной недостаточностью при своевременном начале лечения патологии почек и связанной с ней анемии. На сегодняшний день известны следующие принципиальные способы лечения ренальной анемии:
- — гемотрансфузии;
- — применение эритропоэтинстимулирующих агентов.
Однако гемотрансфузию следует относить к неотложным мероприятиям ввиду довольно широкого спектра ее побочных эффектов, среди которых:
- — риск инфицирования вирусами гепатита, цитомегаловирусом и ВИЧ;
- — увеличение риска смерти;
- — ухудшение результатов трансплантации;
- —- высокие титры предсуществующих у донора антител;
- — угнетение гемопоэза;
- — аллергические реакции;
- — увеличение ОЦК;
- — перегрузка железом;
- — гемосидероз печени;
- — отказ больных от переливаний.
В связи с этим назначение эритропоэтинстимулирующих агентов с момента установления диагноза анемии признано целесообразным и эффективным.
Рекомендации последних лет отражают накопление доказательных данных в диагностике и лечении анемии у пациентов с ХБП/ ХПН (табл. 5.3).
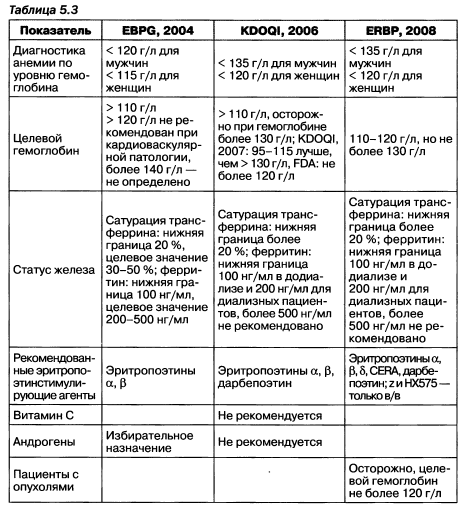
Таким образом, согласно современным представлениям следует резюмировать:
- — анемия диагностируется при гемоглобине < 135 г/л у взрослых мужчин, < 120 г/л у взрослых женщин, снижении более 5 перцентилей с учетом возраста и пола — у детей;
- — целевой гемоглобин 110—120 г/л в предиализе и диализе, но у диализных больных — не более 130 г/л (для взрослых и детей);
- — мониторирование гемоглобина и статуса железа необходимо ежемесячно у пациентов, получающих ЭПО-терапию, при достижении целевого уровня обмен железа следует контролировать 1 раз в 3 месяца;
- — введение эритропоэтинстимулирующих агентов предпочтительно подкожно у пациентов в предиализе и внутривенно у больных, получающих диализ;
- — дозы эритропоэтинстимулирующих агентов определяются препаратом и клинической ситуацией с возможно более редким введением (адекватной дозы) в предиализе;
- — целевые уровни обмена железа: у пациентов, получающих диализ, — ферритин > 200 нг/мл, сатурация трансферрина > 20 %, в предиализе и на перитонеальном диализе — ферритин сыворотки крови > 100 нг/мл, сатурация трансферрина > 20 %; для детей впредиализе и диализе — ферритин сыворотки крови > 100 нг/мл, сатурация трансферрина > 20 %;
- — целесообразно введение препаратов железа в/в у пациентов, получающих диализ, перорально — в предиализе и на перитонеальном диализе;
- — L-карнитин и витамин С не убедительны в лечении анемии, андрогены противопоказаны;
- — трансфузии эритроцитов используются как прецедентная опция, но не как инструмент лечения анемии;
- — неэффективность ЭПО-терапии документируется при невозможности достижения целевого гемоглобина более ПО г/л дозами эритропоэтинстимулирующих агентов, превышающими 500 Ед/кг в неделю;
- — красноклеточная аплазия (PRCA) предполагается при внезапном снижении гемоглобина на 5—10 г/л в неделю на фоне не менее 4-недельного курса ЭПО-терапии, нормальном количестве тромбоцитов и абсолютном содержании ретикулоцитов менее 10 000 в 1 мкл. С 2007 не было зарегистрировано новых случаев красноклеточной аплазии (ERBP, 2008).
Напомним, что среди побочных эффектов эритропоэтинстимулирующих агентов FDA отмечено усиление роста опухолей и снижение продолжительности жизни у пациентов с хронической почечной недостаточностью и прогрессирующими опухолями.
Начинать лечение следует при уровне гемоглобина менее 120 г/л. Анемию необходимо лечить, как только она обнаружена, и так же агрессивно, как гипертензию, сахарный диабет и дислипидемию. Ранняя коррекция анемии способствует увеличению додиализного времени, замедляет снижение функции почек, повышает качество и продолжительность жизни больных за счет органопротекции других органов, в первую очередь сердца и головного мозга (снижение риска развития сердечно-сосудистой заболеваемости и связанной с ней смертности). Эти органы имеют наибольшую после почек капиллярную систему и высокочувствительны к гипоксии. Кроме того, ткани головного мозга содержат рецепторы к эритропоэтину. Поэтому назначение заместительной ЭПО-терапии способствует восстановлению конгестивных функций.
Для больных более удобным является подкожный путь введения эритропоэтинов, в том числе когда они самостоятельно могут выполнить инъекцию. Дополнительными преимуществами подкожного пути введения являются высокая эффективность, возможность уменьшения частоты введения, снижение финансовых затрат.
У пациентов, которые находятся на гемодиализе, препарат обычно вводится после диализа внутривенно или подкожно, при перитонеальном диализе — внутрибрюшинно или подкожно. Препараты эритропоэтинстимулирующих агентов необходимо применять постоянно в качестве заместительной терапии. Эффективность лечения зависит от дозы эритропоэтина и исходных показателей гемоглобина и обмена железа.
Лечение эритропоэтинстимулирующими агентами проводится в 2 этапа: начальная терапия (стадия коррекции) и поддерживающая терапия. В зависимости от начального уровня гемоглобина можно дифференцированно подходить к дозировке эритропоэтина (табл. 5.4). Контроль гемоглобина на фоне терапии следует проводить через 1—2 недели от начала лечения или после изменения назначенной дозы и до достижения целевых значений гемоглобина. После ликвидации анемии мониторинг гемоглобина и гематокрита проводится 1 раз в 2 недели у больных, получающих диализ, и 1 раз в месяц на додиализном этапе. Для достижения целевого уровня гемоглобина 110— 120 г/л следует ориентироваться на его уровень 125 г/л.
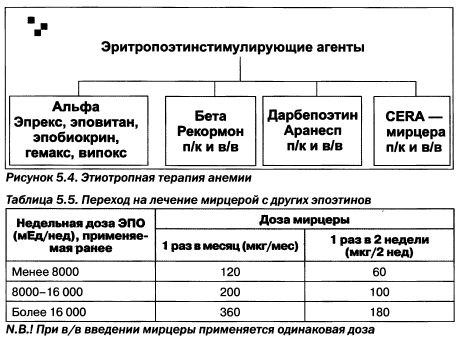
Более высокие дозы эритропоэтинстимулирующих агентов позволяют быстрее добиться целевых значений гемоглобина, а следовательно, и в более короткие сроки снизить неблагоприятные кардиоваскулярные риски. Вместе с тем напомним, что интенсивная терапия эритропоэт^шстимулирующими агентами может приводить к повышению АД и, вероятно, увеличению частоты гриппоподобного симптома, характеризующегося повышением температуры и заложенностью носа. Среди эритропоэтинстимулирующих агентов выделяют следующие (рис. 5.4).

К новым препаратам на нашем рынке следует отнести мирцеру—активатор эритропоэтин-рецепторов длительного действия. Препарат демонстрирует принципиально новую активность на рецепторном уровне. При переходе с других эритропоэтинов на мирцеру производитель рекомендует придерживаться следующих соотношений в дозировке (табл. 5.5).
Необходимой составляющей успешного лечения анемии является поддержание баланса железа. Даже при отсутствии нарушений обмена железа его дефицит развивается при интенсивной терапии эритропоэтинстимулирующими агентами. В клинической практике для достижения целевых значений обмена железа целесообразно использовать комбинированные с витаминами препараты, придерживаясь следующей тактики (табл. 5.6). Следует помнить, что без адекватного содержания железа достижение целевых значений гемоглобина практически невозможно.
Терапия проводится препаратами железа для внутривенного введения (ферролек, феринжект, венофер) и для перорального приема (при отсутствии уремического стоматита, паротита, язвенного эзофагита, эрозивного гастрита, пептической язвы желудка и двенадцатиперстной кишки, геморрагического энтероколита). Прием препаратов железа не следует прекращать после нормализации уровня гемоглобина, следует использовать прерывистое их введение или уменьшить дозу.
Препаратами выбора для додиализной коррекции содержания железа являются комбинированные двухвалентные соли железа, которые значительно лучше всасываются в кишечнике по сравнению с трехвалентным соединением. Целесообразно использовать фумараты и сульфаты двухвалентного железа в комбинации с витаминами. К ним относятся глобирон, фенюльс и ранферон-12 или тардиферон (необходимо контролировать повышенную концентрацию витамина В12). Препараты сорбифер дурулес, фенюльс, фефол, фефолвит, глобирон имеют замедленное высвобождение за счет содержания инертных мелкопористых субстанций. Для лучшей переносимости препараты железа следует принимать во время или после еды.
Синдром белково-энергетического дефицита и один из его компонентов — МИА-синдром (рис. 5.5) составляют вторую группу клинических проявлений хронической почечной недостаточности.


Диагностика синдрома белково-энергетического дефицита и основы его медикаментозной коррекции представлены на рис. 5.6. Рекомендуется ограничение приема белка до 0,6—0,8 г/кг/сутки при наличии хронической почечной недостаточности I, 0,5—0,6 г/кг — при ХПН II и возможно снижение до 0,4—0,5 г/кг при ХПН III. С началом диализа суточный прием протеинов составляет 0,8—1,0 г/кг. Желаемым является увеличение употребления рыбного и соевого белка. Для снижения уровня азотистых шлаков в консервативной терапии применяют леспенефрил, леспефлан, хофитол, кетостерил, стимол.
Для уменьшения образования аммиака и увеличения выведения его из организма больного применяется дуфалак или нормазе (лактувит). Действующим веществом этих препаратов является лактулоза, обеспечивающая улучшение пассажа каловых масс. Таким образом, применение лактулозы при хронической почечной недостаточности способствует уменьшению интоксикации и содержания азотистых шлаков. Препарат назначают по 10—15 мл детям и 30—60 мл взрослым один раз в сутки утром. Лактувит и нормазе содержат меньше лактозы и галактозы, поэтому могут применяться без ограничений у пациентов с сахарным диабетом.
Хорошо зарекомендовали себя также полифепан и мультисорб — не содержащие кремний энтеросорбенты. Эти препараты существенно уменьшают проявления уремии и предупреждают развитие дисбактериоза. Использование энтеросорбентов позволяет более уверенно контролировать содержание азотистых продуктов на додиализном этапе лечения. Вероятно, следует избегать энтеросорбентов, имеющих в своем составе микроэлементы, в частности кремний. Необходимость ограничения использования кремнийсодержащих препаратов связана с имеющимися данными о возможности кумуляции кремния, как и щелочноземельных металлов, при хронической почечной недостаточности. У пациентов с хронической почечной недостаточностью наблюдаются измененные механизмы энтеральной проницаемости, и в связи с этим не исключено минимальное всасывание кремния. Использование леспенефрила и его аналогов не демонстрирует устойчивого контроля азотистых шлаков. Длительность применения гипоазотемических препаратов не ограничена.
У больных, которые не получают адекватный диализ, целесообразным является увеличение пероральной нагрузки бикарбонатом натрия (щелочные минеральные воды, ксилат). Это улучшает выживаемость пациентов. Коррекции метаболического ацидоза способствует также назначение цитрата кальция и цитруллина малата (стимол).
Целесообразность назначения статинов еще окончательно не определена. Исследование AURORA показало, что нет различий между лечением розувастатином 10 мг и приемом плацебо в снижении частоты комбинированной кардиоваскулярной точки, инфаркта и инсульта у 396 пациентов с хронической почечной недостаточностью, находящихся на протяжении 3,8 года на диализе. Вероятно, данные обратной эпидемиологии, свидетельствующие о более высокой выживаемости пациентов с ХПН, имеющих несколько повышенные массу тела, уровень холестерина и АД, вынуждают осторожно относиться к назначению статинов. Возможно, полиненасыщенные жирные кислоты будут более эффективны у пациентов с хронической почечной недостаточностью.
Синдром костно-минеральных нарушений вызывает ремодуляцию костной ткани и кальцификацию сердечно-сосудистой системы (рис. 5.7).
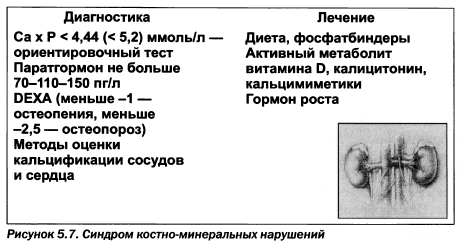
Диагностику нарушений фосфорно-кальциевого обмена проводят с учетом концентрации кальция, фосфора, паратгормона и использованием методов визуализации кальцификации мягких тканей и сосудов. К настоящему времени произведение Са х Р > 4,44 (2,4 х 1,8 = = 4,44) ммоль2/л2 (9,6 х 5,7 = 55 мгУдл2) признано не совсем корректным и из сывороточных маркеров рекомендуется ориентироваться на содержание паратгормона. Новые рекомендации ожидаются в 2009 году. Концентрация общего паратгормона больше 70 пг/мл (для ионизированной фракции больше 40 пг/мл) свидетельствует о наличии гиперпаратиреоза (KDOQI, 2002) и нуждается в коррекции. Целевыми являются уровни: Са х Р — 2,82-4,44 ммоль2/л2, фосфора — 1,0—1,61 ммоль/л, суточного приема кальция — 1 г, паратгормона — 150-300 пг/мл.
Контроль состояния сердечно-сосудистой системы и сохранения вен предусматривает проведение ЭКГ, Эхо сердца, каротидных, феморальных артерий, аорты, периферических сосудов, сетчатки и при ожидаемой кальцификации — компьютерной томографии. Для снижения фосфора сыворотки крови в пределах 1,0— 1,61 ммоль/л используют простые соли кальция (табл. 5.7), фосфатные биндеры, не содержащие кальция (соли севеламера), карбонат лантана (фосренол) в форме растворяющихся во рту таблеток в дозе 0,75—3 г/сутки. Ренагель рекомендован KDOQI в дозе по 800 мг в несколько приемов как препарат первого ряда при 5-й стадии хронической почечной болезни. Апробируются хлорид циркония и дериваты железа (III).
Для повышения уровня кальция используют нативные витамины D2 и D3 — эргокальциферол и холекальциферол; структурные аналоги витамина D2 — тахистин или дигидротахистерол, активные формы витамина D2 — парикальцитол (Zemplar, Abbott Lab), синтетические аналоги витамина D2, которые превращаются в организме в 1а,25(ОН)202-доксеркальциферол (Hectorol); активные метаболиты витамина D3 — 22-оксакальцитриол, l,25(OH)2D3 — кальцитриол и его активный аналог — альфакальцидол (la(OH)D3), максакальцитол. Последний для того, чтобы превратиться в кальцитриол, должен пройти лишь один этап гидроксилирования в печени (в отличие от нативных витаминов D, которые активизируются в почках и печени). Возможны комбинации препаратов — кальций-Д3-никомед (0,5 г кальция и 200 мЕд витамина). Целесообразно использовать активные метаболиты витамина D.
Назначение лечения витамином D согласно KDOQI (2002) следует начинать при уменьшении уровня клубочковой фильтрации ниже 60 мл/мин, поддерживая концентрацию паратгормона в пределах 150—300 пг/мл. Отдельные специалисты предлагают более жесткий контроль — в пределах 80—120 пг/мл (S.C. Cronin, 2003). Пациенты с близкими к нормальным уровнями кальция, фосфора, витамина D3 при наличии повышенного содержания паратиреоидного гормона (ПТГ) нуждаются лишь в коррекции диеты. При наличии стойких тенденций к снижению уровней кальция, l,25(OH)2D3 и повышению фосфора и ПТГ рекомендуют назначать фосфатные биндеры и кальциевые препараты на фоне соблюдения диеты. При наличии выраженных изменений добавляется активная форма витамина D. Биологические эффекты витамина D представлены в табл. 5.8.

Кроме препаратов кальция и витамина D очень эффективным в лечении вторичного гиперпаратиреоза является использование кальцимиметиков, снижающих уровень кальция и фосфора и уменьшающих кальцификацию органов. Первым препаратом, утвержденным FDA, является Mimpara (цинакальцет) (Sensipar в США) в таблетках по 30,60 и 90 мг (Amgen).
Коррекцию дислипидемии проводят, как правило, статинами. Обоснованием для коррекции дислипидемии является доказательная база кардиоваскулярных заболеваний. Исходя из кардиологических руководств, целевые значения общего холестерина составляют менее 4,5 ммоль/л, липопротеидов низкой плотности — менее 2,6 ммоль/л. Вместе с тем известна обратная эпидемиология при хронической почечной недостаточности, свидетельствующая о лучшей выживаемости пациентов с изначально более высокими значениями общего холестерина. В связи с этим до получения доказательных данных по хронической почечной недостаточности целесообразность коррекции липидограммы у таких пациентов, вероятно, определяется наличием высоких кардиоваскулярных рисков. Следует напомнить, что при наличии позитивного теста на С-реактивный протеин риск развития атеросклероза значительно повышается (Good nephrological practice: management of renal patient, 2000). Комбинированная терапия статинами и фибратами не рекомендуется при хронической почечной недостаточности, и в первую очередь при диабетической болезни почек, ввиду высокого риска рабдомиолиза. Гемфиброзил назначается при уровне СКФ не менее 15 мл/мин.
При хронической почечной недостаточности развивается гипергомоцистеинемия. Ее уровень считается умеренно повышенным в диапазоне 15—30 мкмоль/л, средне повышенным — 30—100 мкмоль/л, сильно повышенным — более 100 мкмоль/л. Для коррекции гипергомоцистеинемии применяют фолиевую кислоту, витамины В6 и В12, рекомендуемые также в комбинации с железом для лечения анемии. Снижение уровня гомоцистеина достигается за счет применения больших доз фолиевой кислоты (5 мг/сутки) в комбинации с витаминами В6 (50 мг/сутки) и В12 (1 мкг/сутки). Следует также обратить внимание на нередко проводимую коррекцию оксидантного стресса (омега-3) и назначение L-карнитина (милдроната), которые имеют слабую доказательную базу. Отметим, что карнитин, как и витамин В12, кумулируется у больных с ХПН, поэтому чаще назначается уже при проведении диализа. Желательным является назначение водорастворимых витаминов, например, такой состав (Vitarenal, Mamisch GMBH): витамин С — 62,3 мг, В, — 1,4 мг, В2 — 2,3 мг, В6 — 6 мг, В12 — 6 цг, никотинамид — 20 мг, кальция пантотенат — 16 мг, фолиевая кислота — 1000 цг, биотиновая кислота — 300 дг.
И наконец, четвертый синдром, определяющий сроки начала почечнозаместительной терапии, — это синдром нарушений гомеостаза (рис. 5.8).

Плановая коррекция нарушений гомеостаза включает весь комплекс ренопротекторных мероприятий и заместительной терапии. На этапе предиализа нередко назначают стимол по 1 пакетику два раза в сутки для коррекции ацидоза и азотистых шлаков. При снижении СКФ менее 15 мл/мин ставится вопрос о почечнозаместительной терапии. Как неотложные мероприятия при гиперкалиемии вводятся гипертонические растворы глюкозы, медленно струйно препараты кальция и сода. Из наиболее современных препаратов следует отметить соду-буфер, инновационный для нашего рынка раствор. Это раствор, доведенный до показателя рН 7,3—7,8, что предупреждает скачкообразное ощелачивание и обеспечивает плавную коррекцию ацидоза при одновременном увеличении щелочных резервов крови. Препарат увеличивает также выделение из организма ионов натрия и хлора, повышает осмотический диурез, ощелачивает мочу, предупреждает образование осадка мочевой кислоты в мочевьщелительной системе. Внутрь клеток бикарбонатный анион не проникает. Абсолютным показанием для применения соды-буфер является снижение рН крови менее 7,2, что характеризует наличие хронической почечной недостаточности, приближающейся к терминальной стадии. Доза соды-буфера рассчитывается по формуле:

Например, при BE (—10) и массе 70 кг потребность в соде-буфере составит (24 — 10) х 0,4 х 70 = 392 мл при расчете по первой формуле и 420 мл — по второй.
Обычно за сутки не рекомендуется превышать дозу 300—400 мл взрослым и 100—200 мл — детям.
При хронической почечной недостаточности, обусловленной диабетической болезнью почек, имеется ряд особенностей проведения инфузионной терапии (табл. 5.9). Почечнозаместительная терапия является результатом неэффективного или несвоевременного консервативного лечения хронических заболеваний почек. Наблюдение за пациентом с хронической почечной недостаточностью предусматривает своевременную подготовку к почечнозаместительнои терапии (рис. 5.9).
Составляющими почечнозаместительнои терапии являются диализ (гемо- и перитонеальный) и трансплантация почки. Пациент может получать такую терапию в любой последовательности, но считается рациональным ее начало с трансплантации почки, либо, при ее невозможности, при сохранении остаточной функции почек следует начинать с перитонеального диализа и затем, при снижении его эффективности, переходить на гемодиализ с последующей трансплантацией почки (рис. 5.10, 5.11).
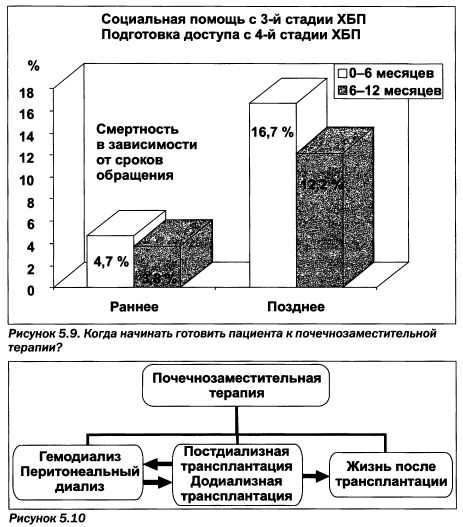
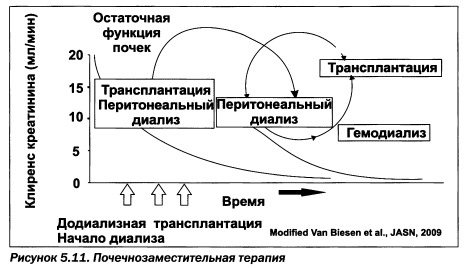
Самой перспективной является додиализная трансплантация почки как по соображениям сохранения здоровья пациента, так и с финансовой точки зрения. Так, средняя стоимость гемодиализа на одного пациента в год в США достигает 65 тыс. долларов, посттрансплантационное обеспечение — 45 тыс., додиализная терапия — 25 тыс. (данные за 2005—2006 годы). Тенденция роста расходов на почечнозаместительную терапию создает проблему даже для таких высокоразвитых стран, как США, Япония и страны ЕС.
По определению Мирового банка (2004), выделяют 4 категории государств: страны с высоким доходом на душу населения (свыше 9386 долларов/год), средне-высоким (9385—3036), средне-низким (3035— 766) и низким (менее 765 долларов/год). Согласно анализу Н. Hidai по 81 стране мира, при высоком доходе на душу населения (23 850 долларов/год) смета гемодиализа составляет 56 451 доллар/год и количество пациентов, которые получают почечнозаместительную терапию, — 748 на миллион населения. В странах с низким валовым доходом на душу населения (405 долларов/год) стоимость гемодиализа в центре гемодиализа составляет 5185 долларов/год, а количество пациентов, которые получают почечную заместительную терапию, — 37 пациентов на миллион населения. Это свидетельствует о том, что в развитых странах стоимость почечнозаместительной терапии составляет эквивалент совокупного валового дохода за 2,4 года на душу населения, в то время как для стран низкого уровня сйета почечнозаместительной терапии на одного пациента приравнивается к 12,4 года валового дохода на одного больного.
Таким образом, в странах с низким доходом на душу населения относительная стоимость гемодиализа в 5 раз больше, а абсолютная — почти в 10 раз меньше (то есть и качество соответственно хуже). Согласно анализу USRDS (2006), средний мировой показатель пациентов, которые получают почечнозаместительную терапию, составляет 339 пациентов на миллион. В последние годы достигнута стабилизация этого показателя вследствие превентивной терапии хронической почечной болезни. В Украине обеспеченность почечнозаместительной терапией в 2008 году составляла 77 на 1 миллион населения, что в 12 раз меньше, чем в развитых странах.
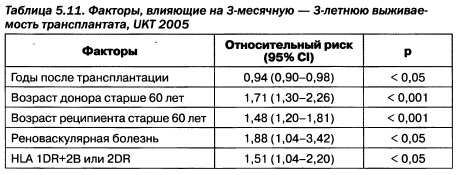
Сравнение возможностей почечнозаместительной терапии определяется не только стоимостным компонентом, но и по выживаемости пациентов. Пациенты, получившие почечный трансплантат, имеют большую продолжительность жизни, хотя и более высокие риски онкологических заболеваний в связи с постоянной иммуносупрессией (табл. 5.10).
Сегодня трансплантация почки постепенно становится основным методом заместительной терапии. Трансплантация может быть проведена от трупного донора или от донора, у которого констатирована смерть мозга, но сердце еще бьется, то есть кровообращение сохраняется. Возможно также проведение трансплантации от живого донора, который может быть с реципиентом в семейных (living relating) и несемейных (unrelating) отношениях (рис. 5.12).
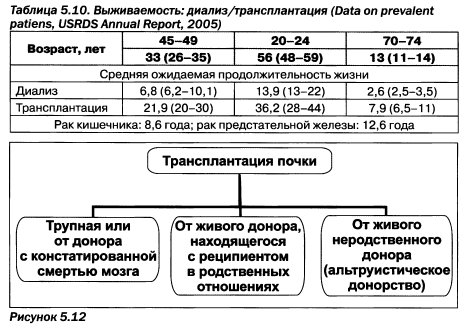
В большинстве развитых стран законодательством разрешены все виды трансплантации. Так, например, Испания лидирует по количеству проведенных трансплантаций почек в Европе. Вместе с тем в Италии, например, не разрешено альтруистическое донорство, то есть живой донор должен находиться с реципиентом в семейных отношениях. И если в Украине существует проблема обеспечения диализной помощью, то за рубежом — донорства почки. Донорство почки в развитых странах определено законодательными актами относительно возможности забора почек в случае отсутствия документированного отказа. В зависимости от потенциальных возможностей реципиенту проводится трансплантация от детского трупного донора — детям, от трупного донора преклонных лет — реципиенту преклонных лет. Поддерживается трансплантация в браке — друг другу от супругов, а также популярное в последнее время альтруистическое донорство тому, кто нуждается в почечнозаместительной терапии.
Додиализная трансплантация является методом выбора по целому ряду причин:
- — прирост пациентов, требующих заместительной терапии, составляет 5—8 % в год (в развивающихся странах);
- — прирост остановился в США и несколько снижается в Северной Европе;
- — в развивающихся странах 25—65 % пациентов не могут получить заместительную терапию (диализ, трансплантацию);
- — прирост пациентов, требующих заместительной терапии, опережает экономические возможности развивающихся стран;
- — пациент, получивший трансплантат, более экономически привлекателен для государства, чем получающий диализ, несмотря на то, что пожизненная иммуносупрессия обеспечивается за средства государства;
- — преимущества для пациентов: нет диализных осложнений, нет социальных ограничений, сохранение остаточной функции почек. Однако необходима культура понимания проблемы.
Вполне понятно, что выживаемость трансплантируемой почки от живого донора более высокая, чем от трупного донора. Вообще выживаемость трансплантата определяется многими факторами, среди которых — правильный подбор донора, техническое проведение трансплантации и эффективность иммуносупрессии. Для подбора донора практически не используется HLA-типирование, определяющим является совпадение группы крови и негативный кросс-матч. Возможности современной иммуносупрессии позволяют успешно проводить трансплантацию даже от АВОнесовместимого донора.
Во время проведения трансплантации очень важным является ишемический период, который по возможности должен быть кратчайшим и сопровождаться корректными медикаментозными мероприятиями. Предпочитаемый фактический протокол применения иммунодепрессантов сегодня выгладит так: метилпреднизолон + такролимус + MofMic + Zenepax + ATG + IV Ig; при необходимости он дополняется иммуноадсорбцией. Ранняя дисфункция трансплантата документируется в сроки от 2 до 12 недель, острое отторжение трансплантата — до 1 года, после чего при успешном функционировании трансплантата ушивается фистула. Выживаемость трансплантата составляет до 97 % в первый год, 87—92 % в течение 3 лет, 75—85 % — 5 лет и менее 40 % в — 15-летнем наблюдении. Следует отметить, что корректная оценка выживаемости проводится с учетом выживаемости трансплантата, выживаемости пациента с функционирующим трансплантатом и выживаемости самого пациента. При этом на выживаемость трансплантата определяющее влияние оказывает токсичность иммуносупрессивного протокола, на выживаемость пациента с функционирующим трансплантатом — риски онкологических заболеваний, а на выживаемость пациента — кардиоваскулярные риски.
Как ни кажется парадоксальным, выживаемость почки от неродственного донора выше, чем от родственного. Вот, к примеру, какие данные (рис. 5.13, табл. 5.11) приводит P. Harden (REENA, 2008). У пациентов с диабетом трансплантация почки нередко проводится сочетанно с поджелудочной железой (рис. 5.14).
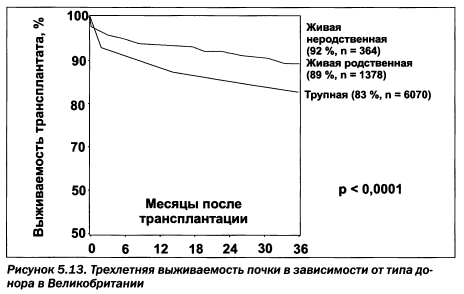
В Украине на 31.12.2005 г. было 384 пациента с трансплантированной почкой (8,2 на 1 млн населения). Ежегодно проводится трансплантация более чем 100 пациентам, что соответствует трансплантационной активности одного небольшого центра в странах Европы. При всех преимуществах трансплантации почки как вида почечнозаместительной терапии у пациентов возникает ряд осложнений (рис. 5.15,5.16).

Наиболее грозным осложнением после успешной трансплантации является хроническая нефропатия трансплантата, обусловленная прежде всего ингибиторами кальцийневрина, например циклоспорином А. В связи с этим в современных протоколах иммуносупрессии рекомендуется использовать вместо циклоспорина такролимус или сиролимус.
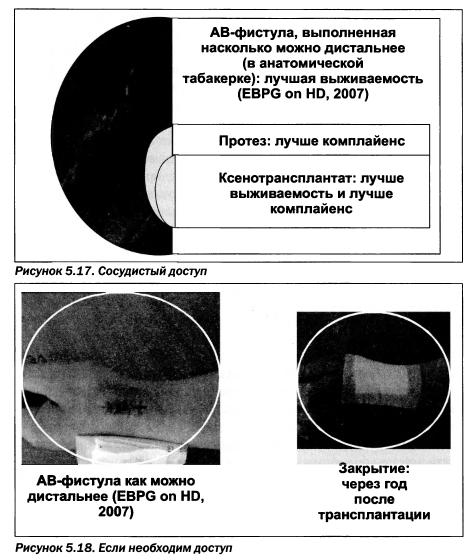
При невозможности проведения трансплантации почки как вида почечнозаместительной терапии пациенту проводится лечение диализом. Плановый диализ начинается при наличии клубочковой фильтрации ниже 15 мл/мин (обычно при 8—10 мл/мин). Неотложный диализ начинается при наличии рН крови менее 7,2, BE < —10; гиперкалиемии вьпие 6,5 ммоль/л; клубочковой фильтрации менее 6 мл/мин или развитии осложнений, таких как: острая почечная недостаточность, злокачественная гипертензия, сердечно-сосудистая недостаточность, отек легких. Следует заметить, что при ожидаемой СКФ менее 30 мл/мин вместо формулы Cockcroft — Gault уместно применять формулу MDRD, учитывающую большее количество показателей:
Примечание: полученный результат умножается на 0,762 для женщин и на 1,18 для чернокожих пациентов. Перитонеальный диализ является ведущим методом заместительной терапии у детей и методом выбора у юрослых. При сохранении остаточной функции почек перитонеальному диализу отдается предпочтение в сравнении с гемодиализом. Количество процедур перитонеального диализа имеет стойкую тенденцию к росту у взрослых больных.
Существуют три главные группы причин, по которым определяют целесообразность назначения гемо- или перитонеального диализа: возрастные, медицинские и психосоциальные. Перитонеальный диализ абсолютно показан у детей до 5 лет из-за функционально недостаточного сосудистого доступа. Кроме того, дети такого возраста не нуждаются в большой физической активности. Принципиально перитонеальный диализ является опцией выбора для всех периодов детского возраста.
Медицинская группа причин для выбора перитонеального диализа включает наличие рефрактерной хронической сердечной недостаточности, болезни протезных клапанов, а также такие хронические болезни, как миеломная, лабильный сахарный диабет, гепатиты В и С, ВИЧ-инфекция, у пациентов, которые ожидают проведения трансплантации почки, при наличии нарушений свертывания крови и возникновении осложнений во время проведения гемодиализа. Назначение перитонеального диализа при наличии левожелудочковой недостаточности приводит к значительному функциональному улучшению работы сердца, повышению качества и длительности жизни пациентов. Необходимость перехода на перитонеальный диализ возникает у пациентов с гипотензией (гипотензия при проведении сеанса гемодиализа корригируется снижением температуры раствора).
При проведении перитонеального диализа сохраняются сосуды, исключается развитие внутрисосудистых поражений и нередко гиперкалиемии, наблюдаются лучшие результаты в коррекции гипертензии и сохранности пациента для проведения трансплантации почки. К психосоциальным факторам, которые определяют стойкую необходимость в назначении перитонеального диализа, относятся отдаленность от центра гемодиализа и желание больного продолжать активный образ жизни. Психосоциальными показаниями являются также наличие выраженной депрессии и необходимость социальной помощи. Выбор метода лечения с помощью перитонеального диализа позволяет больному вести более активный образ жизни и меньше придерживаться диеты.
Перитонеальный и гемодиализ одинаково показаны при наличии сахарного диабета у больных до 50 лет (введение инсулина интраперитонеально), хронической ишемической болезни сердца, заболеваний периферических сосудов, поликистоза почек, склеродермии. Перитонеальный диализ не показан, но может выполняться при наличии дополнительных условий при ожирении, дивертикулите, грыжах, многоразовых хирургических вмешательствах на животе, длительных болях в пояснице и слепоте.
Относительными противопоказаниями для проведения перитонеального диализа являются синдром мальабсорбции, протеинурия более 10 граммов/сутки, выраженный диабетический гастропарез, выраженная гипертриглицеридемия, асцит, вентрикулоперитонеальный шунт, хронические обструктивные заболевания легких, предварительно проведенная трансплантация до 1 месяца в анамнезе, резекция тонкой кишки, наличие внешней кишечной стомы. Психосоциальными показателями являются несоблюдение пациентом правил гигиены, наличие деменции, отсутствие постоянного места жительства, плохие бытовые условия.
Перитонеальный диализ противопоказан при наличии выраженного воспалительного процесса кишечника, активного острого дивертикулита, острого ишемического заболевания кишечника, абдоминального абсцесса, при склеротическом поражении кишечника, в третьем триместре беременности. Психосоциальными причинами для отказа в проведении перитонеального диализа являются выраженные психические заболевания и интеллектуальные расстройства. Различают следующие виды перитонеального диализа: постоянный амбулаторный перитонеальный диализ (CAPD) и автоматизированный перитонеальный диализ — постоянный циркуляторный перитонеальный диализ (CCPD), ночной интермиттирующий перитонеальный диализ (NIPD).
Растворы для проведения перитонеального диализа бывают 4 видов: полиглюкозный, аминокислотный, бикарбонатный и глюкозополимерный. Лишь последний обеспечивает возможность его использования в течение 12 часов (Extraneal, Baxter). Согласно современным установкам, рН раствора должен быть нейтральным. Расчет раствора на одно заполнение — 2—3 л для взрослого пациента и 40 мл/кг для ребенка (или 1200 мл/м2). Неэффективность перитонеального диализа или невозможность его проведения требуют подготовки сосудистого доступа для планового начала гемодиализа.
Плановый сосудистый доступ готовится при ХПН 3-й ст. (ХБП 4-й ст.) (рис. 5.17, 5.18), в случае экстренного начала гемодиализа используется яремная или подключичная вена.
Наиболее эффективным считается ежедневный (6 раз в неделю) 8—12-часовой ночной гемодиализ, ему уступает ежедневный дневной 3—4-часовой гемодиализ. Из технических требований весомые преимущества имеют своевременное начало диализа, простые в использовании многопараметровые диализные машины, ультрачистая вода, наличие предиализаторного гемофильтра, одноиголочный доступ с замком и датчиком истекания жидкости. Опять возвращаются к домашнему гемодиализу, с которого начиналась эра диализной помощи. Уменьшение времени процедур и их частоты пропорционально уменьшает эффективность гемодиализа. Большинство пациентов нуждаются в назначении эритропоэтинстимулирующих агентов, железа, фосфатных биндеров, активных метаболитов витаминов D2 или D3, а также симптоматической терапии. Надлежащий диализ позволяет уменьшить расходы на сопроводительную терапию и увеличить выживаемость диализных пациентов. Смертность среди больных, которые получают диализ, может достигать 5—10 % в год в зависимости от сопутствующей патологии. Так, 5-летняя выживаемость пациентов с сахарным диабетом не достигает 50 %.
В настоящее время используются следующие критерии эффективности лечения гемодиализом: eKt/V > 1,2 (Kt/V > 1,4) при 4—5-часовом диализе трижды в неделю или Kt/V > 1,8—2 при 8-часовом диализе. Эффективность диализа нередко оценивается уже не по Kt/V, a по диализной дозе и уровню фосфора крови. Для расчета диализной дозы используют формулу Скрибнера:
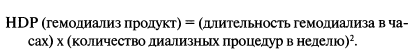
Диализ считается адекватным при HDP > ПО (В.Н. Scribner, 2002). Наиболее эффективным является ежедневный дневной диализ по 2 часа и ежедневный амбулаторный бикарбонатный ночной домашний диализ, что приблизительно равно СКФ 30 и 60 мл/мин соответственно. Для расчета Kt/V National Kidney Foundation’s Kidney Disease Outcomes Quality Initiative (KDOQI) рекомендует второе поколение формул — формулу Daugirdas:

Для достижения адекватного гемодиализа в европейских рекомендациях предложено использовать синтетические высококонвекционные high-flux диализаторы, химически и микробиологически ультрачистую воду. Соответственно на мировом рынке представлены целлюлозные, синтетически модифицированные и синтетические диализаторы, которые позволяют проводить low-flux, high-flux диализ и гемодиафильтрацию. Перед началом гемодиализа пациенты должны быть вакцинированы против гепатита В (четыре инъекции в двойной дозе). Во время диализных процедур показаны прививки против гриппа ежегодно и плановые — против дифтерии, столбняка, а также, при необходимости, прием препаратов для профилактики бактериальных респираторных инфекций (бронхомунал, рибомунил).
На фоне проведения диализа, кроме ранее наблюдавшихся при ХБП, возникает ряд осложнений, связанных преимущественно с доступом (перитонеальным или сосудистым) и изменениями со стороны эндокринной системы. Основные эндокринные нарушения у пациентов на диализе представлены дисфункцией половых гормонов, тиреоидными изменениями, задержкой роста и вторичным гиперпаратиреоидизмом. Отдельным неблагоприятным риск-фактором является повышение уровня С-реактивного белка. Задержка роста наиболее значима для пациентов детского возраста, у которых контроль роста и физического развития является крайне важным. При отставании в росте назначается соматотропныи гормон из расчета 1 мЕд/кг/неделю подкожно до достижения нормального роста, что рассчитывается по формуле 6п + 80, где п — возраст в годах. До назначения гормона роста необходимо выполнять ряд диагностических мероприятий (определение костного возраста, уровень СТГ в крови при пробе с нагрузкой, МРТ гипофиза, DEXA).
