4.5. Кофакторы ферментов
Биология — Тейлор Д., Грин Н., Стаут У. 1 том — 2013
Многим ферментам для эффективной работы требуются те или иные небелковые компоненты, называемые кофакторами. Кофакторы — это вещества, присутствие которых совершенно необходимо для проявления каталитической активности ферментов, хотя сами они в отличие от ферментов сохраняют стабильность при довольно высоких температурах. Роль кофакторов могут играть различные вещества — от простых неорганических ионов до сложных органических молекул; в одних случаях они остаются неизменными в конце реакции, в других — регенерируют в результате того или иного последующего процесса. Кофакторы подразделяются на три типа: неорганические ионы, простетические группы и коферменты. Их мы и рассмотрим в последующих трех разделах.
4.5.1. Неорганические ионы (активаторы ферментов)
Полагают, что эти ионы заставляют молекулы фермента или субстрата принять форму, способствующую образованию фермент-субстратного комплекса. Тем самым увеличиваются шансы на то, что фермент и субстрат действительно прореагируют друг с другом, а, следовательно, возрастает и скорость реакции, катализируемой данным ферментом. Так, например, активность амилазы слюны повышается в присутствии хлорид-ионов.
4.5.2. Простетические группы (например, ФАД, гем)
Если кофактор прочно связан с ферментом и остается в этом связанном состоянии постоянно, то его называют простетической группой (от греч. prostheke – добавление). Роль простетических групп играют органические молекулы. Они помогают ферменту осуществлять его каталитическую функцию, как это видно на примере флавинадениндинуклеотида (ФАД).
ФАД (флавинадениндинуклеотид)
ФАД содержит рибофлавин (витамин В2), который является водород-акцепторной частью его молекулы (рис. 4.16). Функция ФАД связана с окислительными путями клетки, в частности с процессом дыхания, в котором ФАД играет роль одного из переносчиков в дыхательной цепи (гл. 9).

Конечный результат: 2H переносятся от A к B. В качестве связующего звена между A и B действует один фермент. AH2 и B вступают в соединение с активным центром фермента, и ФАД передает H2 от одного субстрата к другому.
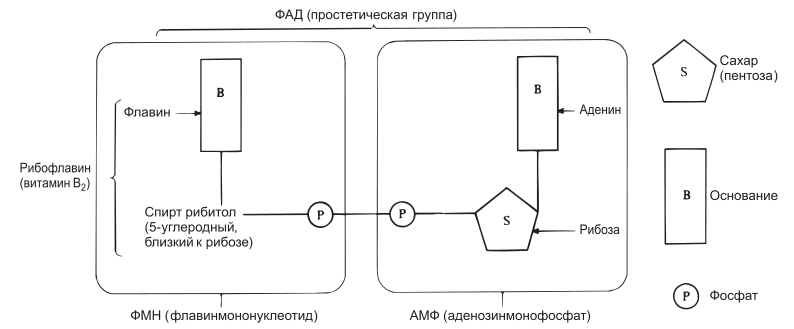
Рис. 4.16. Строение одной из простетических групп — флавинадениндинуклеотида (ФАД). ФАД представляет собой динуклеотид, образованный в результате соединения двух нуклеотидов. Нуклеотид состоит из сахара, основания и фосфата. В данном случае нуклеотиды представлены флавинмононуклеотидом (ФМН) и аденозинмонофосфатом (АМФ). Обратите внимание, что в состав одного из нуклеотидов (ФМН) входит рибофлавин (витамин В2). Этот витамин, следовательно, должен содержаться в рационе.
Гем
Гем — это железосодержащая простетическая группа. Его молекула имеет форму плоского кольца (порфириновое кольцо, такое же, как у хлорофилла), в центре которого находится атом железа. Гем выполняет в организме ряд биологически важных функций.
ПЕРЕНОС ЭЛЕКТРОНОВ. В качестве простетической группы цитохромов (см. дыхательную цепь в гл. 9) гем выступает как переносчик электронов. Присоединяя электроны, железо восстанавливается до Fe(II), а отдавая их, окисляется до Fe(III). Гем, следовательно, принимает участие в окислительно-восстановительных реакциях за счет обратимых изменений валентности железа.
ПЕРЕНОС КИСЛОРОДА. Гемоглобин и миоглобин — два гемсодержащих белка, осуществляющих перенос кислорода. Железо находится в них в восстановленной, Fe(II), форме (гл. 14).
КАТАЛИТИЧЕСКАЯ ФУНКЦИЯ. Гем входит в состав каталаз и пероксидаз, катализирующих расщепление пероксида водорода до кислорода и воды. Содержится он также и в некоторых других ферментах.
4.5.3. Коферменты (например, НАД, НАДФ, ацетилкофермент А, АТФ)
Коферменты, как и простетические группы, — это органические молекулы, выполняющие функцию кофакторов, но в отличие от простетических групп они сохраняют связь с ферментом только в ходе реакции. Все коферменты представляют собой производные витаминов. Никотинамидадениндинуклеотид (НАД) (рис. 4.17)
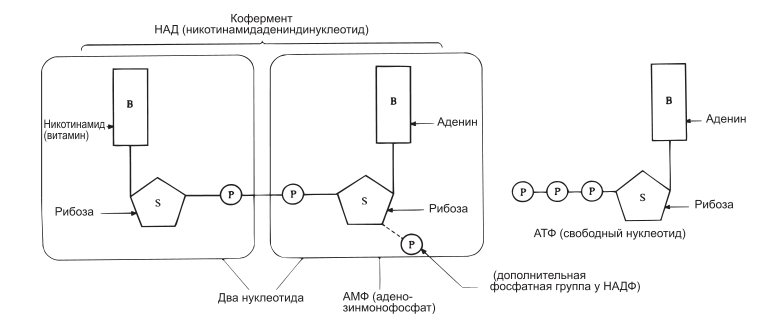
Рис. 4.17. Строение кофермента НАД (никотинамидадениндинуклеотида) и НАДФ (НАД с дополнительной фосфатной группой). НАД и НАДФ представляют собой динуклеотиды (см. рис. 4.16). Обратите внимание, что никотинамид (ниацин), входящий в состав одного из нуклеотидов, является витамином. АМФ близок по своей структуре к АТФ (в молекуле которого имеются две дополнительные фосфатные группы). АТФ служит в клетке носителем энергии. Он образуется в процессе клеточного дыхания.
НАД — производное витамина ниацина («никотиновой кислоты») — может существовать как в окисленной, так и в восстановленной форме. В окисленной форме НАД при катализе играет роль акцептора водорода:

где e1 и e2 — две разные дегидрогеназы.
Конечный результат: 2H переносятся от А к В. Здесь в качестве связующего звена между двумя различными ферментными системами e1 и e2 действует кофермент.
